长链非编码RNA在结肠癌组织与癌旁组织中的表达研究*
2018-01-19廖昆玲谭华根李远奇
王 婧, 孙 妍, 廖昆玲, 谭华根, 李远奇
(广州医科大学附属第五医院健康管理中心, 广东 广州 510700)
结肠癌(colon cancer)是常见的恶性肿瘤,其发病率和病死率较高,而且预后较差。关于近年来我国恶性肿瘤发病和死亡分析的大数据研究表明,我国结肠癌的发病率和死亡率近年来均保持上升趋势,其中结直肠癌发病率在全部恶性肿瘤中排名第4位,死亡率位居肿瘤死亡原因第5位[1-2]。近年来的研究表明,长链非编码RNA(long non-coding RNA, lncRNA)具有调节多种生物过程的潜能,它参与表观遗传调控、染色体重塑并可通过多种途径参与基因表达调控等过程[3-6],在肿瘤的发生和发展过程中发挥着重要作用。研究表明,人类许多疾病与lncRNA的异常表达有关,尤其是肿瘤,已在多种肿瘤中发现lncRNA存在异常表达,这也提示了lncRNA可能是潜在的致癌或抑癌基因[7-10]。本研究通过对lncRNAtor数据库中结肠癌lncRNA的表达数据进行分析,找出在结肠癌中有显著表达差异的lncRNA,并在60对结肠癌组织和相应癌旁组织标本中验证,从而筛选与结肠癌相关的lncRNA,为今后lncRNA在结肠癌的诊断和治疗方面提供理论依据。
材 料 和 方 法
1 标本收集
60例结肠癌临床肿瘤标本均来源于2012年1月~2016年12月在广州医科大学附属第五医院进行手术治疗的患者,术前均未行放疗或化疗,术后病理检查证实为结肠癌组织及相应癌旁正常组织(距离癌变部位边界>2.0 cm)的液氮冻存标本。其中男性 39例,年龄为 (69±10)岁,女性21例,年龄为(62±15)岁。60 例结肠癌组织病理分型均为腺癌,其中低分化8例、中分化43例、高分化9例。本研究所有标本采集均经过患者家属签署知情同意书,并经本医院伦理委员会审核通过。
2 主要试剂
总RNA提取试剂(Trizol)购自Invitrogen; 逆转录试剂盒(PrimeScript®RT reagent Kit)和real-time PCR试剂盒(SYBR®PrimeScript®RT-PCR Kit)购自TaKaRa; 其它化学试剂均为国产分析纯。所用引物由上海英骏生物技术有限公司合成,序列见表1。
3 主要方法
3.1筛选结肠癌lncRNA差异表达数据 首先登陆lncRNAtor数据库网站(http://lncrnator.ewha.ac.kr/index.htm),选择并下载Colon adenocarcinoma: Person neoplasm cancer status数据集,以P<0.01且差异表达倍数大于2或小于0.5的条件筛选结肠癌差异表达的lncRNA,然后在筛选的lncRNA中分别选择上调或下调差异表达倍数排在前2位的4个lncRNA做进一步的验证。

表1 Real-time PCR引物序列
3.2结肠癌组织及癌旁组织总RNA的提取 使用Trizol试剂在液氮冷冻状态下研磨并提取组织(约100 mg)总RNA,然后用紫外可见分光光度检测RNA的质量和浓度。
3.3Real-time PCR验证lncRNA的表达 使用逆转录试剂盒(PrimeScript RT reagent Kit)将上述提取的总RNA逆转录为cDNA。然后参照SYBR®PrimeScript®RT-PCR Kit实验操作说明进行real-time PCR, 检测3.1中筛选的4个lncRNA的相对表达水平。总反应体积20.0 μL: SYBR®Premix Ex TaqTMII (2×) 10.0 μL,PCR Forward Primer (10 μmol/L) 0.8 μL,PCR Reverse Primer (10 μmol/L) 0.8 μL,RT 产物(cDNA 溶液) 2.0 μL, RNase-free H2O 6.4 μL。逆转录条件为:37 ℃逆转录15 min,85 ℃下反应5 s。Real-time PCR反应条件为: 95 ℃预变性30 s; 94 ℃变性5 s, 60 ℃退火20 s, 72 ℃延伸20 s, 40个循环。
4 统计学处理
应用统计学软件SPSS 19.0 对结果进行统计学处理。计量资料以均数±标准差(mean±SD)表示,两独立样本间比较使用t检验。计数资料以例数(n)和百分比(%)表示,两独立样本的四格表资料采用卡方检验,对于理论频数小于5的四格表资料使用Fisher精确检验。受试者工作特征(receiver operating characteristic, ROC)曲线分析采用非参数秩和检验。以P<0.05为差异有统计学意义。
结 果
1 结肠癌差异表达lncRNA的筛选
在lncRNAtor数据库中选取并下载结肠癌差异表达的lncRNA数据(Colon adenocarcinoma: Person neoplasm cancer status),数据集包含正常样本与结肠癌样本中差异表达的基因。然后对该数据集以P<0.01的标准筛选差异表达的lncRNA,结果筛选出在结肠癌组织中差异表达的lncRNA共50个,其中上调表达的lncRNA有28个,下调表达的lncRNA有22个,其中“1”代表正常组织样本共29个,“2”代表结肠癌组织样本共36个,见图1。
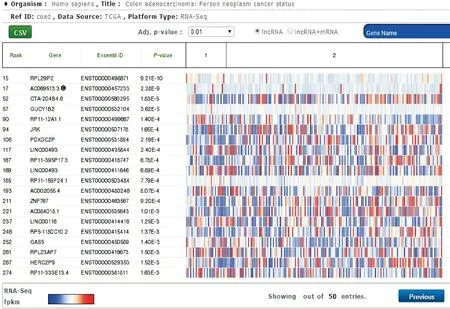
Figure 1. Differentially expressed lncRNA heatmap of colon cancer in lncRNAtor.
图1lncRNAtor中结肠癌差异表达的lncRNA热图
为了进一步筛选出结肠癌发生发展过程中差异表达的lncRNA,我们筛选出差异表达倍数分别排在前十位的lncRNA,见表2。最后我们选择上调表达倍数最高的前2个基因(HNF1A-AS1和ZDHHC8P1)及下调表达倍数最高的前2个基因(SUZ12P和AC069513.3)作进一步研究。
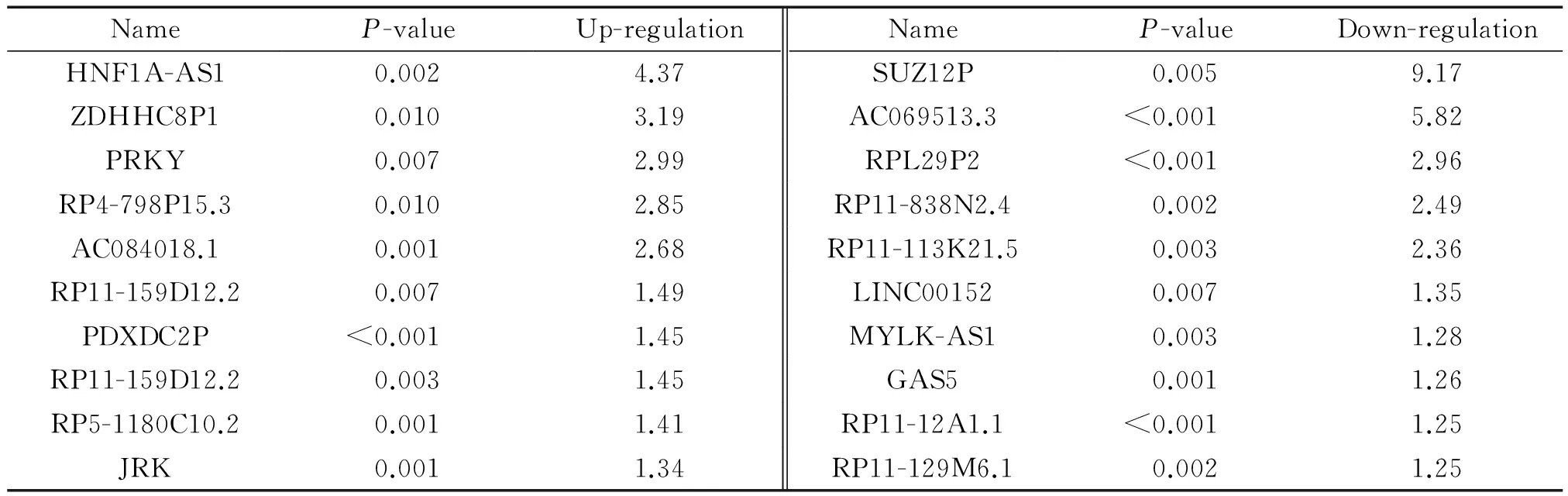
表2 结肠癌组织中差异表达的lncRNA(前20位)
2 Real-time PCR验证结果
我们利用real-time PCR定量验证HNF1A-AS1、ZDHHC8P1、SUZ12P和AC069513.3在60例结肠癌组织及相应癌旁组织中表达水平改变情况,结果发现,与配对的结肠癌旁组织相比,HNF1A-AS1和ZDHHC8P1在结肠癌组织中表达是上调的(P<0.01);SUZ12P在结肠癌组织中表达是下调的(P<0.05);AC069513.3在结肠癌组织中表达的差异无统计学意义,见图2。
3 lncRNA表达与结肠癌临床病理特征的关系
根据lncRNA在结肠癌组织及癌旁组织中的相对表达水平,将60例患者分别分为高表达和低表达2组。结果显示,HNF1A-AS1的表达水平与患者性别(男/女)、年龄(<60/≥60)和肿瘤分化程度(高分化/中分化/低分化)无关,而与结肠癌患者临床分期存在显著相关性,Ⅰ-Ⅱ期的HNF1A-AS1表达水平均明显低于Ⅲ-Ⅳ期(P<0.05);ZDHHC8P1和SUZ12P的表达水平与患者性别(男/女)、年龄(<60/≥60)、肿瘤分化程度(高分化/中分化/低分化)和肿瘤分期(TNMⅠ-Ⅱ期/ TNM Ⅲ-Ⅳ期)均无关,见表3。
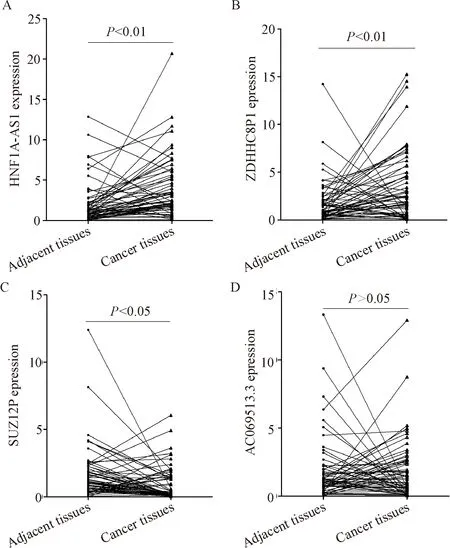
Figure 2. Expression levels of four lncRNAs in colon cancer tissues and adjacent tissues. Mean±SD.n=60. A: the expression levels of HNF1A-AS1; B: the expression levels of ZDHHC8P1; C: the expression levels of SUZ12P; D: the expression levels of AC069513.3.
图24个lncRNA在结肠癌组织及癌旁组织中的相对表达水平
4 lncRNA与结肠癌诊断的ROC 曲线分析
采用ROC曲线分析HNF1A-AS1、ZDHHC8P1、SUZ12P和AC069513.3在结肠癌组织及结肠癌旁组织中诊断的特异性和敏感性。结果显示,HNF1A-AS1相对表达水平的ROC曲线下面积为0.729(95%置信区间: 0.638~0.820,P<0.01),敏感性为78%,特异性为67%;ZDHHC8P1相对表达水平的ROC曲线下面积为0.617(95%置信区间: 0.514~0.721,P<0.05), 敏感性为68%,特异性为55%;SUZ12P相对表达水平的ROC曲线下面积为0.689(95%置信区间: 0.593~0.786,P<0.01),敏感性为65%,特异性为55%;AC069513.3相对表达水平的ROC曲线下面积为0.518(95%置信区间: 0.413~0.624,P>0.05),敏感性为52%,特异性为48%,见图3。这说明HNF1A-AS1、ZDHHC8P1和SUZ12P在结肠癌组织及结肠癌旁组织的诊断中均具有一定的特异性和敏感性。
讨 论
lncRNA最初被认为是不具有功能的RNA片段,后来越来越多的研究发现,lncRNA在表观遗传调控、细胞周期调控和细胞分化调控等众多生命活动中发挥重要作用。研究表明,lncRNA的异常表达存在于很多肿瘤的发生发展过程中。现有的lncRNA数据库资源越来越丰富,许多研究者用生物信息学方法分析这些数据,寻找肿瘤相关 lncRNA[11-14]。本研究通过在lncRNAtor数据库下载并分析结肠癌组织中差异表达的lncRNA数据,结果发现在结肠癌组织中差异表达的lncRNA共50个,其中上调表达的lncRNA有28个,下调表达的lncRNA有22个,这提示它们可能参与了结肠癌的发生发展,并可能在其中发挥重要的调控作用。这与先前的一些研究显示lncRNA的异常表达存在于很多肿瘤的发生发展过程中的结果是一致的。有研究发现,MALAT-1的高表达与非小细胞性肺癌、乳腺癌和肝癌等肿瘤的恶性程度密切相关[15-16];PCGEM1在前列腺癌细胞中过量表达[17];HOTAIR在乳腺癌患者及肝癌复发的和转移的患者中过量表达[18]。
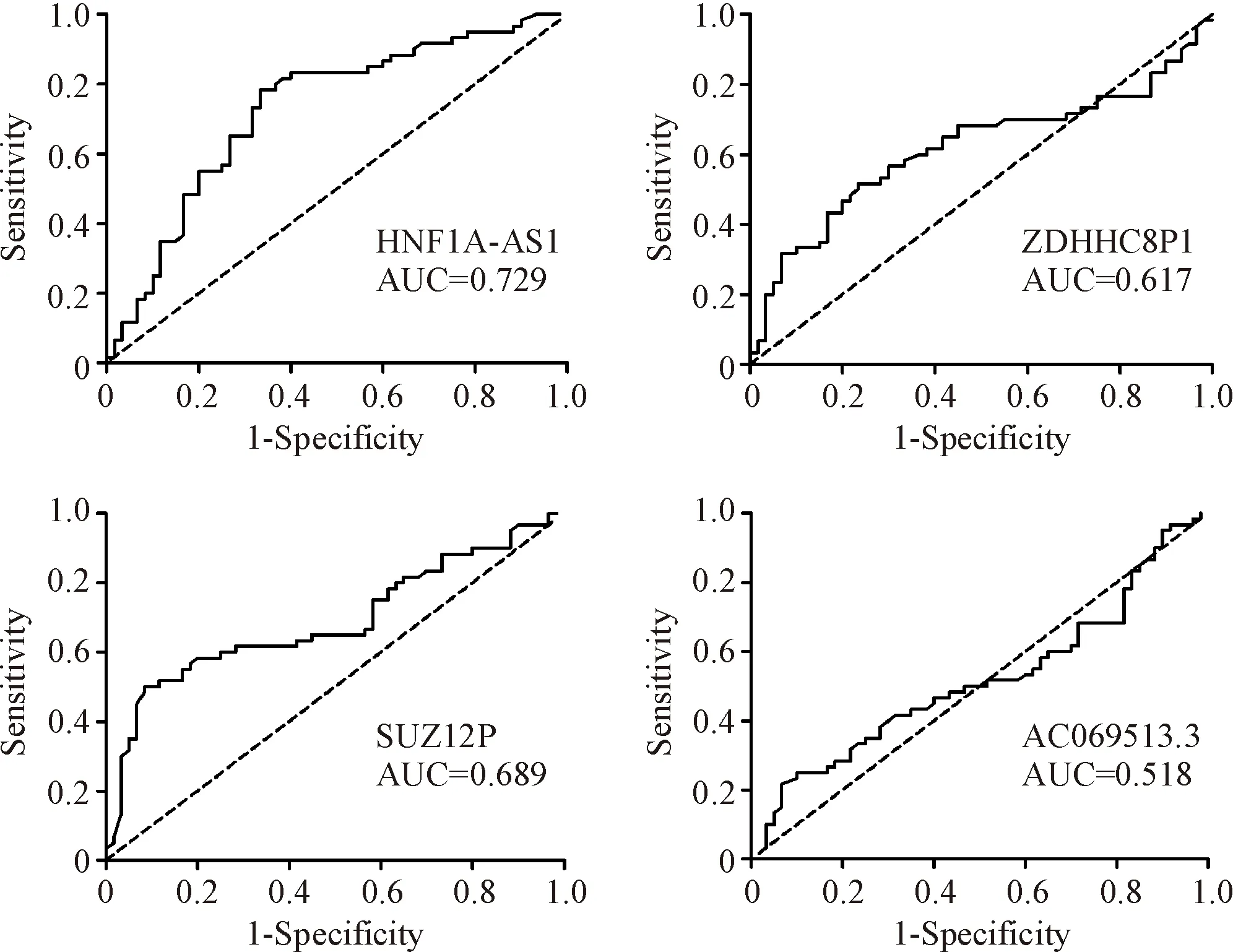
Figure 3. ROC curve analysis of four lncRNAs in diagnosis of colon cancer.n=60.
图34个lncRNA与结肠癌诊断的ROC曲线分析
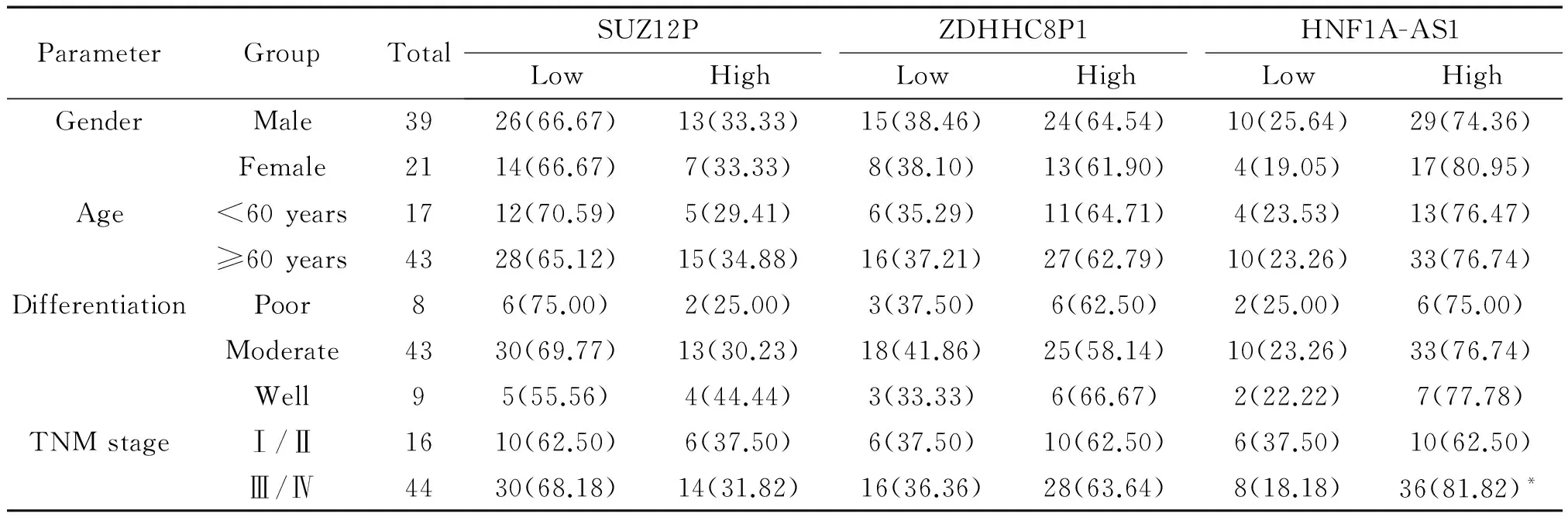
表3 lncRNA的表达与结肠癌患者的临床病理特征之间的关系
*P<0.05vsTNM stage Ⅰ/Ⅱ.
本研究分别选择了2个差异表达倍数较大的上调表达lncRNA和下调表达lncRNA进行下一步实验验证。验证的结果为HNF1A-AS1和ZDHHC8P1在结肠癌组织中均上调表达,SUZ12P在结肠癌组织中下调表达。通过ROC曲线分析HNF1A-AS1、ZDHHC8P1和SUZ12P在结肠癌组织及结肠癌旁组织中诊断的特异性和敏感性,结果发现三者在结肠癌组织及结肠癌旁组织的诊断中均具有一定的特异性和敏感性。这提示它们是结肠癌发生发展过程中重要的lncRNA,具有作为结肠癌诊断潜在分子标志物的可能性。
本研究也进一步分析HNF1A-AS1、ZDHHC8P1和SUZ12P的表达与结肠癌患者临床病理特征的相关性。结果发现,三者的表达水平与患者性别、年龄和分化程度均无关,但HNF1A-AS1表达水平与患者的临床分期存在显著相关性,Ⅰ-Ⅱ期的HNF1A-AS1表达水平均明显低于Ⅲ-Ⅳ期,提示HNF1A-AS1表达水平越高,结肠癌的恶性程度可能越高。目前已有研究表明,HNF1A-AS1在肝癌、非小细胞肺癌、骨肉瘤和胃癌等肿瘤中表达上调[19-21]。如Wang等[19]研究发现,HNF1A-AS1在肝细胞癌细胞株中上调表达,过表达的HNF1A-AS1通过促进细胞增殖和S期进展从而促进肿瘤细胞增殖,而敲低HNF1A-AS1表达后能抑制肿瘤细胞周期相关蛋白cyclin D1和PCNA的表达,研究表明HNF1A-AS1可能有助于HCC进展。Zhao等[21]研究发现,HNF1A-AS1在骨肉瘤组织中显着上调,HNF1A-AS1表达水平与骨肉瘤患者的临床分期,远处转移和总生存期降低呈正相关;敲除HNF1A-AS1可抑制细胞增殖和转移并影响骨肉瘤细胞中Wnt/β-连环蛋白通路的活性,研究说明HNF1A-AS1可能是治疗骨肉瘤的潜在靶标。于是我们提出大胆设想,HNF1A-AS1可能通过某种机制促进细胞增殖、抑制凋亡,或影响上皮间质转化等过程,从而参与结肠癌发生和发展过程。
综上所述,我们通过在60对结肠癌及癌旁组织中验证所筛选的4个lncRNA的差异表达情况,发现HNF1A-AS1、ZDHHC8P1和SUZ12P的差异表达均有统计学意义,且HNF1A-AS1在结肠癌的表达差异性更显著、敏感性更好。研究结果提示HNF1A-AS1、ZDHHC8P1和SUZ12P可能在结肠癌发生发展过程中起到重要的调控作用,它们有可能成为结肠癌的分子诊断和基因治疗的新靶点。然而本研究只是对结肠癌中lncRNA的表达情况进行初步探索和验证,其具体作用机制有待于下一步实验研究。
[1] 郑海伦, 赵 睿, 李大鹏, 等. miR-625-3p在结肠癌组织和细胞中的表达[J].中国病理生理杂志, 2016, 32(8):1376-1382.
[2] Zheng R, Zeng H, Zhang S, et al. National estimates of cancer prevalence in China, 2011[J]. Cancer Lett, 2015, 370(1):33-38.
[3] 武志娟, 钟金城. 长链非编码RNA的功能与疾病[J]. 中国生物化学与分子生物学报, 2012, 28(3):203-210.
[4] 徐 静, 徐秋林, 郭晓华. 长链非编码RNA调控细胞凋亡及自噬的研究进展[J]. 中国病理生理杂志, 2015, 31(8):1525-1530.
[5] Guttman M, Rinn JL. Modular regulatory principles of large noncoding RNAs[J]. Nature, 2012, 482(7385): 339-346.
[6] 邹阮敏, 余 霞, 张文淼, 等. 长链非编码RNA linc-STXBP5-1 在宫颈癌中的表达及其干预效应分析[J]. 中国病理生理杂志, 2016, 32(6):1127-1131, 1137.
[7] 张明娇, 吴 勇, 李珉珉, 等. 长链非编码RNAs的生物功能及其与器官发育和恶性肿瘤的关系[J]. 中国病理生理杂志, 2015, 31(11):2107-2112.
[8] Yang G, Lu X, Yuan L. LncRNA: A link between RNA and cancer[J]. Biochim Biophys Acta, 2014, 1839(11):1097-1109.
[9] 杨翔宇, 余细勇. 长链非编码RNA对心脏发育的表观遗传学调控研究进展[J]. 中国病理生理杂志, 2015, 31(11):2101-2106.
[10] Gibb EA, Brown CJ, Lam WL. The functional role of long non-coding RNA in human careinomas[J]. Mol Cancer, 2011,10:38.
[11] Kim K, Jutooru I, Chadalapaka G, et al. HOTAIR is a negative prognostic factor and exhibits pro-oncogenic acti-vity in pancreatic cancer[J]. Oncogene, 2013, 32(13):1616-1625.
[12] Yang YR, Zang SZ, Zhong CL, et al. Increased expression of the lncRNA PVT1 promotes tumorigenesis in non-small cell lung cancer[J]. Int J Clin Exp Pathol, 2014, 7(10): 6929-6935.
[13] 张浩文, 杨禹丞, 鲁 志. 非编码RNA的生物信息学研究方法:RNA结构预测及其应用[J]. 生命科学, 2014, 26(3):219-227.
[14] 张婧婧, 吴 伟, 王 鹏, 等. 长链非编码RNA HOTAIR通过调控PIK3R3促进肝癌HepG2细胞的转移和侵袭[J]. 中国病理生理杂志, 2016,32(10):1775-1781.
[15] 杨孜欢, 冯杏芝, 方乐堃, 等. 长链非编码RNA MALAT1调控Rac1b表达与结直肠癌侵袭和转移的关系[J]. 中国病理生理杂志, 2015, 31(8):1417-1421.
[16] 黄劲龙, 沈建箴. 长链非编码RNA MALAT-1在肿瘤中的作用及其机制研究进展[J]. 中国肿瘤临床, 2016, 43(4):161-165.
[17] Bernard D, Prasanth KV, Tripathi V, et al. A long nu-clear-retained non-coding RNA regulates synaptogenesis by modulating gene expression[J]. EMBO J, 2010, 29(18): 3082-3093.
[18] Tufarelli C, Stanleyj A, Garrick D, et al. Transcription of antisense RNA leading to gene silencing and methylati on as a novel cause of human genetic disease[J]. Nat Genet, 2003, 34(2):157-165.
[19] Wang C, Mou L, Chai HX, et al. Long non-coding RNA HNF1A-AS1 promotes hepatocellular carcinoma cell proli-feration by repressing NKD1 and P21 expression[J]. Biomed Pharmacother, 2017, 89:926-932.
[20] Dang Y, Lan F, Ouyang X, et al. Expression and clinical significance of long non-coding RNA HNF1A-AS1 in human gastric cancer[J]. World J Surg Oncol, 2015, 13:302.
[21] Zhao H, Hou W, Tao J, et al. Upregulation of lncRNA HNF1A-AS1 promotes cell proliferation and metastasis in osteosarcoma through activation of the Wnt/β-catenin signaling pathway[J]. Am J Transl Res, 2016, 8(8): 3503-3512.
