GPR50敲除导致小鼠神经元数目和发育异常研究*
2018-01-18兰丽君陈继博吕美红马全红
兰丽君,陈继博,吕美红,马全红
苏州大学神经科学研究所(苏州 215123)
GPCRs 家族是体内最大的蛋白质超家族,已鉴定出在人的基因组中有上千个基因编码GPCRs[1],虽然它们的序列同源性较低,但在结构上都具有螺旋-环-螺旋的七次跨膜结构,并且GPCRs中有一半是内源性配体的受体,具有一个胞外端和胞内端,通过偶联 G 蛋白和其他信号通路接受细胞外信号传递到细胞内部。GPCRs在神经传递过程、细胞增殖、器官特异性中是非常重要的[2]。GPR50属于 GPCRs 家族,是位于 X 染色体 Xq28 上的孤独 G 蛋白偶联受体、褪黑激素相关受体(melatonin related receptor)[3-4],主要分布在成年哺乳动物脑内的垂体、下丘脑、海马等多个部位,主要表达在神经元上[5- 6]。已有相关研究表明:GPR50在很多精神类疾病,如:双极情感障碍(Bipolar affective disorder,BPAD)、抑郁症(Major depressive disorder,MDD)以及精神分裂症(Schizophrenia)等神经系统疾病中有不可或缺的作用[7-10]。最近的研究亦发现:GPR50基因在ASD患者体内有两个突变位点:Δ502-505和T532A,而且这种突变只发生在男性个体上[11]。但是到目前为止,GPR50在大脑中的功能尚不清楚。
为了探究GPR50在大脑发育中的作用,我们首先分析了GPR50在不同时期的表达情况,又进一步探究了GPR50对发育的影响,包括对神经元数目和中间神经元的影响,以及对树突发育的影响。我们的结果显示:GPR50敲除影响海马区域钙网膜蛋白(Calretintin,CR)阳性中间神经元的数目,而不影响皮层深层和浅层神经元的数目。另外,成年的GPR50敲除小鼠脑皮层锥体细胞的顶树突方向异常。因此,GPR50在大脑发育中具有重要功能。
材料与方法
1 材 料 野生型小鼠C57BL/6J在苏州大学提供的 SPF 级实验动物中心饲养,C57BL/6J背景的GPR50敲除小鼠(G-/Y)和野生型小鼠(G+/Y)杂交来繁殖;GPR50 antibody(Santa Cruz)、γ-tubulin(Sigma)、Tbr1 antibody(Abcam)、Cux1 antibody(Santa-Cruz)、CR(Abcam)、FD Rapid GolgiStainTM Kit(FD Neuro Technologies,Inc)。
2 方 法
2.1 GPR50小鼠的基因鉴定:剪取长度约为0.5 cm的小鼠尾部组织,提取DNA。然后用如下的引物进行PCR:引物PNF-seq5’-FATCCGGGGGTACCGCGTCGAG-3’;GPR50-zptR 5’-TACCTCCACCTCCTCCAGCAT-3’;GPR50-zptF5’-CAGAGTCACCTGGGACTTGCT-3’;LAR3 5’-CACAACGGGTTCTTCTGTTAG TCC-3’;GPR50-G-zptF 5’-CAGAGTCACCTGGGACTTGCT-3’;GPR50-G-wt-tR 5’-GTAGCAGTAACGGTTGATGGCAATG-3’。PCR产物通过琼脂糖凝胶电泳进行分离。
2.2 Western blot检测蛋白的表达:将E12、E14、E16、E18、P0小鼠用手术剪和镊子取出全脑,立即置于冰上,并分离出皮层和海马部分,用预冷的PBS清洗两遍,再放入研磨器中,加入裂解液(Brain lysis buffer和蛋白酶抑制剂(1∶50));在冰上进行研磨裂解至脑组织成匀浆状,测浓度,并在样品中加入 4×上样缓冲液混匀,使蛋白质变性。配制12% SDS-PAGE分离胶和5%的SDS-PAGE浓缩胶,待凝固后按次序上样,孵育GPR50抗体,以γ-tubulin作为内参,凝胶成像仪进行成像。
2.3 组织免疫荧光染色:将确定基因型的小鼠在体视显微镜下取出完整的脑组织。在4°C 条件下,用4%的多聚甲醛固定24 h,然后换成15%、30%的蔗糖梯度脱水沉底。用冰冻切片机横切海马区,切片厚度14 μm,贴在载玻片上。晾干后用0.3% TritonX-100洗3次,10 min每次。10%的FBS室温封闭2 h。一抗Tbr1(特异标记第六层神经元的maker)、Cux1( 特异标记浅层神经元的maker)以及CR(特异标记中间神经元的maker)(1∶200)在4 °C条件下孵育过夜。回收一抗,用0.3% TritonX-100洗3次,10 min每次。二抗Tbr1:Rabbit555,Cux1和CR:Rabbit 488(1∶800)在室温避光孵育1 h,弃二抗,再次用0.3% TritonX-100洗3次,10 min每次。待切片避光晾干后用含DAPI的封片剂封片。
2.4 高尔基染色:将高尔基染色试剂盒内的A、B液按1∶1震荡混匀后放入4 ml的EP管中,避光贮存;第2天,取G+/Y、G-/Y小鼠大脑放到配好的AB液中,浸泡14~16d,注意避光;15d后,取出浸泡好的脑袋,蘸干AB液,准备切片;将切片机的箱体温度和冻台温度都调至-22℃,准备好明胶包被过的片子,将脑袋放在-80℃冰箱内40 min,然后再避光放到切片机中箱体温度内2 h,制作包埋剂座,固定脑袋,按100 μm切片贴于载玻片上,避光晾干。将晾干的片子放在玻片槽内,用双蒸水洗两次,4min/次;用工作液浸泡10 min(工作液配制:溶液D、溶液E和双蒸水按1∶1∶2配100 ml,现配现用);用双蒸水洗两次,4 min/次;在50%、75%、95%乙醇中各清洗4 min;再在无水乙醇中洗4次,4 min/次;二甲苯中透明13 min;用中性树脂封片,待拍片。

结 果
1 GPR50基因敲除小鼠的获得和鉴定 为了研究GPR50在大脑中的作用,本研究利用了GPR50基因敲除(GPR50-/-)的小鼠。该小鼠在南京模式动物中心定做,GPR50的第二外显子通过同源重组被lacZ-neo cassette序列替代(图1)。GPR50基因敲除小鼠可正常存活、可繁育,且在体重、运动等方面均无明显异常。GPR50杂合子(GPR50+/-,雌性)小鼠通过与雄性C57BL/6N野生型小鼠回交进行保种。因为GPR50基因位于X染色体上,雌性GPR50+/-雄性野生型小鼠(WT)通过杂交可以获得WT小鼠 (雌性或者雄性)、GPR50+/-(雌性)和GPR50-/Y(雄性)小鼠。通过提取小鼠尾巴基因组DNA,并利用对应的引物进行PCR实验。实验结果如图2所示:图中199号和200号小鼠为杂合子雌性小鼠,201为WT小鼠,205号为GPR50基因敲除的雄性小鼠。
2 GPR50在胚胎发育过程中有较高的表达 已有研究表明:GPR50主要分布在成年哺乳动物脑内的垂体、下丘脑、海马等多个部位,而在细胞水平上,则主要表达在神经元上[5-6]。为了研究GPR50在大脑中的作用,我们首先取WT小鼠胚胎发育的不同时期(E12-P0)的脑组织,匀浆裂解后,通过Western blot检测了GPR50蛋白在脑内的表达情况,GPR50在发育的不同时期均有表达(图3),统计结果表明:从E12到E18有增加的趋势,而从P18到P0呈现减少的趋势(图4)。这表明GPR50在大脑发育中发挥一定的作用。

图1 GPR50基因敲除小鼠的获得示意图(GPR50的第二外显子被敲除)
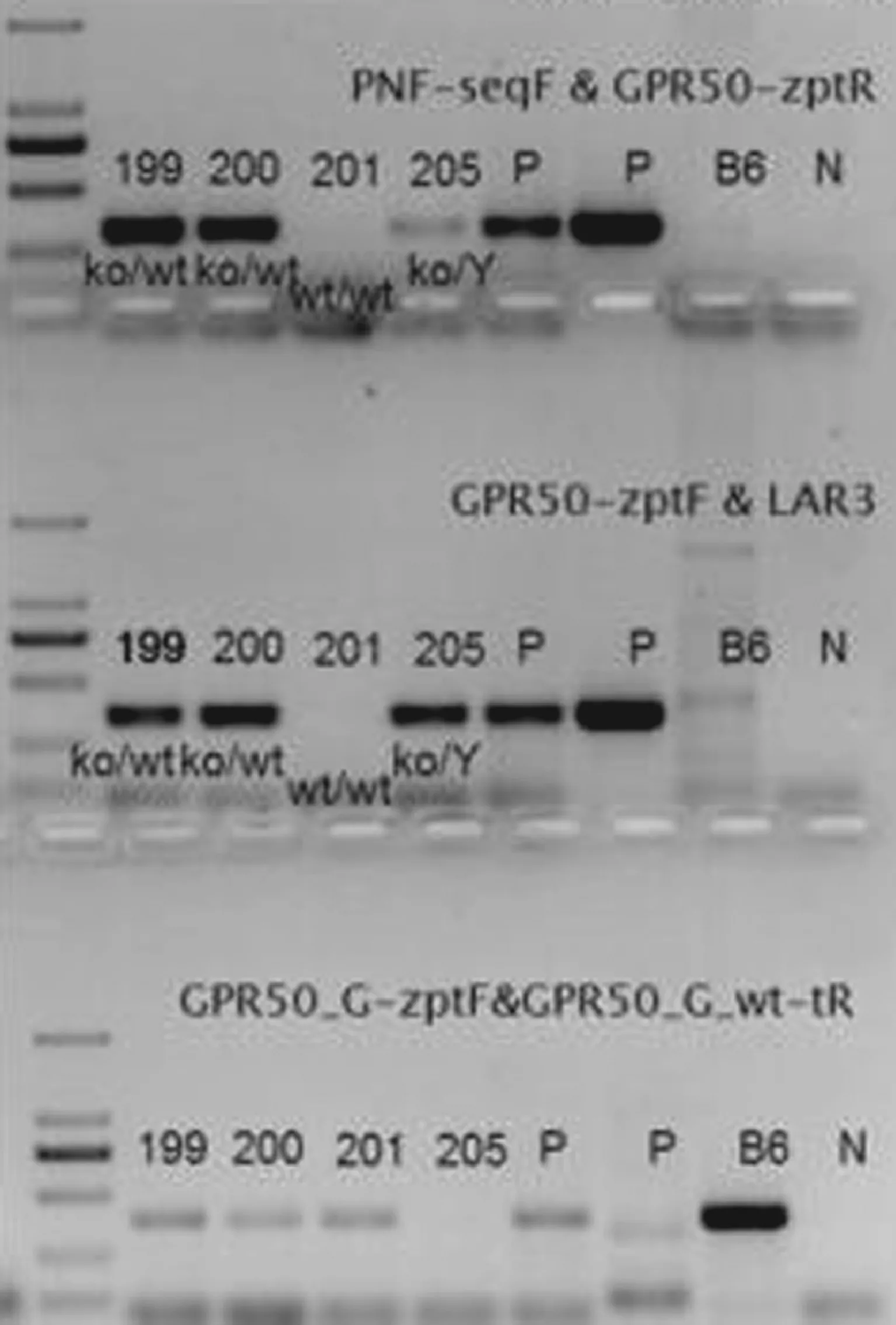
图2 基因鉴定的PCR代表图

图3 GPR50在不同发育阶段野生型小鼠脑内表达

图4 GPR50在不同发育阶段野生型小鼠脑内表达统计图
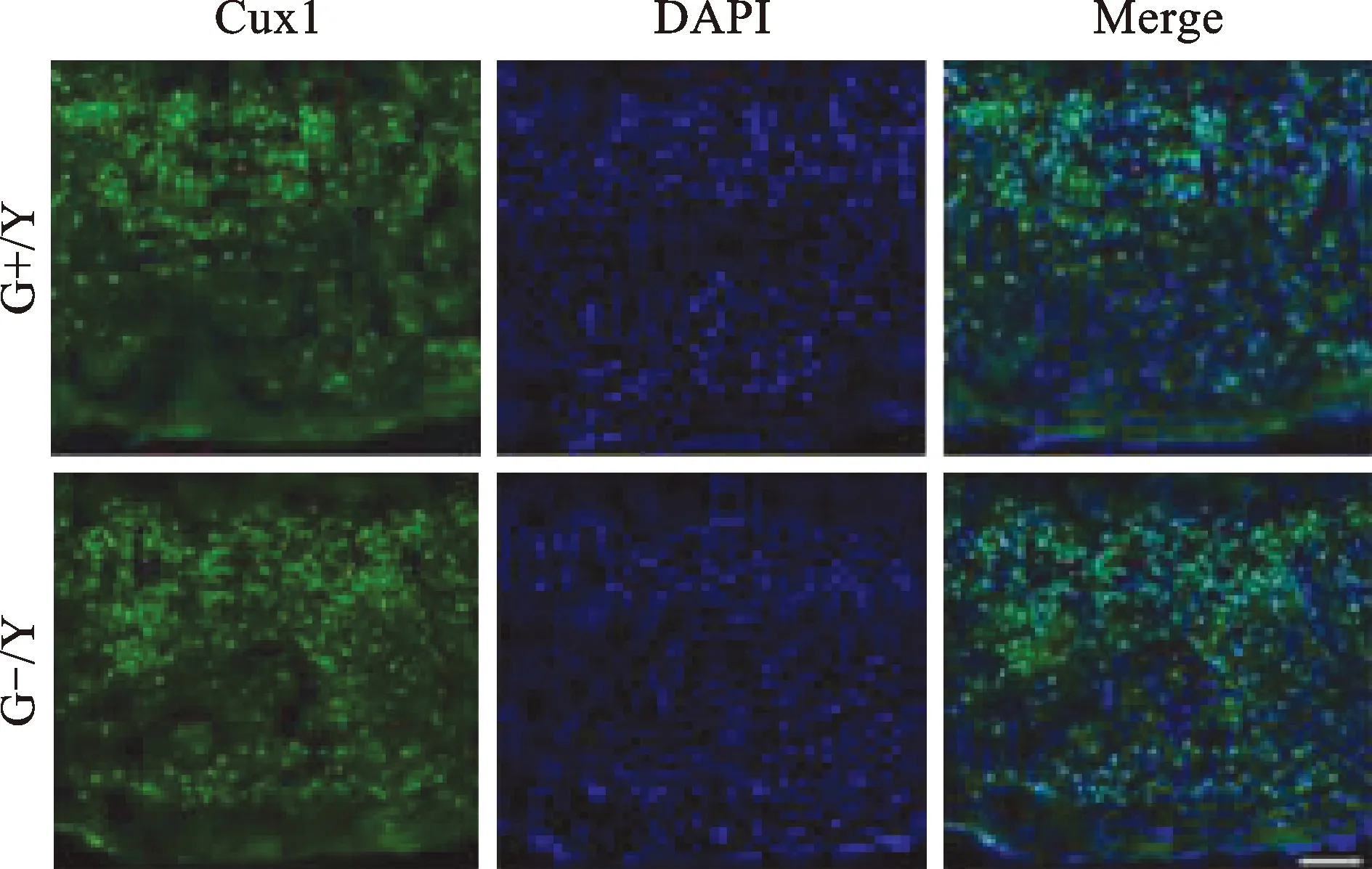
3 GPR50敲除不影响P1小鼠大脑皮层深层和浅层神经元的数目 大脑皮层是高度特化且有着严格分层的结构,从内到外一共分为6层,即Ⅰ~VI层,每一层都有自己特有类型的神经元和胶质细胞[12]。且它们的产生具有一定的时间和空间性,由SVZ区域的神经干细胞按照由内而外的顺序逐步分化而产生的,比如先产生深层神经元,而后是浅层神经元。每层神经元产生的时间和数量都是受严格控制的[13]。在发育阶段,神经元产生的时间节点和数量的变化会导致大脑发育异常,从而导致神经系统疾病[14-15]。我们的前期工作已表明:GPR50亦在神经干细胞上表达,且影响干细胞的增殖和分化[16]。因此,我们首先分析了GPR50敲除后对P1时期小鼠大脑皮层不同层的神经元数目的影响。我们分别利用深层和浅层神经元的特异性蛋白标志物Tbr1和cux1(Tbr1是第VI层神经元的蛋白标志物,Cux1是II-IV神经元的蛋白标志物)在P1时期的小鼠脑内进行免疫荧光染色。如图5~7所示:Tbr1+细胞定位于第VI层。然而,我们的统计结果显示:与WT组小鼠相比,GPR50敲除后并未影响深层神经元的数目。利用同样的方法,我们亦分析了浅层神经元的数目有无变化,结果显示:GPR50敲除组小鼠大脑皮层内浅层神经元(cux+细胞)的数目也无明显改变。以上结果提示:在发育后期,GPR50敲除并不影响浅层和深层神经元的数目。
4 GPR50敲除导致P1小鼠海马CR阳性中间神经元数目显著增多 神经环路是大脑神经系统的基础,神经元与神经元之间依赖于突触相互联系,这些彼此联系的神经元构成一定的神经环路来发挥大脑的高级功能。根据其在突触联系中的作用,大脑皮质神经元主要可以分为兴奋性神经元和抑制性神经元(中间神经元)。虽然中间神经元在大脑皮层总神经元中的数目相对较少,仅占20%左右,但在神经元环路功能上却起到了至关重要的作用。已发现多种神经系统疾病的发生,如癫痫、自闭症、精神分裂症等,均与中间神经元环路发育异常有关。GABA能中间神经元是脑中一种主要的抑制性神经元,和兴奋性神经元一起起着脑内兴奋-抑制的动态平衡,CR+中间神经元是GABA

每只小鼠取10张片子,每组3只小鼠,
图5 P1时期G+/Y小鼠和G-/Y小鼠皮层anti-Tbr1抗体标记的神经元(红色)和DAPI标记所有细胞的细胞核(蓝色)的代表图
每只小鼠取10张片子,每组3只小鼠,
图6 P1时期G+/Y小鼠和G-/Y小鼠皮层anti-Cux1抗体标记的神经元(绿色)和DAPI标记所有细胞的细胞核(蓝色)的代表图

每只小鼠取10张片子,每组3只小鼠,
图7 Tbr1阳性和Cux1阳性细胞数目的统计图
能中间神经元的一种。因此,本研究亦探讨了GPR50对中间神经元的影响。我们的结果显示:P1时期的海马区CR+中间神经元主要分布在DG区域的颗粒层细胞外侧,GPR50敲除组的每张14 μm厚的切片中约(44±4)个CR+中间神经元, WT组小鼠组数目则为(29±4)个,GPR50敲除组CR+中间神经元数目显著高于WT组小鼠,这个结果提示GPR50敲除后,抑制性中间神经元增多,可能打破了神经网络的抑制性与兴奋性中间神经元之间的平衡(见图8)。

每只小鼠取10张片子,每组3只小鼠,
图8 GPR50敲除增加海马钙网膜蛋白阳性中间神经元数目。p1时期G+/Y小鼠和G-/Y小鼠海马DG区用CR抗体标记中间神经元(绿色)和DAPI标记所有细胞的细胞核(蓝色)的代表图
5 GPR50敲除导致大脑皮层锥体神经元顶树突方向紊乱 树突发育是神经系统功能形成的一个基本过程,神经元之间的交流需要树突和轴突之间形成突触。树突像一根分叉的天线,接受来自不同方位的轴突输入来的信号,树突的长度和分支多少决定其接受信号的广度和强度。锥体神经元是皮层内一种主要类型的神经元,它有一个顶树突直接延伸到大脑皮层表面,和几个从胞体伸出的基树突。为了探索GPR50对树突发育的影响,我们利用高尔基染色观察树突的形态。我们发现:在WT组小鼠皮层内,可以清晰可见顶树突的形态,他们排列有序,均垂直地延伸至皮层表面,而在GPR50敲除小鼠皮层的在两个半脑连接处,有的神经元的顶树突变短甚至消失,排列紊乱(见图9)。
图9 GPR50敲除小鼠皮层内锥体神经元顶树突方向紊乱
讨 论
在胚胎发育过程中,GPR50在大脑内的表达,暗示GPR50可能参与神经系统的发育过程。此外,我们亦发现:GPR50影响海马区中间神经元的数目和皮层锥体神经元的顶树突的发育,这些结果表明了GPR50在脑发育中发挥重要的作用。事实上,已有大量数据证实GPR50是多种神经系统疾病的风险因子[7-10]。
我们发现GPR50 KO小鼠P1时期无论是深层还是浅层的神经元数目并没有变化,而我们之前的结果却表明GPR50 KO小鼠来源的神经干细胞在体外能更多的分化成神经元[16],我们推测:在发育早期,GPR50敲除首先导致神经干细胞的增殖和分化能力的增强,但在发育后期,GPR50敲除可能又会产生相反的作用,所以最终在发育后期神经元数目并无明显变化。另一方面,在发育后期,GPR50的敲除后,增多的神经元可能发生了凋亡。所以,为了验证这一点,在接下来的研究中,我们将分析不同发育时期神经元的数目和凋亡情况。对中间神经元的检测的结果初步显示,GPR50 KO小鼠的海马区CR+中间神经元数目显著增多。这提示GPR50 可能参与调控神经网络的兴奋性和抑制间的平衡。目前,抑制和兴奋性神经元的失衡已经被证明和多种神经疾病联系在一起,例如精神分裂症、自闭症和阿尔茨海默疾病等。但CR是GABA能中间神经元众多亚型中的一种,另外还包括小清蛋白 (Parvalbumin,PV),生长抑素(Somatostain,SST)以及神经肽 Y (Neuropeptide Y,NPY)等,因此,下一步我们将评估其他类型的中间神经元,和通过脑电图来确定GPR50在这方面的作用。
总之,我们通过本研究得出:①GPR50在胚胎发育过程中有较高的表达;②GPR50敲除后不影响P1小鼠大脑皮层深层和浅层神经元的数目,但可以使CR阳性中间神经元数目显著增多;③ GPR50敲除也导致大脑皮层椎体神经元顶树突方向紊乱。
[1] Shigeki T, Kadowaki S, Haga T,etal. Identification of G protein-coupled receptor genes from the human genome sequence[J]. FEBS Lett, 2002,520(1-3): 97-101.
[2] Luttrell LM. Reviews in molecular biology and biotechnology: transmembrane signaling by G protein-coupled receptors[J]. Mol Biotechnol, 2008, 39(3): 239-264.
[3] Gubitz AK, and Reppert SM. Assignment of the melatonin-related receptor to human chromosome X (GPR50) and mouse chromosome X (Gpr50)[J]. Genomics, 1999, 55(2):248-251.
[4] Reppert SM, Weaver DR, Ebisawa T,etal. Cloning of a melatonin-related receptor from human pituitary[J]. FEBS Lett, 1996,386(2-3): 219-224.
[5] Hamouda HO, Chen P, Levoye A,etal. Detection of the human GPR50 orphan seven transmembrane protein by polyclonal antibodies mapping different epitopes[J]. J Pineal Res,2007,43(1):10-15.
[6] Sidibe A, Mullier A, Baroncini M,etal. Expression of the orphan GPR50 protein in rodent and human dorsomedial hypothalamus, tanycytes and median eminence[J]. J Pineal Res,2010,48(3):263-269.
[7] Manzini MC, Walsh CA. What disorders of cortical development tell us about the cortex: one plus one does not always make two[J]. Curr Opin Genet Dev, 2011, 21(3): 333-339.
[8] Macintyre DJ, McGhee KA, Maclean AW,etal. Association of GPR50, an X-linked orphan G protein-coupled receptor, and affective disorder in an independent sample of the Scottish population[J].Neurosci Lett,2010,475(3):169-173.
[9] Gogtay N,Ordonez A, Herman DH,etal. Dynamic mapping of cortical development before and after the onset of pediatric bipolar illness[J]. J Child Psychol Psychiatry,2007,48(9):852-862.
[10] Thomson PA, Wray NR, Thomson AM,etal. Sex-specific association between bipolar affective disorder in women and GPR50, an X-linked orphan G protein-coupled receptor[J]. Mol Psychiatry,2005,10(5):470-478.
[11] Chaste P, Clement N, Mercati O,etal. Identification of pathway-biased and deleterious melatonin receptor mutants in autism spectrum disorders and in the general population[J].PLoS One,2010,5(7): e11495.
[12] Molyneaux BJ, Arlotta B, Menezes JRL,etal. Neuronal subtype specification in the cerebral cortex[J].Nat Rev Neurosci,2007,8(6):427-437.
[13] Greig LC, Woodworth MB, Galazo MJ,etal. Molecular logic of neocortical projection neuron specification, development and diversity[J]. Nat Rev Neurosci, 2013,14(11):755-769.
[14] Reif A, Fritzen S, Finger M,etal. Neural stem cell proliferation is decreased in schizophrenia, but not in depression[J].Mol Psychiatry,2006,11(5): 514-522.
[15] Eisch AJ, Petrik D.Depression and hippocampal neurogenesis: a road to remission[J].Science,2012,338(6103):72-75.
[16] Ma YX, Wu ZQ, Feng YJ,etal. G protein coupled receptor 50 promotes self-renewal and neuronal differentiation of embryonic neural progenitor cells through regulation of notch and wnt/beta-catenin signalings[J]. Biochem Biophys Res Commun,2015,458(4):836-842.
