N-乙酰氨基半乳糖转移酶6对乳腺癌细胞MCF-7增殖和迁移的影响
2018-01-18周文媛任军纪元陈晓明
周文媛,任军,纪元,陈晓明
(温州医科大学 检验医学院 生命科学学院,浙江 温州 325035)
乳腺癌是全球女性最常见的癌症。综合乳腺癌诊断和治疗的现状,乳腺癌早期诊断标志物以及药物靶点的发现意义重大[1-2]。GALNT6是N-乙酰氨基半乳糖转移酶(N-acetyl galactosyltransferase,GALNT)家族的重要成员[3],有报道称它与乳腺癌、胃癌等的发生发展存在一定的相关性[4-6]。它在乳腺癌中呈高表达状态,但其作用机制有待进一步探讨。本研究通过构建GALNT6低表达的MCF-7细胞株,检测GALNT6对乳腺癌细胞MCF-7增殖、迁移等生物学功能的影响。
1 材料和方法
1.1 材料
1.1.1 细胞与载体:乳腺癌细胞MCF-7购自上海中国科学院细胞库。GALNT6的RNA干扰载体pGPU6/GFP/Neo-GALNT6和对照载体pGPU6/GFP/Neo-shNC均由上海吉玛技术有限公司设计合成。
1.1.2 试剂:胎牛血清FBS为美国Hyclone公司产品,RPMI 1640培养基为美国Gibco公司产品,胰酶细胞消化液、青霉素-链霉素溶液(100×)、辣根过氧化物酶标记羊抗兔IgG、辣根过氧化物酶标记羊抗鼠IgG和β-Actin小鼠单克隆抗体均购于上海碧云天生物技术研究所,CCK8试剂购于日本同仁株式会社,细胞周期检测试剂盒购于南京凯基生物科技发展有限公司,GALNT6兔多克隆抗体购于美国Abcam公司,PCNA兔单克隆抗体购于美国Cell Signaling Technology公司,Prime Script RT Reagent Kit购于大连宝生物公司。
1.2 方法
1.2.1 细胞培养:将细胞置于含有10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养液中,用25 mL透气细胞培养瓶放在CO2培养箱中培养(37 ℃、5% CO2、95%湿度)。实验共分3组:Mock组:未转染组,NC组:空载体对照组,sh-GALNT6组:GALNT6低表达组。
1.2.2 Real-time PCR:采用Trizol法提取细胞总RNA,ND2000测定RNA浓度,同时观察样品OD260/OD280比值,比值在2.0左右时表示所提取的RNA纯度较高,可用于下一步实验。反转录过程根据试剂盒说明配制反应体系(20 µL):4 µL 5×Prime Script Buffer、1 µL Prime Script RT Enzyme Mix I、1 µL Oligo dTPrime、1 µL Random 6 mers(100 µL)、0.5 µL样品RNA、 (12.5)µL RNase free H2O,将配制好的体系放入PCR仪上50 ℃反转录反应15 min,85 ℃ 5 s终止反应。再按照反转录过程根据试剂盒说明配制反应体系(20 µL),GALNT6、GAPDH荧光定量PCR反应条件为:95 ℃ 2 min,95 ℃ 15 s,60 ℃ 1 min,40个循环。用2-△△Ct法计算GALNT6的cDNA水平,并以GAPDH为内参基因,得出目的基因的表达情况。
1.2.3 Western blot:根据BCA试剂盒说明测定提取的细胞总蛋白浓度,用5×loading Buffer调整蛋白浓度,放置加热器内95 ℃加热变性10 min。配制Tris-甘氨酸SDS聚丙烯酰胺凝胶电泳分离胶和浓缩胶,上样后进行SDS-PAGE蛋白电泳、转膜、5%脱脂牛奶封闭、孵育一抗(4 ℃摇床过夜)、TBST清洗、孵育二抗、TBST清洗、ECL化学发光检测,最后利用Image Lab图像分析软件测定各样本灰度值,利用灰度值进行蛋白表达强度的比较。
1.2.4 CCK8实验:将对数期生长的细胞调整细胞浓度为8×105个/mL,接种于96孔板中,置于细胞培养箱中常规培养;于生长24 h、48 h、72 h、96 h后各孔加入10 µL的CCK8试剂,继续常规培养1~3 h后,在酶标仪上于450 nm处测定各孔吸光度。细胞的生长抑制率计算方法:抑制率%=(ODo-ODs)/ODo×100%(ODo:未转染组吸光度均值;ODs:质粒转染组吸光度均值)。
1.2.5 平板克隆实验:使用6孔板接种细胞,每孔铺300个细胞,放入37 ℃、5% CO2培养箱中培养,直到孔中出现肉眼可见的细胞克隆团(约2周)。900 μL 4%多聚甲醛固定细胞30 min,结晶紫染料染色20 min,洗去染色液,拍照记录实验结果。
1.2.6 流式细胞仪检测细胞周期实验:取对数生长期的各组细胞,调整细胞悬液浓度为1×106/mL,取1 mL细胞悬液于1.5 mL EP管中,用70%的冷乙醇固定(2 h至过夜),染色前用PBS洗去固定液,加100 μL RNaseA水浴30 min,加入400 μL PI染色混匀,4 ℃避光30 min,上机检测。
1.2.7 划痕愈合实验:取对数生长期的各组细胞,调整细胞浓度为1×106个/mL,接种于6孔板中,每孔2 mL培养液,待细胞生长融合约90%时,使细胞同步后,PBS洗涤细胞,用10 µL枪头沿直尺做划痕标记,PBS将划下来的细胞洗去,加入2%血清的细胞培养液,在显微镜下拍照,记为0 h。继续将细胞放在CO2培养箱中培养,分别在培养24 h、48 h、72 h、96 h后拍照;利用电子ruler测量细胞间距后,计算各组各时段的闭合率(%)=(Do-Ds)/Do×100%(Do:0 h细胞间距;Ds:其他时间段细胞间距)。
1.3 统计学处理方法 采用SPSS13.0统计软件进行统计分析。计量资料以 ±s表示,2组比较方差齐性,采用t检验,若方差不齐,则采用非参数检验;多组比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 GALNT6的表达 Real-time PCR结果显示,Mock组与NC组比,GALNT6 mRNA的表达量差异无统计学意义(P>0.05),而sh-GALNT6组与NC组比,GALNT6 mRNA的表达量明显降低,差异有统计学意义(P<0.05),见图1A。Western blot结果显示,Mock组与NC组相比,GALNT6蛋白的表达量差异无统计学意义(P>0.05),而sh-GALNT6组与NC组相比,GALNT6蛋白的表达量明显降低,差异有统计学意义(P<0.05),见图1B。

图1 稳定转染sh-GALNT6 MCF-7细胞模型的鉴定
2.2 沉默GALNT6抑制MCF-7细胞增殖 NC组细胞24 h、48 h、72 h的平均抑制率分别是0.72%、3.40%、1.48%,sh-GALNT6组细胞24 h、48 h、72 h的平均抑制率分别是8.40%、20.99%、17.79%,2组比较差异有统计学意义(P<0.05)。Mock组、NC组、sh-GALNT6组克隆团形成数分别为:97.00±8.89、94.33±2.96、29.33±4.81,与NC组相比,sh-GALNT6组细胞的体外增殖明显降低,差异有统计学意义(P<0.05),见图2。采用流式细胞仪对细胞的周期分布进行检测。以S期和G2期细胞所占比例作为衡量细胞周期分布差异的指标,Mock组与NC组相比,差异无统计学意义(P>0.05),而sh-GALNT6组(0.724±0.007)与NC组(1.021±0.038)比,S期和G2期细胞所占比例降低,差异有统计学意义(P<0.05),见图3。
2.3 沉默GALNT6对MCF-7细胞体外迁移的影响Mock组在24 h、48 h、72 h和96 h的闭合率分别是27%±3%、41%±2%、50%±3%、63%±3%;NC组在24 h、48 h、72 h 和96 h的闭合率分别是29%±4%、41%±3%、60%±4%、60%±3%;sh-GALNT6组在24 h、48 h、72 h和96 h的闭合率分别是9%±3%、14%±3%、28%±3%、30%±3%。Mock组与NC组细胞的迁移能力随着时间的推移而增加,在72 h达到最大值,2组细胞各时间段迁移情况比较差异没有统计学意义(P>0.05);sh-GALNT6组细胞的迁移能力也随着时间的推移而增加,但与NC组相比,迁移能力明显降低(P<0.05),见图4。
2.4 GALNT6对细胞增殖和迁移相关因子的影响Mock组与NC组相比,PCNA蛋白的表达量差异无统计学意义(P>0.05),而sh-GALNT6组与NC组比,PCNA蛋白的表达量明显降低,差异有统计学意义(P<0.05),见图5A。Mock组与NC组比,cyclinD1蛋白的表达量差异无统计学意义(P>0.05),而sh-GALNT6组与NC组比,cyclinD1蛋白的表达量明显降低,差异有统计学意义(P<0.05),见图5B。Mock组与NC组比,MUC1蛋白的表达量差异无统计学意义(P>0.05),而sh-GALNT6组与NC组比,MUC1蛋白的表达量明显降低,差异有统计学意义(P<0.05),见图5C。

图2 平板克隆实验检测各组细胞的增殖能力
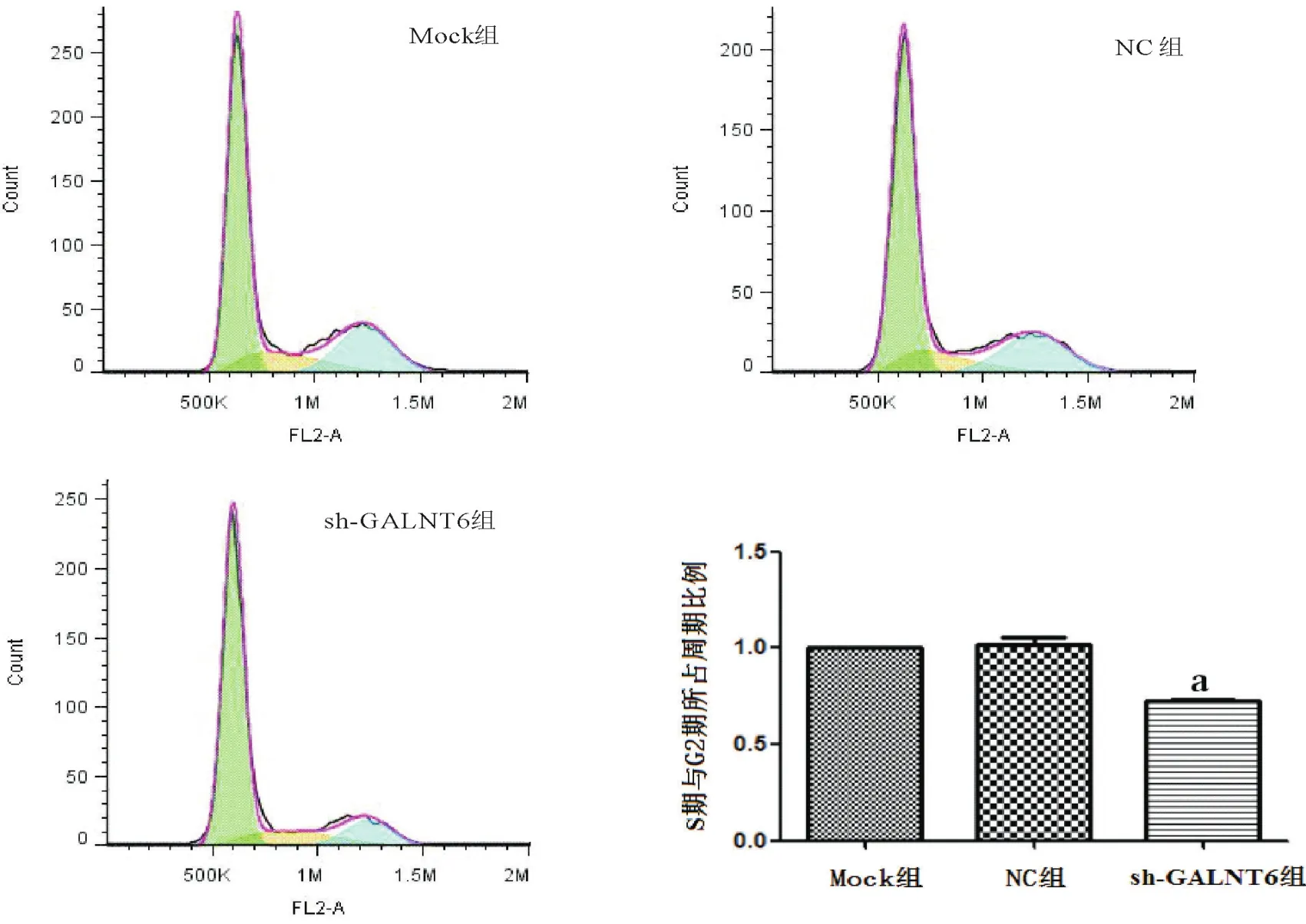
图3 流式细胞仪检测各组细胞周期的分布

图4 划痕实验检测各组细胞的迁移能力
3 讨论
糖基化是一种重要的蛋白翻译后修饰,肿瘤细胞蛋白质糖基化的改变直接影响着肿瘤的生长、黏附、迁移和免疫监视,而异常糖基化的糖蛋白在肿瘤的恶化侵袭及迁移中起着重要作用[6]。GALNT是一类研究较多的催化蛋白质O-糖基化修饰的起始糖基转移酶,将N-乙酰氨基半乳糖结合到蛋白质肽链的Ser或Thr上,由于糖蛋白表面糖链的异常变化可以影响改变细胞的正常生物特性,与肿瘤的发生发展密切相关[7],有研究[3]表明GALNT在乳腺癌中异常表达。GALNT6是GALNT家族的重要成员,研究发现,GALNT6在乳腺癌中处于高表达状态[4-5],但是其对乳腺癌细胞增殖和迁移的研究较少。
细胞增殖在肿瘤的发生发展中起着关键作用,肿瘤细胞增殖速度快,侵袭邻近组织并发生迁移,是肿瘤迁移过程中至关重要的一步[8-9]。本研究利用低表达GALNT6的乳腺癌细胞模型研究GALNT6与乳腺癌细胞增殖和迁移的关系,进一步了解GALNT6在乳腺癌发生发展中的作用,结果表明GALNT6低表达抑制乳腺癌MCF-7细胞的增殖和迁移。PCNA是增殖细胞核抗原因子,参与调节DNA的复制,使DNA复制与细胞功能相协调,与细胞的增殖密切相关,是反映肿瘤细胞增殖状态的良好指标[10]。有研究表明,它在细胞周期的G1期晚期和S期表达量达到峰值,不仅在DNA的合成中起直接作用,在DNA损伤修复、细胞周期控制、基因转录等方面也起着协调作用。本研究结果显示GALNT6低表达抑制PCNA的蛋白水平。细胞周期素在调节细胞周期的过程中起着关键作用,主要有cyclinA、cyclinB、cyclinD1及cyclinE 4种,其中cyclinD1在G1期向S期的发展过程中起调节作用,是细胞周期的启动子,它促进细胞从静止期进入细胞分裂周期,从而使肿瘤细胞增殖加快,有研究表示乳腺癌组织中cyclinD1表达增加是预后差的一种标志[11]。本研究检测结果显示,cyclinD1蛋白水平的表达呈下降趋势,表明低表达GALNT6后,细胞周期受到阻滞,并通过调节cyclinD1抑制了乳腺癌细胞的增殖。
MUC1蛋白是一种高糖基化、高分子量蛋白,又称附膜蛋白,是跨膜分子,同时也是GALNT6糖基化底物之一,并且GALNT6可通过MUC1分子发挥对乳腺癌的影响,它在维持上皮完整性和肿瘤的发生与迁移等方面都起到重要的作用[12-13]。由于MUC1在肿瘤组织中异常表达,使其成为一种重要的肿瘤生物学标志物[14]。本研究检测发现GALNT6低表达会抑制MUC1的蛋白水平,表明GALNT6与乳腺癌细胞MCF-7的迁移息息相关。
综上所述,GALNT6在乳腺癌细胞MCF-7增殖和迁移的过程中有着重要的作用,这表示GALNT6将来可能会成为治疗乳腺癌的分子靶点。
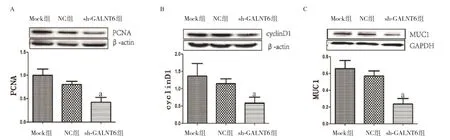
图5 Western blot检测各组细胞目的蛋白的表达水平
[1] SMITH R A, MANASSARAM-BAPTISTE D, BROOKS D, et al. Cancer screening in the United States 2015: a review of current American cancer society guidelines and current issues in cancer screening[J]. CA Cancer J Clin , 2015,65(1): 30-54.
[2] YANG M D, CHANG W S, TSAI C W, et al. Inhibitory effects of AVEMAR on proliferation and metastasis of oral cancer cells[J].Nutr Cancer, 2016, 68(3): 473-480.
[3] PARK J H, NISHIDATE T, KIJIMA K, et al. Critical roles of mucin 1 glycosylation by transactivated polypeptide N-acetylgalactosaminyltransferase 6 in mammary carcinogenesis[J]. Cancer Res, 2010, 70(7): 2759-2769.
[4] GAO Y, LIU Z, FENG J,et al. Expression pattern of polypeptide N-acetylgalactosaminyltransferase-10 in gastric carcinoma[J].Oncol Lett , 2013, 5(1): 113-116.
[5] PARK J H, NISHIDATE T, KIJIMA K, et al. Gritical roles of mucin 1 glycosylation by transactivated polypeptide N-acetylgalactosaminyltransferase 6 in mammary carcinogenesis[J]. Cancer Res, 2010, 70(7): 2759-2769.
[6] SCHJOLDAGER K T, CLAUSEN H. Site-specific protein O-glycosylation modulates proprotein processing - deciphering specific functions of the large polypeptide GalNActransferase gene family[J].Biochim Biophys Acta, 2012,1820(12): 2079-2094.
[7] VITIAZEVA V, KATTLA J J, FLOWERS S A, et al. The O-linked glycome and blood group antigens ABO on mucintype glycoproteins in mucinous and serous epithelial ovarian tumors[J].PLoS One, 2015, 10(6): e0130197.
[8] ZHANG Q, CHEN X, ZHANG X, et al. Knockdown of TMEM14A expression by RNAi inhibits the proliferation and invasion of human ovarian cancer cells[J]. Biosci Rep,2016, 36(1):e00298.
[9] CHIU K Y, WU C C, CHIA C H, et al. Inhibition of growth,migration and invasion of human bladder cancer cells by antrocin, a sesquiterpene lactone isolated from Antrodia cinnamomea, and its molecular mechanisms[J].Cancer Lett, 2016,373(2): 174-184.
[10] KUBBEN F J, PEETERS-HAESEVOETS A, ENGELS L G,et al. Proliferating cell nuclear antigen (PCNA): a new mark-
er to study human colonic cell proliferation[J].Gut,1994,35(4): 530-535.
[11] ARNOLD A, PAPANIKOLAOU A. Cyclin D1 in breast cancer pathogenesis[J].J Clin Oncol, 2015, 23(18): 4215-4224.
[12] BROCKHAUSEN I. Mucin-type O-glycans in human colon and breast cancer: glycodynamics and functions[J].EMBO Rep, 2006, 7(6): 599-604.
[13] REMMERS N, ANDERSON J, LINDE E, et al. Aberrant expression of mucin core proteins and o-linked glycans associated with progression of pancreatic cancer[J].Clin Cancer Res, 2013, 19(8): 1981-1993.
[14] KIM Y S, GUM J JR, BROCKHAUSEN I. Mucin glycoproteins in neoplasia[J]. Glycoconj J, 1996, 13(5): 693-707.
