山核桃干腐病拮抗细菌的鉴定及其抑菌效果1)
2018-01-15葛康康姚翰文潘佳亮郝昕马玲
葛康康 姚翰文 潘佳亮 郝昕 马玲
(东北林业大学,哈尔滨,150001)
山核桃(Caryacathayensis)是胡桃科(Juglandaceae)山核桃属(Carya)的一种干果树种,落叶乔木[1],具有很高的经济价值和广阔的发展前景[2]。山核桃干腐病是近几年才出现的重要病害,不但影响山核桃的果实产量,而且会削弱树势,严重时甚至会导致树木过早死亡,并造成重大经济损失,该病在浙江临安、淳安、桐庐一带发生比较普遍,植株发病率达80%~100%,最严重的造成全株或枝干干枯死亡[3]。2011年首次报道山核桃干腐病病原菌为Botryosphaeriadothidea,属于子囊菌门葡萄座腔菌科(Botryosphaeriaceae)的葡萄座腔菌属(Botryosphaeria)[4]。目前对山核桃干腐病的防治主要停留在物理防治和化学防治阶段。章顺来的研究表明,山核桃干腐病病部病斑少时,一般采取刮除病部后涂药;病斑多时,病部划伤后喷80% 402抗菌剂200倍液的方法进行防治[5]。张传清等报道V(戊唑醇)∶和V(腐霉利)=1∶5复配后对山核桃干腐病具有协同增效作用[6]。化学药剂的使用不仅会破坏生态环境,而且影响果实品质,甚至可能造成食品安全问题。为了能够解决以上问题,寻找能够高效防治山核桃干腐病的低毒或无毒生防制剂势在必行。
生物防治具有无毒、无残留和无污染等特点,枯草芽孢杆菌(Bacillussubtilis)是一种嗜热的好氧革兰氏阳性菌[7-8],能够抑制多种根部病害、枝干病害、叶花部病害的病原菌[9],是一种理想的生防微生物。范青等用从北京苹果园土壤中分离的枯草芽孢杆菌B-912防治柑桔青霉病、绿霉病均取得较好的抑制效果[10],何红等[11]发现来自辣椒体内的枯草芽孢杆菌菌株对香蕉炭疽病菌菌丝生长、分生孢子形成及萌发等有较强的抑制作用,林东等发现枯草芽孢杆菌对水稻白叶枯病菌具有强烈的抑菌作用[12]。本研究在山核桃干腐病病原菌的培养过程中分离到1株具有抑菌活性的生防菌,并对其进行了分离纯化、抑菌活性测定和鉴定等方面的研究,以期为山核桃干腐病的生物防治提供参考。
1 材料
1.1 供试菌株
山核桃干腐病病原菌来自浙江林业科技大学病理组病理实验室,枯草芽孢杆菌菌株BS111分离自环境中,二者均保存在东北林业大学林学院。
1.2 培养基
马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。
牛肉膏蛋白胨固体培养基(LB):牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂20 g,水1 000 mL,pH=7.4~7.6,121 ℃高压蒸汽灭菌20 min。
LB液体培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,水1 000 mL,pH=7.4~7.6,121 ℃高压蒸汽灭菌20 min。
2 研究方法
2.1 拮抗菌BS111的分离纯化
在培养核桃干腐病菌的过程中,分离到1株对核桃干腐病菌有明显抑制作用的拮抗细菌,采用划线法用接种环挑取单菌落将其在牛肉膏蛋白胨固体培养基上进行划线培养,28 ℃培养24 h后,对菌落大小、色泽、表面光滑度及边缘形状等进行观察,并挑取单菌落进行纯化[13],命名为BS111,将纯化后的菌种在冰箱中4 ℃保存备用。
2.2 拮抗菌BS111的鉴定
采用CTAB法提取DNA,PCR扩增,经1%琼脂糖凝胶电泳后将未纯化产物送往北京生物工程科技有限公司进行测序。测序引物为27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACGACTT-3′。根据16 S rDNA的测序结果,在NCBI上应用BLAST进行序列比对,结合GenBank中芽孢杆菌属中的15个种的16 S rDNA,利用MEGA5.1软件和ClustalW软件绘制系统发育树。
根据《常见细菌系统鉴定手册》[15]《微生物学实验手册》[15]进行鉴定,分别进行接触酶、V-P测定、厌氧生长、糖发酵产酸、醇发酵产酸、水解淀粉、柠檬酸盐利用、苯丙氨酸脱氢酶、硝酸盐还原、吲哚实验、酪素水解、7% NaCl耐受度、pH=5.7耐受度、高温65 ℃耐受度等生理生化鉴定。将生防菌在LB固体培养基上进行划线培养,观察菌落形态,并进行芽孢染色和鞭毛染色。
2.3 拮抗菌BS111的抑菌活性测定
采用平板对峙法进行拮抗菌的抑菌活性测定[16]。用打孔器(Φ=4 mm)在培养3 d的山核桃干腐病病原菌菌落边缘打取菌饼,接于PDA平板中央,在其四周距培养皿边缘25 mm处接种拮抗菌,以不接拮抗菌为对照,于恒温箱中25 ℃培养,每个处理3个重复。测量抑菌圈直径。
2.4 不同发酵时间拮抗菌BS111发酵液抑菌活性的测定
挑取拮抗菌BS111单菌落,接种到LB液体培养基中,150 r/min,25 ℃摇床振荡培养;每隔2 h取一次样,测生长曲线(OD600)。取发酵液4 ℃、8 000 r/min、离心30 min,取上清液过0.22 μm滤膜,制成无菌滤液,每隔12 h取一次样,测无菌滤液对山核桃干腐病病原菌抑菌活性;比较生长曲线和抑菌活性随时间变化的关系,以及抑菌活性物质积累的最佳培养时间,以未接菌的培养液为对照。
抑菌率=(对照组菌丝直径-试验组菌丝直径)/(对照组菌丝直径-0.4)×100%。
2.5 不同体积分数拮抗菌BS111发酵液抑菌活性的测定
取摇床培养72 h的无菌滤液溶于50 ℃ PDA,制成体积分数为15.00%、10.00%、7.50%、5.00%、2.50%、1.25%的带药平板,用打孔器(Φ=4 mm)在培养3 d的山核桃干腐病病原菌菌落边缘打取菌饼,接于带药平板中央,3 d后测菌丝直径,并计算抑菌率,每组3次重复。
2.6 拮抗菌BS111发酵液抑菌活性稳定性的测定
热处理对发酵液抑菌活性的影响:取相同体积的6份发酵上清液通过0、10、20、30、40、50 ℃水浴锅处理30 min,以未处理的无菌滤液为对照,过0.22 μm滤膜,测抑菌活性。
酸碱处理对发酵液抑菌活性的影响:取相同体积的7份发酵上清液,分别用1 mol/L HCl和1 mol/L NaOH调节发酵上清液,pH值为3.0、4.5、5.5、6.5、7.5、8.0、9.0,静置2 h后,再用1 mol/L HCl和1 mol/L NaOH调到pH为7.0,以未处理的无菌滤液为对照,过0.22 μm滤膜,测抑菌活性。
紫外线处理对发酵液抑菌活性的影响:取相同体积的4份发酵上清液分别放在紫外光下照射15、30、60、120 min,以未处理的无菌滤液为对照,过0.22 μm滤膜,测抑菌活性。
2.7 拮抗菌无菌滤液对山核桃干腐病病原菌菌丝生长的影响
在培养3 d的山核桃干腐病病原菌菌落边缘打取菌饼,接于带有无菌滤液的PDA带药平板中央,以未接菌的培养液为对照,3 d后挑取菌丝在光学显微镜下观察其形态变化。
3 结果与分析
3.1 拮抗菌BS111培养性状
在牛肉膏蛋白胨培养基上培养24 h的菌株(图1),菌落为白色椭圆形,边缘整齐,中间凹陷有褶皱,表面比较粗糙,不透明,在液体培养基上培养2 d有菌膜产生,革兰氏染色为阳性。

图1 拮抗细菌BS111的培养性状
3.2 拮抗菌BS111 16 S rDNA分子鉴定
菌株BS111的16 S rDNA经PCR扩增得到1条约为1.5 kb的特征带(图2),将PCR后的片段送交北京生物工程进行测序,测序结果表明,该菌株16 S rDNA序列全长为1 129 bp,该序列通过NCBI(http:
www.ncbi.nlin.nili.gov)进行BLAST比对,其中,BS111与JQ308575Bacillussubtilis的同源性最高,达到99%。
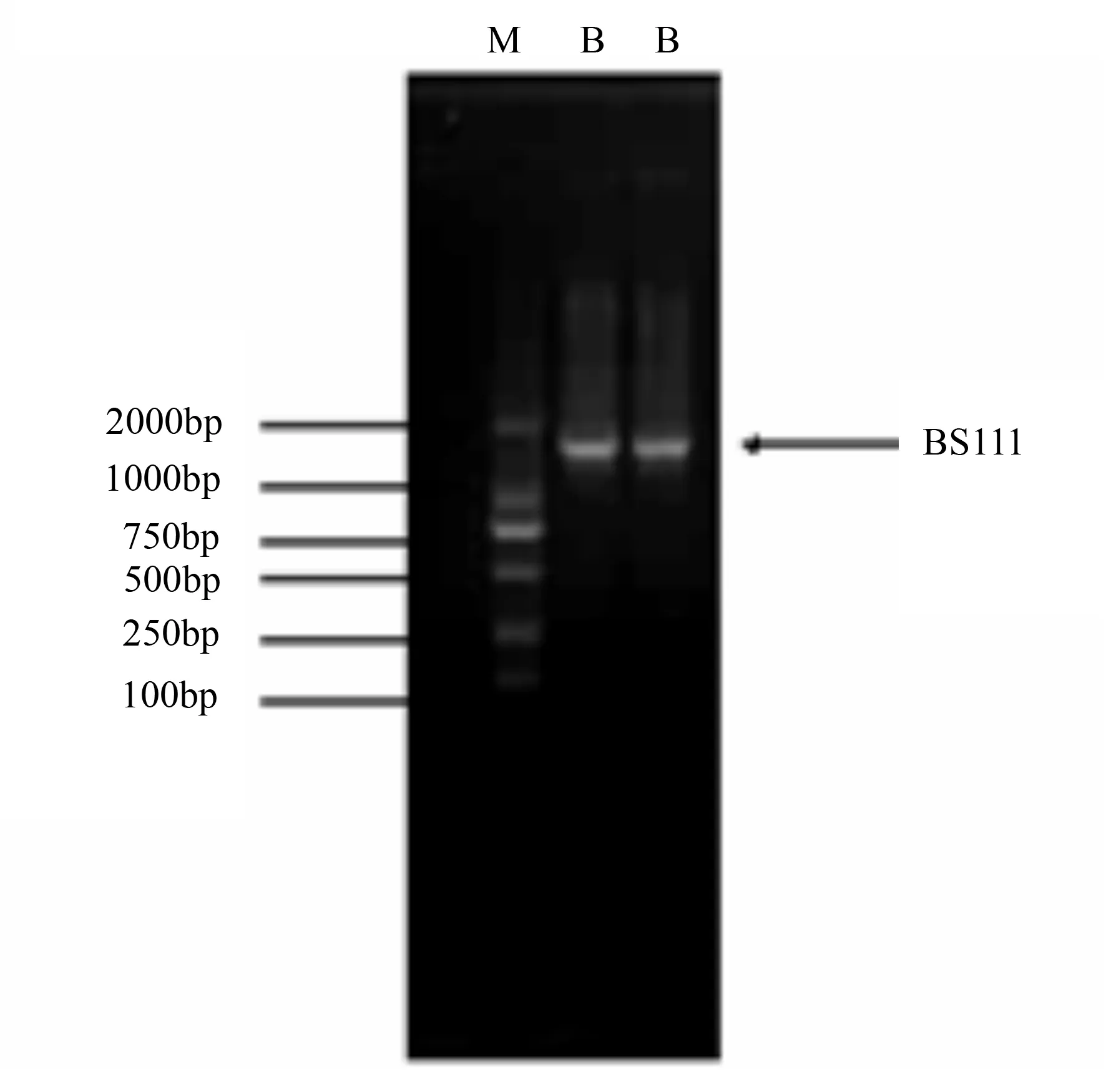
M.2 kb Mark;B.BS111菌株。
将得到的菌株BS111序列与Genbank中的枯草芽孢杆菌、蜡状芽孢杆菌(B.cereus)、解淀粉芽孢杆菌(B.amyloliquefaciens)、甲基营养型芽孢杆菌(B.methylotrophicus)、死谷芽孢杆菌(B.vallismortis)、贝莱斯芽孢杆菌(B.velezensis)等菌株的16 S rDNA序列进行比对。从图3的系统发育树可看出,不同的芽孢杆菌种间自然地形成不同的分支,BS111位于枯草芽孢杆菌的分支中,且与登录号为JQ308575的枯草芽孢杆菌的序列相似性高达100%。

图3 拮抗菌株BS111的16S rDNA序列系统发育树
3.3 拮抗菌BS111生理生化鉴定
对菌株BS111各项生理生化指标的测定结果表明,接触酶反应为阳性,V-P测定呈阳性,能够利用葡萄糖和甘露醇,并且产酸,但不产气,厌氧条件下不能生长,能够利用柠檬酸盐,不能形成吲哚,苯丙氨酸脱氢酶反应为阴性,能够水解淀粉,在7% NaCl培养基上能够生长,在65 ℃高温条件下不能生长,在pH=5.7的酸性条件下不能生长。通过与枯草芽孢杆菌进行对比,发现BS111除不能在pH=5.7的酸性条件下生长外,其余都与枯草芽孢杆菌的生理生化指标相同,故可以鉴定BS111为枯草芽孢杆菌。
3.4 拮抗菌株BS111对山核桃干腐病病原菌的抑制作用
通过平板对峙法可以看出,枯草芽孢杆菌BS111菌体能够抑制山核桃干腐病病原菌的生长(图4)。抑菌圈平均直径为18 mm。

图4 拮抗菌BS111对山核桃干腐病病原菌的抑制作用
3.5 拮抗菌BS111生长曲线及抑菌活性随时间变化情况
对拮抗菌BS111生长曲线进行测定,以检测菌体生长状况。结果如图5所示,枯草芽孢杆菌BS111在12~24 h为对数期,24 h后菌体数量进入稳定期,36 h后菌体进入衰亡期。对不同时间点的无菌滤液进行抑菌能力测定,无菌滤液在前12 h抑菌率几乎为0,此时无菌滤液对山核桃干腐病病原菌几乎无抑制效果,在24 h时抑菌率迅速增长至70.65%,在24~60 h,抑菌率变化在70.65%~77.85%,变化差异不明显,在60~72 h,抑菌效果有明显提高,最高抑菌率为83.26%。此结果表明,无菌滤液在不同时间段内抑菌差异显著(P<0.05)。

图5 拮抗菌株BS111生长曲线与无菌滤液抑菌率
3.6 拮抗株BS111发酵液抑菌活性及其稳定性
对不同体积分数发酵液抑菌活性的测定结果见图6。随着发酵液体积分数的降低,抑菌率明显降低,其中15%的抑菌效果最好,抑菌率为86.82%(表1),该拮抗菌的EC50为4.16%,回归方程为y=1.942x-1.203,相关系数为0.969。

表1 不同体积分数拮抗菌株BS111发酵液的抑菌活性
注:表中数据为平均值±标准差,同列数据后不同小写字母表示差异显著(P<0.05)。
0、10、20、30、40、50 ℃水浴分别处理30 min后的BS111无菌滤液对山核桃干腐病的抑菌活性见表2。从表2可以看出,用不同温度处理过的无菌滤液抑菌效果有明显区别。0 ℃处理后发酵上清液对山核桃干腐病病原菌的抑菌效果最好,抑菌率为(62.29±0.13)%,远远大于对照组抑菌率(42.94±0.11)%,在0~20 ℃,抑菌率虽然有下降趋势,但是都高于对照组,在30~50 ℃时,抑菌率和对照组差异不显著。由此可以看出,该无菌滤液在0~20 ℃低温条件下的抑菌效果比高温条件下好,在30~50 ℃高温条件下抑菌效果差异不明显。

a.15%的发酵液;b.10%的发酵液;c.7.5%的发酵液;d.5%的发酵液;e.2.5%的发酵液;f.1.25%的发酵液;CK.对照组。
经不同酸碱处理后的无菌滤液的抑菌活性有显著变化。pH=3.0~5.5处理2 h后,抑菌率为(33.38±0.24)%~(36.59±0.28)%,明显小于对照组抑菌率(40.49±0.35)%,经pH=6.5~8.0处理2 h后抑菌率为40%~43%,与对照组差异不明显,经pH=9.0处理2 h后,抑菌率为(46.62±0.23)%,明显大于对照组。由此可以看出,无菌滤液的抑菌活性随着pH的升高,抑菌活性上升,且在pH=9.0时抑菌效果最好,无菌滤液在pH=6.5~8.0时抑菌活性稳定。无菌滤液经紫外处理后,抑菌率高于或接近对照组,并且随着紫外处理时间的延长,抑菌效果有明显提高,120 min时抑菌效果最好,抑菌率为(57.55±0.18)%。

表2 拮抗菌株BS111发酵液抑菌活性稳定性
注:表中数据为平均值±标准差,同列数据后不同小写字母表示差异显著(P<0.05)。
3.7 拮抗处理后山核桃干腐病病原菌菌丝生长的显微观察
对照组和处理组菌丝的显微形态观察结果表明,山核桃干腐病病原菌菌丝经拮抗菌BS111无菌滤液处理后菌丝形态出现异常。对照组菌丝在生长过程中,菌丝细长,处理组菌丝表现出菌丝变粗,弯曲,有褶皱,部分原生质体消失,菌丝顶端膨大变粗等特点(图7)。
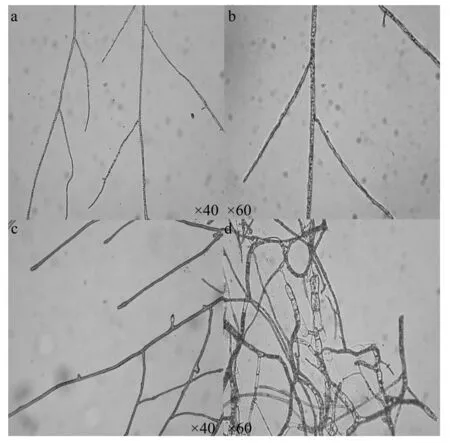
a、b.为正常生长的菌丝;c、d.为发酵液处理过的菌丝。
4 结论与讨论
目前,对山核桃干腐病的防治主要采用化学药剂,但化学药剂在防治病害的同时也对当地生态产生严重的影响,因此高效低毒的生防制剂产品成为山核桃生产发展的迫切需要[17]。枯草芽孢杆菌是一种非常广谱的拮抗细菌,侯珲等发现枯草芽孢杆菌对番茄茎基腐烂病菌和葡萄灰霉病菌具有抑制作用[18],吴丽媛从土壤中分离出能够抑制甜瓜细菌性果斑病的拮抗细菌枯草芽孢杆菌[19],吴辉等从土壤中分离到1株具有高效拮抗辣椒疫霉菌(Phytophthoracapsici)的生防菌Bs04[20],本研究分离到的拮抗菌BS111对山核桃干腐病病原菌具有较好的抑菌效果,经鉴定拮抗菌BS111为枯草芽孢杆菌。关于枯草芽孢杆菌防治山核桃干腐病病的研究在国内尚鲜见相关报道,这为山核桃干腐病生防制剂开发提供了材料。
本研究通过对拮抗菌无菌滤液的抑制作用测定表明,拮抗菌无菌滤液能够显著抑制山核桃干腐病病原菌菌丝生长,且在发酵72 h时抑菌效果最好,这说明拮抗菌在培养过程中产生能够抑制山核桃干腐病病原菌菌丝生长的次生代谢产物,由此表明拮抗菌BS111在大量发酵后对山核桃干腐病的防治具有很好的应用价值。本研究对拮抗菌BS111进行了鉴定,并对其拮抗作用和抑菌活性进行了研究,而对其发酵条件的优化、抗菌活性物质的提取鉴定及田间防效还有待于进一步深入研究。
拮抗细菌在植物病害防治中起到非常重要的作用。林业上施用的生物抗生素或其他拮抗蛋白等和常规有机合成农药一样,都要受到环境的影响[21]。在生物农药的活性成分分离、提纯、浓缩等所有的生产加工过程中也都需要获得其对光、热等各种条件的稳定性。本研究研究了其发酵产物在经过紫外线、热、酸碱等条件的处理后抗菌活性的变化,表明该拮抗菌具有很好的生防潜力。
吴辉等[20]通过光学显微镜观察Bs04对辣椒疫霉菌丝形态的影响,发现菌丝分支增多、顶端畸形、原生质浓缩及生长缓慢等现象。本试验显微观察抑菌作用的结果为菌丝变粗、弯曲、有褶皱、部分原生质体消失、菌丝顶端膨大变粗等特点,对于具体抑菌机理有待进一步的研究。
[1] 薛波.大别山山核桃品种类型及其品质的研究[D].合肥:安徽农业大学,2013.
[2] 张传清,徐志宏,孙品雷,等.新病害:山核桃果实黑斑病病原菌的鉴定[J].植物保护,2010,36(4):160-162.
[3] 王璇.山核桃干腐病病原菌的鉴定及其系统发育分析[D].杭州:浙江农林大学,2013.
[4] 王璇,马良进,吕全,等.山核桃干腐病病原菌的鉴定[J].浙江农林大学学报,2014,31(2):238-245.
[5] 章顺来.山核桃干腐病的防治[J].新农村,2007(9):15.
[6] 张传清,徐志宏,孙品雷,等.基于侵染特性的山核桃干腐病防治技术[J].中国森林病虫,2011,30(3):43-45,35.
[7] OBAGWU J, KORSTEN L. Integrated control of citrus green and blue molds usingBacillussubtilisin combination with sodium bicarbonate or hot water[J]. Postharvest Biology and Technology,2003,28(1):187-194.
[8] EMMERT EA, HANDELSMAN J. Biocontrol of plant disease: a (gram-) positive perspective[J]. FEMS Microbiol Lett,1999,171(1):1-9.
[9] 杨佐忠.枯草杆菌拮抗体在植物病害生物防治中的应用[J].四川林业科技,2001,22(3):41-44.
[10] 范青,田世平,李永兴,等.枯草芽孢杆菌(Bacillussubtilis)B-912对采后柑桔果实青、绿霉病的抑制效果[J].植物病理学报,2000,30(4):343-101.
[11] 何红,蔡学清,关雄,等.辣椒内生枯草芽孢杆菌(Bacillussubtilis)BS-2和BS-1防治辣椒炭疽病研究[J].植物病理学报,2003,33(2):170-173.
[12] 林东,徐庆,刘忆舟,等.枯草芽孢杆菌SO113分泌蛋白的抑菌作用及抗菌蛋白的分离纯化[J].农业生物技术学报,2001,9(1):77-80.
[13] 邓刚,屈星,陈秀蓉,等.甘肃番茄细菌性斑点病病原菌鉴定[J].植物保护,2008,34(5):47-51.
[14] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[15] 周德庆.微生物学实验手册[M].上海:上海科学技术出版社,1986.
[16] 贾凤安,陈亮,陈立,等.大棚甜瓜三种主要真菌病害拮抗细菌的筛选与鉴定[J].植物保护学报,2010,37(6):505-510.
[17] 翟慧者,胡同乐,陈曲,等.10种化学杀菌剂对苹果树腐烂病的防效评价[J].植物保护,2012,38(3):151-154,171.
[18] 侯珲,朱建兰.枯草芽孢杆菌对番茄茎基腐病菌和葡萄灰霉病菌的抑制作用研究[J].甘肃农业大学学报,2003,38(1):51-56.
[19] 吴丽媛.甜瓜细菌性果斑病生防菌的筛选及其抑菌机理的初步研究[D].呼和浩特:内蒙古农业大学,2013.
[20] 吴辉,潘梦武,高易宏,等.辣椒疫病生防菌的筛选、鉴定及其抑菌机理初探[J].湖北农业科学,2015(7):1596-1599.
[21] 朱昌雄,白新盛,张木.生物农药的发展现状及前景展望[J].上海环境科学,2002,21(11):654-657,661.
