两种实验废液在开放实验教学中综合利用的探索
2018-01-15孟春霞毛丽莉高先池
孟春霞 毛丽莉 高先池
化学实验虽然能使学生领悟和感受到科学给人类创造的文明,但同时也伴随着对环境的污染和对人类的危害[1]。中国海洋大学化工学院实验教学中心每年为9个院系20多个专业的3 000多名本科生开设100多个化学实验,实验内容包括化学物质分析与检测、物质及材料制备、天然产物提取分离等。这些实验所涉及的试剂和药品的种类多达上百种,在废物处置过程中还会产生新的物质,可能产生次生危害。探索研究如何低能耗、经济化地对实验废液进行综合利用也成为实验室环境治理中的一项重要课题。
开放实验强调对学生独立思考问题和解决问题能力的培养,学生在实验过程中成为名副其实的“主体”,从 “封闭的束缚态”转变为 “开放的自由态”[2-3]。通过开放实验的方式和实践平台,把实验废液的回收利用引入学生开放实验的研究中,可以调动学生参与实验的积极性,并在实践过程中获取知识、开阔视野、培养综合实践能力。本文针对无机及分析化学实验室产生量比较大的两种废液在开放实验教学中的综合利用进行初步的探讨。
1 含铬废液
无机实验室收集的含铬废液一般是酸性(pH≈1),其中铬主要以Cr3+和Cr2O27-的形式存在,溶液中还存在K+、Na+、NO-3、SO24-等。另外,元素实验中产生的部分含铬废物以BaCrO4、PbCrO4、AgCrO4沉淀形式存在,沉淀中还存在部分的BaSO4、AgCl等。Cr6+的毒性比 Cr3+大100倍,它能诱发皮肤溃疡、贫血、肾炎及神经炎等[4]。总铬和六价铬均属环保部规定的Ⅰ类污染物,城镇污水处理厂最高排放浓度要求总铬的含量不超过0.1 mg/L,Cr6+的含量不超过0.05 mg/L[5]。
1.1 实验原理
根据实验室含铬废液的特点选用还原—沉淀—氧化法,将废液中的铬回收利用制备重铬酸钾,重新应用到实验中。实验原理如下:1)将废液和底部的沉淀摇匀后,用盐酸调节废液的酸度 (pH=3),然或按1∶1.5的量加入Na2SO3,六价铬被还原为三价铬:
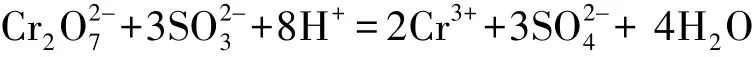
2)将反应后的废液过滤,滤液中主要为Cr3+,以及 K+、 Fe3+、 Na+、 NO-3、 SO24-等。 将过滤后的滤液用2 mol/L的KOH溶液调节pH =7.0~8.0,使Cr3+全部转化为Cr(OH)3沉淀,静置过夜,过滤沉淀,洗涤。滤液用分光光度法测定其中的铬含量是否达到排放标准。在沉淀中,加入1.5倍用量的6H2O2,以KOH调节溶液的pH值 (pH=10.0),使Cr(Ⅲ)充分氧化为Cr(Ⅵ)。溶液置于蒸发皿中加热除去过量的H2O2,蒸发浓缩至有少量晶体析出,趁热过滤,滤液冷却至室温后转移至冰浴中即可析出重铬酸钾晶体。
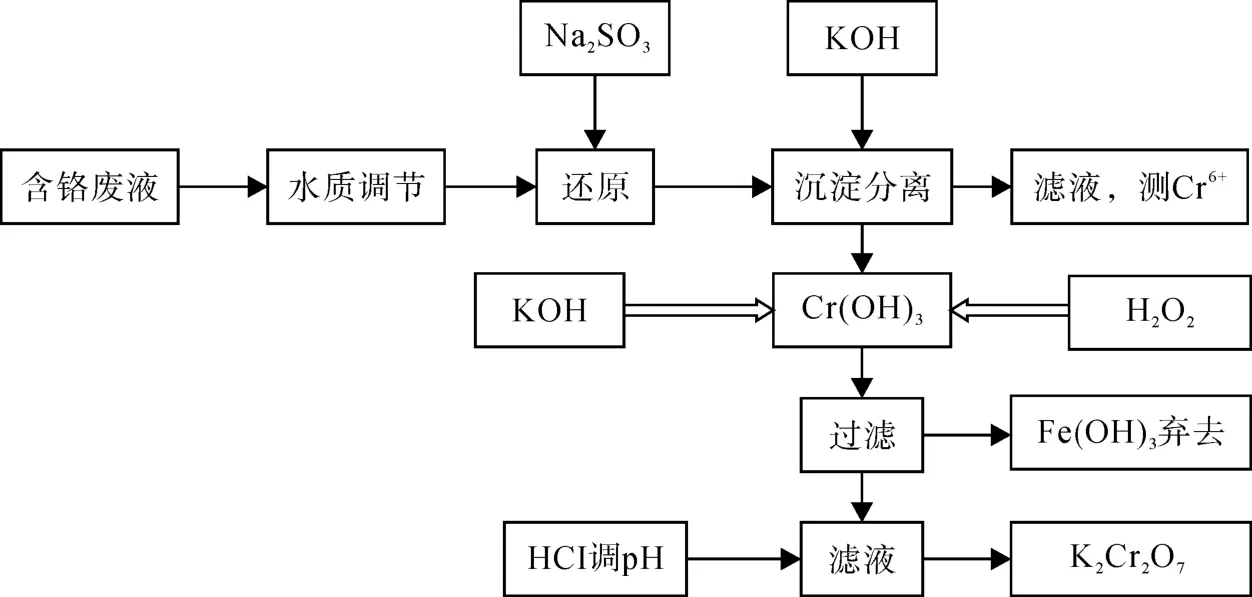
图1 重铬酸钾的制备流程图
1.2 利用含铬废液开设综合性开放实验的设计
开放实验要求学生用原子吸收光谱法和比色法测定废液中的总铬、铬 (Ⅵ)含量,并据此设计出还原—沉淀—氧化法回收制备重铬酸钾。实验过程中涉及废液pH的测定、Cr(Ⅵ)的测定、总铬的测定、还原剂的选择、还原剂的实际用量、氧化剂的选择、氧化时pH值的选择、重铬酸钾纯度的测定、分光光度计及原子吸收光谱的使用等,这些问题都由学生自行设计并组织实施,自行分析实验结果并得出结论。
1)Cr6+的还原和提纯。
准确移取一定量的实验室收集的含铬废液,用6 mol/L的HCl调节pH=2.0~3.0,根据废液中铬的含量,加入1.5倍用量的亚硫酸钠并不断搅拌,使废液中的Cr(Ⅵ)以及部分的含铬沉淀充分还原为Cr(Ⅲ),过滤,滤液用KOH调节pH值为7.0~8.0,静置过夜,使Cr3+完全沉淀为Cr(OH)3,同时沉淀还有Fe(OH)3,减压过滤分离沉淀和滤液。
2)Cr3+的氧化及重铬酸钾的制备。
Cr(OH)3用去离子水洗涤后,加入1.5倍用量的6H2O2,使Cr(Ⅲ)充分氧化为Cr(Ⅵ)。加入KOH调节溶液的pH=10.0,用酒精灯加热除去溶液中过量的H2O2,利用玻璃砂芯漏斗过滤除去溶液中的杂质。用6 mol/L的HCl调节溶液的pH=1.0~2.0,置于蒸发皿中蒸发浓缩至有少量晶体析出,趁热过滤,滤液冷却至室温后转移至冰浴上即可得到重铬酸钾晶体。将所得到的晶体重结晶除去残留的KCl后,干燥称重。
3)废液中Cr6+的测定。
准确移取20.00 mL的滤液,转移至50 mL的容量瓶中,加入 0.50 mL的硫酸-磷酸混酸,2.50 mL的二苯碳酰二肼溶液,定容,摇匀。静置10 min后,以试剂空白为参比,用1 cm的比色皿,于540 nm波长处测量吸光度(A),计算滤液中Cr6+含量,看是否达到排放标准。
4)重铬酸钾纯度的测定。
准确称取制备的重铬酸钾样品0.20~0.22 g溶于250 mL的容量瓶中,用移液管吸取25.00 mL该溶液置于250 mL碘量瓶中,加入10 mL 2 mol/L H2SO4和2 g碘化钾,放于暗处5 min,然后再加入100 mL水,用Na2S2O3标准溶液滴定至溶液变成黄绿色,然后再加入3 mL淀粉指示剂,再继续滴定至蓝色褪去并呈亮绿色为止。发生的反应如下:
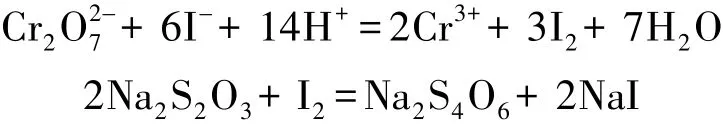
学生在独立完成综合性开放实验的情况下,不但掌握了实验的原理,仪器的基本操作,实验的影响因素以及如何选择最佳的实验条件,而且提高了理论联系实际的能力。
2 含碘废液
碘及碘化钾是实验室常用的化学试剂,消耗量大,但其价格昂贵。“化学反应速度与活化能的测定”实验是大学化学实验中必做的一个实验,实验中用到大量的碘化钾,实验结束后产生大量的含碘废液。若将这些废液直接排放,不仅造成碘资源的巨大浪费,也对环境造成极大的危害[6]。因此,利用含碘废液为学生开设开放实验,回收废液中的碘,具有较好的经济及环境意义。
2.1 实验原理
“化学反应速度与活化能实验测定”产生的含碘废液中碘的主要存在形式为 I-和 I2。加入Na2S2O3溶液,废液中的I2即可转化为I-。在溶液中加入Cu2+,I-转化成CuI沉淀析出[7-8]。废液中发生的反应为:
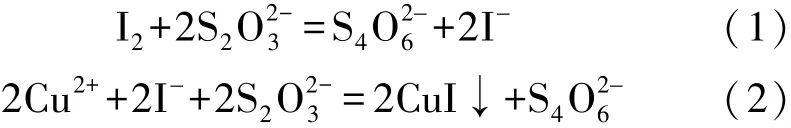
式 (2)的平衡常数为1.78×1026,在Cu2+稍过量的情况下,废液中的I-几乎全部沉淀出来。
由金属活动性顺序,Cu能被Fe置换,还原成单质铜。因此用铁粉或清洁的铁屑,可将CuI变为FeI2溶液和金属铜沉淀析出。然后在FeI2溶液中加入K2CO3溶液,可得到FeCO3沉淀和KI溶液。将KI溶液蒸发浓缩,得到固体KI[9]。反应原理为:
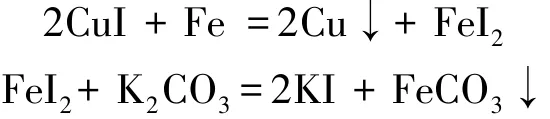
2.2 利用含碘实验废液制备单质碘及制备碘化钾
“化学反应速度与活环能”实验废液中的碘可能以I-、I2、IO-3等形式存在,从废液中提取碘之前,必须要定性测定碘的存在形式和准确测定碘的含量。先将单质碘用四氯化碳萃取并与其他形式碘分离,再判断I-、IO-3是否存在[10-11]。
1)废液中碘含量的测定。
准确移取50.00 mL废液,加入20 mL CCl4萃取后,使废液中的I2全部转移到CCl4中。用水洗涤两次废液后,加入0.1 moL/L的KI溶液,放置5 min后,利用碘量法测定CCl4中碘的含量。
2)碘化钾的制备。
碘与氢氧化钾反应完全后,所得固体混合物(KI、KIO3及未反应的KOH)加少量蒸馏水溶解,往溶液中缓慢加入甲酸溶液还原碘酸钾,再用KOH调pH值为9~10,通入蒸汽,保温1~2 h,静置过滤,得到清亮的溶液,蒸发浓缩至大部分结晶析出,再经冷却结晶、离心分离、干燥(110℃),制得碘化钾成品。
沉淀碘的反应平衡常数很大,Cu2+的加入量比理论计算量过量2[12]即可保证I-完全沉淀。碘化亚铜见光易分解,因此沉淀碘化亚铜时应尽量在暗处进行。陈化温度稍高一些,可适当缩短陈化时间,但温度过高时,碘化亚铜部分分解。通常室温下陈化4 h即可。
3)碘化钾纯度的测定。
准确称取0.1 g左右的KI,溶于50 mL去离子水中。加入5醋酸溶液5 mL、3滴曙红钠指示剂(5 g/L),用AgNO3标准溶液避光滴定至沉淀呈红色,记录体积,平行测定三份[9,13],计算碘化钾的含量。
3 开放实验的组织与考核
3.1 实验方案设计与实施
在整个开放实验过程中,学生每3~5人为一个小组,每个小组中设有方案总控负责人、文献查询负责人、实验设计负责人等,每位学生根据自己的兴趣和意愿选择承担某一部分工作[14]。根据实验要求及目的查阅相关资料,以组为单位上交实验设计方案。例如在含铬废液处理的试验中,学生根据查阅的文献资料设计了不同的实验方案,其中还原剂的选择有Fe粉、Na2SO3、NaHSO3、FeSO4等;在调节 pH值上选择的试剂有 HCl、H2SO4、NaOH、生石灰等;氧化剂的选择有H2O2、KMnO4等。指导老师组织学生以小组为单位对设计的实验方案进行讨论,给大家相互学习的机会,启发式的提示该实验涉及的相关理论知识。最后,指导老师对每个小组设计的实验方案进行审查,从实验方案的安全性、可行性以及实验室现有的条件等方面来确定最终的实验方案。
在进行实验之前,指导教师先给参与实验的学生发放相关的资料,如废液的铬含量测定中涉及原子吸收光谱、可见分光光度计的使用方法,标准溶液的配置方法,酸度计的使用方法,缓冲溶液的配置,原子吸收光谱的工作原理等资料。其次,对实验中涉及的原子吸收光谱、分光光度计、酸度计等仪器的使用进行简单的培训。各实验环节的工作由小组成员合作完成,让学生在已掌握基础知识和实验技能技巧的基础上,选择适当的方案来解决问题。
3.2 实验考核与总结
开放实验主要是从实验预习、实验操作、实验记录、实验报告、实验结束的后续工作等方面对学生的考核。实验结束后,学生要完成总结性的实验论文,内容包括研究意义、文献综述、理论依据、实验过程、结果及讨论和收获。论文完成后,指导老师组织答辩,给学生一个展示自己完成整个实验的过程及体会的机会。通过总结讨论,参与的学生能够深刻地认识实验室废液处理的意义,理解综合设计性实验的内涵。
4 体会与思考
利用实验废液为学生开设综合性开放实验,能够激发学生的学习兴趣,由被动实验到主动实验,不但巩固了理论知识,而且还提高了学生运用所学知识分析问题和解决问题的能力,为专业课的学习打下了坚实的基础。总结学生在整个开放实验过程中出现的问题,提出以下两个方面的建议。
1)对开放实验的指导教师而言,适时地指导起着不可或缺的作用。开放实验进行之前,需要指导学生查阅相关的文献资料,对学生设计的实验方案进行筛选,主要考虑实验方案的安全性、可行性以及实验室现有的条件;实验进行过程中,需要对学生进行必要的仪器操作培训及大量的预实验准备,同时要注重引导学生掌握实验的整体思路和相关理论,培养学生的动手操作能力;实验结束后,引导学生对实验过程进行总结,提高学生的总结表达能力。
2)对参与开放实验的学生而言,在实验进行前需要写出详细的实验步骤和方法,以及实验过程中需要用到的仪器和试剂;在整个实验过程中必须实事求是地记录实验内容,总结实验结果;在实验结束后,要及时整理数据,结合实验过程中出现的问题,提出自己的体会和建议。学生经过查询整理资料、自主动手实验与分析处理实验数据,能够有效提升自身的综合能力。
5 结束语
以实验废液作为开放实验的原材料,不但有利于及时处理实验室大量的废液,降低实验室的环境污染,也有利于节约实验费用,符合绿色化学实验的要求。实验室废液综合利用的开放实验内容丰富且有一定难度,参与的学生在掌握了相关背景知识的同时,在动手能力、创新自主能力、分析判断和解决问题能力以及团队协作性方面均得到了提高。更重要的是,学生了解了处理废液不容易,平时实验过程中要尽量节约药品,尽可能少产生废液。
[1]张显球,杜明霞,吴薇.实验室废液污染控制[J].实验技术与管理,2007,24(2):154-156.
[2]杨玲,李田,吴忠云,等.开放式实验教学中药品准备和管理的探索与实践[J].实验技术与管理,2016,33(1):194-197.
[3]宋琤,陈理灿,张兰,等.节约环保型开放性化学实验教学开展的探索研究[J].实验技术与管理,2012,29(7):149-151.
[4]夏芳.化验室废液的处理与某些试剂的回收[J].化工环保,2003,23(3):180-181.
[5]国家环境保护总局.《城镇污水处理厂污染物综合排放标准》(GB-18918-2002)[S].北京:国家环境保护总局,2002.
[6]高利伟,史联军,郑江华.回收碘的研究[J].贵州工业大学学报 (自然科学版),2005,34(4):13-16.
[7]钟国清.含碘废液回收碘的研究[J].广西化工,1995,24(1):37-38.
[8]万东北,张勇,谢步云,等.含碘废液的回收研究[J].赣南师范学院学报,2007(3):79-81.
[9]孟春霞,高先池,孙婧.利用含碘废液制备碘化钾的实验研究[J].实验室科学,2014,17(5):6-9.
[10]吕俊芳,刘启瑞,郑国柱,等.含碘废液中碘的含量测定与回收[J].延安大学学报 (自然科学版),2000,19(1):57-60.
[11]陈小利,吕俊芳,师海龙.等.化学反应速度和活化能实验废液中碘的快速回收及测定[J].延安大学学报 (自然科学版),2004,23(4):47-49.
[12]魏剑英,许炎妹,韩国祥,等.含碘废水中碘的回收[J].无机盐工业,2007,39(9):47-49.
[13]中华人民共和国国家标准 (GB/T1272-2007).化学试剂碘化钾[S].北京:全国化学标准化技术委员会化学试剂分会,2007.
[14]库宗军,汪莲生,葛杏莉.联系实际问题开设研究性化学实验[J].实验室研究与探索,2009,28(2):110-112.
