不同前处理方法及显色体系测定面制食品中铝含量的方法比较
2018-01-15谱尼测试集团股份有限公司
□ 路 丹 谱尼测试集团股份有限公司
铝是人体非必需微量元素,食品中使用的含铝添加剂是人类膳食铝暴露的主要来源[1]。长期摄入过量的铝会损伤人的大脑,毒害神经和骨髓,导致痴呆,还可能出现贫血、骨质疏松等疾病[2-3]。WHO/FAO于1989年就正式将铝确定为食品污染物加以控制,提出人体铝的暂定每周允许摄入量为7 mg/kg BW[4]。2011年6月,在JECFA的第74次大会上,将铝的暂定每周耐受摄入量(PTWI)修订为2 mg/kg BW。
目前,旧国家标准法[5]测定面制品中铝含量是三元显色体系显色,而新国家标准法[6]测定面制品中铝含量是四元显色体系显色。近年来文献报道有关面制品铝含量测定的前处理方法有硝酸-高氯酸消化[7]、硝酸-硫酸消化[8]、干法消化[9]等,显色体系有铝三元显色体系和铝四元显色体系[10],各种方法都有其优缺点。本文对比了不同前处理方法及不同显色体系对测定面制食品中铝含量的影响,总结了样品处理过程及显色过程的一些经验,探讨了不同处理技术的优缺点,对提供铝的检测水平有一定帮助。
1 材料与方法
1.1 试剂与仪器
硝酸(优级纯)、高氯酸(优级纯)、硫酸(优级纯)、盐酸(优级纯)、冰乙酸(优级纯)、乙酸钠、乙二胺、聚乙二醇辛基苯醚、铬天青S、溴化十六烷基三甲胺、溴代十六烷基吡啶、抗坏血酸、铝标准溶液(1 000 μg/mL),铝标准使用液(1.0 μg/mL,由铝标准溶液逐级稀释而成)。
分析天平(感量0.000 1 g)、紫外/可见分光光度计、恒温干燥箱、酸度计(±0.1pH)。所用玻璃仪器均需以硝酸(1+4)浸泡过夜,用水反复冲洗,最后用去离子水冲洗干净备用。
1.2 实验方法
1.2.1 样品处理
1.2.1.1 硝酸-高氯酸湿法消化
精确称取经85 ℃干燥4 h后样品1.0 g左右,置于锥形瓶中,加数粒玻璃珠,加10~15 mL硝酸-高氯酸(5+1)混合液,置电热板上缓缓加热至消化液无色透明,并出现大量高氯酸烟雾,取下锥形瓶,加入0.5 mL硫酸,再置电热板上适当升高温度加热除去高氯酸,加10~15 mL水,加热至沸,冷却后用水定容至50 mL容量瓶(保证试样溶液中含1%硫酸)中,同时做消化空白。
1.2.1.2 硝酸-硫酸湿法消化
精确称取经85 ℃干燥4 h后样品1.0 g左右,置于锥形瓶中,加数粒玻璃珠,加入10 mL硝酸、0.5 mL硫酸,在电热板上加热。若变棕黑色,再补加硝酸消化,直至管口冒白烟,消化液呈无色透明或略带黄色,冷却,用水转移定容至50 mL容量瓶,混匀备用,同时做试剂空白试验。
1.2.1.3 干法消化
精确称取经85 ℃干燥4 h后样品1.0 g左右,置于瓷坩埚中,在电热板上慢慢炭化至不再冒烟,于马弗炉550℃灰化4 h,冷却后用1%的硫酸定容至50 mL(保证试样溶液中含1%硫酸),同时做消化空白。
1.3 显色测定
1.3.1 三元络合体系显色测定
吸取1.0 mL消化好的试样、空白溶液,置于25 mL比色管中。向试样管和试剂空白管依次加入8.0 mL乙酸-乙酸钠缓冲液、1.0 mL 10g/L抗坏血酸溶液,混匀;加2.0 mL 0.2 g/L 溴化十六烷基三甲胺溶液,混匀;再加2.0 mL 0.5 g/L铬天青S溶液,摇匀后,用水稀释至刻度。室温放置20 min后,用1 cm比色杯于分光光度计上,以零管调零点,于640 nm波长处测其吸光度,绘制标准曲线比较定量。
1.3.2 四元络合体系显色测定
吸取1.0 mL消化好的试样、空白溶液,置于25 mL比色管中,加水至10 mL刻度。向试样管和试剂空白管中滴加1滴对硝基苯酚乙醇溶液(1 g/L),混匀,滴加氨水溶液(1+1)至浅黄色,滴加2.5%硝酸溶液至黄色刚刚消失,再多加1.0 mL,加入1.0 mL 10 g/L抗坏血酸溶液,混匀后加2.0 mL 1g/L铬天青S溶液,混匀后加1.0 mL 3%Triton X-100溶液、3.0 mL 3g/L CPB溶液、3.0 mL乙二胺-盐酸缓冲溶液,加水定容至25.0 mL,混匀,放置40 min,于620 nm波长处测其吸光度,绘制标准曲线比较定量。
1.4 标准曲线系列
1.4.1 三元络合体系标准曲线
吸取0.0、0.5、1.0、2.0、3.0、4.0、5.0 mL铝标准使用液(相当于含铝0、0.5、1.0、2.0、3.0、4.0、5.0 μg)分别置于25 mL比色管中,依次向各管中加入1.0 mL 1%的硫酸溶液,向标准管中依次加入8.0 mL乙酸-乙酸钠缓冲液、1.0 mL 10 g/L抗坏血酸溶液,混匀;加2.0 mL 0.2g/L 溴化十六烷基三甲胺溶液,混匀;再加2.0 mL 0.5 g/L铬天青S溶液,摇匀后,用水稀释至刻度。室温放置20 min后,用1 cm比色杯于分光光度计上,以零管调零点,于640 nm波长处测其吸光度,以标准系列溶液中铝的质量为横坐标,以相应的吸光值为纵坐标绘制标准曲线。
1.4.2 四元络合体系标准曲线
吸取0.0、0.5、1.0、2.0、3.0、4.0、5.0 mL铝标准使用液(相当于含铝0、0.5、1.0、2.0、3.0、4.0、5.0 μg) 分 别置于25 mL比色管中,依次向各管中加入1.0 mL 1%的硫酸溶液,加水至10 mL刻度。向标准管中依次滴加1滴对硝基苯酚乙醇溶液(1 g/L),混匀;滴加氨水溶液(1+1)至浅黄色,滴加2.5%硝酸溶液至黄色刚刚消失,再多加1.0 mL,加入1.0 mL 10g/L抗坏血酸溶液,混匀后加2.0 mL 1g/L铬天青S溶液,混匀后加1.0 mL 3% Triton X-100溶液、3.0 mL 3g/L CPB溶液、3.0 mL乙二胺-盐酸缓冲溶液,加水定容至25.0 mL,混匀,放置40 min,于620 nm波长处测其吸光度,以标准系列溶液中铝的质量为横坐标,以相应的吸光值为纵坐标绘制标准曲线。
1.5 结果计算

式中:X为试样中铝的含量(mg/kg);m1为测定用试样消化液中铝的质量(μg);m0为空白溶液中铝的质量(μg);V1为试样消化液总体积(mL);V2为测定用试样消化液体积(mL);m为试样称样量(g)。
2 实验结果及讨论
2.1 铝含量的标准曲线
以吸光度A对溶液c进行线性回归,测得铝的三元络合体系标准曲线为 A=0.05c-0.010 9,r2=0.992 7;测得铝的四元络合体系标准曲线为A=0.152 5c-0.022 1,r2=0.997 6。
2.2 精密度试验
对两份不同的样品用以上不同的消化方法及显色体系进行测定,分别求出试样中铝的含量,结果见表1。
由表1纵向可以看出三元络合体系中硝酸-高氯酸消化法的精密度为5.1%和3.6%,硝酸-硫酸消化法的精密度为4.1%和2.5%,干法消化法的精密度为2.6%和2.4%;四元络合体系中硝酸-高氯酸消化法的精密度为2.2%和2.2%,硝酸-硫酸消化法的精密度为2.7%和2.0%,干法消化法的精密度为2.3%和1.3%;横向可以看出硝酸-高氯酸消化法在三元络合体系的精密度为5.1%和3.6%,在四元络合体系的精密度为2.2%和2.2%,硝酸-硫酸消化法在三元络合体系的精密度为4.1%和2.5%,在四元络合体系的精密度为2.7%和2.0%,干法消化法在三元络合体系的精密度为2.6%和2.4%,在四元络合体系的精密度为2.3%和1.3%。
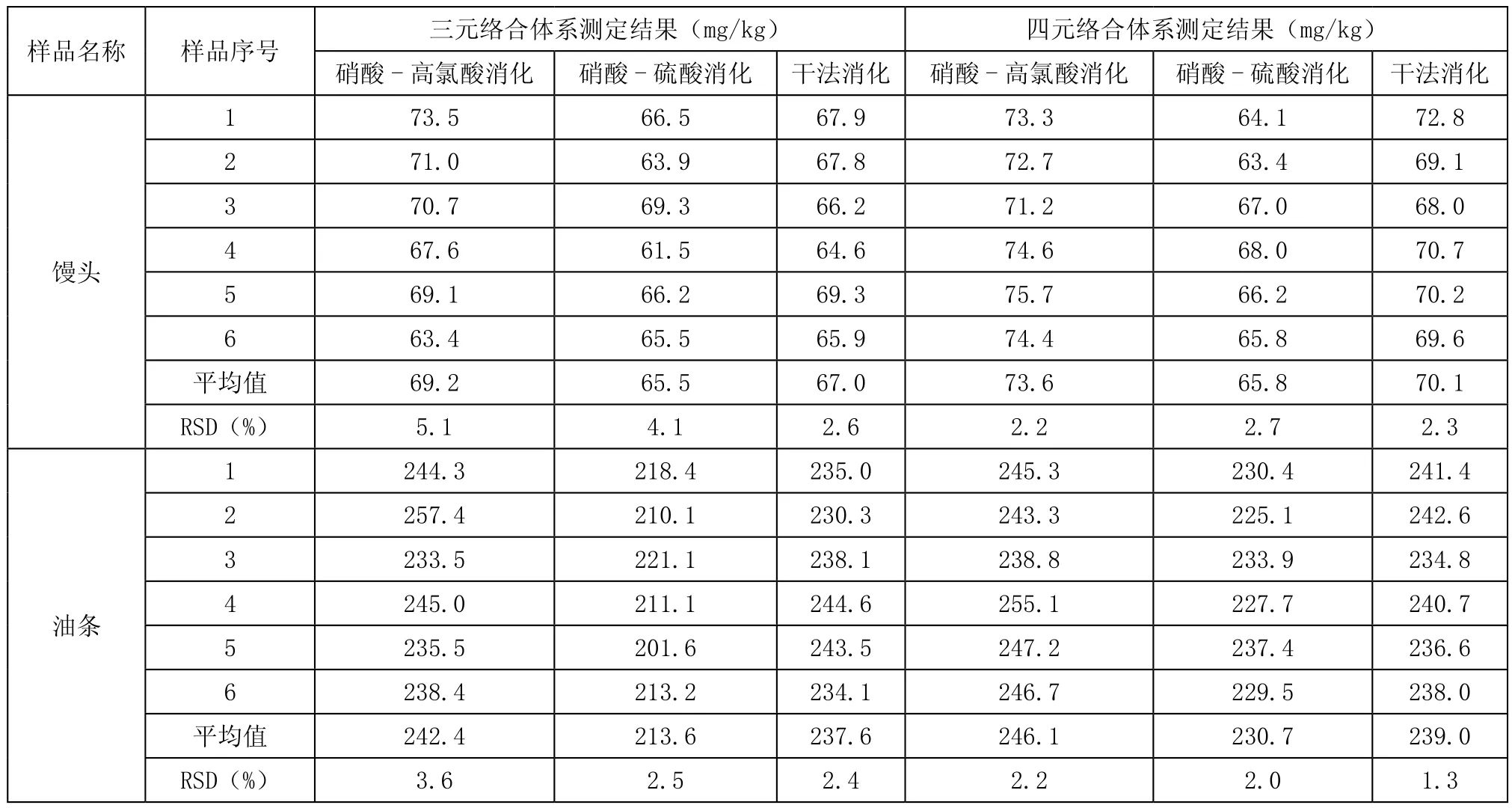
表1 不同前处理方法及显色系统测定结果
2.3 准确度试验
对以上两份样品在不同的消化方式及显色体系下进行6平行加标回收实验,结果见表2。
由表2纵向可以看出三元络合体系中硝酸-高氯酸消化法的回收率范围为93.2%~103.9%,硝酸-硫酸消化法的回收率范围为86.8%~97.9%,干法消化法的回收率范围为88.8%~97.0%;四元络合体系中硝酸-高氯酸消化法的回收率范围为94.0%~104.3%,硝酸-硫酸消化法的回收率范围为89.2%~98.4%,干法消化法的回收率范围为90.0%~98.2%。横向可以看出硝酸-高氯酸消化法在三元络合体系的回收率范围为93.2%~103.9%,在四元络合体系的回收率范围为94.0%~104.3%,硝酸-硫酸消化法在三元络合体系的回收率范围为86.8%~97.9%,在四元络合体系的回收率范围为89.2%~98.4%,干法消化法在三元络合体系的回收率范围为88.8%~97.0%,在四元络合体系的回收率范围为90.0%~98.2%。

表2 不同前处理方法及显色系统测定结果
2.4 讨论
2.4.1 溶液pH值影响
不同的缓冲溶液及酸度对铝的测定有很大影响,若溶液pH控制不当,显色时就不能生成稳定的络合物,导致检测结果不准确,尤其是湿法消化中,酸残留对结果影响更大,而干法消化避免了样品前处理中酸残留对结果的影响。不同的缓冲液导致了显色时不同的酸度,在三元显色系统中,由乙酸-乙酸钠缓冲液来调节溶液显色酸度,在四元显色体系中,由乙二胺-盐酸缓冲溶液来调节溶液显色酸度,从显色结果来看,乙二胺-盐酸缓冲液对显色更稳定一些。
2.4.2 不同消化方法的影响
本实验采用了三种不同的消化方式,硝酸-高氯酸消化法中,高氯酸是否赶净较难控制,对显色时溶液酸度的影响较大;硝酸-硫酸消化法中,虽然避免了高氯酸残留的问题,但是相比较来说消化时间长,酸消耗量大;干法消化法中避免了酸的残留对显色时溶液酸度的影响,且耗酸少,操作简便。
2.4.3 不同显色体系显色时间的影响
在实验过程中发现,三元显色体系显色时间较快,一般在20 min即可显色完全,但是稳定性较差,不能长时间放置,而四元显色体系显色时间较慢,但是显色后稳定好。故三元络合体系选择在20 min后比色,四元络合体系选择在40 min后比色。
2.4.4 铬天青S用量的影响
显色剂用量会影响显色效果,一般应略过量,但量过大空白会增大,通过实验结果验证,本实验选用2.0 mL的铬天青S溶液显色。
3 结论
由实验结果表明,以上几种处理方法均适用于面制食品中铝含量的检测,但在相同的络合体系中,硝酸-高氯酸消化检测结果较高,干法消化次之;在硝酸-高氯酸消化中,高氯酸残留对显色有影响,且高氯酸有引起爆炸的危险;硝酸-硫酸消化法中,虽然精密度较硝酸-高氯酸消化结果高,但耗酸量大,费时费力;干法消化简单、方便,酸消耗量小,操作更加安全,精密度与准确度都能达到要求,且与湿法消化结果相差不大,精密度较高。在相同前处理条件下,四元络合体系较三元络合体系显色稳定,且精密度与准确度均较高。在面制食品铝的测定方法中,采用干法消化的四元显色体系测定面制品中铝的方法更加简便、安全,易于操作。
[1]国家食品安全风险评估专家委员会.中国居民膳食铝暴露风险评估报告[R].2014.
[2]Crapper. Aluminium, Neurofibrillary Degeneration and Alzheimer’s Disease[J].Committee on Nutrition Pediatrics,1986(2):50-52.
[3]King S.The clinical biochemistry of aluminum[J].CRC Crit Rev V lin Lab Science,1981(1):1-4.
[4]王林,苏德昭,王永芳等.中国居民每日摄入铝量及面制食品中铝限量卫生标准研究[J].中国食品卫生杂志 ,1996(2):2-6.
[5]中华人民共和国卫生部.GB/T 5009.182-2003 面制食品中铝的测定[S].北京:中国标准出版社,2003.
[6]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.182-2017 食品安全国家标准 食品中铝的测定[S].北京:中国标准出版社,2017.
[7]食品类样品硝酸高氯酸湿法消化的试验现象和消化进程控制[J].预防医学杂志,2005(6):764-765.
[8]平红,李宏坤,李永吉,等.改进铬天青S分光光度法测定油炸面制食品中铝的含量[J].食品科技 ,2010(9):314-317.
[9]张 书文 ,张 燕 ,李 燕 ,等 .对食品中铝含量国标测定方法的改进[J].化学分析计量,2009(2):57-59.
[10]郭青枝,赵二劳,范建凤.面制食品中铝的四元络合体系测定法[J].环境与健康杂志,2008(25):911-912.
