慈菇消脂丸对非酒精性脂肪性肝炎大鼠脂毒性及氧化应激的影响
2018-01-13马燕花杨少军师霞邱晓青徐三朋
马燕花++杨少军++师霞++邱晓青++徐三朋
摘要:目的 观察慈菇消脂丸对非酒精性脂肪性肝炎(NASH)大鼠肝脏脂质代谢及抗氧化能力的影响,探讨其相关作用机制。方法 SD大鼠随机分为正常组、模型组、阳性药组和中药高、中、低剂量组。采用高脂饲料饲喂大鼠建立NASH模型,造模同时给予相应药物干预。造模12周,实验大鼠全部处死,取大鼠肝脏和血清。检测血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、三酰甘油(TG)、总胆固醇(TC)、总超氧化物歧化酶(T-SOD)、低密度脂蛋白胆固醇(LDL-C)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、游离脂肪酸(FFA)及肝组织匀浆T-SOD、MDA、GSH-Px、FFA,HE染色观察肝组织病理形态,透射电镜观察肝细胞超微结构,油红O染色观察肝细胞脂肪变性。结果 造模大鼠肝组织呈中重度脂肪变性并伴有炎症细胞浸润。与正常组比较,模型组大鼠肝湿重、肝指数和血清ALT、AST、TG、TC、LDL-C、MDA、FFA及肝组织匀浆MDA、FFA均明显升高(P<0.05,P<0.01),血清及肝组织匀浆T-SOD、GSH-Px明显降低(P<0.05,P<0.01);与模型组比较,中药高剂量组血清ALT、AST、TG、TC、LDL-C、MDA、FFA明显降低,肝组织匀浆MDA、FFA明显降低(P<0.05,P<0.01),血清及肝组织匀浆T-SOD、GSH-Px明显升高(P<0.01)。病理观察显示,与模型组比较,中药各剂量组大鼠肝小叶内空泡样变、脂肪样变减少,炎性细胞浸润明显改善。结论 慈菇消脂丸能明显改善模型大鼠肝功能及血脂水平,提高肝脏抗氧化能力,减轻脂质过氧化损伤,达到防治NASH的目的。
关键词:非酒精性脂肪性肝炎;慈菇消脂丸;脂毒性;氧化应激;大鼠
DOI:10.3969/j.issn.1005-5304.2018.01.011
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2018)01-0048-06
Effects of Cigu Xiaozhi Pills on Lipotoxicity and Oxidative Stress
in Rats with Non-alcoholic Steatohepatitis
MA Yan-hua1, YANG Shao-jun2, SHI Xia1, QIU Xiao-qing3, XU San-peng1
1. Gansu University of Chinese Medicine, Lanzhou 730000, China;
2. Beihai Traditional Chinese Medicine Hospital, Beihai 536000, China;
3. Affiliated Hospital of Gansu University of Chinese Medicine, Lanzhou 730000, China
Abstract: Objective To explore the effects of Cigu Xiaozhi Pills on lipotoxicity and oxidative stress in rats with non-alcoholic steatohepatitis (NASH); To discuss relevant mechanism of action. Methods SD rats were divided into six groups randomly: normal control group, model group, positive medicine group, Cigu Xiaozhi Pills high-, medium-, and low-dose groups. NASH model was established by feeding rats with high fat diet for 12 weeks. At the same time, the model rats were given medicine intervention. At the end of 12 weeks, all the experimental animals were killed and the liver and serum were taken. Serum samples were taken for detection of ALT, AST, TG, TC, T-SOD, LDL-C, MDA, GSH-Px and FFA. Liver tissues were taken for detection of T-SOD, MDA, GSH-Px and FFA. The liver histopathological changes were observed under microscope with HE staining. The ultrastructure of liver cells was observed by transmission electron microscope. The fatty degeneration of liver cells was observed by oil red O staining. Results Liver histopathological examination showed that the liver tissue of model group showed moderate to
基金項目:国家自然科学基金地区基金(81560753)
severe steatosis and inflammatory cell infiltration. Compared with normal control group, rat liver wet weight, liver index, ALT, AST, TG, TC, LDL-C, MDA and FFA in serum, and FFA and MDA in liver homogenate in model group significantly increased (P<0.05, P<0.01), while T-SOD and GSH-Px activity in serum and liver homogenate significantly decreased (P<0.05, P<0.01). Compared with model group, Cigu Xiaozhi Pills high-dose group could significantly decrease the elevation of serum ALT, AST, TG, TC, LDL-C, MDA and FFA (P<0.05, P<0.01), but increase T-SOD and GSH-Px activity in serum and liver tissue (P<0.01). The pathological section showed that: compared with model group, the hepatic lobule vacuolar degeneration and fatty degeneration were significantly reduced in Cigu Xiaozhi Pills high-, medium- and low-dose groups, and the inflammatory cell infiltration was improved. Conclusion Cigu Xiaozhi Pills can obviously improve liver function and blood lipid of NASH rat model induced by high-fat diet, enhance antioxidant capacity, reduce lipid peroxidation and achieve the purpose of prevention and treatment of NASH.endprint
Keywords: non-alcoholic steatohepatitis; Cigu Xiaozhi Pills; lipotoxicity; oxidative stress; rats
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)作为非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的临床病理类型之一,由于其可进展为肝纤维化、肝硬化甚至肝癌等终末期肝病,一直备受重视。NASH发病机制复杂,涉及脂代谢紊乱、胰岛素抵抗、肝脂质过氧化增加、细胞因子异常等多个相互关联的病理生理环节。研究发现,NASH发生、发展过程中肝细胞脂毒性凋亡是其重要特征,并参与整个发病过程[1]。游离脂肪酸(FFA)在NASH的发生中发挥重要作用[2]。血液循环中高浓度FFA导致的氧化应激反应与NASH肝细胞脂毒性凋亡密切相关[3]。慈菇消脂丸经多年临床应用,在治疗脂肪性肝病、肝纤维化、高脂血症及肥胖患者等方面取得较好疗效[4-5]。因此,本研究通过建立NASH大鼠模型,观察慈菇消脂丸对NASH大鼠脂毒性及氧化应激的影响,进一步探讨其作用机制,为临床应用提供依据。
1 实验材料
1.1 动物和饲料
健康雄性SD大鼠60只,SPF级,8周龄,体质量(200±20)g,甘肃中医药大学动物实验中心,动物许可证号SCXK(甘)2015-0002。饲养于温度(22±2)℃、相对湿度50%~60%环境,12 h/12 h明暗交替。高脂饲料(73.8%基础饲料+10%蛋黄粉+15%猪油+1%胆固醇+0.2%胆酸钠),北京可澳协力饲料有限公司。
1.2 药物
慈菇消脂丸(山慈菇、泽泻、柴胡、山楂、决明子、甘草、何首乌等15味),饮片购自甘肃中医药大学附属医院中药房,加水适量,普通方法煎煮,浓缩至所需浓度;盐酸吡格列酮片,北京太洋药业股份有限公司,规格15 mg/片,7片/盒,批号161101。
1.3 主要试剂与仪器
丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、丙二醛(MDA)、总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)、FFA检测试剂盒和考马斯亮蓝,南京建成生物工程研究所;油红O,美国Sigma公司。全自动生化分析仪(Alcyon 300),美国Abbott;OLYMPUS万能显微镜(VANOXAHB-LB型),日本OLYWPUS公司;透射电镜(日立-HS500),日本日立公司;酶联免疫检测仪(PG-3022A型),Amersham Bioscienee;石蜡切片机(IVS-410),北京医讯科技有限公司。
2 实验方法
2.1 造模、分组及给药
参照文献[6]方法采用高脂饲料喂养制作模型。大鼠标准食水适应性喂养1周后,将其随机分为正常组、模型组、阳性药组和中药高、中、低剂量组,每组10只。正常组给予普通标准饲料(总热量15.335 J/g,碳水化合物热卡占53%,脂肪热卡占9%,蛋白质热卡占20%)喂养,同时按10 mL/kg体质量灌服生理盐水;模型组给予高脂饲料喂养,同时按10 mL/kg体质量灌服生理盐水;中药各剂量组在高脂饲料喂养的同时给予10 mL/kg体质量相应浓度药液灌胃;阳性药组在高脂饲料喂养的同时给予吡格列酮药液10 mL/kg灌胃。每日1次,连续12周。动物给药剂量按人与大鼠体表面积比折算成等效剂量。中药高剂量按人等效剂量12倍量即0.648 g/100 g体质量;中药中剂量按人等效剂量6倍量即0.324 g/100 g体质量;中药低剂量按人等效剂量3倍量即0.162 g/100 g体质量。每日观察大鼠进食、饮水、行为、活动、精神状态、毛发及二便等情况,每周称重1次。
2.2 取材
实验持续至12周末结束。大鼠禁食24 h,次日腹腔注射10%水合氯醛麻醉,取静脉血,3000 r/min离心15 min,分离血清,用于测定肝功能、血脂。迅速取出肝脏,称量后将肝组织分为3块:1块做新鲜冰冻切片,红油O染色观察肝细胞脂肪变性;1块置于4%多聚甲醛液中固定,HE染色观察肝脏组织学变化;1块置于4%戊二醛中固定,透射电镜观察肝细胞超微结构。
2.3 一般观察
观察大鼠生活状态、食欲行为、毛发、死亡情况。处死前称重,麻醉后取出肝脏,称量肝湿质量,计算肝指数(肝脏湿质量÷体质量×100%)。
2.4 大鼠血清肝功能和血脂测定
ALT、AST、TG、TC、LDL-C均用全自动生化分析仪测定,黄嘌呤氧化酶法测定T-SOD,硫代巴比妥酸法测定MAD,5,5-双硫代对硝基苯甲酸(DTNB)比色法测定GSH-Px,ELISA测定FFA。
2.5 大鼠肝匀浆指标测定
精确称取相同部位肝组织200 mg,用预冷生理盐水漂洗,按质量体积(g∶mL)1∶9加入匀浆介质1.8 mL,冰浴条件下2000 r/min匀浆3~5 min,制成10%肝组织匀浆。按试剂盒说明书操作检测肝组织T-SOD、MAD、GSH-Px、FFA。
2.6 病理观察
新鲜肝组织冰冻切片,油红O染色观察肝细胞脂质情况,另取部分肝组织4%多聚甲醛固定,常规制备组织石蜡切片,HE染色观察肝组织形态学变化。
2.7 电镜超微结构观察
取肝组织块切成约1 mm3,固定液(用25 g/L戊二醛l mL、双蒸馏水4 mL、0.2 mol/L PBS 5 mL配制)固定后漂洗,逐级脱水、浸透、固化,LKB型超薄切片机切片50~60 nm,枸櫞酸铅染色,透射电镜下观察肝细胞及细胞外基质的超微结构变化。endprint
3 统计学方法
采用SPSS13.0统计软件进行分析。计量资料以—x±s表示,多组间比较采用方差分析,两两比较采用LSD法。P<0.05表示差异有统计学意义。
4 结果
4.1 一般状况
正常组大鼠毛色有光泽,行动灵活,进食水量正常;模型量组大鼠毛色暗淡,进食量减少,不喜活动;与正常组比较,中药各剂量组大鼠毛色、行为、饮食无明显异常;与正常组比较,模型组大鼠肝湿质量和肝指数均显著增加(P<0.01);与模型组比较,中药各剂量组肝湿质量和肝指数均显著降低(P<0.01)。结果见表1。
4.2 慈菇消脂丸对模型大鼠血清酶学及脂质水平的影响
与正常组比较,模型组大鼠血清ALT、AST、MDA、TC、TG、LDL-C、FFA显著升高(P<0.05,P<0.01),GSH-Px、T-SOD活性显著降低(P<0.01);与模型组比较,中药高剂量组大鼠血清ALT、AST、MDA、TC、TG、LDL-C、FFA显著降低(P<0.05,P<0.01),GSH-Px、T-SOD活性显著升高(P<0.01),中药中剂量组大鼠血清ALT、AST、MDA、TG、LDL-C、FFA显著降低(P<0.05,P<0.01),GSH-Px活性显著升高(P<0.01),中药低剂量组大鼠血清LDL-C含量显著降低(P<0.05),其他各项指标无显著变化,阳性药组大鼠血清ALT、AST、MDA、TG、LDL-C、FFA显著降低(P<0.05,P<0.01),GSH-Px、T-SOD活性显著升高(P<0.01)。中药各剂量组与阳性药组比较无显著差异。结果见表2、表3。
4.3 慈菇消脂丸对模型大鼠肝组织酶学及脂质水平的影响
与正常组比较,模型组大鼠肝匀浆FFA、MDA含量显著升高(P<0.01),T-SOD、GSH-Px活性显著降低(P<0.05,P<0.01);与模型组比较,中药高剂量组大鼠肝匀浆FFA、MDA显著降低(P<0.01),T-SOD、GSH-Px活性显著升高(P<0.01),中药中剂量组大鼠肝匀浆T-SOD、GSH-Px活性显著升高(P<0.05),MDA含量显著降低(P<0.01),FFA含量无显著变化;中药低剂量组大鼠肝匀浆MDA含量显著降低(P<0.05),其余各项指标无显著变化,阳性药组大鼠肝匀浆FFA、MDA含量显著降低(P<0.05,P<0.01),GSH-Px、T-SOD活性显著升高(P<0.05,P<0.01);与阳性药组比较,中药低剂量组FFA含量显著升高(P<0.05),其余各项指标与阳性药组比较无显著差异。结果见表4。
4.4 肝组织病理变化
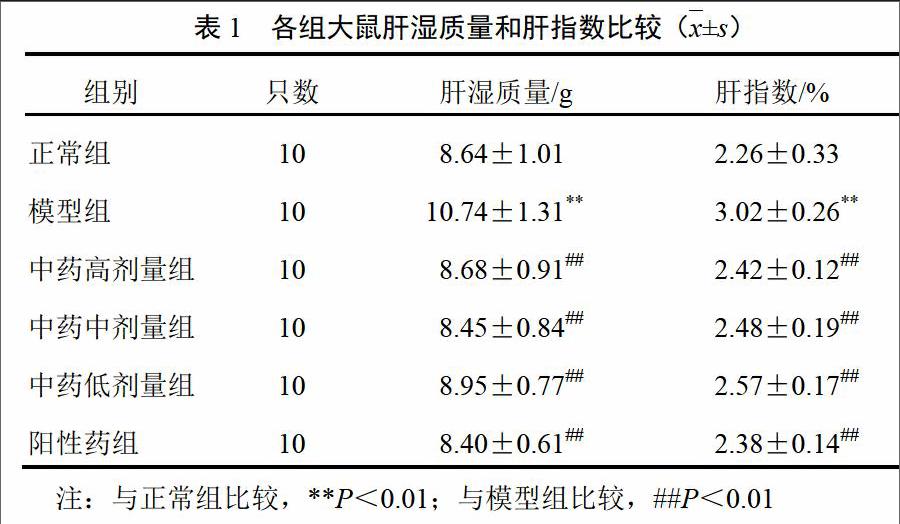
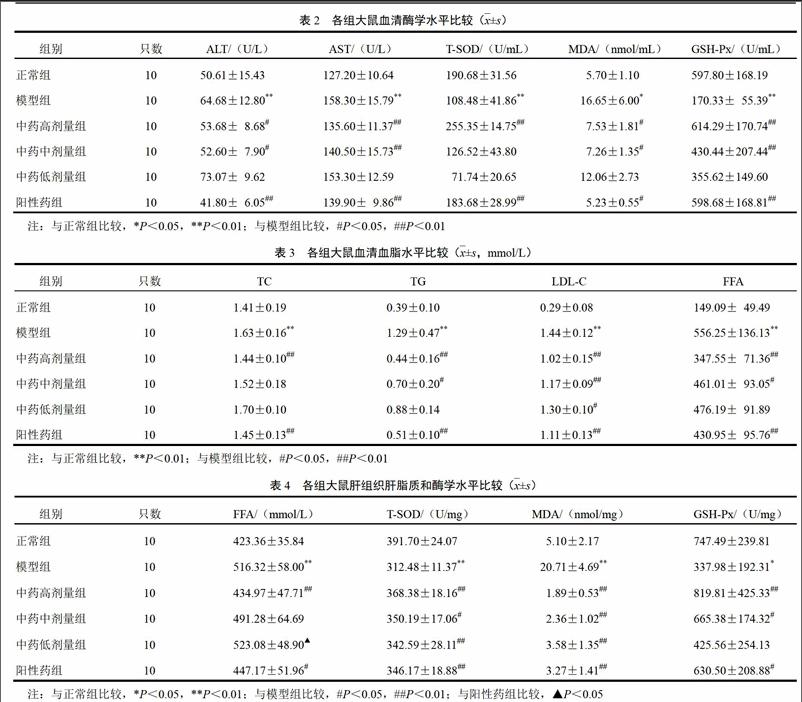
HE染色及油红O染色光镜观察显示,正常组大鼠肝组织肝小叶结构完整,肝索、肝窦分布如常,肝细胞形态一致,未见明显变性坏死,小叶内及汇管区未见明显淋巴细胞浸润;模型组大鼠肝组织肝小叶结构完整,肝索明显增宽,肝窦融合,可见肝细胞弥漫性脂肪变,部分区域汇管区及小叶内少量淋巴细胞浸润。与模型组比较,中药各剂量组大鼠肝细胞脂肪变性及炎症反应不同程度减轻。中药高剂量组大鼠肝组织仅少数区域肝细胞内见极少量大小不等脂肪空泡,汇管区及小叶内未见明显淋巴细胞浸润;中药中剂量组大鼠肝小叶中央部分区域肝细胞内见少量脂肪空泡,汇管区及小叶内未见明显淋巴细胞浸润;中药低剂量组大鼠肝小叶中央部分区域肝细胞内见数量较多的脂肪空泡,汇管区及小叶内少量炎性细胞浸润。结果见图1、图2。
4.5 电镜超微结构变化
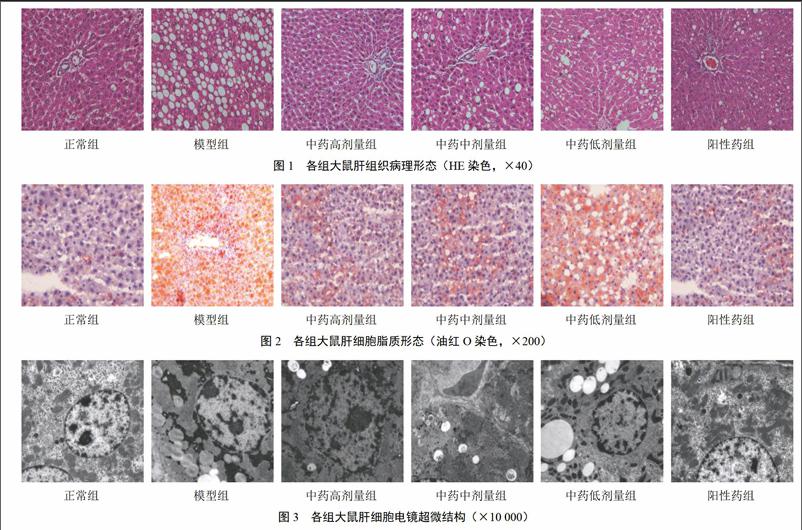
正常组肝细胞形态结构正常,膜界限清晰,Disse隙正常,血窦面和胆小管面可见微绒毛伸入腔内,肝细胞连接面连接紧密,细胞质内可见数量丰富且形态正常的线粒体、内质网、高尔基体复合体、核糖体,以及糖原颗粒、微小脂滴等内含物,未见脂滴分布;细胞核形状规则且居中,核仁明显。模型组肝细胞肿胀,胞浆中布满众多大小不一的脂滴空泡,Disse隙扩大且部分区域可见微绒毛和胶原纤维增生现象,偶见部分细胞中的内质网扩张,线粒体变形、糖原颗粒大量聚集;细胞核固缩,可见异性染色质。与模型组比较,中药各剂量组均可见肝细胞内脂滴空泡不同程度减少,各种细胞器和细胞内含物均未出现异常,其中,中药高剂量组肝细胞只含极少数脂滴,中药中剂量组肝细胞内含少数脂滴,中药低剂量组肝细胞所含脂滴较多,但未见胶原纤维有增生现象。结果见图3。
5 讨论
NASH的发病机制目前广泛接受的观点是Day和James于1998年提出的“二次打击”学说[7]。第一次打击主要由于胰岛素抵抗造成脂代谢紊乱,引起肝细胞脂肪变性,形成单纯性脂肪肝;第二次打击核心为氧化应激和脂质过氧化反应,造成肝细胞凋亡甚至坏死。NASH患者有明显的胰岛素抵抗[8],当其发生时,脂肪组织分解释放的FFA增多,导致血液循环中FFA增加,引起脂质过氧化反应、线粒体的功能紊乱、溶酶体细胞膜的变化、内质网活性氧的形成、蛋白激酶的激活、炎症途径的激活,造成肝细胞功能障碍。作为第二次打击的核心,氧化应激介导了单纯性脂肪肝向脂肪性肝炎、肝纤维化甚至肝硬化的进展[9-10]。
目前对于NASH治疗暂无特效药物。NASH属中医“癥积”“痰浊”“胁痛”等范畴。临床所见证型颇多,2011年中华中医药学会脾胃病分会就NAFLD提出中医诊疗共识意见,将NAFLD的证候分为湿浊内停证、肝郁脾虚证、湿热蕴结证和痰瘀互结证[11]。从中可以部分归纳出NAFLD的中医主要病机为肝郁脾虚、湿热浊毒内蕴、气滞血瘀。由此说明浊毒壅滞是NAFLD的主要病机之一。笔者认为“痰湿、浊脂(毒)”可能在NAFLD发病中起着关键作用,故提出以解毒化痰为主要治法的慈菇消脂丸对其进行干预。慈菇消脂丸为本课题组自拟方,方中山慈菇有化痰解毒、消脂散结之功效,泽泻、山楂祛脂化浊,丹参、土鳖虫逐瘀通络,柴胡、黃芩、法半夏疏肝理脾,决明子清肝降脂。全方立法以解毒化痰、消降浊脂为主。endprint
本研究采用高脂饲料喂养成功建立NASH大鼠模型,运用慈菇消脂丸高、中、低剂量进行干预。实验结果表明,慈菇消脂丸能显著降低高脂饮食诱导的NASH大鼠血清ALT、AST、TG、TC、LDL-C、MDA、FFA及肝匀浆MDA、FFA含量;升高大鼠血清及肝匀浆T-SOD、GSH-Px活性,有效改善NASH大鼠的肝功、血脂,抑制活性氧的生成,提高抗氧化能力。光镜及电镜下病理组织学观察显示,慈菇消脂丸明显改善NASH大鼠肝脏脂肪变性和炎症反应。
综上,胰岛素抵抗使血液循环中FFA过高,当其浓度超过正常水平上限时,导致多种引起脂毒性的应激反应,包括内质网应激[12]、氧化应激[13]、凋亡及炎症。生成过多的活性氧,攻击生物膜而发生肝细胞膜脂质过氧化反应,同时耗竭肝细胞内重要的抗氧化酶,使氧化物与抗氧化物之间的动态平衡失调,MDA含量升高,T-SOD、GSH-Px活性降低;同时抑制肝脏向外输送脂肪酸,造成脂肪堆积严重[14-15],最终导致肝细胞的损伤。而慈菇消脂丸对NASH具有防治作用,其机制可能与降低脂毒性、提高抗氧化作用有关。
参考文献:
[1] MELLS J E, ANANIA F A. The role of gastrointestinal hormones in hepatic lipid metabolism[J]. Semin Liver Dis,2013,33(4):343-357.
[2] ATTAR B M, VAN THIEL D H. Current concepts and management approaches in nonalcoholic fatty liver disease[J]. Scientific World Journal,2013,2013(11):481893.
[3] YAMAGUCHI K, YANG L, MCCALL S, et al. Inhibiting triglyceride synthesis improves hepatic steatosis but exacerbates liver damage and fibrosis in obese mice with nonalcoholic steatohepatitis[J]. Hepatology,2007,45(6):1366-1374.
[4] 郑昱,杨少军.慈菇化脂方治疗脂肪肝50例[J].中国中医药信息杂志, 2002,9(5):67-68.
[5] 杨少军,孟陆亮,张立清,等.慈菇消脂丸治疗脂肪肝的临床研究[J].中国中医药科技,2009,16(5):343-344.
[6] 孙林林,石军,郝菁华,等.高脂饮食致大鼠非酒精性脂肪性肝炎肝纤维化模型的建立[J].临床肝胆病杂志,2011,27(3):254-257.
[7] DAY C P, JAMES O F. Steatohepatitis:a tale of two “hits”[J]. Gastroenterology,1998,114(4):842-845.
[8] ANGULO P, LINDOR K D. Insulin resistance and mitochondrial abnormalities in NASH:a cool look into a burning issue[J]. Gastroenterology,2001,120:1281-1285.
[9] ASHRAF N U, SHEIKH T A. Endoplasmic reticulum stress and oxidative stress in the pathogenesis of non-alcoholic fatty liver disease[J]. Free Radic Res,2015,49(12):1405-1418.
[10] TAKAKI A, KAWAI D, YAMAMOTO K. Multiple hits including oxidative stress as pathogenesis and treatment target in non-alcoholic steatohepatitis (NASH)[J]. Int J Mol Sci,2013, 14(10):20704-20728.
[11] 中华中医药学会脾胃病分会.非酒精性脂肪性肝病中医诊疗共识意见[J].北京中医药,2011,30(2):83-86.
[12] LEGRAND-POELS S, ESSER N, L'HOMME L, et al. Free fatty acids asmodulators of the NLRP3 inflammasome in obesity/type 2 diabetes[J]. Biochem Pharmacol,2014,92(1):131-141.
[13] GAO D, NONG S, HUANG X, et al. The effects of palmitate on hepatic insulin resistance are mediated by NADPH oxidase 3-derived reactive oxygen species through JNK and p38 MAPK pathways[J]. J Biol Chem,2010,285(39):29965-29973.
[14] 李青艷,王绩凯,冯哲伟,等.非酒精性脂肪肝患者脂质过氧化与肝功能的相关性研究[J].重庆医学,2012,41(16):1591-1592.
[15] 张艳,卢洁,周莹群,等.非酒精性脂肪性肝病与氧化应激[J].世界临床药物,2013,34(8):459-463.
(收稿日期:2017-03-09)
(修回日期:2017-04-12;编辑:华强)
开放科学(资源服务)标识码(OSID)endprint
