香鱼(Plecoglossus altivelis)铁蛋白的分子鉴定、表达及功能研究*
2018-01-12陈梦丹徐铸婕李长红
陈梦丹 朱 凯 徐铸婕 李长红 苗 亮 陈 炯
(宁波大学海洋学院 生物化学与分子生物学实验室 宁波 315211)
铁蛋白(Ferritin, Fer)是广泛存在于生物体内的一种铁储存蛋白, 在维持机体铁平衡中发挥着重要作用。Fer的结构高度保守, 由24个亚基围绕形成的巨大复合体, 中间含有一个中空球体, 内部可储存4500个铁原子(Harrison et al, 1996; Orino et al, 2008)。铁蛋白中的铁以三价铁离子氧化物的形式存在, 不仅能储存机体内过剩的铁, 为含铁元素蛋白质的合成提供铁原子, 还能防止铁氧化过程中所产生的自由基带来的伤害(Harrison et al, 1996; Orino et al, 2008)。哺乳动物Fer通常由轻链(light chain, L)和重链(heavy chain, H)两种铁蛋白亚基组成, 其中H亚基通过将二价铁氧化为三价铁实现快速解毒(Clegg et al, 1981),L亚基在铁的矿化、铁核晶体形成和长期储存中发挥重要作用(Levi et al, 1994)。在鱼类和两栖类动物等低等脊椎动物中, 通常还具有中型链(middle chain, M)(Dickey et al, 1987; Andersen et al, 1995; Zhang et al,2010; Elvitigala et al, 2013; Oh et al, 2016)。由于具有FTH亚基的铁氧化酶中心和FTL亚基铁成核位点, M亚基兼具H和L亚基的功能(Torti et al, 2002)。除具有铁离子储存和抗氧化损伤功能, Fer在机体免疫反应中也起着重要作用。
香鱼(Plecoglossus altivelis)是日本、中国和朝鲜等东亚地区国家特有的一种小型名贵经济鱼类。近年来,由于长期集约化养殖、种质退化和环境污染等诸多原因, 细菌性病害频繁发生, 对香鱼养殖业造成极大的经济损失(李长红等, 2009)。人工养殖香鱼要求无污染和绿色健康, 抗生素和农药的使用受到诸多限制。因此, 迫切需要深入研究香鱼的免疫机制, 为指导病害防治和抗病遗传育种奠定理论基础。鉴于Ferritin在动物抗菌免疫反应中的重要作用, 我们拟对香鱼Fer(PaFer)进行研究, 测定其基因cDNA序列, 分析其结构特征、系统进化关系及其mRNA在组织中的表达特征, 并研究鳗弧菌感染后香鱼重要组织中 PaFer mRNA的表达变化; 原核表达PaFer重组蛋白并纯化复性, 分析其铁结合和抑菌活性, 为进一步深入研究鱼类Ferritin在鱼类的铁代谢及免疫机制提供基础资料。
1 材料与方法
1.1 实验材料与试剂
本实验所用的健康香鱼(20—25g)购自宁波水产大世界, 规格均一、健康无伤。创伤弧菌(Vibrio vulnificus)、溶藻弧菌(Vibrio alginolyticus)、鳗弧菌(Vibrio anguillarum)香鱼分离株ayu-H080701、副溶血弧菌(Vibrio parahaemolyticus)、大肠杆菌(Escherichia coli) BL21 plys E和TG1菌株、载体pET-28a等由本实验室保存。RNAiso试剂、AMV逆转录酶、T4 DNA连接酶、pMD19-T Simple Vector、Ex Taq DNA聚合酶、Ni-NTA SefinoseTM试剂盒和SYBR Premix Ex Taq试剂盒均购于 TaKaRa公司(日本); 菲洛嗪试剂购自生工生物工程(上海)股份有限公司; Gel Extraction Kit购于Omega公司(美国); 引物合成及序列测定由英维捷基贸易有限公司(上海)完成。
1.2 组织样品制备
香鱼暂养7d后, 随机选取5尾, 分别采集肝、心、肾、脑、脾、肠、鳃和肌肉等组织, 立即放入液氮中,随后保存于实验室–70℃超低温冰箱, 用于分析PaFer基因mRNA的组织表达特征。剩余香鱼随机分成感染组和对照组, 各30尾。感染组以1.0×104CFU/尾的感染浓度腹腔注射鳗弧菌悬液(李长红等, 2009),对照组注射等体积无菌生理盐水。感染组和对照组香鱼于注射后4、8、12和24h采集血液和组织样品, 每组每次取4尾香鱼。组织采集方法同上。
1.3 PaFer基因cDNA序列获得及分析
采用Illumina HisSeq 2000测序平台对香鱼头肾来源的单核/巨噬细胞进行转录组测序, 从测序结果中获得PaFer基因cDNA序列, 并通过特异引物PCR扩增和和序列测定的方法进行验证。同源蛋白序列比对采用 BLASTP 软件(http://www.ncbi.nlm.nih.gov/BLAST/); 多重序列比对采用 ClustalW 软件(http://clustalw.ddbj.nig.ac.jp/); 系统进化树构建采用MEGA 5.0软件(Tamura et al, 2011); 蛋白分子量大小及等电点预测采用Compute pI/Mw程序 (http://web.expasy.org/compute_pi/); 信号肽序列预测采用SignalP 4.1软件 (http://www.cbs.dtu.dk/services/SignalP/);N糖基化位点预测采用 NetCGlyc 1.0软件 (http://www.cbs.dtu.dk/services/NetCGlyc/); 保守结构域预测采用 PROSITE软件(http://kr.expasy.org/prosite/);二级结构预测参考Rost(1996)的方法。
氨基酸序列多重比对及进化树构建所用序列详见表1。
1.4 不同组织中PaFer mRNA的表达
采用 qPCR分析健康香鱼不同组织中 PaFer mRNA的表达, 以及鳗弧菌感染后不同时间段 PaFermRNA在各组织中转录水平变化。参照 Li等(2015)的方法进行总RNA的抽提、DNase I处理、第一链cDNA合成及qPCR检测。

表1 多重比对及系统发育进化树构建采用序列Tab.1 The sequences used for multiple alignment and phylogenetic tree construction
根据获得PaFer cDNA序列设计引物, 引物序列如下:
PaFer(+): 5′-GCTGGAGAAGAACGTCAACC-3′;
PaFer(-): 5′-GCGTCCATCTTGGTGAGATT-3′。
预期扩增片段为165bp。
以香鱼β-actin基因(登录号: AB020884)作为内参,扩增引物序列如下:
pActin2(+): 5′-TCGTGCGTGACATCAAGGAG-3′;
pActin2(–): 5′-CGCACTTCATGATGCTGTTG-3′。
预期扩增片段为231bp (Li et al, 2014)。
qPCR 扩增体系(25μL): SYBR Premix Ex Taq (2×)缓冲液 12.5μL、cDNA 模板 0.5μL、引物(10μmol/L)各 1μL, 超纯水补足至 25μL。扩增反应在 ABI Step One荧光定量 PCR仪(美国)上进行, 反应条件为:94 ℃ 3min (预变性, 1个循环); 94℃ 30s, 58℃ 30s,72 ℃ 30s (扩增段, 40个循环); 94 ℃ 30s, 72℃ 60s,95 ℃ 3 0s (融解阶段, 1个循环)。qPCR监测时每个样品重复 3次, 包括目的基因(PaFer)和内参基因(β-actin)。根据相对标准曲线法 2–ΔΔCt分析 PaFer mRNA的相对表达量(Livak et al, 2001)。
1.5 原核表达和蛋白纯化
根据PaFer的ORF设计原核表达引物, 引物序列如下:
pET-28a-PaFer(+): 5′-GGAATTC ATGGAGTCTC AGATCCGCC-3′;
pET-28a-PaFer(–): 5′-CAAGCTT TTAGCTCTGG CTCCCCAAG-3′。
下划线碱基为限制性内切酶 EcoR I和 Hind III的识别序列, 斜体字母为保护碱基。PCR扩增体系(25μL): 10×LA buffer 2.5μL, dNTP (2.5mmol/L) 3.5μL,cDNA 模板 1μL, 上下游引物(10μmol/L)各 1μL, LA Taq DNA聚合酶0.25μL, ddH2O 15.75μL。扩增反应在Mastercycler pro梯度PCR仪(德国eppendorf公司)上进行, 反应条件为: 94℃预变性2min; 94℃变性30s,56℃退火30s, 72℃延伸1.5min, 共30个循环, 循环结束后72℃延伸10min。扩增产物经电泳分离、切胶纯化后, 用 EcoRⅠ和 HindⅢ双酶切后, 与同样酶切的原核表达载体 pET-28a相连接, 获得重组质粒pET28a-PaFer。pET28a-PaFer转化大肠杆菌 BL21 pLys E菌株, IPTG诱导表达, 细菌总蛋白经SDS-PAGE分离, 考马斯亮蓝G-250染色检测 PaFer重组蛋白(rPaFer)表达情况。
转化菌经 IPTG大量诱导后, 收集大肠杆菌, 于4℃ 8000g离心10min, 弃上清, 加入PBS重悬浮细菌沉淀, 超声波破碎3次, 4 ℃ 8 000g离心10min, 获得包涵体沉淀, PBS洗涤 5次后, 将用结合缓冲液(20mmol/L Tris-HCl, 8mol/L尿素, 500mmol/L NaCl,5mmol/L咪唑, pH 8.0)洗涤, 然后4 ℃ 12000r/min离心 30min, 收集上清用于存化复性。按照 Ni-NTA SefinoseTM试剂盒说明书, 取洗涤后蛋白溶液, 上样至预平衡的Ni2+柱中, 依次用洗涤缓冲液1和洗涤缓冲液2洗脱去除杂蛋白, 最后洗涤缓冲液洗脱目的蛋白。收集每一步的洗脱液, 经SDS-PAGE检测样品的蛋白质纯度。
1.6 铁离子螯合能力测定
采用 Bradford法(Bradford, 1976)测定纯化复性的rPaFer浓度, 以牛血清蛋白为标准样。冷冻干燥后保存, 用于后续结合铁和抑菌实验。rPaFer螯合铁离子的能力测定参照 De Zoysa等(2007)提出的方法并略作改进。具体步骤如下: 分别将 1mL不同浓度rPaFer水溶液 (0, 2, 4, 6, 8和 10μg/mL)加至 20μL FeCl2(2mmol/L)中, 然后加入 40μL 菲洛嗪试剂(5mmol/L), 混匀, 室温振荡孵育10min。采用分光光度计(Ultrospec 1100 Pro UV/Visible spectrophotometer)于波长 562nm测定溶液的吸光值。每个样品平行测定3次。根据下面公式计算rPaFer的铁离子螯合能力:
铁离子螯合能力(%) = [C-(S-B)]/C×100
其中, S表示rPaFer样品水溶液反应后的吸光值, C表示水替代反应体系中样品溶液后的吸光值, B表示水代替反应中的FeCl2溶液后的吸光值。
1.7 抗菌活性分析
参照Chang等(2006)的方法, 采用二倍稀释法将rPaFer原液稀释至 100、50、25、12.5、6.25、3.125和1.5625μg/mL共7个浓度。将创伤弧菌、副溶血弧菌、鳗弧菌和溶藻弧菌活化后, 30℃培养18h后用无菌生理盐水稀释至1.0×105CFU/mL菌悬液备用。将稀释后的菌悬液接种至 96孔 U型微量滴定板内(20μL/孔), 然后加入不同浓度的PaFer蛋白到各孔内(80μL/孔), 混匀后置30℃恒温培养24h。以不接菌的为空白对照组, 采用Varioskan Flash全波长多功能酶标仪(Thermo Fisher)测定OD600值。以细菌没有生长的最小药物浓度作为rPaFer抑制4种弧菌的最小抑菌浓度(minimum inhibitory concentration, MIC), 重复3次。
1.8 统计分析
实验结果表示为平均值±标准误(mean±S.D.), 采用 SPSS 13.0软件中的单因素方差分析(One-way ANOVA)进行统计, P<0.05为差异具有显著性。
2 结果
2.1 PaFer cDNA序列分析
PaFer cDNA序列包含943bp核苷酸(GenBank登录号: FR714867), 包含一个完整的、长度为531bp的ORF, 预测编码一个由176个氨基酸组成、相对分子质量约为20.4kDa的多肽, 预测理论等电点为5.46, N末端不存在信号肽序列。
通过PROSITE工具对PaFer氨基酸序列的保守结构域预测, 结果表明, PaFer在氨基酸7—156位存在保守的铁蛋白样双铁结构域(ferritin-like di-iron domain), 并且仅存在 1个铁离子结合区域信号(iron-binding region signature, IBRS2) (123–DPHLCD FLETHYLNEQVEAIK–143) (图 1)。通过 NCBI的 CDD工具预测表明, 铁氧化酶双铁中心铁结合位点具有 7个高度保守的氨基酸残基(24E, 31Y, 58E, 59E, 62H,104E和138Q) (图1), 这7个残基在H和M亚基中作为铁离子配体发挥作用(Lawson et al, 1989; Arosio et al, 2009)。哺乳动物L亚基成核位置中3个带负电荷氨基酸残基(E54, E57和E61) (Santambrogio et al,1996)也存在于 PaFer, 但 E57被 D57取代(图 1)。二级结构预测表明, PaFer存在 4个 α螺旋, 分别为4—38、45—72、93—120 和 124—154(图 1), 这个 4螺旋束与哺乳动物Fer的相似(Harrison et al, 1996)。
2.2 PaFer的系统进化分析
氨基酸序列多重比对表明, PaFer与中国大鲵(Andrias davidianus)及其他鱼类 Fer-M 同源性为68.5%—92.0%, 其中与胡瓜鱼(Osmerus mordax)、虹鳟(Oncorhynchus mykiss)和大西洋鲑Fer-M的同源性分别为 91.9%、92.0%和 92.0%。系统进化树分析表明, 各物种 Fer-M、Fer-H和 Fer-L分别成簇, PaFer与胡瓜鱼、大西洋鲑和虹鳟的 Fer-M 聚为一个小簇,与虹鳟Fer-M进化相关性最高(图2)。
2.3 PaFer mRNA的组织表达特征
实时荧光定量PCR结果显示, PaFer基因扩增产物 mRNA在所检的香鱼各组织中均有表达, 其中在脾脏中表达量最高, 肾脏、鳃、脑和心脏中的表达量次之, 肝脏和肠中表达量相对较少, 而在肌肉组织中表达量微弱(图3)。
2.4 鳗弧菌侵染过程中香鱼各组织PaFer mRNA表达变化
腹腔注射鳗弧菌后, 感染组香鱼表现典型的弧菌病症状, 并能从肝、脾和肾等组织中分离出病原菌(结果未显示), 对照组香鱼无明显症状。与对照组相比, 鳗弧菌感染4h后, 肝中PaFer mRNA的表达量显著增加, 24h时达到峰值, 为对照组的 103.67倍(P<0.05); 脾和肾中PaFer mRNA表达量在感染8h后显著增加, 均在24h时达到峰值, 分别为对照组5.75和 70.88倍(P<0.05)(图 4)。
2.5 PaFer的原核表达及纯化
重组质粒 pET-28a-PaFer经测序验证无误后, 转化至大肠杆菌BL21 Plys E中, 加入IPTG诱导表达,菌体蛋白经SDS-PAGE电泳分离及考马斯亮蓝G-250染色后, 出现一条高表达蛋白条带, 相对分子质量约为23kDa, 与预期大小相符(图5)。利用重组质粒携带的多组氨酸标签, 表达的重组蛋白经Ni2+亲和层析柱纯化后经 SDS-PAGE检测, 显示为单一条带(图 5),实现了重组蛋白 rPaFer的一步纯化。纯化的 rPaFer经尿素梯度透析复性及透析去除尿素后, 用于检测其活性。
2.6 PaFer结合铁能力分析
菲洛嗪是一种高灵敏性的低铁显色剂, 能与Fe2+配位, 形成有色螯合物。实验结果表明, 随着 rPaFer浓度的增加, 各样品的铁离子螯合能力也随之增加,当浓度为 4μg/mL时达到峰值(43.96%), 之后进入平台期(图 6)。
2.7 PaFer体外抑菌作用
利用酶标仪测定 rPaFer蛋白对 4种鱼类常见弧菌的体外抑菌活性, 结果表明, PaFer对鳗弧菌、溶藻弧菌和创伤弧菌均有抑制作用, 其 MIC值分别为:1.5625、25、100μg/mL, 对副溶血弧菌无明显抑制作用。
3 讨论
铁蛋白调节铁离子的储存和释放, 是鱼类先天免疫系统的重要组成部分。本研究在香鱼单核/巨噬细胞转录组测序的基础上得到了香鱼铁蛋白基因。序列分析揭示, PaFer具有与其它物种铁蛋白相似的结构特征: 包括保守的铁蛋白样双铁结构域、铁氧化酶双铁中心铁结合位点的 7个高度保守的氨基酸残基及4个α螺旋等, 且与大西洋鲑和虹鳟Fer-M同源性最高, 为 92.0%。系统进化树分析表明, 各物种Fer-M、Fer-H和Fer-L分别成簇, PaFer与胡瓜鱼、大西洋鲑和虹鳟的Fer-M聚为一个小簇, 与虹鳟Fer-M进化相关性最高。

图1 香鱼与其他物种Fer氨基酸序列的多重比对Fig.1 Multiple alignment of fish Fer isoforms and those of other species

图2 基于NJ法构建的香鱼和其他物种全长铁蛋白亚基氨基酸序列的系统进化树Fig.2 Phylogenetic (Neighbor-joining) analysis of complete ferritin subunits from ayu and other species

图3 健康香鱼PaFer mRNA的组织表达特征Fig.3 The mRNA expression patterns of PaFer in various tissues of healthy ayu
表达特征分析表明, PaFer mRNA在健康香鱼被检组织中有不同程度的表达, 且在脾脏中表达量最高, 与已报道的大黄鱼(Zhang et al, 2010)、半滑舌鳎(Wang et al, 2011)、条石鲷(Elvitigala et al, 2013)和牙鲆(Wang et al, 2015)等鱼类Fer-M在肝脏中表达最高不同。脾脏是机体参与贮铁的主要器官之一, PaFer在脾脏中大量表达, 揭示其可能在香鱼铁离子贮存中发挥重要的作用。目前, 已有较多文献揭示鱼类Fer的表达与病原体感染密切相关, 主要体现为病原体感染后鱼类 Fer基因表达显著上调(Zhanget al,2010; Wanget al, 2011; Wanget al, 2015)。例如, 大黄鱼感染弱化的活鳗弧菌后, 肝中Fer-M mRNA的表达在12h达到峰值, 上调4.4倍, 脾Fer-M mRNA的表达在12h达到峰值, 上调4.7倍, 肾脏Fer-M mRNA的表达量在5d时达到峰值, 上调4.4倍(Zhanget al,2010); 半滑舌鳎感染鳗弧菌后, 肾、脾和肝中Fer-M mRNA表达分别在48h、4h和1h时达到峰值, 分别约为对照组的62、48和11倍(Wanget al, 2011); 而半滑舌鳎感染海豚链球菌后, 肾、脾和肝中 Fer-M mRNA表达达到峰值的时间分别为24h、48h和24h,上调倍数也明显低于鳗弧菌感染组(Wanget al, 2011);牙鲆感染迟缓爱德华菌后, FerM在头肾、脾和肝中的表达量显著上调, 达到峰值的时间分别为 12h、24h和12h, 分别约为对照组的13、35和20倍(Wanget al,2015)。本研究中, 香鱼感染鳗弧菌后, 肝、脾和肾中PaFer mRNA表达变化趋势与上述研究结果相似, 但达到峰值的时间点和峰值不同, 肝、脾和肾中 PaFer mRNA均在感染 24h时达到最高, 分别为对照组的103.67、5.75和70.88倍, 揭示PaFer可能在香鱼抗细菌侵染的免疫反应中发挥着重要作用。

图4 鳗弧菌感染后香鱼各组织中PaFer mRNA的表达变化Fig.4 Analysis on PaFer mRNA expression changes in various tissues of V. anguillarum infected ayu

图5 PaFer的原核表达及纯化Fig.5 Prokaryotic expression of PaFer in Escherichia coli and its purification
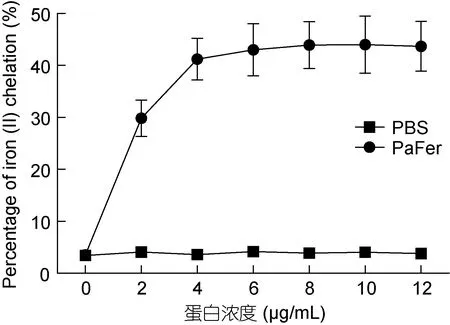
图6 不同浓度rPaFer的铁螯合能力Fig.6 Iron chelation activity of rPaFer in different concentrations
研究表明, 半滑舌鳎、条石鲷和牙鲆Fer-M重组蛋白表现出显著的铁螯合活性, 分别在浓度为 8、6和 8µg/mL时铁螯合能力最强(Wanget al, 2011;Elvitigalaet al, 2013; Wanget al, 2015), 而且牙鲆Fer-M 重组蛋白能完全抑制迟缓爱德华氏菌的生长,半滑舌鳎Fer-M重组蛋白能完全抑制鳗弧菌的生长。在本实验中, rPaFer具有明显的铁螯合能力, 并能体外抑制三种鱼类重要的弧菌病原鳗弧菌、溶藻弧菌和创伤弧菌的生长, 与上述研究结果基本一致。结合病原菌感染诱导鱼体各组织中Fer表达量大幅上调这一结果, 我们推测, 由于铁是大部分微生物生长和维系其致病性的必需元素(Bullen, 1981), 当病原菌感染鱼体后, 短时间内铁蛋白大量合成, 一方面通过螯合环境中对细菌代谢所必需的铁离子来抑制细菌的繁殖(Ong et al, 2006), 另一方面, 由于鱼体血浆内铁离子含量大大降低(Lauffer, 1992), 大量合成的铁蛋白可维持体内铁含量的稳定, 从而参与调控铁代谢以及抵抗微生物的宿主自身免疫过程。
4 结论
本研究测定了香鱼 Ferritin基因的 cDNA序列,序列分析揭示它与虹鳟和大西洋鲑Ferritin M亚基序列最为相似。健康香鱼中, PaFer mRNA在脾中表达量最高, 鳗弧菌感染后, PaFer mRNA在各组织中表达量显著上调; 铁结合能力和抑菌活性实验表明,PaFer重组蛋白具有明显的铁结合能力, 且对鳗弧菌、溶藻弧菌和创伤弧菌生长均有明显抑制作用, 揭示PaFer与香鱼抗病原感染的免疫反应紧密相关, 可能通过调控铁代谢参与鱼类抵抗微生物的宿主自身免疫过程。研究结果为进一步研究鱼类铁蛋白的结构和功能机制奠定了基础。
李长红, 陈 炯, 史雨红等, 2009. 宁海地区香鱼弧菌病病原菌鉴定. 微生物学报, 49(7): 931—937
Andersen O, Dehli A, Standal H et al, 1995. Two ferritin subunits of Atlantic salmon (Salmo salar): cloning of the liver cDNAs and antibody preparation. Mol Mar Biol Biotechnol, 4(2): 164—170
Arosio P, Ingrassia R, Cavadini P, 2009. Ferritins: a family of molecules for iron storage, antioxidation and more. Biochim Biophys Acta Gen Subj, 1790(7): 589—599
Bradford M M, 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 72(1—2):248—254
Bullen J J, 1981. The significance of iron in infection. Clin Infect Dis, 3(6): 1127—1138
Chang C I, Zhang Y A, Zou J et al, 2006. Two cathelicidin genes are present in both rainbow trout (Oncorhynchus mykiss) and Atlantic salmon (Salmo salar). Antimicrob Agents Chemother, 50(1): 185—195
Clegg G A, Fitton J E, Harrison P M et al, 1981. Ferritin:molecular structure and iron-storage mechanisms. Prog Biophys Mol Biol, 36: 53—86
De Zoysa M, Lee J, 2007. Two ferritin subunits from disk abalone (Haliotis discus discus): cloning, characterization and expression analysis. Fish Shellfish Immunol, 23(3):624—635
Dickey L F, Sreedharan S, Theil E C et al, 1987. Differences in the regulation of messenger RNA for housekeeping and specialized-cell ferritin. A comparison of three distinct ferritin complementary DNAs, the corresponding subunits,and identification of the first processed in amphibia. J Biol Chem, 262(16): 7901—7907
Elvitigala D A S, Premachandra H K A, Whang I et al, 2013. A teleostean counterpart of ferritin M subunit from rock bream(Oplegnathus fasciatus): an active constituent in iron chelation and DNA protection against oxidative damage,with a modulated expression upon pathogen stress. Fish Shellfish Immunol, 35(5): 1455—1465
Harrison P M, Arosio P, 1996. The ferritins: molecular properties,iron storage function and cellular regulation. Biochim Biophys Acta Bioenerg, 1275(3): 161—203
Hu Y H, Zheng W J, Sun L, 2010. Identification and molecular analysis of a ferritin subunit from red drum (Sciaenops ocellatus). Fish Shellfish Immunol, 28(4): 678—686
Lauffer R B, 1992. Iron and Human Disease. Boca Raton: CRC Press
Lawson D M, Treffry A, Artymiuk P J et al, 1989. Identification of the ferroxidase centre in ferritin. FEBS Lett, 254(1—2):207—210
Lee J H, Pooley N J, Mohd-Adnan A et al, 2014. Cloning and characterisation of multiple ferritin isoforms in the Atlantic salmon (Salmo salar). PLoS One, 9(7): e103729
Levi S, Santambrogio P, Cozzi A et al, 1994. The role of the L-chain in ferritin iron incorporation: studies of homo and heteropolymers. J Mol Biol, 238(5): 649—654
Li C H, Lu X J, Li D F et al, 2014. Passive protective effect of chicken egg yolk immunoglobulins against experimental Vibrio anguillarum infection in ayu (Plecoglossus altivelis).Fish Shellfish Immunol, 37(1): 108—114
Li C H, Lu X J, Li M Y et al, 2015. Cathelicidin modulates the function of monocytes/macrophages via the P2X7 receptor in a teleost, Plecoglossus altivelis. Fish Shellfish Immunol,47(2): 878—885
Liu H, Takano T, Peatman E et al, 2010. Molecular characterization and gene expression of the channel catfish ferritin H subunit after bacterial infection and iron treatment.J Exp Zool Part A: Ecol Genet Physiol, 313A(6): 359—368
Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod. Methods, 25(4): 402—408
Neves J V, Wilson J M, Rodrigues P N S, 2009. Transferrin and ferritin response to bacterial infection: the role of the liver and brain in fish. Dev Comp Immunol, 33(7): 848—857
Oh M, Umasuthan N, Elvitigala D A S et al, 2016. First comparative characterization of three distinct ferritin subunits from a teleost: evidence for immune-responsive mRNA expression and iron depriving activity of seahorse(Hippocampus abdominalis) ferritins. Fish Shellfish Immunol, 49: 450—460
Ong S T, Ho J Z S, Ho B et al, 2006. Iron-withholding strategy in innate immunity. Immunobiology, 211(4): 295—314
Orino K, Watanabe K, 2008. Molecular, physiological and clinical aspects of the iron storage protein ferritin. Vet J,178(2): 191—201
Rost B, 1996. PHD: predicting one-dimensional protein structure by profile-based neural networks. Methods Enzymol, 266:525—539
Santambrogio P, Levi S, Cozzi A et al, 1996. Evidence that the specificity of iron incorporation into homopolymers of human ferritin L- and H-chains is conferred by the nucleation and ferroxidase centres. Biochem J, 314(1):139—144
Scudiero R, Esposito M G, Trinchella F, 2013. Middle ferritin genes from the icefish Chionodraco rastrospinosus:comparative analysis and evolution of fish ferritins. C R Biol, 336(3): 134—141
Tamura K, Peterson D, Peterson N et al, 2011. MEGA5:Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Mol Biol Evol, 28(10): 2731—2739
Torti F M, Torti S V, 2002. Regulation of ferritin genes and protein. Blood, 99(10): 3505—3516
Wang J J, Sun L, 2015. Ferritin M of Paralichthys olivaceus possesses antimicrobial and antioxidative properties. Fish Physiol Biochem, 41(4): 951—959
Wang W, Zhang M, Sun L, 2011. Ferritin M of Cynoglossus semilaevis: an iron-binding protein and a broad-spectrum antimicrobial that depends on the integrity of the ferroxidase center and nucleation center for biological activity. Fish Shellfish Immunol, 31(2): 269—274
Zhang X, Wei W, Wu H Z et al, 2010. Gene cloning and characterization of ferritin H and M subunits from large yellow croaker (Pseudosciaena crocea). Fish Shellfish Immunol, 28(5—6): 735—742
