苯并芘对鲤鱼肾脏SOD和CAT的影响
2018-01-12赵莎莎袁华根
赵莎莎, 袁华根
(江苏农牧科技职业学院,江苏泰州 225300)
多环芳烃(PAHs)是一类的常见污染物,主要来源于煤、石油等燃烧产生的烟气、尾气以及焦化炼油等工业废水中,具有致癌、致畸和致突变型特性。在水环境中通过重点监测,PAHs在体内代谢时通过自身或中间代谢物氧化产生大量活性氧自由基[1],进而产生DNA断裂、脂质过氧化、酶失活等毒性反应[2]。苯并芘由于其性质稳定、致癌性性强所以是PAHs的典型代表[3]。一些研究表明,苯并芘是高活性致癌剂,而并不是直接的致癌物,必须与细胞微粒体中的混合功能氧化酶相互作用才具有致癌性。随着苯并芘浓度的增加,癌症的发生率也会明显提高,且肿瘤的潜伏期也会明显缩短,苯并芘不仅会引发动物产生癌症而且还会导致子代发生肿瘤癌变,不但会造成动物免疫功能下降,而且也会造成胚胎畸形甚至死亡[4-9]。
鱼类体内抗氧化酶主要包括超氧化物歧化酶(SOD),过氧化氢酶(CAT)。其中SOD是机体内天然存在的超氧自由基清除因子,它通过上述反应可以把有害的超氧自由基转化为过氧化氢[10]。CAT则是催化体内废物过氧化氢,将其分解为完全无害的水,减少对机体的损害[11]。肾脏是机体的重要器官,承担机体排泄功能,可排除蛋白质代谢的最终产物和对机体有害的毒物和废物,以调节体液平衡和调节电解质酸碱平衡;分泌生物活性物质,同时可以通过重吸收功能保留水分及其他有用物质[12]。在鱼类肾脏中含有丰富的抗氧化酶,因此通过研究不同浓度的苯并芘对鱼类肾脏的SOD、CAT酶含量的影响来描述水体受污染的程度。目前,已有很多关于海洋鱼类的报道[13~14],但是在淡水鱼方面的研究较少,而鲤鱼又是淡水鱼中的代表,希望通过研究苯并芘对鲤鱼的抗氧化酶的影响为改善水环境的污染提供理论依据。
1 材料与方法
试验时间:2016年6月;试验地点:江苏省兽用生物制药高技术研究重点实验室。
1.1 试验动物
试验鱼选购自无污染的渔场,所购鲤鱼来自同一鱼池,平均体质量为(25.16±2.15)g,经5%食盐水消毒后进入实验室[15]。
1.2 仪器与试剂
紫外分光光度计UV 2000(优尼科);匀浆机ART、苯并芘(BaP),购自美国AccuStandard公司;助溶剂二甲基亚砜(DMSO),购自美国Amreccr公司;超氧化物歧化酶(SOD)、过氧化氢酶(CAT)试剂盒,购自南京建成生物工程研究所;其余试剂均为分析纯级别。
1.3 试验方法
1.3.1 暴露 所有试验用鱼在去氯自来水中培养,通过对水中成分分析,水中的重金属元素几乎没有或者不能被监测出来,水质满足鲤鱼生存所需的要求。驯养2周后,随机分组,每个处理组4尾。分别置于长×宽×高为100 cm×70 cm×50 cm的塑料缸中,盛水200 L/缸。试验时每天更换用水,换水量为原来的1/2,以便浓度保持基本一致。试验期间用充气泵连续进行充气,每天按时投放饲料,水温基本控制在约23 ℃,自然光照,试验进行30 d,并每5 d换1次水,彻底清洗水箱。将苯并芘溶于水中,由于苯并芘的溶解度比较小,所以在水中再加入助溶剂二甲基亚砜(DMSO)。4个处理组分别接受苯并芘浓度为0、0.1、0.5、1.0 μg/L的染毒,每个浓度设2个平行,对照组只投放二甲基亚砜(DMSO)[16]。
1.3.2 取样及样品处理 将鱼捞出迅速解剖鱼体取出肾脏,用预冷的0.9%生理盐水冲洗表面血液,在滤纸上除去多余的液体后,-4 ℃保存,按质量体积比1 g ∶10 mL加入0.9%生理盐水充分匀浆,4 ℃下,5 000 r/min离心约10 min,去上清液进行酶活力分析和蛋白质含量测定。每尾鱼都独立作为一个样本。
1.4 酶活性的测定
1.4.1 超氧化物歧化酶(SOD)的活性测定 采用黄嘌呤氧化酶法[17~18]。SOD活性的定义:1 mg蛋白在1 mL反应液中SOD抑制表达率达50%时,所对应的SOD量为一个亚硝酸盐单位(NU)。而鲫鱼肾脏SOD活性用SOD试剂盒测定。
测定原理:肾脏SOD活性A(SOD)/(NU·mg)=2{(D对照管-D测定管)/D对照管}×(反应液总体积/样品量)/蛋白质含量。
1.4.2 过氧化氢酶(CAT)的活性测定[19]CAT活性的定义:1 mg蛋白质1 min分解底物过氧化氢的相对量为1个活力单位。
测定原理:CAT分解H2O2的反应通过加入钼酸铵中止反应,剩余的H2O2与钼酸铵作用产生一种淡黄色的络合物,在405 nm处测定其生成量,可计算出CAT活力。
1.5 蛋白质含量的测定
样品中蛋白质含量用Lowry法测定,以牛血清白蛋白为参照[18]。
1.6 数据处理
试验数据用SPSS 13.0版软件进行单因素方差分析处理,并用CORREL进行相关性分析。
2 结果与分析
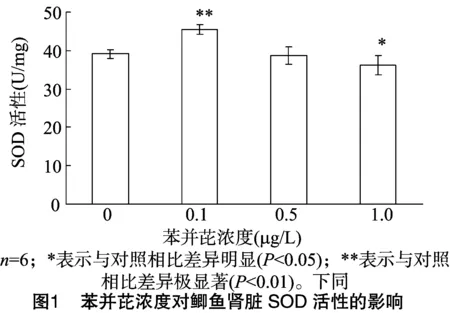
2.1 苯并芘对鲤鱼肾脏超氧化物歧化酶(SOD)活性的影响
不同浓度的苯并芘30 d后对鲫鱼肾脏中SOD的影响见图1。由图1可见,不同浓度苯并芘水溶液暴露30 d后,0.1、0.5、1.0 μg/L浓度组分别比对照组高6.355 U/mg、低 0.415 U/mg、低2.985 U/mg。Excel软件中的CORREL函数相关性分析表明,鲤鱼在含有不同浓度苯并芘的水中暴露 30 d 后,SOD活性与苯并芘浓度(r=-0.81)呈负相关。苯并芘浓度在 0.1 μg/L 与对照组相比差异极显著(P<0.01);在浓度为 1.0 μg/L 与对照组相比差异显著(P<0.05)。
2.2 苯并芘对鲤鱼肾脏过氧化氢酶(CAT)活性的影响
由图2可见,不同浓度苯并芘水溶液暴露30 d后,0.1、0.5、1.0 μg/L浓度组分别比对照组高1.155 U/mg、低 0.993 U/mg、低1.678 U/mg。Excel软件中的CORREL函数相关性分析表明,鲤鱼在含有不同浓度苯并芘的水中暴露 30 d 后,CAT活性与苯并芘浓度(r=-0.92)呈负相关,且在浓度为1.0 μg/L时,与对照组相比差异显著(P<0.05)。

3 讨论
苯并芘属多环芳香烃类的环境污染物,在自然界分布广、致癌性强,通常将其作为环境致癌物的代表,是主要的环境污染检测对象[1,3]。
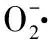
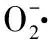
水体中的污染物主要是PAHs,苯并芘是PAHs典型的一种[3]。因此,本试验通过对不同浓度的苯并芘对鲫鱼肾脏SOD、CAT含量影响的研究,以期为水体监测提供一些数据。据有关研究试验表明,在抗氧化防御系统中,对低浓度污染物的感染,酶的活力或活性物质的含量升高;当污染程度不断加大,对机体已经构成损害,那么抗氧化酶的活力或活性物质的含量则会下降[25]。本试验中所得到的数据和结论与之相同,即当苯并芘浓度较低时(0.1 μg/L),SOD和CAT的活性均高于对照组,当苯并芘浓度逐渐加大时,SOD和CAT的活性均低于对照组。且其相关性分别为-0.81和-0.92,说明变化整体是呈下降趋势的,这可能因为当机体受到外来物质感染时,刺激机体的抗氧化性防御机制,使得抗氧化酶SOD和CAT大量产生,将体内自由基清除,从而起到保护机体的作用;但是随着感染浓度的加大,机体的抗氧化防御作用有限,可能造成活性氧自由基的积累和对细胞膜的损伤,降低机体的健康水平[19]。
[1]Rey-Salgueirol R,Martinez-Carballoe M,Garcia-Falcon M S. et al survey of polycyclic aromatic hydrocarbons in canned bivalves and investigation of their potential sources[J]. Food Research International,2009,42(8):983-988.
[2]Winston GW. Oxidants and antioxidants in aquatic animal[J]. Comp Biochem Physiol,1991,100:173-176.
[3]黄长江,胡晓蓉,董巧香. 苯并芘对罗非鱼肝脏抗氧化防御系统的影响[J]. 汕头大学学报(自然科学版),2006(4):51-56.
[4]刘 宁,沈明浩. 食品毒理学[M]. 北京:中国轻工业出版社,2007.
[5]郑榕辉,王重刚. 多环芳烃对鱼类生殖机能的影响[J]. 台湾海峡,2004,23(2):245-252.
[6]段小丽,魏复盛. 苯并(a)芘的环境污染、健康危害及研究热点问题[J]. 世界科技研究与发展,2002,24(1):11-16.
[7]王广峰. 苯并芘对人体的危害和食品中苯并芘的来源及防控[J]. 菏泽学院学报,2014,36(2):66-70.
[8]叶 萌,刘秉慈,杜宏举,等. 苯并芘诱导人胚肺成纤维细胞eyelinD1、CDK4、E2F-1/4的表达改变[J]. 卫生研究,2006(2):135-138.
[9]王家锦,穆 莹,宋桂宁,等. 苯并芘致癌致畸作用的观察与研究[J]. 中国生育健康杂志,1997(4):159-161.
[10]徐凤彩. 基础生物化学[M]. 广州:华南理工大学出版社,1999:202-203.
[11]庄惠生,杨 光. 双酚A对鲤鱼急性和亚急性毒性的研究[J]. 环境化学,2005,24(6):682-684.
[12]杨焕民,柳巨柳. 动物生理学[M]. 北京:高等教育出版社,2011.
[13]王重刚,陈奕欣,郑微云,等. 苯并(a)芘和芘的混合物暴露对梭鱼脾脏抗氧化防御系统的影响[J]. 海洋学报,2003,25(2):135-139.
[14]Pacheco M,Santos M A. Induction of liver EROD and erythrocytic nuclear abnormalities by cyclophosphamide and PAHs inAnguillaanguillaL.[J]. Ecotoxicology and Environmental Safety,1998,40(1/2):71-76.
[15]沈洪艳,甄芳芳,任洪强,等. 对氯硝基苯对锦鲤(Cyprinuscarpio)的急性毒性试验[J]. 生态环境,2007,16(2):407-409.
[16]毕研娇. 白泥脱硫废水排海的生态风险评估[D]. 青岛:中国海洋大学,2012.
[17]季建平. 超氧化物歧化酶微量快速测定法[J]. 南京铁道医学院学报,1991,10(1):27-30.
[18]李 康,周忠良,陈立侨,等. 苯并[a]芘对鲫鱼生物标志物的影响研究[J]. 环境科学研究,2006(1):91-95.
[19]Jin L H,Bahn J H,Eum W S,et al. Transduction of human catalase mediated by an HIV-1 TAT protein basic domain and arginine-rich peptides into mammalian cells[J]. Free Radical Biology & Medicine,2001,31(11):1509-1519.
[20]张克烽,张子平,陈 芸,等. 动物抗氧化系统中主要抗氧化酶基因的研究进展[J]. 动物学杂志,2007,42(2):153-160.
[21]陈剑杰,曹谨玲,罗永巨,等. 氟对鲤鱼鳃组织免疫相关酶及 IL-1β表达影响[J]. 核农学报,2014,28(6):1092-1098.
[22]韩志萍,杨志红,吴 湘,等. 铅胁迫对芦竹抗氧化酶活性的影响[J]. 核农学报,2010,24(4):846-850.
[23]Iiall I B,Gutterid G J M C. Free radicals in biology and mcdicine[M]. 2 nd ed. Oxford:Clarendon Press,1989.
[24]王 玥,胡义波,姜乃澄. 氨态氮、亚硝态氮对罗氏沼虾免疫相关酶类的影响[J]. 浙江大学学报(理学版),2005,32(6):698-705.
[25]刘 洁,林智勇,王克坚. 不同浓度苯并(a)芘对杂色鲍抗氧化酶活性的影响[J]. 应用海洋学学报,2014(4):486-491.
