伴生小麦对黄瓜叶片衰老期间糖代谢相关指标的影响
2018-01-11李圆圆韩庆姝刘苏雅吴凤芝周新刚刘守伟
李圆圆 张 婧 韩庆姝 刘苏雅 吴凤芝 周新刚 刘守伟
(东北农业大学园艺园林学院,黑龙江哈尔滨 150030)
叶片衰老是叶片发育的最后一个阶段,是营养物质从老叶向新叶和种子转移的复杂过程(Guiboileau et al.,2010;Zhang et al.,2012), 其间伴随着一系列生理生化变化,受生长发育时期和环境胁迫的诱导(孙玉莹 等,2013)。黄瓜是我国种植范围最广、栽培面积最大的蔬菜种类之一(商庆梅 等,2010),叶片衰老是限制黄瓜长季节生产的重要因素(孙艳 等,2008),北方越冬栽培时的低温寡照以及南方露地栽培的高温,均可造成叶片提早衰老及秧苗寿命的缩短。多年来,人们对黄瓜叶片正常衰老过程中的外部形态特征(商庆梅,2009)及生理指标(王利 等,2007)等方面进行了相关研究,也探讨了环境胁迫下与黄瓜叶片衰老相关的一些生理指标的变化(晋晓彤,2009),提出了通过改善光质(王虹 等,2010)、添加秸秆(高青海和王亚坤,2014)等措施可延缓黄瓜叶片衰老。研究表明,黄瓜伴生小麦具有控病促生的作用,能促进黄瓜生长,提高产量,降低霜霉病和角斑病的发病率和病情指数(王东凯 等,2012),降低叶绿素和蛋白质的降解速度,提高抗氧化酶活性,减缓黄瓜叶片衰老(高春琦和吴凤芝,2014)。
糖是调控植物代谢和生长发育的重要信号物质,糖代谢在植物衰老过程中起着非常重要的作用(雷美玉 等,2007)。研究表明,叶片衰老是由于细胞内糖水平升高(Wingler et al.,2006);衰老加剧了烟草和拟南芥叶片中糖的积累(Wingler et al.,2012),强光下培育的烟草和大麦,其离体叶片表现出黄化加剧和糖的积累(Krapp et al.,1991;Parrott et al.,2005),高水平的糖含量促进了叶片衰老,说明糖代谢在一定程度上调控着叶片的衰老(Wingler et al., 2006)。可见,糖代谢影响着植物的生长、发育以及衰老进程。本试验采用田间试验,用小麦伴生黄瓜栽培,通过测定黄瓜同一叶片不同叶龄的糖代谢产物含量以及相关酶的活性,探明在小麦伴生栽培模式下,黄瓜叶片衰老过程中糖代谢相关指标的变化情况,以期为小麦与黄瓜伴生栽培模式的应用及进一步开展黄瓜衰老问题的研究提供基本理论依据和技术支撑。
1 材料与方法
1.1 试验材料
供试土壤为黄瓜多年连作土壤,基本化学性质:铵态氮含量47.65 mg·kg-1,硝态氮149.66 mg·kg-1,速效磷 319.27 mg·kg-1,速效钾 316.00 mg·kg-1,全氮 1.41 g·kg-1,全磷 1.43 g·kg-1,有机质 68.38 g·kg-1,pH 7.7,EC 值 1.03 mS·cm-1。
主栽作物黄瓜(Cucumis sativusL.)品种津早9号,购自天津科润黄瓜研究所。伴生作物小麦(Triticum aestivumL.)选用品资II-5,由东北农业大学园艺园林学院设施园艺与蔬菜生理生态研究室提供。
1.2 试验设计
试验于2017年4~7月在东北农业大学园艺站试验实习基地大棚和园艺园林学院蔬菜生理生态实验室进行。
黄瓜常规育苗,两叶一心时定植于大棚,株距30 cm,行距60 cm,垄作,每垄定植12株,单因素随机区组设计,每处理3次重复,小区面积3 m2(5 m×0.6 m),小区两侧设保护行。定植黄瓜的同时播种小麦种子,采用穴播的方式,在黄瓜垄的一侧,距黄瓜茎基部5 cm处播种40粒小麦种子。小麦生长到30 cm左右时刈割(此时黄瓜株高50 cm左右),留10 cm茬,以不影响黄瓜生长为准。以黄瓜单作为对照。
待黄瓜幼苗长至三叶一心时,对第4片叶进行叶龄(叶片伸出后天数)标记,在第4片叶叶龄为20 d开始取第4、5片叶,每次选取长势较一致的植株3株,每10 d取1次,共取5次,每次每重复取3株,一部分鲜样用于可溶性糖、还原糖、葡萄糖和蔗糖含量的测定,一部分叶片保存于-80 ℃冰箱中用于蔗糖合成酶、蔗糖磷酸合成酶、中性转化酶和酸性转化酶活性的测定。
1.3 测定项目
1.3.1 糖含量测定 参考张志良等(2009)的方法:可溶性糖含量的测定采用蒽酮比色法;还原糖含量的测定采用3,5-二硝基水杨酸(DNS)比色法;葡萄糖含量的测定采用葡萄糖氧化酶法;蔗糖含量的测定采用Roe比色法。
1.3.2 酶活性测定 蔗糖合成酶(SS)活性的测定采用Rufly和Huber(1983)的方法;蔗糖磷酸合成酶(SPS)活性的测定采用Zhun等(1997)的方法;中/酸性转化酶(N/AI)活性的测定采用Merlo和Passera(1991)的方法。
1.4 数据分析
原始数据的整理使用 Microsoft Excel(Office 2003)软件,数据处理采用 SAS 9.2软件的Turkey法进行方差分析(P<0.05),差异显著性测验采用t检验法。
2 结果与分析
2.1 伴生小麦对黄瓜叶片糖含量的影响
从表1可以看出,整个取样时期黄瓜叶片可溶性糖含量变化总体呈先下降后上升趋势。在黄瓜第4片叶叶龄为20、30 d时,伴生小麦处理和黄瓜单作的叶片可溶性糖含量均较高,在40 d时明显下降;与单作相比,伴生小麦处理的黄瓜叶片中可溶性糖含量在第4片叶叶龄为30、50 d时分别显著降低了14.06%和20.93%。
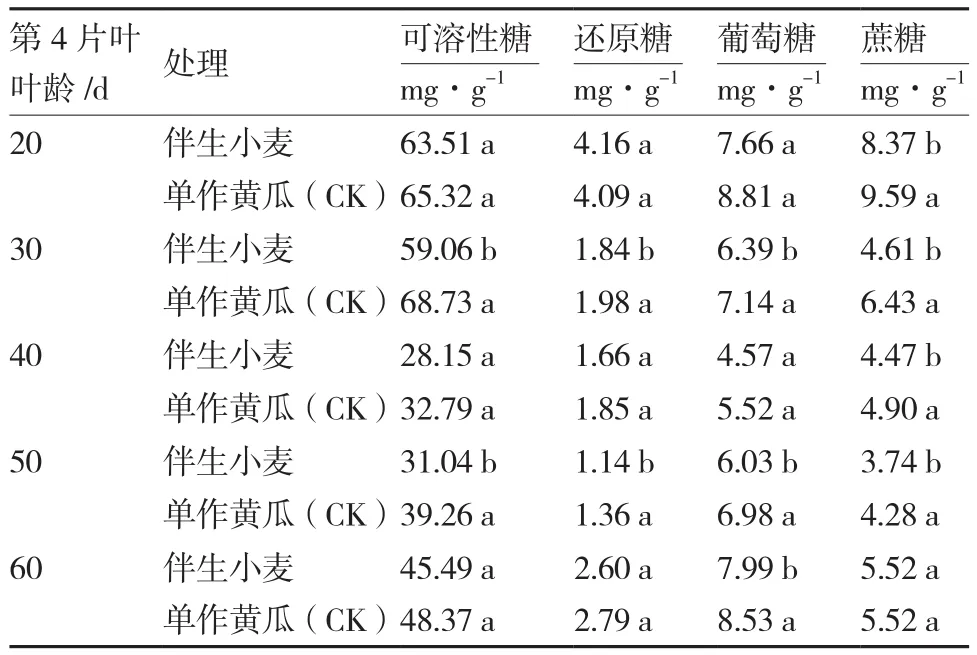
表1 伴生小麦对黄瓜叶片糖含量的影响
整个取样时期黄瓜叶片还原糖、葡萄糖、蔗糖含量变化也呈先下降后上升趋势(表1)。其中伴生小麦处理的黄瓜叶片还原糖含量在各时期均低于黄瓜单作(20 d除外),在黄瓜第4片叶叶龄为30、50 d时分别比单作显著降低了7.01%和16.18%;伴生小麦处理的黄瓜叶片葡萄糖含量在各时期始终低于单作,在黄瓜第4片叶叶龄为30、50、60 d时分别比单作显著降低了10.50%、13.61%和6.33%;在黄瓜第4片叶叶龄为20~50 d时,伴生小麦处理的黄瓜叶片中蔗糖含量分别比单作显著降低了12.72%、28.30%、8.78%和12.62%。
2.2 伴生小麦对黄瓜叶片糖代谢关键酶活性的影响
从表2可以看出,伴生小麦处理的黄瓜叶片蔗糖合成酶活性在各时期均高于单作处理(60 d除外),在黄瓜第4片叶叶龄为30、40、50 d时分别比单作显著提高了27.89%、33.97%和75.41%。

表2 伴生小麦对黄瓜叶片糖代谢关键酶活性的影响
伴生小麦处理的黄瓜叶片蔗糖磷酸合成酶活性、中性转化酶活性、酸性转化酶活性在各时期均高于单作处理(表2)。其中蔗糖磷酸合成酶活性在黄瓜第4片叶叶龄为30、40 d时分别比单作处理显著提高了45.34%和23.33%,在黄瓜第4片叶叶龄为30 d时活性最高,达到130.92 mg·g-1·h-1;中性转化酶活性在黄瓜第4片叶叶龄为20、60 d时分别比单作处理显著提高了10.80%和5.42%;酸性转化酶活性在黄瓜第4片叶叶龄为20、30、50 d时分别比单作处理显著提高了7.95%、7.67%和6.33%。
3 结论与讨论
3.1 伴生小麦对黄瓜叶片糖含量的影响
糖是调控植物代谢和发育的重要信号物质,众多研究表明可溶性碳水化合物在植物衰老过程中起到重要作用(Gibson,2005)。Holland等(2016)研究发现植株发育过程中碳水化合物的浓度诱导了植株的衰老,高浓度碳水化合物与衰老起始的发生有关(Parrott et al.,2005)。在烟草和拟南芥的研究中也发现衰老加剧了叶片中糖的积累(Wingler et al.,2012)。本试验结果表明,伴生小麦栽培的黄瓜叶片可溶性糖与还原糖含量在黄瓜第4片叶叶龄为30、50 d时显著低于单作,且蔗糖含量(60 d除外)以及葡萄糖含量(20 d与40 d除外)也显著低于单作,说明伴生小麦栽培模式在一定程度上能够降低这4种糖的积累,表明伴生小麦延缓黄瓜衰老可能是通过调节叶片内的糖含量,增强了植株抵御外界不良环境的能力(Watanabe et al.,2013),从而达到延缓植株衰老的作用(Wingler et al.,2012)。
另外一些研究表明,糖积累是光合作用的主要抑制因子(Pego et al.,2000),能够显著抑制光合作用,加剧叶片衰老(Jang et al.,1997),而低糖含量则促进光合作用与营养的循环利用,延缓植物叶片衰老(Rolland et al.,2002)。近年来,国内外众多研究也发现糖和激素之间存在相互作用,并对它们各自的代谢途径产生影响。研究表明,较低浓度的葡萄糖和脱落酸促进植物生长(Leon & Sheen,2003),高水平的葡萄糖和脱落酸共同参与了植物幼苗的生长停滞(Dekkers et al.,2008),而在植物体内脱落酸和蔗糖以一种协调的方式相互作用积累储存(Finkelstein & Gibson,2001)。本试验中黄瓜植株伴生小麦后,可能通过对碳水化合物的调节进而调控了叶片的衰老进程,降低了糖在叶片中的积累,影响了植株激素水平,增强了黄瓜叶片的光合作用(高春琦和吴凤芝,2014),与前人研究结果一致(Shi et al.,2016),这可能是伴生小麦延缓黄瓜叶片衰老的原因之一。伴生小麦后黄瓜叶片内糖与光合作用以及激素的相互作用还有待研究。
3.2 伴生小麦对黄瓜叶片糖代谢关键酶活性的影响
植物叶片中蔗糖合成酶主要作用是催化蔗糖分解(Hoffmann-Thoma et al.,1996),其活性可作为库强度的指示器(Schaffer & Petreikov,1997)。蔗糖磷酸合成酶活性反映蔗糖合成途径的能力,较高的蔗糖合成酶和蔗糖磷酸合成酶活性反映了叶片将光合产物转化为蔗糖的能力(Halford et al.,2011)。本试验结果表明,伴生小麦处理的黄瓜叶片蔗糖合成酶活性在黄瓜第4片叶叶龄为30、40、50 d时显著高于单作,且在50 d时活性达到最高,说明在黄瓜叶片衰老的前中期蔗糖合成活动占主要地位;而伴生小麦处理的蔗糖磷酸合成酶活性在黄瓜第4片叶叶龄为30、40 d时显著高于单作,且各处理在30 d时活性均达到最高,说明在黄瓜叶片衰老后期蔗糖降解比较活跃,在这一时期叶片内蔗糖含量开始下降,且伴生小麦处理显著低于单作,伴生小麦处理降低了黄瓜叶片蔗糖的积累,可能是增强了叶片对蔗糖的利用和运输,促进蔗糖的重新分配(Chen & Wang,2012)。说明伴生小麦后黄瓜叶片具有更强的源强度以确保把蔗糖高效地运输到库组织,增强了对叶片糖代谢的调控,延缓了叶片的衰老。
植物体内转化酶主要有酸性转化酶和中性转化酶两种形式(Koch,2004),其催化质外体和细胞内的蔗糖转化为葡萄糖和果糖,参与蔗糖的分解代谢(Roitsch & Gonzalez,2004)。本试验结果表明,伴生小麦处理后,黄瓜叶片中中性转化酶活性在黄瓜第4片叶叶龄为20 d和60 d时显著高于单作,酸性转化酶活性在黄瓜第4片叶叶龄为20、30 d和50 d时显著高于单作,说明在衰老的各个时期伴生小麦处理的黄瓜叶片均具有较强的蔗糖分解能力,促进了叶片的糖代谢,延缓了叶片的衰老(Sebastian & Sofia,2016)。
综观以上数据,当伴生小麦处理的黄瓜叶片转化酶活性显著高于单作时,葡萄糖和蔗糖含量却低于单作,这可能是因为在这些时期,与单作相比,伴生小麦处理的黄瓜植株具有更活跃的转化酶活性变化的同时,蔗糖合成酶和蔗糖磷酸合成酶的活性变化也同样活跃,蔗糖的分解代谢和合成代谢都处于活跃状态,使得伴生小麦处理后黄瓜叶片中糖这种能源物质在保证叶片正常生长外,可能还源源不断地向植株其他部位进行转移以提供能量,保持植株整体更健康的生长,从而有利于延缓衰老。由单一因素诱导的衰老已有诸多研究,而这些途径与植物发育和内源信号感知途径之间的交叉作用的研究却很少(Guo & Gan,2012)。伴生小麦对黄瓜叶片糖代谢的影响可能是伴生小麦对植株体内各项生理活动的调控,影响糖和光合作用、糖和激素等的相互作用(Fareen et al.,2016);另一个更深层次的原因可能是由于伴生小麦后,小麦根系分泌物直接或间接改变了土壤微生物群落结构与多样性(吴凤芝 等,2014),进而提高作物的养分利用效率,促进伴生作物的生长(Wu et al.,2016),而这些过程可能会直接或间接影响伴生作物叶片中糖含量以及与糖代谢相关的酶活性,从而调控了叶片的糖代谢过程,延缓叶片的衰老。具体作用机制还有待进一步研究。综上所述,本试验通过对伴生小麦条件下黄瓜叶片衰老期间不同糖含量、相关酶活性的分析,表明伴生小麦通过降低了黄瓜叶片内糖的积累,增强了糖代谢关键酶活性,从而提高了叶片糖代谢能力,延缓了黄瓜叶片的衰老。
高春琦,吴凤芝.2014.伴生小麦对黄瓜生长及生理指标的影响.中国蔬菜,(10):24-28.
高青海,王亚坤.2014.作物秸秆对黄瓜衰老中根系活力和叶片氮代谢的影响.干旱地区农业研究,(6):32.
晋晓彤.2009.高温、强光、氮营养胁迫对黄瓜幼苗衰老的影响〔硕士论文〕.天津:天津大学.
雷美玉,李辉亮,刘立元,彭世清.2007.糖在植物中的感知与信号传导研究进展.西北植物学报,27(10):2118-2127.
商庆梅.2009.黄瓜衰老特征特性研究〔硕士论文〕.哈尔滨:东北农业大学.
商庆梅,秦志伟,周秀艳.2010.黄瓜植株衰老过程中根系内生理生化指标变化.东北农业大学学报,41(9):27-30.
孙艳,梁宇柱,陈敬东.2008.黄瓜叶片衰老过程中抗坏血酸含量与生理指标关系的研究,西北植物学报,28(3):512-516.
孙玉莹,毕京翠,赵志超.2013.作物叶片衰老研究进展.作物杂志,(4):11-19.
王东凯,杨威,刘博.2012.不同栽培方式对设施黄瓜主要病害及品质的影响.北方园艺,(9):10-13.
王虹,姜玉萍,师恺.2010.光质对黄瓜叶片衰老与抗氧化酶系统的影响.中国农业科学,43(3):529-534.
王利,张亚红,郭文忠.2007.黄瓜博耐13-b叶片衰老机理研究.农业科学研究,28(4):12-15.
吴凤芝,李敏,曹鹏,马亚飞,王丽丽.2014.小麦根系分泌物对黄瓜生长及土壤真菌群落结构的影响.应用生态学报,25(10):2861-2867.
张志良,瞿伟菁,李小方.2009.植物生理学实验指导.北京:高等教育出版社:103-107.
Chen H J,Wang S J.2012.Abscisic acid enhances starch degradation and sugar transport in rice upper leaf sheaths at the post-heading stage.Acta Physiologiae Plantarum,34(4):1493-1500.
Dekkers,B,Schuurmans J,Smeekens S.2008.Interaction between sugar and abscisic acid signaling during early seedling development inArabidopsis.Plant Mol Boil,67:151-167.
Fareen S,Mohammad Y,Mohammad F,Ahmad F,Shamsul H.2016.Role of sugars under abiotic stress.Plant Physiology and Biochemistry,109:54-61.
Finkelstein R,Gibson S.2001.ABA and sugar interactions regulating development:crosstalk or voices in a crowd? Plant Biol,5:26-32.
Gibson S I.2005.Control of plant development and gene expression by sugar signaling.Plant Biol,8:93-102.
Guiboileau A,Sormani R,Meyer C,Masclaux-Daubresse C.2010.Senescence and death of plant organs:nutrient recycling and developmental regulation.Plant Biol,333:382-391.
Guo Y,Gan S S.2012.Convergence and divergence in gene expression profiles induced by leaf senescence and 27 senescence-promoting hormonal,pathological and environmental stress treatments.Plant Cell and Environment,35:644-655.
Halford N G,Curtis T Y,Muttucumaru N,Postles J,Mottram D S.2011.Sugars in crop plants.Ann Appl Biol,158:1-25.
Hoffmann-Thoma G,Hinkel K,Nicolay P,Willenbrink J.1996.Sucrose accumulation in sweet sorghum stem internodes in relation to growth.Physiol Plant,97:277-284.
Holland V,Fragner L,Jungcurt T,Weckwerth W,B rü ggemann W.2016.Girdling interruption between source and sink in Quercus pubescens does not trigger leaf senescence.Photosynthetica,54(4):589-597.
Jang J,Leon P,Zhou L,Sheen J.1997.Hexokinase as a sugar sensor in higher plants.Plant Cell,9:15-19.
Koch K.2004.Sucrose metabolism:regulatory mechanisms and pivotal roles in sugar sensing and plant development.Curr Opin Plant Biol,7:235-246.
Krapp A,Quick W P,Stitt M.1991.Ribulose-1,5-biphosphate carboxylase/oxygenase,other Calvin enzymes,and chlorophyll decrease when glucose is supplied to mature spinach leaves via the transpiration stream.Planta,186:58-69.
Leon P,Sheen J.2003.Sugar and hormone connections.Trends Plant Sci,8:1360-1385.
Merlo L,Passera C.1991.Change in carbohydrate and enzyme levels during development of leaves ofPrunus persica,a sorbitol synthesizing species.Plant Physiol,83:621-626.
Parrott D,Yang L,Shama L,Fischer A M.2005.Senescence is accelerated,and several proteases are induced by carbon ‘feast’conditions in barley(Hordeum vulgareL.)leaves.Planta,222:989-1000.
Pego J,Kortstee A,Huijser C,Smeekens S.2000.Photosynthesis,sugars and the regulation of gene expression.J Exp Bot,51:407-416.
Roitsch M C,Gonzalez M C.2004.Function and regulation of plant invertases:sweet sensations.Trends Plant Sci,9:606-613.
Rolland F,Moore B,Sheen J.2002.Sugar sensing and signaling in plants.Plant Cell,14:185-205.
Rufly T W,Huber S C.1983.Changes in starch formation and activities of sucrose phosphate synthase and cytoplasmic fructose-1,6-biosphatase in response to source-sink alterations.Plant Physiol,72(2):474-478.
Schaffer A A,Petreikov M.1997.Sucrose-starch metabolism in tomato fruit undergoing transient starch accumulation.Plant Physiol,113:739-746.
Sebastian M,Sofia B L.2016.Integrating transcriptomic and metabolomic analysis tounderstand natural leaf senescence in sun fl ower.Plant Biotechnology Journal,14:719-734.
Shi H,Wang B,Yang P,Li Y,Miao F.2016.Differences in sugar accumulation and mobilization between sequential and nonsequential senescence wheat cultivars under natural and drought conditions.PLoS One,11:155-166.
Watanabe M,Balazadeh S,Tohge T,Erban A,Giavalisco P,Kopka J,Mueller-Roeber B,Fernie A R,Hoefgen R.2013.Comprehensive dissection of spatiotemporal metabolic shifts in primary,secondary,and lipid metabolism during developmental senescence inArabidopsis.Plant Physiol,162:1290-1310.
Wingler A,Purdy S,MacLean J A,Pourtau N.2006.The role of sugars in integrating environmental signals during the regulation of leaf senescence.J Exp Bot,57:391-399.
Wingler A,Dellate T,O’Hara L,Premavesi L,Jhurreea D,Paul M,Schluepmann H.2012.Trehalose 6-phosphate is required for the onset of leaf senescence associated with high carbon availability.Plant Physiol,158:1241-1251.
Wu X,Wu F,Zhou X,Fu X,Tao Y,Xu W,Pan K,Liu S.2016.Effects of intercropping with potato onion on the growth of tomato and rhizosphere alkaline phosphatase genes diversity.Front Plant Sci,7:846.
Zhang C,Liu M,Fu J X.2012.Exogenous sugars involvement in senescence and ethylene production of tree peony ‘Luoyang Hong’cut flowers.Korean Journal of Horticultural Science & Technology,30(6):718-724.
Zhun Y J,Komor E,Moore P H.1997.Surose accumulation in the sugarcane stem is regulared by the difference between the activities of soluble acid invertase and sucrose phosphate synthase.Plant Physiol,115:609-616.
