HIF-2α与VE-cadherin在宫颈腺癌中的作用研究
2018-01-11伍艳平黄小环李月洁周铁军
伍艳平 黄小环 龚 莉 李月洁 周铁军▲
1.西南医科大学附属医院病理科,四川泸州 646000;2.重庆三峡医药高等专科学校,重庆 404120
HIF-2α与VE-cadherin在宫颈腺癌中的作用研究
伍艳平1黄小环2龚 莉1李月洁1周铁军1▲
1.西南医科大学附属医院病理科,四川泸州 646000;2.重庆三峡医药高等专科学校,重庆 404120
目的探究HIF-2α与VE-cadherin宫颈腺癌发生发展中的作用。方法收集60例宫颈腺癌组织和18例同期因子宫肌瘤行子宫全切手术的正常宫颈组织,采用免疫组织化学方法检测HIF-2α与VE-cadherin蛋白在宫颈腺癌及正常宫颈组织中的表达。结果宫颈腺癌组织中HIF-2α与VE-cadherin的阳性表达率分别为56.67%和65.00%,明显高于正常宫颈组织,差异有统计学意义(P<0.05);HIF-2α和VE-cadherin蛋白的表达与宫颈腺癌瘤体的大小、临床分期、淋巴结转移有关(P<0.05),与宫颈腺癌的病理分级及其患者年龄无关(P>0.05);HIF-2α和VE-cadherin在宫颈腺癌中的表达具有正相关关系,二者相关系数为0.632(P<0.05)。结论HIF-2α和VE-cadherin在宫颈腺癌中的表达显著升高,且VE-cadherin可能是HIF-2α的下游靶基因,二者可能共同参与调节宫颈腺癌的发生发展和转移过程。
缺氧诱导因子-2α;血管内皮钙粘素;宫颈腺癌;转移
R737.33
A
2095-0616(2018)01-30-04
四川省科学技术厅与泸州市人民政府、泸州医学院联合科研专项资金计划项目(川科发计[2014]10号);泸州医学院附属医院科研课题[2014]71号)。
▲通讯作者
The role of HIF-2α and VE-cadherin in cervical adenocarcinoma
WU Yanping1HUANG Xiaohuan2GONG Li1LI Yuejie1ZHOU Tiejun1
1.Department of Pathology,the Affiliated Hospital of Southwest Medical University,Luzhou 646000,China;2.Chongqing Three Gorges Medical College, Chongqing 404120, China
ObjectiveTo investigate the effect of HIF-2alpha and VE-cadherin in cervical adenocarcinoma.MethodsImmunohistochemistry was used to detect the protein expression of HIF-2alpha and VE-cadherin in 60 cases of cervical adenocarcinoma and 18 cases of normal cervical tissues.ResultsThe positive expression rates of HIF-2alpha and VE-cadherin in cervical adenocarcinoma were 56.67% and 65.00% respectively,which were significantly higher than those in normal cervical tissues,the difference was statistically significant (P<0.05).The expression of HIF-2 alpha and VE-cadherin were significantly correlated with tumor sizes(P<0.05),clinical stage (P<0.05) and lymphatic metastasis(P<0.05),but showed no statistical correlation with pathological grade(P>0.05)and age (P> 0.05) in cervical adenocarcinoma.In addition,the expression of VE-cadherin was positively correlated with the expression of HIF-2alpha(r=0.632,P<0.05).ConclusionThe protein expression of HIF-2alpha and VE-cadherin were significantly increased in cervical adenocarcinoma.VE-cadherin may be the downstream target gene of HIF-2alpha.They two may co-participate the initiation and development of cervical adenocarcinoma.
HIF-2α;VE-cadherin;Cervical adenocarcinoma;Metastasis
宫颈癌是女性生殖系统最常见的恶性肿瘤之一,其平均发病年龄呈年轻化趋势,严重威胁全球妇女的健康[1]。复发和转移是导致恶性肿瘤患者主要的致死原因,关于肿瘤发生发展机制的研究很多,但是目前仍不清楚。目前针对宫颈癌的治疗手段主要为手术治疗、放化疗、生物治疗等,这些治疗手段在治疗过程中都会对正常组织细胞造成损伤。近年来,靶向治疗受到广泛关注,针对有HER2基因突变的乳腺癌的靶向治疗已经取得了一定的成果。找到有关宫颈癌发生发展的关键因子,将为宫颈癌的预防和治疗提供新的方向。有研究表明HIF-2α和VE-cadherin在多种恶性肿瘤中存在着表达异常,参与肿瘤生长、转移等过程。本研究旨在通过免疫组织化学检测HIF-2α与VE-cadherin宫颈腺癌组织中的表达情况,探究二者在宫颈腺癌发生发展中的作用。
1 资料与方法
1.1 主要试剂
兔抗人HIF-2α多克隆抗体及兔抗人VE-cadherin多克隆抗体均购自英国Abcam公司,Envision法免疫组织化学检测试剂盒及DAB试剂盒购自北京中杉金桥有限公司。
1.2 一般资料
收集筛选2011年9月~2013年6月西南医科大学附属医院手术切除的宫颈腺癌石蜡组织块60例,患者年龄26~70岁,平均(43.36±9.36)岁,≥56岁39例,<56岁21例。根据国际妇产科联盟最新的关于宫颈腺癌临床分期(FIGO分期),其中Ⅰ期40例,Ⅱ期20例;按分化程度为:高分化29例、中分化18例和低分化13例,其中淋巴结转移阳性患者19例,淋巴结转移阴性患者41例。随机选取同期因子宫肌瘤行子宫全切手术的正常宫颈组织块18例作为对照组,所选宫颈腺癌组织患者术前均未接受化疗及放疗。
1.3 免疫组织化学检测及评判标准
石蜡切片厚约3μm,经过脱蜡脱苯、柠檬酸液高压抗原修复、3%过氧化氢溶液阻断内源性过氧化物酶活性,然后滴加HIF-2α和VE-cadherin抗体(稀释度1∶100),在37℃湿盒中孵育3h,然后加Envision试剂室温孵育2h,DAB显色(显微镜下控制显色时间),苏木精衬染,中性树脂封片。免疫组织化学染色结果采用双盲计分。HIF-2α和VE-cadherin的表达以细胞染色强度、细胞阳性百分率,两者得分相加来进行判定[2]。无染色记为0分,淡黄色记为1分,棕黄色记为2分,棕褐色记为3分;细胞阳性率<5%记为0分,≥5%~<25%记为1分,≥25%~<50%记为2分,≥50%记为3分。上述二项相加,0~1分为阴性(-),2~3分为(+),4分为(++),5~ 6分为(+++)。统计时,0~1分为阴性,其余均为阳性。
1.4 统计学处理
所有数据用SPSS15.0统计分析软件进行数据的统计学处理。计数数据和半定量数据采用χ2检验,相关分析采用Spearman's等级相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 HIF-2α和VE-cadherin在正常宫颈组织和宫颈腺癌中的蛋白表达
HIF-2α的表达于细胞核和细胞浆,呈棕黄色颗粒(见图1),VE-cadherin主要表达于胞浆(见图2)。HIF-2α在宫颈腺癌组织中的阳性表达率为56.67%,在正常宫颈组织中的阳性表达率11.1%,HIF-2α在宫颈癌组的表达明显高于正常宫颈组,差异有统计学差异(P<0.05);VE-cadherin在宫颈腺癌组中的阳性表达率为65.00%,明显高于正常宫颈组,差异有统计学差异(P<0.05)。见表1。
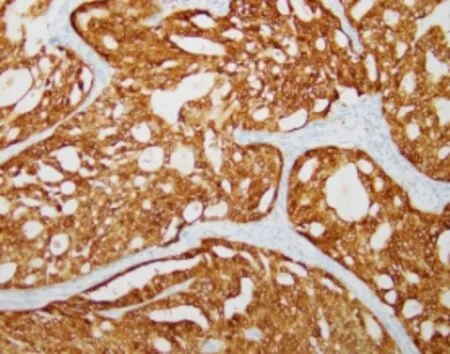
图1 HIF-2α在宫颈腺癌中的阳性表达(Envision ×200)

图2 VE-cad在宫颈腺癌中的阳性表达(Envision ×200)

表1 HIF-2α和 VE-cadherin 在正常宫颈组织和宫颈腺癌中的蛋白表达
2.2 HIF-2α和VE-cadherin蛋白的表达与临床病理参数的关系
HIF-2α和VE-cadherin蛋白的表达与肿瘤瘤体的大小、临床分期、淋巴结转移有关(P<0.05)。与年龄、分化程度无关(P>0.05)。见表2。
2.3 宫颈腺癌HIF-2α与VE-cadherin蛋白的表达的相关性
HIF-2α和VE-cadherin表达水平免疫组化的半定量数据进行相关分析显示:HIF-2α和VE-cadherin在宫颈腺癌中的表达具有正相关关系,二者相关系数为0.632,P<0.05。见表3。

表2 HIF-2α and VE-cadherin 蛋白表达与宫颈腺癌患者临床病理参数的关系

表3 HIF-2α and VE-cadherin 蛋白表达水平在宫颈腺癌原发病灶中的相关性
3 讨论
缺氧诱导因子(HIF)是细胞适应缺氧微环境的主要调节因子,其持续表达并调节大量编码基因,参与肿瘤的发生、发展过程[3]。目前明确HIF家族主要包含HIF-1、HIF-2以及HIF-3[4]。HIF主要由氧不稳定的HIF-1α、HIF-2α和HIF-3α功能性亚基及稳定表达的组成性亚基HIF-β构成。研究表明缺氧时,HIF-α的稳定性增强,由细胞质中转入细胞核与芳香烃受体核转位蛋白(aryl hydrocarbon receptor nuclear translocator,ARNT)形成二聚体,然后与靶基因启动子中的缺氧反应元件(hypoxia response elements,HRE)结合,通过招募转录因子促进靶基因转录,参与了肿瘤血管生成,细胞增殖、存活、代谢、侵袭和转移,调节肿瘤干细胞生长[5-7]。还有研究表明HIF参与调节放射治疗、化疗及免疫治疗相关基因,增加肿瘤的耐药性[7-8]。
HIF-2α是缺氧诱导因子家族中的关键因子,它位于2P21-P16,编码含有870氨基酸的蛋白。HIF-2α的表达具有组织特异性和种属特异性,它参与多种生物学过程。有研究表明特异性的拮抗HIF-2α能抑制肿瘤血管生成;甚至临床实验表明使用HIF-2小分子抑制剂(如PT2385和PT2399)能特异性分解HIF-2α和HIF-β形成的二聚体,从而有效阻断透明细胞肾细胞癌细胞生长、增殖和肿瘤血管形成[9]。Wang等[10]研究指出,HIF-2α与干细胞因子(stem cell factor,SCF)基因启动子中的HRE相互作用促进其转录,通过正向调节上皮间质转化过程促进肝癌细胞的浸润和转移。本研究表明HIF-2α的阳性表达率为56.67%,明显高于正常宫颈组织11.11%,而且其表达水平与癌组织的大小、淋巴结转移情况和肿瘤的临床分期有关,与其他研究者的研究结果类似[11-13]。提示HIF-2α在宫颈腺癌的发生、发展、浸润和转移中起着一定作用。
VE-cadherin是一种跨膜蛋白,它位于血管内皮细胞之间,参与细胞间粘附,通过影响血管的通透性参与肿瘤细胞转移等生物学行为[14]。它在高度侵袭性肿瘤中表达,而在非侵袭性肿瘤中不表达[15]。有研究表明将基因修饰的树突状细胞疫苗(DC-VEC)转入已接种肿瘤细胞的小鼠体内,发现DC-VEC疫苗能延缓肿瘤进程和延长小鼠生存期,进一步研究发现实验组小鼠体内产生了大量免疫球蛋白,肿瘤组织中T细胞浸润增加并且表现出强烈的抗VE-cadherin细胞毒性作用,使得肿瘤的血管生成也受到抑制;还有研究表明下调VE-cadherin表达能抑制恶性黑色素瘤血管生成拟态的形成[15-16]。提示VE-cadherin可能是通过调节肿瘤免疫、肿瘤营养供给来影响肿瘤的生长。本研究表明VE-cadherin的阳性表达率为65.00%,明显高于正常宫颈组织5.56%,而且其表达水平与癌组织的大小、淋巴结转移情况和肿瘤的临床分期有关,这与其它肿瘤的研究基本一致。但是值得注意的是,Zhao等[17]得到了相反的结论。
研究表明VE-cadherin的表达与HIF-2α、HIF-1α、Bcl-2及 R3-PTPs有关。HIF-2α 可与Ets-1、Twist-1等协同作用于VE-cadherin启动子中的HRE,调控其表达并参与血管生成,影响肿瘤的生长[18-21]。本研究表明HIF-2α和VE-cadherin在宫颈腺癌中呈正相关关系,r=0.632(P<0.05)。提示VE-cadherin可能是HIF-2α的下游靶基因,HIF-2α可能是通过诱导VE-cadherin的表达来增加宫颈腺癌浸润及转移的机会。因此联合检测宫颈腺癌患者肿瘤组织中HIF-2α和VE-cadherin的表达水平可能对其肿瘤浸润、转移有一定预警作用。同时HIF-2α抗体、VE-cadherin抗体和抗血管生成剂在宫颈腺癌的治疗方面可能具有潜在的基础与临床研究价值,可以为宫颈腺癌的治疗提供新的思路。
[1] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] 刘韡,马瑞,王艳霞,安瑞芳.Livin在妊娠滋养层细胞肿瘤中的表达及意义[J].中国医药科学,2013,3(24):7-9,44.
[3] Triner D,Shah YM.Hypoxia-inducible factors:a central link between inflammation and cancer[J].J Clin Ivest,2016,126(10):3689-3698.
[4] ztürk E,Hobiger S,Despot-Slade E,et al.Hypoxia regulates RhoA and Wnt/β-catenin signaling in a context-dependent way to control re-differentiation of chondrocytes[J].Sci Rep,2017,7(1):9032.
[5] Rankin EB,Giaccia AJ.Hypoxic control of metastasis[J].Science(New York,N.Y.),2016,352(6282):175-180.
[6] Koh MY,Powis G.Passing the baton:the HIF switch[J].Trends Biochem Sci,2012,37(9):364-372.
[7] Peng G,Liu Y.Hypoxia-inducible factors in cancer stem cells and inflammation[J].Trends Pharmacol Sci,2015,36(6):374-383.
[8] Samanta D,Gilkes DM,Chaturvedi P,et al.Hypoxiainducible factors are required for chemotherapy resistance of breast cancer stem cells[J].Proc Natl Acad Sci USA,2014,111(50):E5429-5438.
[9] Martínez-Sáez O,Gajate Borau P,Alonso-Gordoa T,et al.Targeting HIF-2α in clear cell renal cell carcinoma:A promising therapeutic strategy[J].Crit Rev Oncol Hemat,2017,111:117-123.
[10] Xiuchao W,Jie D,et al.HIF-2 dependent expression of stem cell factor ptomotes metastasis in hepatocellular carcinoma[J].Cancer Lett,2017,393:113-124.
[11] Keith B,Johnson RS,Simon MC.HIF-1α and HIF-2α:Sibling rivalry in hypoxic tumour growth and progression [J].Nat Rev Cancer,2012,12(1):9-22.
[12] Semenza GL. Molecular mechanisms mediating metastasis of hypoxic breast cancer cells [J].Trends Mol Med,2012,18(9):534-543.
[13] Kroeger N,Seligson DB,Signoretti S,et al.Poor prognosis and advanced clinicopathological features of clear cell renal cell carcinoma (ccRCC) are associated with cytoplasmic subcellular localization of Hypoxia inducible factor-2α[J].Eur J Cancer (Oxford, England:1990),2014,50(8):1531-1540.
[14] El Hallani S,Boisselier B,Peglion F,et al.A new alternative mechanism in glioblastoma vascularization: tubular vasculogenic mimicry [J].Brain,2010,133(4):973-982.
[15] Williamson SC,Metcalf RL,TraPani F,et al.Vasculogenic mimicry in small cell lung cancer[J].Nat Commun,2016,7:13322.
[16] Zhou J,Xi Y,Mu X,et al.Antitumor immunity induced by VE-cadherin modified DC vaccine[J].Oncotarget,2017, 8:67369-67379.
[17] Zhao N,Sun BC,Sun T,et al.Hypoxia-induced vasculogenic mimicry formation via VE-cadherin regulation by Bcl-2[J].Med Oncol (Northwood,London,England),2012,29(5):3599-3607.
[18] Tang NN,Zhu H,Zhang HJ,et al.HIF-1α induces VE-cadherin expression and modulates vasculogenic mimicry in esophageal carcinoma cells[J].World J Gastroentero,2014,20(47):17894-17904.
[19] Dorofejeva O.Defining the molecular basis of interaction between R3 receptor-type protein tyrosine phosphatases and VE-cadherin[J].PloS one,2017,12(9):e0184574.
[20] Le Bras A,Lionneton F,Mattot V,et al.HIF-2alpha specifically activates the VE-cadherin promoter independently of hypoxia and in synergy with Ets-1 through two essential ETS-binding sites[J].Oncogene,2007,26(53):7480-7489.
[21] Yang J,Zhu DM,Zhou XG,et al.HIF-2α Promotes the formation of vasculogenic mimicry in pancreatic cancer by regulating the binding of Twist1 to the VE-cadherin Promoter[J].Oncotarget,2017,8(29):47801-47815.
2017-09-25)
