褐藻多糖硫酸酯的结构与生物活性研究*
2018-01-10张全斌
王 晶 张全斌
褐藻多糖硫酸酯的结构与生物活性研究*
王 晶1, 2张全斌1, 2①
(1. 中国科学院海洋研究所 海洋生物学重点实验室, 青岛 266071; 2. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室, 青岛 266071)
褐藻多糖硫酸酯(fucoidan, FPS)是所有褐藻中所固有的细胞间多糖, 存在于细胞壁基质中。生长于潮间带、长时间与空气接触的褐藻种类中, 如多年生的墨角藻()类, 其褐藻多糖硫酸酯的含量可高达20%; 生长在较深处的海带()类中含量较低, 约为1%~2%。褐藻多糖硫酸酯是一类独特的结合有硫酸基的水溶性杂聚糖, 其化学组成和结构非常复杂, 以岩藻糖和硫酸基为主, 随着褐藻的种类不同还含有半乳糖、木糖、糖醛酸等其他成分。褐藻多糖硫酸酯具有多种生物活性, 目前针对墨角藻、泡叶藻()、鼠尾藻()等褐藻中的褐藻多糖硫酸酯研究较多, 发现其具有免疫调节、抗病毒、抗肿瘤、抗凝血、抗氧化等生物活性。本文主要就褐藻多糖硫酸酯的提取、纯化、结构及生物活性等方面研究进行综述。
褐藻多糖硫酸酯; 结构; 生物活性
褐藻多糖硫酸酯(fucoidan, FPS)是一种含有硫酸基的水溶性杂多糖, 主要存在于褐藻和棘皮动物中, 是一种细胞间多糖, 存在于细胞壁基质中。褐藻多糖硫酸酯的含量随着藻的种类和生长环境不同而不同, 一般占褐藻的1%~20%(纪明侯, 1997)。不同褐藻来源的褐藻多糖硫酸酯的结构不同, 不过其主要的化学成分类似, 是由岩藻糖和硫酸基组成, 随着褐藻的种类不同还含有半乳糖、木糖、糖醛酸等其他成分(Bilan and Usov, 2008)。近年来研究表明褐藻多糖硫酸酯具有多种生物活性, 常见的有抗氧化、抗肿瘤、免疫调节、抗凝血等(Senthilkumar et al., 2013)。由于褐藻多糖硫酸酯的结构和功能密切相关, 因此目前对褐藻多糖硫酸酯的研究主要集中在两个方面: 其一是阐明褐藻多糖硫酸酯的精细结构, 对其构效关系进行系统研究; 其二是研究褐藻多糖硫酸酯的生物学功能及其机制, 为其在生物医药领域的应用奠定基础。
1 褐藻多糖硫酸酯的提取、纯化与分离
1.1 褐藻多糖硫酸酯的提取
褐藻多糖硫酸酯可以用水、稀酸或氯化钙溶液提取, 向提取液中加入氢氧化铅、氢氧化铝、乙醇或季胺盐类阳离子表面活性剂, 可使褐藻多糖硫酸酯沉淀出来; 为了减少色素、蛋白质等的溶出, 提取之前可以先以高浓度醇类或甲醛溶液处理藻体(纪明侯, 1997)。近年来也陆续有学者采用微波、超声波以及高分子絮凝沉淀等方法提取褐藻多糖硫酸酯(谭洁怡等, 2006; 刘群和徐中平, 2007)。研究表明, 不同的褐藻多糖硫酸酯提取方法, 不仅影响其产率, 而且对其化学组成和结构也有一定影响, 使阐明同一种属褐藻来源的褐藻多糖硫酸酯结构更加困难。因此, 我们需要建立一种更加温和的提取方法, 在较低的温度、酸度和反应时间下, 提取褐藻多糖硫酸酯, 确保褐藻多糖硫酸酯的结构特异性。不同的提取方法制备褐藻多糖硫酸酯的条件及其化学组成如表1所示。

表1 褐藻多糖硫酸酯的提取条件及化学组成
注: FPS为褐藻多糖硫酸酯(degration fucoidan)。
1.2 褐藻多糖硫酸酯的纯化
制备的粗褐藻多糖硫酸酯通常含有部分水溶性褐藻胶、蛋白质、褐藻淀粉、色素等, 需要进一步纯化, 常用的纯化方法有乙醇重沉淀法和季铵盐类沉淀法。
乙醇重沉淀法应用得比较多, 用乙醇重沉淀法对从鼠尾藻中提取的硫酸多糖进行纯化的步骤如下: 将鼠尾藻硫酸多糖粗产品加水溶解, 再加入乙醇(至含量为30%), 离心取上清液, 然后再加入乙醇(至含量70%)后, 搅拌静置, 离心取沉淀, 用无水乙醚清洗, 经冷冻干燥即得褐藻多糖硫酸(史永富等, 2009)。季铵盐类沉淀法是利用阳离子表面活性剂如十六烷基氯化吡啶(Cetylpyridiniumchloridemonohydrate, CPC)或十六烷基三甲基溴化铵(Cetylpyridiniumchloridemonohydrate, CTAB)能与高分子电解质产生沉淀的性质使褐藻多糖硫酸酯沉淀下来。Anno等(1966)将粗褐藻多糖硫酸酯溶于0.5mol/L KCl或CaCl2溶液中, 加入CPC, 比例为1mg褐藻多糖硫酸酯加2mg CPC。静置生成沉淀, 离心分离, 溶于2mol/L KCl或CaCl2中, 加入2倍乙醇产生沉淀, 经乙醇、乙醚洗涤, 干燥, 即得纯褐藻多糖硫酸酯。Paskins-Hurlburt等(1976)用CTAB纯化粗褐藻多糖硫酸酯, 在粗褐藻多糖硫酸酯溶液中依次加入CTAB、4mol/L NaCl和乙醇, 将得到的沉淀再溶于水, 经透析、离心、冻干, 即得纯的褐藻多糖硫酸酯。王作芸和赵学武(1985)采用两种方法对从铜藻()中提取的褐藻多糖硫酸酯进行纯化, 将制得的粗褐藻多糖硫酸酯20g溶于200mL水中, 搅拌加入80mL 4mol/L的CaCl2, 离心(4000r/min), 弃去沉淀。其上清液分为二份, 一份加乙醇至30%(v/v), 离心弃去沉淀, 在上清液中继续搅拌加入乙醇至60%(v/v), 离心(4000r/min), 收集沉淀, 用95%乙醇和无水乙醇分别洗涤二次后, 烘干得褐藻多糖硫酸酯3.81g。粗褐藻多糖硫酸酯的含岩藻糖为18.5%, 提纯后含岩藻糖为44.7%, 按岩藻糖计算, 回收率为92.1%。另一份上清液加50mL5% CPC, 形成白色沉淀物, 离心后弃去上清液, 用25mL 0.5mol/L的CaCl2洗涤沉淀, 然后加150mL 3mol/L的CaCl2, 离心(3000r/min), 将上部白色胶状物取走, 小心倾倒出中部溶液, 在中部溶液中加入300mL 90%乙醇, 离心弃去上清液, 用CaCl2重新溶解, 再加乙醇60%(v/v)处理两次, 最后沉淀物用95%乙醇和无水乙醇洗涤, 干燥得褐藻多糖硫酸酯1.56g, 含岩褐糖47.2%, 按岩藻糖计算其回收率为39.8%。可见, 这两种方法对褐藻多糖硫酸酯纯化效果都非常好, 只是CPC沉淀法的回收率只有乙醇沉淀法的一半。
此外, 在提取和纯化过程中, 可采取酶消化法除去混杂在提取液中的褐藻淀粉和蛋白质。Fleury和Lahaye等(1993)在研究法国褐藻胶工业的副产品时就采用葡聚糖酶和碱性蛋白酶来清除其中的褐藻淀粉和蛋白质。
1.3 褐藻多糖硫酸酯的分级
由于褐藻多糖硫酸酯化学组分相当复杂, 对制备出的粗褐藻多糖硫酸酯的色谱和电泳检查一般都呈现不均一性, 因此人们逐步使用分级方法将混杂的多糖分成不同级分以进行深入研究。常用的分级方法有两种: 一种是乙醇分级沉淀法, 即利用不同的乙醇浓度沉淀出不同的级分; 另一种是色谱法, 利用凝胶过滤色谱和离子交换色谱进行分级。凝胶过滤色谱法将多糖按照分子量大小进行分级, 离子交换色谱法则能将多糖分成荷电性不同的级分。
Larsen等(1966)从泡叶藻的碱提取液中加钙盐除去褐藻胶之后, 用乙醇分级沉淀, 分离出至少三种褐藻多糖硫酸酯, 分别皆含有不同量的褐藻糖、木糖、葡萄糖醛酸、硫酸基和蛋白质, 其中主要部分(占干藻重的6%)为泡叶藻糖胶(ascophyllan), 大约含褐藻糖25%、木糖26%、糖醛酸钠19%、硫酸基13%和蛋白质12%。
史永富等(2009)将鼠尾藻中褐藻多糖硫酸酯经DEAE-52阴离子纤维素交换层析分级得到F1、F2、F3、F4、F5五个组分, 硫酸根占比分别为0、3.94%、6.57%、12.60%、38.08%。将含有硫酸根的组分F2、F3、F4、F5分别经SephadexG-200凝胶柱层析分级纯化后得到f1、f2、f3、f4、f5、f6六个级分, 其中f2、f4为大分子质量凝聚体, f1、f3、f5、f6相对分子质量分别为4.05×104、7.13×104、1.325×105和7.99×104。Dillon等(1953)将多囊墨角藻()中提取的褐藻多糖硫酸酯用DEAE-纤维素柱进行分级, 分离出少量木聚糖, 同时还得到含有褐藻糖和少量半乳糖的组分。Li等(2006)先用DEAE-Sepharose CL-6B对从羊栖菜()中提取的褐藻多糖硫酸酯进行分级, 用不同浓度的NaCl进行梯度洗脱, 得到3个组分, 其中得率最高的组分F3又用Sepharose CL-6B进行二次分级得到三个组分, 这些组分的主要成分都是褐藻糖、甘露糖和半乳糖, 以及硫酸根、糖醛酸和少量蛋白质。琼脂糖凝胶电泳显示这些组分都只有一个条带, 是单一组分。Wang等(2008)用DEAE-Sepharose FF对从海带中提取的褐藻多糖硫酸酯进行分级, 用不同浓度的NaCl进行梯度洗脱, 得到F1、F2和F3三个组分, 其中F1糖醛酸含量最多、硫酸基最少, F3硫酸基含量最多。从单糖组成来看, F1含有岩藻糖、半乳糖、甘露糖、葡萄糖等多种单糖; F2主要由岩藻糖和半乳糖组成, 岩藻糖含量是半乳糖的3倍; 而F3主要由岩藻糖和半乳糖组成, 半乳糖含量是岩藻糖的3倍。
对多糖的分级已经是多糖研究中必不可少的手段, 分级的方法越来越多, 分离效果也越来越好, 为结构和构效关系的研究奠定了基础。
2 褐藻多糖硫酸酯的结构
2.1 褐藻多糖硫酸酯的化学组分
1913年, Kylin首次从褐藻掌状海带()中用稀酸提取出一种多糖, 经水解后以苯腙分离出甲基戊糖, 确定为L-fucoidan(褐藻糖或岩藻糖)。随着人们对这类化合物的深入研究, 了解了其化学成分和结构的复杂性, 得知褐藻多糖硫酸酯并非为单一结构的化合物, 而是具有不同化学组分的一族化合物。Bird和Haas(1931)也对该藻的水提取、酒精沉淀物进行了研究, 产物的灰分为26%~30%, 灰分中硫酸根为17%~19%, 水解后, 总SO4为35.5%~37.7%, 甲基戊糖为33%~37%; 他们提出褐藻多糖硫酸酯的分子式为(RR′O×SO2×OM)n, 其中R为褐藻糖(C6H10O4), R′为未知物, M可能是Na、K、Ca0.5或Mg0.5等金属离子。Schweiger(1962)从巨藻的分泌物中经分离、提纯得到一种多糖, 称之为半乳糖-褐藻糖胶(galactofucan)。褐藻糖和半乳糖之比, 经数次提纯后一直恒定在18︰1, 其中还含有木糖, 变化范围为0.5%~2.5%。于是, 他首次提出, 褐藻多糖硫酸酯并非纯的硫酸褐藻多糖(fucan sulfate), 而是由褐藻糖、半乳糖和微量木糖组成的杂聚物, 即木糖-半乳糖-褐藻糖胶(xylogalactofucan)。Marais和Joseleau(2001)从泡叶藻中提取出的褐藻多糖硫酸酯的组成为褐藻糖66%、木糖3%、硫酸根31%(摩尔百分数)。Bilan等(2007)从太平洋采集了褐藻, 用2% CaCl2水溶液在85°C提取5h, 提取液除去褐藻胶, 用乙醇沉淀得粗褐藻多糖硫酸酯, 其组成为褐藻糖39.0%、硫酸根18.4%、半乳糖7.0%、木糖3.4%、葡萄糖2.1%、甘露糖1.6%。Li等(2006)用水提醇沉的方法提取了羊栖菜中的褐藻多糖硫酸酯, 该多糖主要由褐藻糖、硫酸根和糖醛酸组成, 中性单糖主要为褐藻糖、甘露糖和半乳糖, 还有少量的木糖、葡萄糖、鼠李糖和阿拉伯糖。Zhang等(2009)用高效液相色谱(high performance liquid chromatography, HPLC)的方法测定了从海带中提取出的褐藻多糖硫酸酯单糖的组成, 褐藻多糖硫酸酯经2mol/L的三氟乙酸水解后, 采用1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone, PMP)柱前衍生化的方法, 在245nm处测定, 其单糖组成为褐藻糖、半乳糖、甘露糖、鼠李糖、葡萄糖、木糖和葡萄糖。
大量文献表明, 褐藻多糖硫酸酯的组成复杂, 并非由均一的褐藻糖和硫酸根组成, 由不同褐藻得到的褐藻多糖硫酸酯的化学组成有很大差异, 除含有褐藻糖和硫酸基外, 还含有半乳糖、木糖、甘露糖、阿拉伯糖、鼠李糖、葡萄糖等多种单糖。常见褐藻中中性单糖的含量如表2所示。
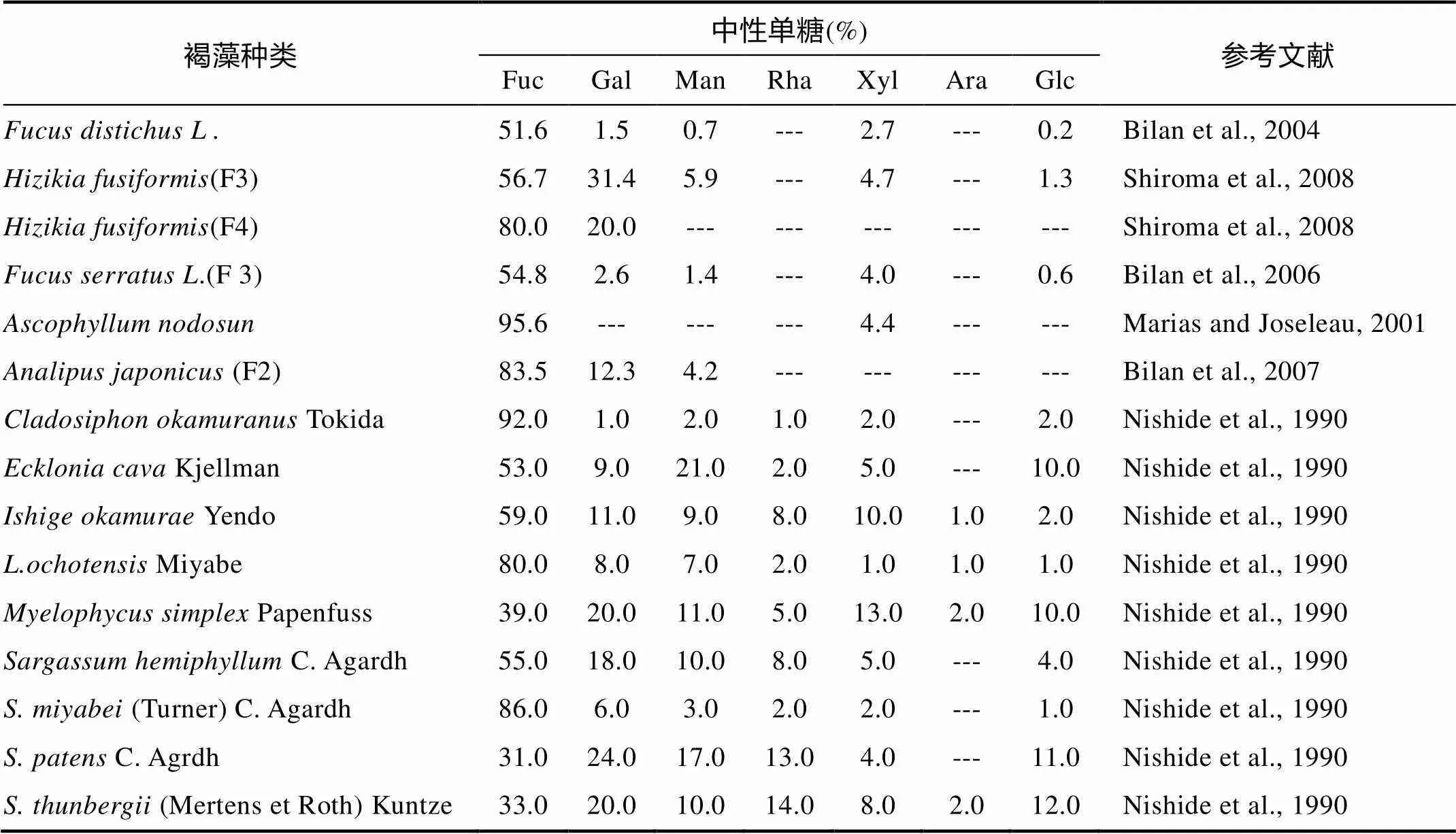
表2 几种褐藻多糖硫酸酯中性单糖的含量
注: Fuc. 褐藻糖; Gal. 半乳糖; Man. 甘露糖; Rha. 鼠李糖; Xyl. 木糖; Ara. 阿拉伯糖; Glc. 葡萄糖; “---”表示“无”。
2.2 褐藻多糖硫酸酯的结构
由于褐藻多糖硫酸酯化学组分复杂、分子量较高, 其结构研究进展十分缓慢。褐藻多糖硫酸酯的主要来源为棘皮动物()和褐藻, 其结构随着来源的不同有较大的差异。一般来说, 来源于棘皮动物的褐藻多糖硫酸酯结构比较简单, 多为线性分子, 硫酸根的连接方式也比较有规律; 而来源于褐藻中的褐藻多糖硫酸酯多有支链结构, 单糖的种类和硫酸根的连接方式也比较复杂(Pereira et al., 1999)。
Pereira等(1999)运用化学分析和波谱分析的方法, 对从棘皮动物海参和海胆、中提取的褐藻多糖硫酸酯的结构进行了细致的研究。这些多糖都是以(1→3)连接的α-L-褐藻糖为基本骨架, 硫酸根主要取代在2位或(和)4位上, 每四个糖单元构成一个重复单元(Pereira et al., 1999)。从海胆和卵层胶膜中提取的褐藻多糖硫酸酯的结构各有两种, 前者的结构与的相同, 由四个单糖构成一个重复单元, 而后者由三个单糖构成一个重复单元(Vilela-Silva et al., 2002)(图1、图2)。
近年来, 科学家对从墨角藻中提取的褐藻多糖硫酸酯进行了深入研究。Conchie 和Percival(1950)将从墨角藻制取的褐藻多糖硫酸酯(褐藻糖38%, SO432.8%)进行甲基化和水解, 得到L-褐藻糖、3-O-甲基-L-褐藻糖和2,3-二-O-甲基-L-褐藻糖, 其摩尔比为1︰3︰1。由旋光性推测褐藻糖均为α构型。有些褐藻多糖硫酸酯可能带有两个硫酸基, 而另一些(C1, 4连接)则未被硫酸基取代; 游离褐藻糖是来自C3上结合的末端分枝点单位。由此看来, 褐藻多糖硫酸酯的主要组成单位是1,2-α-L-褐藻糖, C4上带有硫酸基(图3)。
1993年, Patankar等(1993)对Conchie等人的结构模型进行了修正, 提出褐藻多糖硫酸酯的骨架结构由(1→3)连接的α-L-褐藻糖组成, 硫酸根主要取代在C4位上, 同时, 每2~3个褐藻糖残基就有一个由褐藻糖组成的支链(图4)。
Bilan等(2002)先后对不同墨角藻来源的褐藻多糖硫酸酯的结构进行了研究。从枯墨角藻()中提取的褐藻多糖硫酸酯中L-褐藻糖、硫酸根和乙酰基的摩尔比为1︰1.23︰0.36, 该多糖主链由(1→3)和(1→4)连接的α-L-褐藻糖组成, 硫酸根主要连接在C2位上, 少量连接在3-连接的褐藻糖的C4位上, 乙酰基随机连接在褐藻糖剩余的羟基上(图5)。
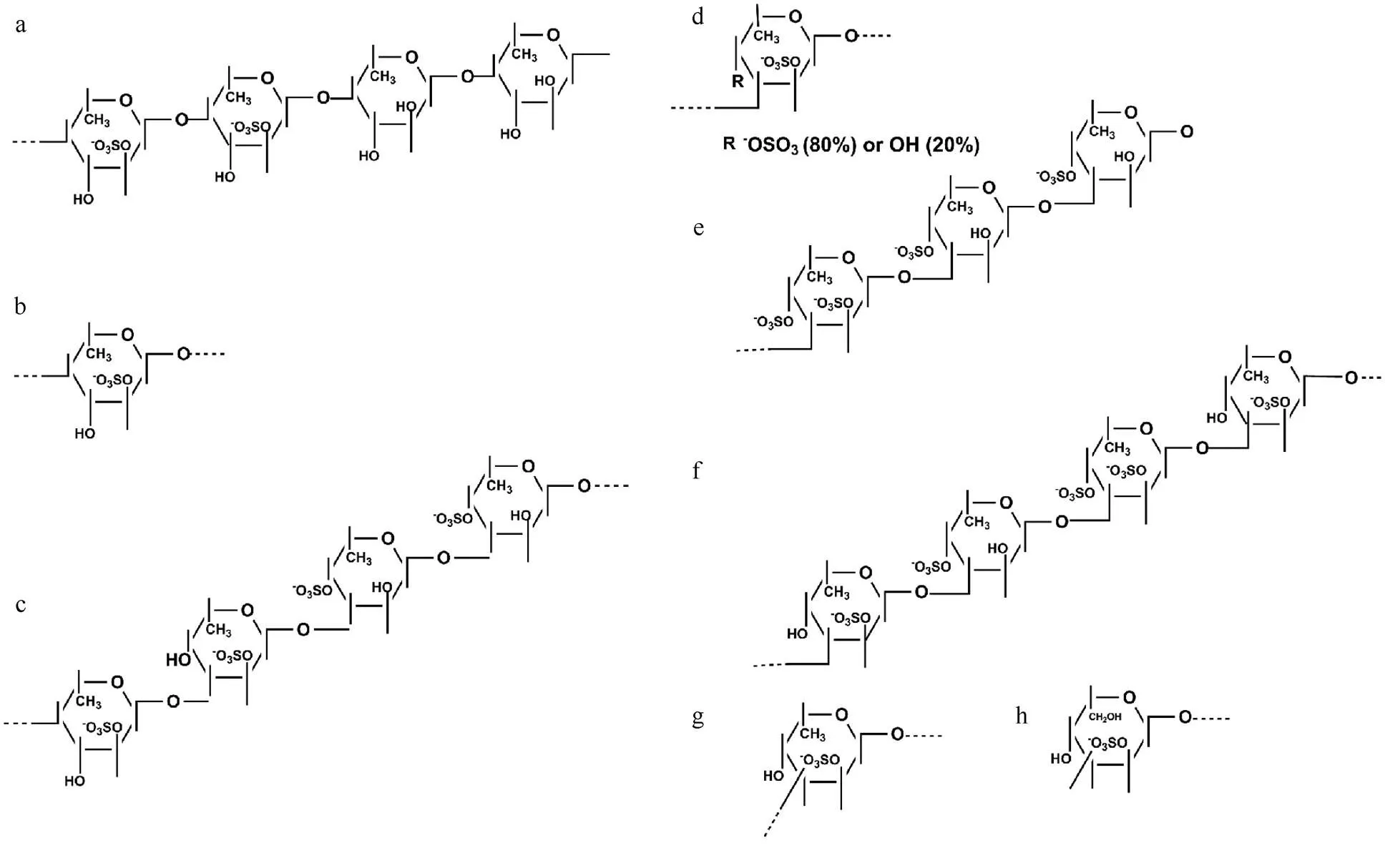
图1 从不同海胆(Echinoidea)中提取的褐藻多糖硫酸酯的结构(Vilela-Silva et al., 2002)
注: a. 从.中提取的褐藻多糖硫酸酯成分I; b. 从.中提取的褐藻多糖硫酸酯成分II; c. 从.中提取的褐藻多糖硫酸酯; d. 从.中提取的褐藻多糖硫酸酯成分I; e. 从.中提取的褐藻多糖硫酸酯成分II; f. 从.中提取的褐藻多糖硫酸酯; g. 从.中提取的褐藻多糖硫酸酯; h. 从.中提取的褐藻多糖硫酸酯。

图2 从海参(Holothuroidea)中提取的褐藻多糖硫酸酯的结构(Pereira et al., 1999)

图3 从墨角藻(Fucales)提取的褐藻多糖硫酸酯的结构模型(Conchie and Percival, 1950)

图4 从墨角藻(Fucales)提取的褐藻多糖硫酸酯的修订后结构模型(Patankar et al., 1993)

图5 从枯墨角藻(Fucus evanescens)提取的褐藻多糖硫酸酯的结构模型(Bilan et al., 2002)
从两列墨角藻()提取的褐藻多糖硫酸酯的一个组分中L-褐藻糖、硫酸根和乙酰基的摩尔比为1︰1.21︰0.08, 从一维和二维的核磁共振(nuclear magnetic resonance, NMR)分析可知该多糖的主链由C2, 4位硫酸根取代的(1→3)连接的α-L-褐藻糖和C2位硫酸根取代的(1→4)连接的α-L-褐藻糖交替连接的二糖重复单元组成, 每隔一定的重复单元出现乙酰基取代的α-L-褐藻糖(Bilan et al., 2004)(图6)。该结构与枯墨角藻模型十分相近。

图6 从两列墨角藻(Fucus distichus)提取的褐藻多糖硫酸酯的结构模型(Bilan et al., 2004)
从齿缘墨角藻()中提取的褐藻多糖硫酸酯的一个组分中L-褐藻糖、硫酸根和乙酰基的摩尔比为1︰1︰0.1, 此外还含有少量木糖和半乳糖。该多糖的结构较枯墨角藻和两列墨角藻更为复杂, 虽然主链也是由(1→3)和(1→4)交替连接的α-L-褐藻糖组成, 但它还含有由3个褐藻糖残基组成的支链, 末端可能是4-硫酸根或2, 4-二硫酸根取代的褐藻糖(Bilan et al., 2006)(图7)。

图7 从齿缘墨角藻(Fucus serratus)提取的褐藻多糖硫酸酯的结构模型(Bilan et al., 2006)
注: 以a和b指代两种不同的主链结构; (a) (about 50%): R1= SO3–, R2= H, (b) (about 50%): R1= H, R2= α-L-Fucp-(1→4)- α-L-Fucp(2SO3)-(1→3)-α-L-Fucp(2SO3)-(1→。
研究发现, 不同褐藻来源的褐藻多糖硫酸酯的结构并不完全相同。对从粉团扇藻()中提取的褐藻多糖硫酸酯的结构研究表明, 该多糖含有(1→4)连接的β-D-葡萄糖醛酸、(1→4)连接的β-D-葡萄糖、(1→4)连接的β-D-甘露糖、(1→4)连接的β-D-半乳糖及(1→2)连接的α-L-褐藻糖等多种残基(Hussein et al., 1980)。Checolot等(2001)采用甲基化分析和NMR的方法对从泡叶藻中提取的褐藻多糖硫酸酯的酸水解产物——低分子量褐藻多糖硫酸酯的结构进行了研究, 结果表明该多糖的主链含有大量(1→4)连接的α-L-褐藻糖, 硫酸根主要连接在C2位, 少量连接在C3位, 极少连接在C4位, 同时, 首次发现了C2, 3双取代的褐藻糖(图8)。与Patankar等(1993)报道的墨角藻的结构有很大差别。
Periera等(1999)对从巴西海带()中提取的褐藻多糖硫酸酯的结构与抗凝血活性进行了研究。从NMR分析结果看, 巴西海带褐藻多糖硫酸酯在岩藻糖异头碳的位置出现5个峰, 表明其为杂聚多糖, 由于NMR谱的复杂性, 不能确定其结构。但从NMR分析结果看, 巴西海带褐藻多糖硫酸酯与墨角藻、泡叶藻褐藻多糖硫酸酯的结构有很大差异, 前者中存在(1→2)连接的糖苷键, 而且4-O-硫酸化程度很高, 而后者主链已被确定为(1→3)连接。同时他们的研究显示巴西海带褐藻多糖硫酸酯的抗凝血活性明显高于泡叶藻或墨角藻的褐藻多糖硫酸酯, 这表明海带属中褐藻多糖硫酸酯结构的独特性与其生物活性密切相关。
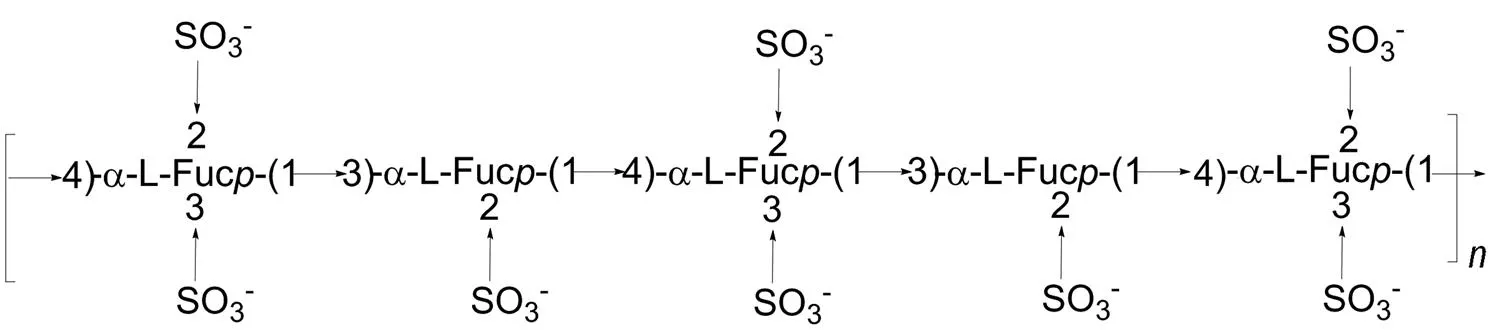
图8 从泡叶藻(Ascophyllum nodosum)提取的褐藻多糖硫酸酯的结构模型(Checolot et al., 2001)
Rocha等(2005)研究了从施氏褐舌藻()中提取的褐藻多糖硫酸酯的结构, 该多糖的分子量为215000Da, 褐藻糖、木糖、半乳糖及硫酸根的摩尔比为1.0︰0.5︰2.0︰2.0, 此外还含有少量的糖醛酸。化学分析、甲基化分析和NMR分析的结果表明该多糖拥有一种特殊的结构, 主链由4-连接的β-D-半乳糖构成, 硫酸根取代在C3位上, 约有25%的糖残基含有支链, 支链由α-L-褐藻糖(C3被硫酸根取代)或者是二个非硫酸根取代的4-连接的β-D-木糖组成(图9)。

图9 从施氏褐舌藻(Spatoglossum schroederi)提取的褐藻多糖硫酸酯的结构模型(Rocha et al., 2005)
Chizhov等(1999)通过化学分析和波谱分析的方法对从绳藻()中提取的褐藻多糖硫酸酯分级组分的结构进行了研究。该多糖的一个组分的单糖全部由褐藻糖组成, 其骨架结构为(1→3)连接的α-L-褐藻糖组成, 含有很多支链, 支链由1-连接的褐藻糖组成, 硫酸根主要连接在C4位, 少量连接在C2位(图10)。
从羊栖菜()中提取的褐藻多糖硫酸酯的结构非常复杂。Shiroma等(2008)对此进行了研究。经过DEAE-Sepharose分级后, 组分F4含有较高的褐藻糖(31.9%)和硫酸根(38.0%), 单糖的种类也大大减少, 只有褐藻糖和半乳糖。该多糖的主链主要由(1→3)连接的α-L-褐藻糖构成, 每4个褐藻糖残基含有一个支链, 支链由2个褐藻糖或半乳糖的残基组成, 硫酸根的连接位置没有确定(图11)。

图10 从绳藻(Chorda filum)提取的褐藻多糖硫酸酯的结构模型(Chizhov et al., 1999)
Li等(2006)用热水提取的方法从羊栖菜()中提取出了褐藻多糖硫酸酯, 经过DEAE-Sepharose-CL-6B和Sepharose- CL-6B柱层析分级, 对得到的一个组分F32利用甲基化分析和NMR进行结构鉴定。F32含有的中性单糖种类多, 主要为褐藻糖、甘露糖和半乳糖, 还含有少量的木糖、葡萄糖、鼠李糖和阿拉伯糖。F32含有多个支链结构, 具体如图12所示。可见不同羊栖菜褐藻多糖硫酸酯的组分在结构上有很大差异。

图11 羊栖菜(Hizikia fusiforme)提取的褐藻多糖硫酸酯的结构模型(Shiroma et al., 2008)
注: R为α-L-Fuc-(1→4)- α-L-Fuc-(1→(50%)或α-L-Gal-(1→4)- α-D-Gal-(1→(50%)。

图12 从羊栖菜(Hizikia fusiforme)提取的褐藻多糖硫酸酯的结构模型(Li et al., 2006)
本文作者利用弱的阴离子交换树脂对低分子量褐藻多糖硫酸酯DFPS进行分级纯化, 得到分级组分DF1、DF2、DF3(Wang et al., 2010)。结合化学分析和波谱分析的方法对DF2的结构进行了鉴定, 发现其主要由(1→3)连接的褐藻糖组成, 还有少量的(1→4)连接的褐藻糖, 每四个糖单位就有一个支链, 支链由褐藻糖或(1→6)链接的半乳糖组成, 硫酸根的连接方式不均一, 分别连接在褐藻糖的2或4位, 或者半乳糖的3、4位, 有些双取代(图13)。Jin等(2012)对DF1组分结构进行了研究, 发现其主链以2-连接甘露糖和4-连接葡萄糖醛酸交替连接组成, 同时在2-连接甘露糖的C6位有部分硫酸化, 在C3位有部分岩藻糖基化。

图13 海带中褐藻多糖硫酸酯组分DF2的结构推测(Wang et al., 2010)
Thanh等(2013)使用电喷雾离子化质谱(electrospray ionisation mass spectrometry, ESI-MS)方法对从褐藻中制备的褐藻多糖硫酸酯的结构进行了研究, 其主链由1-3-α-L-Fucp构成, 支链→4)-Galp(1→链接在岩藻糖的4位上, 硫酸基取代在岩藻糖的2位或半乳糖的4位上(图14)。
Usoltseva等(2016)对褐藻和中制备的褐藻多糖硫酸酯的结构进行了比较研究, 它们的主链结构相似, 都是由→3)-α-L-Fuc-(2,4-O3−)-(1→构成, 但是支链结构不同, 从制备的褐藻多糖硫酸酯中发现了HexA-(1→2)-Fuc、HexA-(1→2)-Gal、Gal- (1→4)-HexA、Fuc-(1→2)-Gal-6-SO3−、Fuc-4- SO3−-(1→6)-Gal、Gal-(1→2)-Gal-2-SO3−、Gal- 4-SO3−-(1→6)-Gal, Gal-4-SO3−-(1→3)-Fuc-(1→3)- Fuc、Fuc-4-SO3−-(1→6)-Gal- (1→4)-Gal, Gal- (1→4)-Gal-(1→3)-Fuc、Gal-2-SO3−-(1→4)-Gal-(1→4)-Gal, Gal-(1→4)-Gal-6-SO3−-(1→2)-Gal等支链结构。
近年来, 随着多维核磁共振技术的发展和高分辨质谱在多糖结构分析中的应用, 以及褐藻多糖硫酸酯特异性酶的发现, 褐藻多糖硫酸酯的结构研究有了很大进展, 但是, 对很多不同来源的褐藻多糖硫酸酯的结构还没有完全明确。褐藻多糖硫酸酯在很多方面有较强的生物活性, 为了更好地开展应用, 必须加快其结构方面的研究。

图14 Turbinaria ornata中褐藻多糖硫酸酯的结构(Thanh et al., 2013)
注: a~d代表不同的结构; F. 岩藻糖; G. 半乳糖; 主链1-3链接, 支链1-4链接; 硫酸基:岩藻糖或者半乳糖的C2 和/或 C4残基上
3 褐藻多糖硫酸酯的生物活性
3.1 抗凝血活性
褐藻多糖硫酸酯的抗凝血活性是研究最早、最广泛的生物活性。褐藻多糖硫酸酯具有跟肝素类似的抗凝血活性, 通过直接作用于凝血酶或激活凝血酶抑制因子阻碍了凝血酶原(Ⅱa因子)和Ⅹa因子的产生, 并通过肝素辅助因子Ⅱ(HCⅡ)而不是抗凝血酶Ⅲ较缓慢地抑制Ⅹa因子的活性(Chen et al., 2012)。褐藻多糖硫酸酯对纤溶系统也有影响, 能够加强组纤溶酶原激活物(t-PA)和尿激酶型纤溶酶原激活物(u-PA)对纤溶酶原的活化, 增加纤溶酶的产生(Grauffel et al., 1989)。墨角藻和水云()中的褐藻多糖硫酸酯还对血小板聚集具有明显的抑制效果(Ustyuzhanina et al., 2013)。
随着对抗凝作用的深入研究, 人们发现不同褐藻来源的褐藻多糖硫酸酯由于其结构不同, 抗凝血活性也不同。多糖的分子量、单糖组成、硫酸根的含量和取代位置对抗凝血活性有显著影响(Nishino and Nagumo, 1992; Chevolot et al., 1999; Chandía and Matsuhiro, 2007)。一般来说, 随着分子量和硫酸根含量的增加, 抗凝血活性增强, 但是分子量太大其抗凝血活性反而下降。对从海带中提取出的褐藻多糖硫酸酯的抗凝血活性研究表明, 分子量在8000Da的样品的抗凝血活性最强。褐藻多糖硫酸酯分子量对抗凝血活性的影响要比硫酸根含量的影响更大, 其抗凝血活性随着分子量的降低而显著降低。褐藻多糖硫酸酯达到抗凝剂活性则需要相当大分子量的糖链才能与凝血酶(血流中的凝结蛋白)相结合。Senthilkumar等(2013)证实褐藻多糖硫酸酯的分子量在近似于100kDa时, 能够具有一定的抗凝性, 且其抗凝血活性与抗凝血酶和肝素辅酶2有关。肝素能够刺激肝细胞生长因子(hepatocyte growth factor, HGF)的释放, 促进组织再生, 具有十分高效的抗凝血活性, 是一种广泛应用的抗凝剂。对于分子量相近的褐藻多糖硫酸脂, 硫酸根含量越高则抗凝血活性越高(赵雪等, 2007)。Haroun-Bouhedja等(2000)研究发现从泡叶藻中提取的褐藻多糖硫酸酯的抗凝血活性与硫酸基的取代度有关, 双硫酸根取代能增强抗凝血活性。从墨角藻中提取的褐藻多糖硫酸酯经过氨基化修饰后可以有效激活血纤维蛋白溶酶原, 从而促进血凝物的溶解(Soeda et al., 1994), 可见不同的取代基团对抗凝血活性有一定影响。Jin等(2013a)对11种褐藻多糖硫酸酯的抗凝血活性进行了研究, 结果表明样品Y5~Y11的分子量从大到小为50.1kDa ~8.4kDa, 随着分子量的降低其活化部分凝血活酶时间(activated partial thromboplastin time, APTT)和凝血酶时间 (thrombin time, TT)活性也逐渐降低且有浓度依赖性, 样品Y1~Y4不仅分子量不同而且岩藻糖和半乳糖的比值也不同, 其抗凝血活性更为复杂, 这说明不仅分子量对生物活性有影响, 岩藻糖和半乳糖的比值对生物活性也有一定影响。Zhang等(2014)对从墨角藻中制备的褐藻多糖硫酸酯的抗凝血活性的构效关系进行了研究, 讨论了电荷密度、分子量和单糖组成对抗凝血的活性影响。当褐藻多糖硫酸酯每个糖单元含有0.5个硫酸基、且含有大于70个糖单元时可以通过改善血浆中IX凝血因子不足起到抗凝血作用。为了探讨抗凝机理, Pereira等(1999)对不同来源的褐藻多糖硫酸酯的抗凝血活性进行了比较, 从褐藻中提取的带有支链的褐藻多糖硫酸酯直接具有抗凝血活性, 然而从棘皮动物中提取的线性褐藻多糖硫酸酯抗凝血作用的发挥需要有肝素介导因子Ⅱ存在, 由此可知, 多糖的空间结构对抗凝血的作用机制也有一定影响。
3.2 抗肿瘤作用
褐藻多糖硫酸酯具有直接的抗肿瘤作用。褐藻多糖硫酸酯能明显抑制小鼠S180实体瘤的生长, 延长肿瘤负荷鼠的生存期, 且呈现剂量相关性, 其抑瘤率达到环磷酰胺阳性对照的70.4%~78.2%。但是它对体外培养的A549细胞、HeLa细胞和L1210细胞的生长均无显著抑制作用, 这说明褐藻多糖硫酸酯的抗肿瘤作用不是通过细胞毒作用实现。褐藻多糖硫酸酯中剂量组和大剂量组能显著提高碳粒廓清实验中的廓清指数K、吞噬指数α和脾脏器指数, 推测其抗肿瘤机制可能是通过对免疫功能的增强来实现的(王君和胡霞敏, 2009)。Nagamine等(2009)研究了褐藻多糖硫酸酯对Huh7肝癌细胞的抑制作用并探讨了其作用机制。MTT法结果显示褐藻多糖硫酸酯能明显抑制Huh7的生长, 且与浓度成正相关性, 其半数抑制率为2.0mg/mL。蛋白质印迹结果表明褐藻多糖硫酸酯处理的Huh7细胞的培养基中α-胎蛋白的含量下降, 在1.0mg/mL褐藻多糖硫酸酯作用下, Huh7细胞中趋化因子配体12 mRNA表达显著下调, 而趋化因子受体4的表达不受影响, 他们认为褐藻多糖硫酸酯的抗肿瘤活性是通过下调趋化因子配体12 mRNA的表达所实现。刘秋英等(2004)研究了从半叶马尾藻()中提取的褐藻多糖硫酸酯对抑癌基因p53和Rb的影响。他们将浓度分别为50、100和200mg/kg的褐藻多糖硫酸酯经腹腔注射入S180肉瘤小鼠体内, 连续10天, 抑瘤率分别为30.5%、47.6%和63.5%。用逆转录PCR(reverse transcription PCR, RT-PCR)分析抑癌基因p53和Rb中mRNA的含量, 并用Western-blotting检测p53和Rb中蛋白质的表达水平发现, 褐藻多糖硫酸酯可上调抑癌基因p53和Rb中mRNA的表达以及增加p53和Rb中蛋白质的含量。他们认为褐藻多糖硫酸酯通过上调抑癌基因的表达起到一定的抑瘤作用。褐藻多糖硫酸酯的抗肿瘤活性可能还和它的分子量以及硫酸根含量有关。Boo等(2011)发现褐藻多糖硫酸酯能引起人肺癌细胞A549、人结肠癌细胞HT-29和HCT116的凋亡, 使其活细胞数量急剧减少, 并且褐藻多糖硫酸酯的这种促细胞凋亡作用呈现出一种剂量相关性。Lee等(2012)发现褐藻多糖硫酸酯能够通过调控PI3K-Akt-mTOR和NF-kB信号通路抑制MMP-2、MMP-9的活性, 下调癌细胞的迁移和侵蚀水平, 进而抑制人肺癌细胞的新陈代谢。Ye等(2008)对从马尾藻()中提取的褐藻多糖硫酸酯分级组分的抗肿瘤活性进行了研究, 发现低分子量、高硫酸根含量的组分SP3-1和SP3-2对HepG2、A549和MGC-803细胞有显著的抑制活性。
裙带菜()中的褐藻多糖硫酸酯能够通过增加活性氧产物, 引发线粒体氧化性损伤, 线粒体膜电位(mitochondrial membrane potential, MMP)去极化和细胞色素C的释放, 下调凋亡抑制蛋白的水平, 激活caspase-3和caspase-9, 诱发活性氧介导的线粒体通路, 进而引起肝癌细胞凋亡, 这揭示了由线粒体介导的通路可能在由褐藻多糖硫酸酯引发的细胞凋亡中起到了重要作用(Yang et al., 2013)。Zhang等(2011)还发现褐藻多糖硫酸酯诱发的细胞凋亡伴随着胞外信号调节激酶(extracellular regulated protein kinases, ERK)活性的降低, ERK通路是细胞凋亡的主要调节子, 而褐藻多糖硫酸酯能够引发MCF-7细胞中ERK的磷酸化。
褐藻多糖硫酸酯不仅对肿瘤有治疗作用, 也可以从一定程度上抑制肿瘤的形成。Gamal-Eldeen等(2009)研究了长角马尾藻()中不同分级组分的褐藻多糖硫酸酯的癌症化学预防活性。组分E1和E4具有较好的肿瘤形成抑制活性, 它们可以保护性地调控癌症诱导因子的新陈代谢, 抑制癌症诱导因子激活细胞色素P450, 同时提高癌症诱导因子脱毒酶谷胱甘肽S-转移酶的活性, 从而表现出很好的癌症化学预防活性。另外, 褐藻多糖硫酸酯在对癌细胞产生抑制作用的同时不影响正常细胞的生长增殖(Senthilkumar et al., 2013)。因此, 褐藻多糖硫酸酯可作为一种无毒副作用的化合物, 用于肿瘤预防和化学治疗领域。
3.3 免疫调节活性
褐藻多糖硫酸酯的免疫调节活性是通过对免疫细胞的调控实现的。从马尾藻中提取的褐藻多糖硫酸酯的免疫促进作用与剂量有密切关系。以不同的剂量喂养小鼠, 当剂量为20、40和60mg/kg·d时, 使小鼠脾的重量显著增加; 当多糖剂量为40、60mg/kg·d时, 使小鼠腋下淋巴结的重量显著增加, 对单核巨噬细胞的吞噬功能加强有显著影响, 能明显提高小鼠碳粒廓清速率和吞噬指数α, 并对巨噬细胞增生以及淋巴小结形成有明显作用; 当多糖剂量为60mg/kg·d时, 对肝增重的效果也达到显著水平(王士长等, 2006)。
树状细胞是一种重要的抗原提示细胞, Kim等(2007)研究了褐藻多糖硫酸酯对树状细胞(dendritic cells, DCs)的免疫调节作用。从墨角藻中提取的褐藻多糖硫酸酯能提高DCs细胞的活力, 增加白介素-12和肿瘤坏死因子α的产量, 以及提高主要的组织相容性细胞classⅠ、classⅡ、CD54和CD86的表达, 同时可以延长脾细胞中同种抗原寿命。他们认为对DCs细胞进行免疫调节的其中一种途径至少包含多显性转录核因子(NF-kappa B)。
褐藻多糖硫酸酯的免疫调节活性与褐藻多糖硫酸酯的物理性质有一定关系。将褐藻多糖硫酸酯做成被卵磷脂包裹的纳米微球与免疫细胞连接, 可以提高人体B细胞和T细胞的增长速度, 改善白介素-6的分泌情况, 比单纯用褐藻多糖硫酸酯效果好, 这可能和褐藻多糖硫酸酯纳米微球更容易被吸收有关。且T细胞在褐藻多糖硫酸酯纳米微球的浓度为0.6mg/mL时的生长状况好于1.0mg/mL, 这说明0.6mg/mL是T细胞生长的最佳浓度(Qadir et al., 2008)。
近年来, 褐藻多糖硫酸酯提取物被广泛应用于临床试验中, 有研究发现, 口服褐藻多糖硫酸酯提取物溶液1.5至4个月可以增加乳腺癌病患者血液中IL-12、干扰素γ和TNF-α的水平(Zhang et al., 2011)。这些因子参与免疫调节过程, 说明褐藻多糖硫酸酯具有明显的免疫调节活性。
食用褐藻中的褐藻多糖硫酸酯可通过直接抑制病毒复制和刺激免疫系统功能对机体起到一定的保护作用, 还可以通过修饰细胞表面来激发人体内的免疫功能。褐藻多糖硫酸酯还能促进肝脏淋巴细胞和外周巨噬细胞的有丝分裂, 形成免疫保护。在自然杀伤细胞中, 褐藻多糖硫酸酯能够显著增强细胞溶解和有丝分裂的活性, 能诱导单核细胞来源的树突细胞的成熟, 并与其他细胞因子和T细胞介导的免疫应答协同作用激活人体免疫功能(Yang et al., 2008)。Lee等(2012)证实了褐藻多糖硫酸酯能通过调控PI3K-Akt-mTOR和NF-kB信号通路抑制MMP-2/-9的活性, 抑制人肺癌细胞的新陈代谢, 下调癌细胞的迁移和侵蚀水平, 诱导内皮祖细胞向基底膜等类似结构的增殖、迁移和分化, 改善基底膜结构, 对糖尿病肾病(diabetic nephropathy, DN)等与基底膜相关的疾病有一定的影响。
3.4 抗病毒活性
关于褐藻多糖硫酸酯的抗病毒活性已有不少报道。褐藻多糖硫酸酯对单纯性包疹病毒1(herpes simplex virus-1, HSV-1)的复制有抑制作用(Besednova et al., 2016)。HSV-1的复制受生物体的免疫应答体系控制。用褐藻多糖硫酸酯喂养受HSV-1感染的小鼠, 可以增强小鼠巨噬细胞和B细胞的吞噬作用, 同时增加自然杀伤细胞(natural killer cell, NK)的活性。连续喂养三周后, 小鼠体内中性抗体显著增强。他们认为褐藻多糖硫酸酯对受HSV-1感染小鼠的保护作用可能是通过直接抑制病毒复制和激活免疫防御系统实现的。
抗人类免疫缺陷病毒(human immunodeficiency virus, HIV)作用是硫酸多糖抗病毒研究中的热点, 硫酸化基团的存在对其抗HIV活性是必要的, 其作用强度随硫酸化程度的升高而增强。其抗HIV病毒机理主要是通过阻断HIV与靶细胞上的受体CD4的连接发挥抗病毒作用。细胞上的CD4分子氨基末端含有丰富的碱性氨基酸, 是HIV入侵宿主细胞和硫酸多糖抗HIV的作用靶点。褐藻多糖硫酸酯对HIV感染的起始阶段和后来的复制阶段均有抑制作用。在不产生细胞毒性的浓度下均可抑制HIV诱导的合胞体形成和HIV逆转录酶的活性(Dinesh et al., 2016)。
褐藻多糖硫酸酯对于禽流感病毒(newcastle disease virus, NDV)有显著的抑制作用, 在NDV感染前或后1h用0.25~16μg褐藻多糖硫酸酯处理鸡胚胎, 可以显著抑制NDV病毒感染, 最高可以使感染率降低90%(Trejo-Avila et al., 2016)。
褐藻多糖硫酸酯对植物病毒性感染也有一定的抑制作用。Lapshina等(2006)研究了从墨角藻中提取的褐藻多糖硫酸酯对养殖烟草叶感染烟草花叶病毒(tobacco mosaic virus, TMV)后传染速度的抑制作用。该实验用2μg/mL的TMV感染烟草叶, 向治疗组添加1mg/mL褐藻多糖硫酸酯。研究发现, 治疗组烟叶由TMV引起的坏死损伤数目比模型组减少90%; 添加TMV和褐藻多糖硫酸酯混合物3天之后, 病毒的毒性和浓度分别为62%和66%, 比单独用TMV培育的要低。由此可见, 褐藻多糖硫酸酯可以有效抑制TMV感染的扩散。同时研究还发现褐藻多糖硫酸酯是在基因水平上发挥作用, 其抗病毒活性机制是通过抑制病毒诱导的多核体细胞的形成来抑制病毒对细胞的吸附作用, 硫酸根是褐藻多糖硫酸酯抗病毒活性必需的成分。
3.5 抗氧化活性
自由基在体内积累可以引起衰老、心脑血管、老年痴呆等多种疾病, 近年来寻求高效、低毒的抗氧化剂成为科学家研究的热点。褐藻多糖硫酸酯具有清除自由基、抗氧化、抗衰老等多种生物活性。利用五种蛋白酶和六种碳水化合物酶对裙带菜中的褐藻多糖硫酸酯进行了提取和体外抗氧化活性研究。不同酶提取的褐藻多糖硫酸酯均有较强的清除DPPH(2,2- diphenyl-1-picrylhydrazyl)自由基和羟自由基的能力, 虽然它们清除超氧阴离子自由基的能力较弱, 但仍然是一种安全性高、水溶性好的抗氧化剂来源(Je et al., 2009)。褐藻多糖硫酸酯的抗氧化活性与多糖的分子量和硫酸根含量及单糖的种类有关。Ajisaka等(2016)研究了从不同褐藻中制备的褐藻多糖硫酸酯的抗氧化活性和其化学组成的关系。结果表明, 硫酸基是褐藻多糖硫酸酯发挥抗氧化活性的关键基团, 但是硫酸基的增加并不能导致抗氧化活性增加, 当褐藻多糖硫酸酯的支链连有葡萄糖醛酸等单糖时其抗氧化活性相近。总之, 褐藻多糖硫酸酯的抗氧化活性是由多种因素决定的。
3.6 肾脏保护活性
P-选择素是一种黏附分子, 从正常肾小球的免疫组化染色中无法检测出, 但在肾脏炎症早期, P-选择素在肾小球内皮细胞和附着的血小板表面均有表达, 这有助于中性粒细胞的聚集, 从而促进炎症的进展(周同等, 1998)。在很多肾病动物模型中, 都发现P-选择素对肾病的发生、发展起着很重要的作用。褐藻多糖硫酸酯是P-选择素的抑制剂, 它在肾脏疾病中表现出的作用可能和P-选择素有一定关系(Bachelet et al., 2009)。周同等(1998)研究发现褐藻多糖硫酸酯可以抑制肾小球性肾炎中P-选择素的表达, 减少炎性细胞浸润和血小板在肾组织的聚集。但是, De Vriese等(1999)指出, 在抗肾小球基底膜(glomerular basement membrane, GBM)肾炎中, P-选择素几乎消除了小静脉内中性粒细胞的移动, 但对蛋白尿的发生没有影响, 他们认为P-选择素介导的中性粒细胞的黏附对于中性粒细胞和肾小球毛细血管内皮细胞的相互作用不是必要条件。可见, P-选择素在慢性肾功能衰竭(chronic renal failure, CRF)中的作用还需要进一步研究。Zhang等(2005)研究了褐藻多糖硫酸酯在海曼肾炎中的作用, 在海曼肾炎的模型中, 分别以50、100和200mg/kg剂量的褐藻多糖硫酸酯每天给大鼠灌胃。持续四周后, 在剂量为100和200mg/kg的治疗组中, 尿蛋白和血肌酐均明显下降, 这可能和褐藻多糖硫酸酯阻断P-选择素和中性粒细胞黏附之间的相互作用有关(Zhang et al., 2005)。
氧化应激是体内活性氧(reactive oxygen species, ROS)产生增加和(或)抗氧化防御能力降低的结局。ROS可通过多种途径损伤肾脏的功能和结构。ROS通过对入球小动脉、出球小动脉及系膜细胞舒缩性质的影响, 引起小球血流动力学改变和肾脏进行性损伤; 过氧化物能损害肾小球的选择性通透性能, 引起尿蛋白排泄增加, 肾小管内的大量尿蛋白可通过产生ROS损害肾小管上皮细胞; 过氧化物对肾小球、血管及肾间质成分具有直接细胞毒性作用。此外, 过氧化物还可以上调炎症反应, 诱导前炎症因子及化学趋化因子产生(Goi et al., 2009; Korish, 2009)。这些因素都可以加速慢性肾功能衰竭(chronic renal failure, CRF)的进程。研究发现肾结石对肾脏损伤是由于肾结石可以诱导产生氧自由基, 而褐藻多糖硫酸酯可以保护由草酸盐导致的肾脏损伤。褐藻多糖硫酸酯可以降低高草酸尿症老鼠的体内自由基, 并增加其抗氧化酶的活性, 降低脂质过氧化水平, 从而减轻对肾脏的损伤(Thamilselvan et al., 2003; Veena et al., 2006)。
现代医学认为CRF患者末期肾组织病理均表现为肾间质纤维化。目前研究认为肾间质纤维化是单核巨噬细胞浸润, 细胞外基质合成增加、降解减少, 以及致纤维化的细胞因子表达上调等多种因素综合作用的结果。商滨等(2006)的研究表明, 褐藻多糖硫酸酯可以明显抑制人肾间质成纤维细胞(human renal interstitum fibroblast, HRIF)增殖, 同时抑制HRIF分泌FN、IN两种糖蛋白, 推测其可显著减少细胞外基质的合成, 从而减少细胞外基质的聚集, 改善和延缓肾间质纤维化。刘建春等(2007)研究发现, 在CRF早中期褐藻多糖硫酸酯可以抑制TGF-β1和MCP-1两种细胞因子的表达, 从而延缓肾间质纤维化进展。
肾小球硬化(glomerulosclerosis, GS)是多种生物活性物质、多种细胞成分参与的复杂过程, 肾脏局部和机体系统的环境都可以影响其发生、发展。引起肾小球硬化的原因可大致分为肾小球内高血压、免疫性和代谢性三类。细胞外基质产生细胞、血流动力学改变、血管紧张素Ⅱ、内皮素、细胞因子、细胞外基质转化失平衡、脂代谢紊乱、氧化应激、细胞凋亡等都是影响肾小球硬化的因素。王兆华等(2005)针对褐藻多糖硫酸酯对阿霉素肾病肾硬化大鼠肾脏的保护作用进行了研究, 结果表明, 褐藻多糖硫酸酯可以降低阿霉素肾病肾硬化大鼠的尿蛋白、血清肌酐和尿素氮水平, 改善肾脏功能。该多糖可以抑制大鼠肾脏中TGF-β1表达并减少细胞外基质中Ⅳ型胶原蛋白和纤维连接蛋白的合成, 并且可以减少肾皮质TGF-β1、mRNA和PAI-1 mRNA的表达, 具有延缓肾小球硬化的作用(王兆华, 2005)。
3.7 神经保护活性
有研究发现, 从海带中制备的褐藻多糖硫酸酯能减轻1-甲基-4-苯基-1,2,3,6-四氢吡啶离子(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine, MPP+)引起的细胞损伤, 对1-甲基-4-苯基- 1,2,3,6-四氢吡啶诱导的PD小鼠模型有显著的保护作用, 该成果已获国家发明专利授权(ZL 200710099008.8) (罗鼎真等, 2009; Luo et al., 2009; Cui et al., 2010)。FPS是从海带中制备得到的粗多糖, 其分子质量不均一, 化学组成复杂, 化学结构难以确定, 限制了其进一步开发为多糖类药物。因此, Jin等(2013)对FPS进行了氧化降解和分级纯化, 并利用PD细胞模型对得到的一系列分级组分进行活性筛选, 实验结果表明, 硫酸杂聚糖组分UF具有最强的神经保护作用, 是FPS神经保护活性的主要组分。进一步对其神经保护机制进行研究, 发现UF对H2O2诱导的SH-SY5Y细胞的保护作用与UF抗凋亡活性有关, 其UF抗凋亡活性与PI3K/AKT信号通路有关, UF可以促进PI3K和AKt的磷酸化, 激活PI3K/AKT信号通路, 同时, UF对PI3K/AKT信号通路中的相关蛋白也有一定的调控作用, 可以提高抑凋亡蛋白Bcl-2的表达, 降低促凋亡蛋白Bax P53的表达(Wang et al., 2017)。
3.8 其他活性
选择素又称凝集素样细胞黏附分子, 为跨膜糖蛋白, 主要位于白细胞(L-选择素)、血小板(P-选择素)和内皮细胞(P-和E-选择素)表面, 介导细胞与细胞间的黏附。它们具有高度选择性, 其配体为位于细胞膜上的寡糖。在炎症早期, 白细胞稳定黏附、渗出和向炎症部位迁移之前, 选择素与细胞表面聚集的寡糖结合, 介导白细胞最初的着边和滚动。褐藻多糖硫酸酯因具有与L-、P-选择素配体类似的硫酸化寡糖结构, 容易与L-和P-选择素结合而抑制它们与各自的配体结合, 从而发挥对L-和P-选择素的抑制作用(Novoyatleva et al., 2016)。褐藻多糖硫酸酯还可以抑制CCl4引起的肝细胞呈纤维化过程, 保护肝细胞, 延长星形肝细胞的寿命(Song et al., 2017)。
褐藻中的褐藻多糖硫酸酯能够有效降低血清中总胆固醇(total cholesterol chol, CHOL)、低密度脂蛋白胆固醇(low density lipoprotein- cholesterol ldl-c, LDL-C)和三酯甘油(triglyceride, TRIG)的含量, 并且增加高密度脂蛋白胆固醇(high density lipid-cholesterol, HDL-C)的浓度, 减少人们得高血脂、高血糖疾病的风险。还能够减轻体重, 减少脂肪组织块, 下调脂肪形成转录因子和其他特定的靶基因, 具有潜在的减肥作用(Kim et al., 2014)。
此外, 褐藻多糖硫酸酯还具有抗炎、保护缺血再灌注损伤、抑制血管紧张素酶等多种生物活性(Cong et al., 2016; Atashrazm et al., 2016)。随着研究技术和方法的深入, 相信更多褐藻多糖硫酸酯的生物活性会被发现, 其应用也将更加广泛。
4 褐藻多糖硫酸酯未来研究趋势
褐藻多糖硫酸酯的结构复杂, 是制约其生物活性应用的一个主要因素。目前, 对褐藻多糖硫酸酯结构的研究主要是通过降解的方法制备寡糖, 结合波谱学方法进行一级结构的鉴定。但是, 很少有人从褐藻多糖硫酸酯的生物合成途径对其结构进行研究。我们认为未来褐藻多糖硫酸酯的一个研究重点是从海藻体内寻找褐藻多糖硫酸酯合成的关键酶, 从生物合成途径来解析褐藻多糖硫酸酯的结构特点。同时, 利用寻找到的褐藻多糖硫酸酯合成的关键酶在体外合成褐藻多糖硫酸酯寡糖, 这对于寡糖的大量制备和应用有重要的意义。
对褐藻多糖硫酸酯生物活性的研究逐渐从药效学的研究深入到药理机制的研究, 但是, 由于多糖是一个大分子物质, 寻找能和靶目标特异性结合的糖单元十分困难。未来一方面可以针对制备特异性褐藻多糖硫酸酯寡糖单元进行机制研究, 另一方面可以通过一些模拟软件来寻找可以和特定靶点结合的糖单元。同时, 可以利用相关软件模拟褐藻多糖硫酸酯的二级结构, 通过糖与靶点的结合能力分析优化多糖的结构。
纪明侯, 1997. 海藻化学. 北京: 科学出版社, 318
刘 群, 徐中平, 2007. 海带硫酸酯多糖的酶法提取工艺条件. 河北渔业, (6)55—57
刘建春, 2007. 褐藻多糖硫酸酯对腺嘌呤致大鼠肾间质纤维化的作用及其机制探讨. 北京: 中国协和医科大学硕士学位论文
罗鼎真, 崔艳秋, 王晓民, 2009. 褐藻多糖硫酸酯减轻1-甲基-4-苯基吡啶离子引起的细胞损伤和氧化应激. 首都医科大学学报, 30(4): 475—480
商 滨, 2006. 褐藻多糖硫酸酯对人肾间质成纤维细胞的影响. 大连: 大连医科大学硕士学位论文
史永富, 汪秋宽, 张甜翠, 2009. 鼠尾藻中岩藻聚糖硫酸酯提取工艺及纯化研究. 现代食品科技, 25(5): 511—514, 549
谭洁怡, 王一飞, 钱垂文, 2006. 超声波法提取裙带菜中褐藻多糖硫酸酯的工艺研究. 食品与发酵工业, 32(1): 115—117
王 君, 胡霞敏, 2009. 海藻提取物Fucoidan抗肿瘤作用的实验研究. 时珍国医国药, 20(7): 1757— 1758
王士长, 陈 静, 潘健存等, 2006. 马尾藻多糖的提取及其免疫活性. 食品科学, 27(9): 257—260
王兆华, 2005. 褐藻多糖硫酸酯对阿霉素肾病肾硬化大鼠肾脏的保护作用. 济南: 山东大学硕士学位论文
王作芸, 赵学武, 1985. 铜藻的褐藻糖胶、褐藻淀粉和褐藻胶的分离及提纯. 水产学报, 9(1): 71—77
赵 雪, 傅海舰, 薛长湖等, 2007. 自由基氧化法制备海带岩藻聚糖硫酸酯的抗凝血活性. 中国水产科学, 14(6): 1017—1022
周 同, 李 晓, 郝翠兰等, 1998. 黏附分子P选择素在人类肾小球疾病中表达及其意义. 中华肾脏病杂志, 14(3): 155—158
Ajisaka K, Yokoyama T, Matsuo K, 2016. Structural characteristics and antioxidant activities of fucoidans from five brown seaweeds. Journal of Applied Glycoscience, 2016, 63(2): 31—37
Anno K, Terahata H, Hayashi Y et al., 1966. Isolation and purification of fucoidin from brown seaweed. Agricultural and Biological Chemistry, 1966, 30(5): 495—499
Atashrazm F, Lowenthal R M, Woods G M et al., 2016. Fucoidan suppresses the growth of human acute promyelocytic leukemia cells in vitro and in vivo. Journal of Cellular Physiology, 2016, 231(3): 688—697
Bachelet L, Bertholon I, Lavigne D et al., 2009. Affinity of low molecular weight fucoidan for P-selectin triggers its binding to activated human platelets. Biochimica Et Biophysica Acta (BBA)-General Subjects, 1790(2): 141—146, doi: 10.1016/j.bbagen. 2008.10.008.
Besednova N, Makarenkova I, Zvyagintseva T et al., 2016. Antiviral activity and pathogenetic targets for seaweed sulfated polysaccharides in herpesvirus infections. Biochemistry (Moscow) Supplement Series B: Biomedical Chemistry, 10(1): 31—42
Bilan M, Grachev A A, Ustuzhanina N E et al., 2004. A highly regular fraction of a fucoidan from the brown seaweedL. Carbohydrate Research, 339(3): 511—517
Bilan M, Grachev A A, Ustuzhanina N E et al., 2002. Structure of a fucoidan from the brown seaweedC. Ag. Carbohydrate Research, 337(8): 719—730
Bilan M ZakharovaI A N, Grachev A A et al., 2007. Polysaccharides of algae: 60. Fucoidan from the pacific brown alga(Harv.) winne (Ectocarpales, Scytosiphonaceae). Russian Journal of Bioorganic Chemistry, 33(1): 38—46, doi: 10.1134/s1068162007010049
Bilan M I, Grachev A A, Shashkov A S et al., 2006. Structure of a fucoidan from the brown seaweedL. Carbohydrate Research, 341(2): 238—245
Bilan M I, Usov A I, 2008. Structural analysis of Fucoidans. Natural Product Communications, 3(10): 1639—1648
Bird G M, Haas P, 1931. On the nature of the cell wall constituents ofspp. mannuronic acid. Biochemical Journal, 25(2): 403—411
Boo H J, Hyun H J, Kim C S et al., 2011. Fucoidan frominduces apoptosis in A549 human lung carcinoma cells. Phytotherapy Research, 25(7): 1082—1086, doi: 10.1002/ptr. 3489
Chandía N P, Matsuhiro B, 2007. Characterization of a fucoidan from(Phaeophyta) and its anticoagulant and elicitor properties. International Journal of Biological Macromolecules, 42(3): 235—240
Chen A J, Zhang F, Shi J et al., 2012. Study on antithrombotic and antiplatelet activities of low molecular weight fucoidan from. Journal of Ocean University of China, 11(2): 236—240, doi: 10.1007/s11802-012-1874-1
Chevolot L, Foucault A, Chaubet F et al., 1999. Further data on the structure of brown seaweed fucans: relationships with anticoagulant activity. 319(1—4): 154—165
Chevolot L, Mulloy B, Ratiskol J et al., 2001. A disaccharide repeat unit is the major structure in fucoidans from two species of brown algae. Carbohydrate Research, 330(4): 529—535
Chizhov A O, Dell A, Morris H R et al., 1999.A study of fucoidan from the brown seaweed. Carbohydrate Research, 320(1—2): 108—119
Conchie J, Percival E G V, 1950. Fucoidin. Part II. the Hydrolysis of a Methylated Fucoidin Prepared from. Journal of the Chemical Society, 827—832
Cong Q, Chen H J, Liao W F et al., 2016. Structural characterization and effect on anti—angiogenic activity of a fucoidan from. Carbohydrate Polymers, 136: 899—907
Cui Y Q, Zhang L J, Zhang T et al., 2010. Inhibitory effect of fucoidan on nitric oxide production in lipopolysaccharide—activated primary microglia. Clinical and Experimental Pharmacology and Physiology, 37(4): 422—428, doi: 10.1111/j.1440- 1681.2009.05314.x
De Vriese A S, Endlich K, Elger M et al., 1999. The role of selectins in glomerular leukocyte recruitment in rat anti-glomerular basement membrane glomerulonephritis. Journal of American society of Nephrology, 10(12): 2510—2517
Jin W J, Wang J, Jiang H et al., 2013a. The neuroprotective activities of heteropolysaccharides extracted from. Carbohydrate Polymers, 97(1): 116—120, doi: 10.1016/j.carbpol. 2013.04.055
Dinesh S, Menon T M, Hanna L E et al., 2016.anti—HIV—1 activity of fucoidan from. International Journal of Biological Macromolecules, 82: 83—88
Fleury N, Lahaye M, 1993. Studies on by-products from the industrial extraction of alginate. Journal of Applied Phycology, 5(6): 605—614
Gamal-Eldeen A, Ahmed E F, Abo-Zeid M A, 2009.cancer chemopreventive properties of polysaccharide extract from the brown alga,. Food and Chemical Toxicology, 47(6): 1378—1384, doi: 10.1016/j.fct. 2009.03.016
Goi G, Massaccesi L, Herrera C J B et al., 2009. Oxidative stress in elderly chronic renal failure patients: effects of renal replacement therapies on cell membrane fluidity. Journal of Nephrology, 22(5): 630—636
Grauffel V, Kloareg B, Mabeau S et al., 1989. New natural polysaccharides with potent antithrombic activity: fucans from brown algae. Biomaterials, 10(6): 363—368
Haroun-Bouhedja F, Ellouali M, Sinquin C et al., 2000. Relationship between sulfate groups and biological activities of fucans. Thrombosis Research, 100(5): 453—459
Hussein M M D, Abdel-Aziz A, Salem H M, 1980. Some structural features of a new sulphated heteropolysaccharide from. Phytochemistry, 19(10): 2133—2135
Je J Y, Park P J, Kim E K et al., 2009. Antioxidant activity of enzymatic extracts from the brown seaweedby electron spin resonance spectroscopy. LWT-Food Science and Technology, 42(4): 874—878
Jin W H, Wang J, Ren S M et al., 2012. Structural analysis of a heteropolysaccharide fromby electrospray mass spectrometry in tandem with collision-induced dissociation tandem mass spectrometry (ESI-CID-MS/MS). Marine Drugs, 10(12): 2138—2152, doi: 10.3390/md1010 2138
Jin W H, Zhang Q B, Wang J et al., 2013a. A comparative study of the anticoagulant activities of eleven fucoidans. Carbohydrate Polymers, 91(1): 1—6, doi: 10.1016/j.carbpol.2012.07.067
Jin W H, Zhang W J, Wang J et al., 2014. Characterization of laminaran and a highly sulfated polysaccharide from. Carbohydrate Research, 385: 58—64, doi: 10.1016/ j.carres.2013.12.009
Jin W J, Wang J, Jiang H et al., 2013b. The neuroprotective activities of heteropolysaccharides extracted from. Carbohydrate Polymers, 97(1): 116—120, doi: 10.1016/j.carbpol. 2013.04.055
Kim M H, Joo H G, 2008. Immunostimulatory effects of fucoidan on bone marrow-derived dendritic cells. Immunology Letters, 115(2): 138—143, doi: 10. 1016/j.imlet.2007.10.016
Kim M J, Jeon J, Lee J S, 2014. Fucoidan Prevents high-fat diet-induced obesity in animals by suppression of fat accumulation. Phytotherapy Research, 28(1): 137—143
Korish A A, 2009. Oxidative stress and nitric oxide deficiency in inflammation of chronic renal failure Possible preventive role of L-arginine and multiple antioxidants. Saudi Medical Journal, 30(9): 1150—1157
Lapshina L A, Reunov A V, Nagorskaya V P et al., 2006. Inhibitory effect of fucoidan from brown algaon the spread of infection induced by tobacco mosaic virus in tobacco leaves of two cultivars. Russian Journal of Plant Physiology, 53(2): 246—251
Larsen B, Haug A, Painter R L, 1966. Sulphated polysaccharides in brown algae. Ⅰ. Isolation and preliminary characterisation of three sulphated polysaccharides from(L.) Le Jol. Acta Chemica Scandinavica, 20: 219—230
Lee H, Kim J S, Kim E et al., 2012. Fucoidan from seaweedinhibits migration and invasion of human lung cancer cell via PI3K-Akt- mTOR pathways. PLoS One, 7(11): e50624
Li B, Wei X J, Sun J L et al., 2006. Structural investigation of a fucoidan containing a fucose-free core from the brown seaweed,. Carbohydrate Research, 341(9): 1135—1146
Luo D Z, Zhang Q B, Wang H M et al., 2009. Fucoidan protects against dopaminergic neuron deathand. European Journal of Pharmacology, 617(1—3): 33—40
Marais M F, Joseleau J P, 2001. A fucoidan fraction from. Carbohydrate Research, 336(2): 155—159
Nagamine T, Hayakawa K, Kusakabe T et al., 2009. Inhibitory effect of Fucoidan on Huh7 hepatoma cells through downregulation of CXCL12. Nutrition and Cancer—an International Journal, 61(3): 340—347, doi: 10.1080/01635580802567 133
Nishide E, Anzai H, Uchida N et al., 1990. Sugar constituents of fucose-containing polysaccharides from various Japanese brown algae. Proceedings of the Thirteenth International Seaweed Symposium held in Vancouver, Canada August 13–18, 204— 205: 573—576
Nishino T, Nagumo T, 1992. Anticoagulant and antithrombin activities of oversulfated fucans. Carbohydrate Research, 229(2): 355—362
Novoyatleva T, Kojonazarov B, Owczarek A et al., 2016. A natural polysaccharidic ligand P-selectin, Obstructs hypoxia—induced pulmonary arterial hypertension and acute lung vasoconstriction. American Journal of Respiratory and Critical Care Medicine, 193: A7309—A7309
Paskins-Hurlburt, A J, Tanaka Y, Skoryna S C, 1976. Isolation and Metal—Binding Properties of Fucoidan. Botanica Marina, 19(5): 327—328
Patankar, M S, Oehninger S, Barnett T et al., 1993. A revised structure for fucoidan may explain some of its biological activities. The Journal of Biological Chemistry, 268(29): 21770—21776
Pereira M S, Mulloy B, Mourão P A S, 1999. Structure and anticoagulant activity of sulfated fucans- Comparison between the regular, repetitive, and linear fucans from echinoderms with the more heterogeneous and branched polymers from brown algae. Journal of Biological Chemistry, 274(12): 7656—7667
Qadir S A, Kwon M C, Han J G et al., 2008. Enhancement of immunomodulatory and anticancer activity of fucoidan by Nano encapsulation. Food Science and Biotechnology, 17(6): 1254—1260
Rocha H A O, Moraes F A, Trindade E S et al., 2005. Structural and hemostatic activities of a sulfated galactofucan from the brown alga: an ideal antithrombotic agent? Journal of Biological Chemistry, 280(50): 41278—41288
Schweiger R G, 1962. Methanolysis of fucoidan. II. presence of sugars other than L-Fucose. Journal of Organic Chemistry, 27(12): 4270—4272
Senthilkumar K, Manivasagan P, Venkatesan J et al., 2013. Brown seaweed fucoidan: Biological activity and apoptosis, growth signaling mechanism in cancer. International Journal of Biological Macromolecules, 60: 366—374, doi: 10.1016/j. ijbiomac.2013.06.030
Shiroma R, Konishi T, Uechi S et al., 2008. Structural study of fucoidan from the brown seaweed Hizikia fusiformis. Food Science and Technology Research, 14(2): 176—182
Soeda S, Ohmagari Y, Shimeno H et al., 1994. Preparation of aminated fucoidan and its evaluation as an antithrombotic and antilipemic agent. Biological and Pharmaceutical Bulletin, 17(4): 784—788
Song Y F, Wang Q K, He Y H et al., 2017. The positive effects of fucoidans extracted from the brown seaweed Saccharina japonica on protection against CCl4—induced liver injury. Journal of Applied Phycology, 1—11
Dillon T, Kristensen K K, ÓhEocha C, 1953. The seed mucilage of Ascophyllum nodosum. Proceedings of the Royal Irish Academy. Section B: Biological, Geological, and Chemical Science, 55: 189—194
Thamilselvan S, Khan S R, Menon M, 2003. Oxalate and calcium oxalate mediated free radical toxicity in renal epithelial cells: effect of antioxidants. Urological Research, 31(1): 3—9, doi: 10.1007/s 00240-002-0286-x
Thanh T T T, Tran V T T, Yuguchi Y et al., 2013. Structure of fucoidan from brown seaweedas studied by electrospray ionization mass spectrometry (ESIMS) and small angle X-ray scattering (SAXS) techniques. Marine Drugs, 11(7): 2431—2443
Trejo-Avila L M, Elizondo-Gonzalez R, Rodriguez- Santillan P et al., 2016. Innocuity and anti- Newcastle-virus-activity offucoidan in chicken embryos. Poultry Science, 95(12): 2795—2802
Usoltseva R V, Anastyuk S D, Shevchenko N M et al., 2016. The comparison of structure and anticancer activityof polysaccharides from brown algaeand. Carbohydrate Polymers, 153: 258—265, doi: 10. 1016/j.carbpol.2016.07.103
Ustyuzhanina N E, Ushakova N A, Zyuzina K A et al., 2013. Influence of fucoidans on hemostatic system. Marine Drugs, 11(7): 2444—2458
Veena C K, Josephine A, Preetha S P et al., 2006. Renal peroxidative changes mediated by oxalate: The protective role of fucoidan. Life Sciences, 79(19): 1789—1795
Vilela-Silva A C E S, Castro M O, Valente A P et al., 2002. Sulfated fucans from the egg jellies of the closely related sea urchinsandensure species-specific fertilization. Journal of Biological Chemistry, 277(1): 379—387, doi: 10. 1074/jbc.M108496200
Wang J, Zhang Q B, Zhang Z S et al., 2008. Antioxidant activity of sulfated polysaccharide fractions extracted from. International Journal of Biological Macromolecules, 42(2): 127—132, doi: 10.1016/j.ijbiomac.2007.10.003
Wang, J, Zhang Q B, Zhang Z S et al., 2010. Structural studies on a novel fucogalactan sulfate extracted from the brown seaweed. International Journal of Biological Macromolecules, 47(2): 126—131, doi: 10.1016/j.ijbiomac.2010. 05.010
Wang J, Liu H D, Zhang X et al., 2017. Sulfated Hetero-polysaccharides protect SH-SY5Y cells from H2O2-induced apoptosis by affecting the PI3K/Akt signaling pathway. Marine Drugs, 15(4): 110
Yang L L, Wang P S, Wang H X et al., 2013. Fucoidan derived frominduces apoptosis in human hepatocellular carcinoma SMMC-7721 cells via the ROS-mediated mitochondrial pathway. Marine Drugs, 11(6): 1961—1976
Yang M X, Ma C H, Sun J T et al., 2008. Fucoidan stimulation induces a functional maturation of human monocyte—derived dendritic cells. International Immunopharmacology, 8(13—14): 1754—1760
Ye H, Wang K Q, Zhou C H et al., 2008. Purification , antitumor and antioxidant activitiesof polysaccharides from the brown seaweed. Food Chemistry, 111(2): 428—432, doi: 10.1016/j. foodchem.2008.04.012
Zhang J J, Zhang Q B, Wang J et al., 2009. Analysis of the monosaccharide composition of fucoidan by precolumn derivation HPLC. Chinese Journal of Oceanology and Limnology, 27(3): 578—582, doi: 10.1007/s00343-009-9205-0
Zhang Q B, Li N, Zhao T T et al., 2005. Fucoidan inhibits the development of proteinuria in active Heymann nephritis. Phytotherapy Research, 19(1): 50—53, doi: 10.1002/ptr.1623
Zhang Z, Till S, Jiang C et al., 2014. Structure—activity relationship of the pro-and anticoagulant effects offucoidan. Thrombosis and Haemostasis, 111(3): 429—437, doi: 10.1160/ TH13-08-0635
Zhang Z Y, Teruya K, Eto H et al., 2011. Fucoidan extract induces apoptosis in MCF-7 cells via a mechanism involving the ROS-dependent JNK activation and mitochondria—mediated pathways. PLoS One, 6(11): e27441
A Study on the Structure and Activity of Fucoidan
WANG Jing1, 2, ZHANG Quan-Bin1, 2*
(1. Institute of Oceanology Chinese Academy of Sciences, Qingdao 266071, China; 2. Qingdao National Laboratory and Marine Science and Technology, Marine Biology and Biotechnology Laboratory, Qingdao 266071, China)
Natural polysaccharides made predominantly of sulfated α--fucose residues are known as fucoidan. They are present in brown algae and in some marine invertebrates. The amount of fucoidan in brown algae varies from 20% in Fucus to 2% in Laminaria. Fucoidan, over the past few years, has attracted steady attention as a readily accessible biopolymer possessing diverse biological activity. Algal fucoidans have much more complex and heterogeneous structures devoid of regularity. It is noteworthy that fucoidans isolated from species belonging to different orders of brown algae differed in the structure of their main chain that was built of either 3-substituted or alternating 3- and 4-substituted α-L-fucose residues. Algal fucoidans are mainly composed of sulfated fucose. As the type of their glycosidic bond and sulfate group distribution are still under debate, their molecular structure remains to be strongly established. Fucoidan displays diverse biological activity with potential medicinal value, such as being an anticoagulant, antithrombotic, anti-inflammatory, antitumor, contraceptive, antiviral, and antioxidant. This review discusses the different extraction methods, purification methods, the structural features, and activities of fucoidan.
Fucoidan; structure; biological activity
TS255.1
10.12036/hykxjk20170811001
国家自然科学基金项目(41406144); 中国科学院青年创新促进会基金项目(2016190)。王 晶, 女, 副研究员, 主要从事海洋药物开发和海藻资源高值化利用研究, E-mail: jingwang@qdio.ac.cn
张全斌, 男, 研究员, 博士生导师, 从事海藻化学与海洋药物研究, E-mail: qbzhang@qdio.ac.cn
2017-08-11,
2017-08-24
