不同绝经状态女性血清HE4、CA125和ROMA指数在卵巢癌诊断中的意义
2018-01-10陈艳炯西安交通大学医学部病原生物学与免疫学系第一附属医院检验科陕西西安7006
冯 艾,张 琳,陈艳炯(西安交通大学医学部:. 病原生物学与免疫学系;2. 第一附属医院检验科,陕西西安 7006)
不同绝经状态女性血清HE4、CA125和ROMA指数在卵巢癌诊断中的意义
冯 艾1,2,张 琳1,2,陈艳炯1
(西安交通大学医学部:1. 病原生物学与免疫学系;2. 第一附属医院检验科,陕西西安 710061)
目的根据女性绝经状态不同评价人附睾蛋白4(HE4)、糖类抗原125(CA125)和ROMA指数在诊断卵巢癌方面的应用价值和意义。方法选取妇科包块患者进行手术,确诊为卵巢癌的患者73例(卵巢癌组,分为早期和晚期),卵巢良性肿瘤患者66例(良性肿瘤组)以及健康妇女57例(健康对照组)为研究对象,每组进一步分为未绝经组和绝经组。采用化学发光免疫分析法测定血清HE4和CA125水平,并计算ROMA指数。结果①卵巢癌组的HE4、CA125和ROMA水平均高于良性肿瘤组和健康对照组,有统计学意义(P<0.01);②受试者工作特征(ROC)曲线分析表明,以良性肿瘤组+健康对照组为参照,未绝经组与绝经组HE4、CA125和ROMA曲线下面积(AUC)分别为0.944、0.822、0.941vs. 0.994、1.000、1.000;③在未绝经组,HE4的特异度及阳性预测值最高,最佳cut off值为75.92 pmol/mL时诊断灵敏度和特异度分别为73.1%和100%;在绝经组,CA125具有较高的灵敏度,最佳cut off值为57.65 U/mL时诊断灵敏度和特异度分别为100%和95.4%;④血清CA125在绝经组早晚期组比较差异无统计学意义(P>0.05)。结论在未绝经组中HE4具有更好的鉴别诊断价值,在绝经组ROMA指数能兼顾灵敏度和特异度,具有较高的诊断效能。根据绝经状态不同建立HE4、CA125和ROMA指数的参考区间,在卵巢癌诊断中有一定的临床意义。
卵巢癌;人附睾蛋白4(HE4);糖类抗原125(CA125);ROMA指数
在妇科常见的恶性肿瘤中,卵巢癌的发病率排名第三位,但其死亡率却居首位[1],具有病死率高、预后差等特点。由于卵巢的胚胎发育、组织解剖及内分泌功能复杂,早期症状不典型,术前鉴别卵巢肿瘤的组织类型以及良恶性相当困难。统计资料显示约70%的患者发现时已经进入卵巢癌晚期,晚期患者5年生存率往往不足30%,而早期卵巢癌患者5年生存率能够达到90%[2]。因此,若卵巢癌能得到及早的诊断,可大大延长患者的生存期。卵巢癌的早期诊断具有非常重要的临床意义。目前,临床上诊断卵巢癌主要依据妇科检查和阴道超声检查,对于症状不典型以及早期瘤体较小的患者容易漏诊[3]。
糖类抗原125(carbohydrate antigen 125, CA125)作为一种血清肿瘤标志物已广泛应用于临床,其在上皮性卵巢恶性肿瘤细胞中存在高度表达,但临床研究发现CA125在子宫内膜癌以及卵巢囊肿、子宫肌瘤、子宫内膜异位症等妇科良性疾病中均有异常表达[4],因此特异性不高。人附睾蛋白4(human epididymis protein 4, HE4)是一种新型肿瘤标志物,最早在附睾上皮细胞内被发现,在良性肿瘤及正常组织中含量极低,但在卵巢癌中含量很高,对于早期鉴别和诊断卵巢癌具有重要的价值[5]。近年来FDA批准了通过结合患者月经情况,并依据血清HE4和CA125水平,建立回归模型的卵巢恶性肿瘤的风险算法,即ROMA指数计算(risk of ovarian malignancy algorithm, ROMA),用于评估卵巢癌发生情况。本研究比较了卵巢癌组、良性肿瘤组和健康对照组血清HE4、CA125和ROMA的水平,发现ROMA指数升高在卵巢癌诊断中更有意义。
1 资料与方法
1.1研究对象卵巢癌的患者:本研究纳入的研究对象均来自2015年10月至2017年5月西安交通大学第一附属医院收治住院进行手术治疗的患者,年龄27~76岁,平均(54.19±10.14)岁。根据中华医学会妇科肿瘤分会推荐的《常见妇科恶性肿瘤诊治指南》[6]筛选卵巢癌患者73例,按照是否绝经,将纳入的73例卵巢癌患者分为未绝经组26例和绝经组47例(停经12个月以上定义为绝经)。纳入标准:①卵巢癌原发患者,初发、未经治疗(包括手术、化疗或放疗);②入组患者全部行手术治疗,术前采集患者外周血,术后经病理诊断确诊为卵巢癌。排除标准:①病史资料不全者;②有重要器官功能不全者;③有其他器官或组织的肿瘤患者。进一步按2009年国际妇产科联盟(Federation International of Gynecology and Obstetrics, FIGO)诊断标准,将卵巢癌分为(Ⅰ、Ⅱ、Ⅲ、Ⅳ期),Ⅰ~Ⅱ期为早期,Ⅲ~Ⅳ期为晚期,其中未绝经组卵巢癌患者早期10例,未绝经组卵巢癌患者晚期16例,绝经组卵巢癌患者早期14例,绝经组卵巢癌患者晚期33例。
卵巢良性肿瘤患者:选取我院同期妇科病区患者,经盆腔彩超初筛,进行手术治疗后,诊断为卵巢良性疾病患者共66例,年龄35~84岁,平均(54.80±11.38)岁。诊断标准:临床通过体征、X片、B超、CT及相关实验室检测,最终经病理切片确诊。健康妇女:选取本院同时期经体检确认为健康的女性成人57例作为对照组,年龄35~76岁,平均(55.37±9.79)岁。所选研究对象均无其他内外科疾病和肿瘤家族史。
1.2研究方法①标本采集。清晨空腹采集静脉血5 mL。待血液自然收缩后,经4 000 r/min,离心10 min分离出血清,无溶血及脂血,分装后标记并置-80 ℃低温冰箱冷冻保存至检测。②检测方法。血清HE4和CA125水平测定采用罗氏Modular E170电化学发光仪及配套诊断试剂进行检测。所有操作均按照厂家说明书进行。HE4和CA125试剂盒参考区间分别为0~140 pmol/mL和0~35 U/mL。ROMA指数计算公式如下[7]:绝经前预测指数(PI)=-12.0+2.38×LN(HE4)+0.0626×LN(CA125);绝经后预测指数(PI)=-8.09+1.04×LN(HE4)+0.732×LN(CA125);LN表示自然对数,ROMA值=exp(PI)/[1+exp(PI)]×100;ROMA指数评价标准为:以罗氏Elecsys仪器检测特异性为75%时,绝经前妇女ROMA值>11.4%患卵巢癌风险高;绝经后妇女ROMA值>29.9%患卵巢癌风险高。
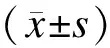
2 结 果
2.1卵巢良性及恶性肿瘤的病理分型和构成比根据1998年国际妇科病理学会(International Society Gynecologic Pathology, ISGP)组织学分类及诊断标准,将卵巢癌分为5种类型,其中浆液性卵巢癌所占百分比最高。卵巢良性肿瘤分为5种类型,其中卵巢囊肿所占百分比最高(表1)。
2.2绝经状态与年龄在卵巢良恶性肿瘤及健康对照组间的比较对卵巢癌组、卵巢良性肿瘤组以及健康对照组进行绝经状态和年龄的比较,所选病例在是否绝经以及年龄差异间均无统计学意义(P=0.435,0.904,表2)。
表1卵巢良恶性肿瘤病理分型及构成比
Tab.1 Pathological classification and proportion of benign and malignant ovarian tumors

类型例数构成比(%)卵巢癌组(n=73) 浆液性囊腺癌4054.8 黏液性囊腺癌1013.7 子宫内膜样癌912.3 透明细胞癌912.3 其他非上皮细胞癌56.9良性肿瘤组(n=66) 卵巢浆液性囊腺瘤46.0 卵巢黏液性囊腺瘤57.6 卵巢囊肿3350.0 卵巢畸胎瘤1218.2 子宫内膜异位增生1218.2
表23组在绝经状态及年龄之间的比较
Tab.2 Comparison of menopausal status and age between the three groups

组别绝经状态绝经前绝经后χ2P年龄<50岁≥50岁χ2P卵巢癌组26472449良性肿瘤组17491.6650.43522440.2010.904健康对照组19381740
2.3血清HE4、CA125和ROMA检测结果在卵巢良恶性肿瘤及健康对照组间的比较卵巢癌组与健康组相比,血清HE4、CA125和ROMA水平均明显升高(HE4:Z=-9.154,P=0.000;CA125:Z=-8.800,P=0.000;ROMA:Z=-9.016,P=0.000),差异具有统计学意义;良性组与健康组相比,CA125的检测值明显升高(CA125:Z=-2.191,P=0.028),差异具有统计学意义;卵巢癌组与良性组相比,血清HE4、CA125和ROMA的检测值均明显升高(HE4:Z=-9.34,P=0.000;CA125:Z=-8.938,P=0.000;ROMA:Z=-9.189,P=0.000);其余各组之间差异无统计学意义(表3)。
表3血清HE4、CA125和ROMA检测值在3组间的比较[中位数(四分位间距)]
Tab.3 Comparison of serum HE4, CA125 and ROMA values between the three groups [median (four percentile)]

组别例数HE4(pmol/mL)CA125(U/mL)ROMA(%)卵巢癌组73599.7(281.8,826.9)ab1140.6(200.5,1836.0)ab84.6(87.8,98.3)ab良性肿瘤组6657.6(47.0,64.1)23.3(11.2,29.9)c12.7(7.5,15.7)健康对照组5753.1(42.9,60.3)15.8(10.4,21.0)10.7(7.2,14.6)
与健康对照组相比,aP<0.01;与良性肿瘤组相比,bP<0.01;与健康对照组相比,cP<0.05。
2.4血清HE4、CA125和ROMA指数诊断卵巢癌的效能评价以卵巢良性肿瘤+健康人群为参照,血清HE4、CA125、ROMA指数、HE4/CA125并联试验、HE4/ROMA并联试验、CA125/ROMA并联试验和HE4/CA125/ROMA并联试验对卵巢癌的诊断灵敏度、诊断特异度、阳性预测值和阴性预测值(表4)。
2.5血清HE4、CA125和ROMA指数ROC曲线下面积的比较以卵巢良性肿瘤患者+健康妇女为参照,绘制ROC曲线,通过曲线下面积(AUC)来判断其诊断价值的大小。在未绝经组中,HE4、CA125和ROMA指数的ROC曲线下面积分别为0.944、0.822、0.941,HE4AUC最高,最佳cut off值75.92 pmol/mL,此时诊断灵敏度为73.1%,特异度为100%;CA125最佳cut off值151.80 U/mL,此时诊断灵敏度为73.1%,特异度为80.6%;ROMA指数最佳cut off值11.505%,此时诊断灵敏度为92.3%,特异度为91.7%。在绝经组中,HE4、CA125和ROMA指数的ROC曲线下面积分别为0.994、1.000、1.000,HE4AUC最低,最佳cut off值141.55 pmol/mL,此时诊断灵敏度为95.7%,特异度为100%;CA125最佳cut off值57.65 U/mL,此时诊断灵敏度为100%,特异度为95.4%;ROMA指数最佳cut off值49.45%,此时诊断灵敏度为100%,特异度为100%(图1)。
表4血清HE4、CA125和ROMA指数诊断卵巢癌的效能评价
Tab.4 Evaluation efficiency of serum HE4, CA125 and ROMA indexes in diagnosis of ovarian cancer (%)


图1血清HE4、CA125和ROMA指数在未绝经组(A)和绝经组(B)ROC曲线下面积分别为0.944、0.822、0.941vs.0.994、1.000、1.000
Fig.1 ROC curves of serum HE4, CA125 and ROMA indexes for pre-menopause group (A) and post-menopause group (B) were 0.944, 0.822, 0.941vs. 0.994, 1.000, 1.0002.6血清HE4、CA125和ROMA检测结果在未绝经以及绝经卵巢癌患者早晚期之间的比较在未绝经组中,随着卵巢肿瘤分期的升高,3种肿瘤标志物水平均明显增高(P<0.05);在绝经组中,卵巢癌患者晚期比早期血清HE4和ROMA指数明显增高(P<0.05,图2)。
2.7相关性分析将病理分期与血清HE4、CA125和ROMA指数分别进行相关性检验,结果显示卵巢癌病理分期与血清HE4水平呈显著正相关(R=0.524,P=0.000);与血清CA125水平呈显著正相关(R=0.309,P=0.005);与ROMA指数呈显著正相关(R=0.514,P=0.000)。

图2血清HE4、CA125和ROMA检测结果在未绝经以及绝经卵巢癌患者早晚期之间的比较
Fig.2 Comparison of serum HE4, CA125 and ROMA indexes test results between early and late premenopausal and postmenopausal patients with ovarian cancer
A:血清HE4水平在未绝经的早晚期,绝经组早晚期以及未绝经组早期与绝经组晚期之间的比较;B:血清CA125水平在未绝经的早晚期之间的比较;C:ROMA指数在未绝经的早晚期,绝经组早晚期,未绝经组与绝经组的早期之间的比较。
3 讨 论
血清CA125水平与卵巢癌的发生、发展、消退以及复发关系密切,诊断灵敏度较高。术前血清CA125水平随着肿瘤临床分期的增加而升高,在对卵巢癌术后随访研究发现,CA125水平与肿瘤切除的程度密切相关,血清CA125水平上升往往提示卵巢癌复发。目前,CA125仍是临床上辅助诊断卵巢癌的首选肿瘤标志物,但CA125诊断卵巢癌的特异度较低,大约20%的卵巢恶性肿瘤缺乏CA125特异表达[8]。一些研究表明[9],HE4是一种酸性小分子分泌蛋白,是乳清酸蛋白WAP结构域家族蛋白中的一员。WAP家族成员被认为在炎症时保护细胞和组织对抗蛋白水解酶的过度作用,在卵巢排卵期间,卵巢表面上皮是发生周期性损害和炎症的作用点,而这个炎症的过程与卵巢恶性肿瘤的病因有较强的关联。在卵巢恶性肿瘤细胞中,HE4的启动子中有一些炎症反应因素,其可能促进HE4的高度表达。HE4在正常卵巢组织中不表达,而在90%的浆液性卵巢癌中存在高表达[10],HE4在子宫内膜样以及透明细胞性卵巢癌中也有表达,在粘液性以及性索细胞卵巢癌中几乎不表达,本实验中浆液性卵巢癌比例为54.8%。
一些研究表明[11],HE4和CA125联合检测可用于手术后化疗患者预后监测,提示联合检测相对于单项有更好的价值。PEDRADA等[12]对47例上皮性卵巢癌手术后化疗患者进行22个月的随访,发现HE4在预测上皮性卵巢癌复发方面的作用可能优于CA125。在卵巢癌的诊断中,除了血清HE4和CA125的升高,尿液中的HE4也升高[13],提示阴道超声联合多种肿瘤标志物检测可提高卵巢癌的诊断效能。
WEI等[14]采用电化学发光法测定158例患者血清HE4、CA125水平,结果显示,卵巢癌组血清HE4、CA125和ROMA指数显著高于良性肿瘤组及健康对照组(P<0.05),良性肿瘤组血清CA125显著高于健康对照组(P<0.05)。这与我们的实验结果相似,提示CA125的特异性不佳,在部分炎症反应或良性肿瘤等疾病中也可明显升高。因此,仅通过CA125水平升高会造成较多的误诊。
所以,CA125有必要联合其他指标以提高其诊断特异度。HYE等[15]研究发现HE4的灵敏度(78.3%)及特异度(94.0%)均高于CA125(69.6%、65.7%),ROMA指数与HE4具有相同的灵敏度,特异度略小于HE4但明显大于CA125。而本实验是将卵巢癌患者分为未绝经组和绝经组,使用血清HE4、CA125、ROMA指数单项或并联试验对卵巢癌的诊断效能进行评价。在未绝经组中,在相同灵敏度的情况下,HE4的特异度高于CA125,ROMA指数具有较高的灵敏度和阴性预测值;在绝经组HE4同样具有较高的特异度和阳性预测值,ROMA指数能更好的兼顾灵敏度和特异度,HE4/CA125并联试验可提高灵敏度和特异度。本实验表明,HE4较CA125在诊断卵巢癌方面有更高的特异度,两者联合ROMA指数检测能提高卵巢癌诊断的灵敏度。
为进一步判断HE4、CA125和 ROMA指数对卵巢癌的诊断效能,本研究以卵巢良性肿瘤+健康人为参照,绘制ROC曲线。在未绝经组HE4、CA125和 ROMA指数最佳cut off值分别为(75.92 pmol/mL、151.80 U/mL、11.505%),ROC曲线下面积分别为(0.944、0.822、0.941);绝经组HE4、CA125和 ROMA指数最佳cut off值分别为(141.55 pmol/mL、57.65 U/mL、49.45%),ROC曲线下面积分别为(0.994、1.000、1.000)。波兰学者[16]以卵巢良性肿瘤为参照绘制ROC曲线,HE4、CA125和 ROMA指数在未绝经组和绝经组最佳cut off值分别为(70.3 pmol/mL、64.6 U/mL、14.9%vs. 109.1 pmol/mL、39.4 U/mL、33.4%)。此结果与本次实验均显示,未绝经组HE4最佳cut off值与临床使用参考区间0~140 pmol/mL差异较大,无论在未绝经组或绝经组中CA125最佳cut off值均高于临床使用参考区间为0~35 U/mL,因此还需要进一步的研究来确定适合的参考范围。
血清HE4、CA125和ROMA指数在未绝经组的早晚期比较中,差异具有统计学意义(P<0.05),说明3个指标均有助于未绝经卵巢癌患者临床分期的诊断;血清HE4和ROMA指数在绝经组的早晚期比较中,差异也具有统计学意义(P<0.05),但血清CA125在绝经组早晚期比较中差异无统计学意义(P>0.05),说明在判断绝经后女性罹患卵巢癌早期或晚期时,HE4及ROMA指数诊断效能高于CA125;ROMA指数在卵巢癌早期患者未绝经与绝经比较,具有显著性差异(P<0.05),说明ROMA指数与卵巢癌早期患者的绝经状态有关,ROMA指数在绝经组检测水平显著高于未绝经组检测值。在对319例日本妇女早期(Ⅰ、Ⅱ)上皮性卵巢癌的研究中发现[17],血清HE4结合ROMA指数有助于卵巢癌的诊断,并能较好的对卵巢癌患者肿瘤分期进行判定,与本实验一致。
血清HE4、CA125和ROMA指数分别进行相关性检验,结果显示卵巢癌病理分期与3种指标均呈显著正相关,表明随着卵巢癌病理分期的增加,血清HE4、CA125和ROMA指数逐渐增加。
综上所述,①HE4在未绝经组和绝经组的最佳cut off值分别为75.92 pmol/mL和141.55 pmol/mL,临床使用参考区间为0~140 pmol/mL;CA125在未绝经组和绝经组的最佳cut off值分别为151.80 U/mL和57.65 U/mL,临床使用参考区间为0~35 U/mL,所以需要提高特异性,降低误诊率。因此,有必要进一步扩大样本量,按绝经状态分组建立适合各种检测人群的参考区间;②对易感人群进行卵巢癌筛查可选用多种标记物联合检测,其对卵巢癌的诊断效率要优于单项指标;③血清HE4作为妇科盆腔恶性肿瘤筛查的新标志物,在对卵巢癌的诊断特异性方面明显优于CA125,在未绝经卵巢癌患者中HE4具有更好的鉴别诊断价值;④ROMA指数的应用有助于提高对卵巢癌的诊断效能,在绝经后卵巢癌患者中ROMA的灵敏度为100%,特异度为100%,如再联合其他标记物,其敏感度几乎不变。因此,进行卵巢癌筛查应选用合适的肿瘤标志物,筛查试验应选用灵敏性高的检测项目,而确诊实验应选用特异性高的项目,灵活运用以上血清学指标,以提高灵敏度降低漏诊率,达到早期诊断早期治疗提高患者生存率和生存质量的目的。
[1] 张爽爽,夏庆民,郑荣寿,等. 中国2010年卵巢癌发病与死亡分析[J]. 中国肿瘤, 2016, 25(3):169-173.
[2] SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1):7-30.
[3] 高淳,文智. 影像学联合肿瘤标志物对卵巢癌诊断的研究进展[J]. 医学综述,2014, 20(5):894-896.
[4] KADIJA S, STEFANOVIC A, JEREMIC K, et al.The utility of human epididymal protein 4, cancer antigen 125, and risk for malignancy algorithm in ovarian cancer and endometriosis[J]. Int J Gynecol Cancer, 2012, 22(2):238-244.
[5] ABDEL-AZEEZ HA, LABIB HA, SHARAF SM, et al. HE4 and mesothelin: Novel biomarkers of ovarian carcinoma in patients with pelvic masses[J]. Asian Pac J Cancer Prev, 2010, 11(1):111-116.
[6] 沈铿,崔恒. 常见妇科恶性肿瘤诊治指南(第4版)[M]. 北京:人民卫生出版社, 2014:108-111.
[7] MOORE RG, MCMEEKIN DS, BROWN AK, et al. A novel multiple marker bioassay utilizing HE4 and CA125 for the prediction of ovarian cancer in patients with a pelvic mass[J]. Gynecol Oncol, 2009, 112(1):40-46.
[8] 张颖,史惠蓉. 卵巢上皮性肿瘤组织中人组织激肽释放酶15和CA125蛋白的表达[J]. 郑州大学学报(医学版), 2010, 45(01):62-65.
[9] WU L, DAI ZY, QIAN YH, et al. Diagnostic value of serum human epididymis protein 4 (HE4) in ovarian carcinoma: A systematic review and meta-analysis[J]. Int J Gynecol Cancer, 2012, 22(7):1106-1112.
[10] LEVANON KC, CRUM C, DRAPKIN R. New insights into the pathogenesis of serous ovarian cancer and its clinical impact[J]. J Clin Oncol, 2008,26(32):5284-5293.
[11] AURELIE P, AURELIE R, BEATRICE G, et al. Serum CA125 and HE4 levels as predictors for optimal interval surgery and platinum sensitivity after neoadjuvant platinumbased chemotherapy in patients with advanced epithelial ovarian cancer[J]. J Ovarian Res, 2016, 9(61):1-6.
[12] PEDRADA I, METHASINEE P, PRASIT P. Does human epididymis protein 4 (HE4) have a role in prediction of recurrent epithelial ovarian cancer[J]. Asian Pac J Cancer Prev, 2016, 17(9):4483-4486.
[13] BURCU KK, ERALP B, BERK B, et al. Alternative tumor markers in the diagnosis of ovarian cancer[J]. Ginekologia Polska, 2016, 87(8):565-569.
[14] WEI S, LI H, ZHANG B. The diagnostic value of serum HE4 and CA-125 and ROMA index in ovarian cancer [J]. Biomed Rep, 2016, 5(1):41-44.
[15] HYE YC, SUNG HP, YOUNG HP, et al. Comparison of HE4, CA125, and risk of ovarian malignancy algorithm in the prediction of ovarian cancer in korean women[J]. Korean Med Sci, 2015, 30(12):1777-1783.
[16] TERLIKOWSKA KM, DOBRZYCKA B, WITKOWSKA AM, et al. Preoperative HE4, CA125 and ROMA in the differential diagnosis of benign and malignant adnexal masse[J]. J Ovarian Res, 2016, 9(43):1-7.
[17] FUJIWARA H, SUZUKI M, TAKESHIMA N, et al. Evaluation of human epididymis protein 4 (HE4) and risk of ovarian malignancy algorithm (ROMA) as diagnostic tools of type Ⅰ and type Ⅱ epithelial ovarian cancer in Japanese women[J]. Tumour Biol, 2015, 36(2):1045-1053.
ThesignificanceofserumHE4,CA125andROMAindexesindiagnosisofovariancancertodifferentmenopausalstatus
FENG Ai1,2, ZHANG Lin1,2, CHEN Yan-jiong1
(1. Department of Microbiology and Immunology, Xi’an Jiaotong University Health Science Center, Xi’an 710061; 2. Clinical Laboratory, the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061, China)
ObjectiveTo evaluate the significance of HE4, CA125 and ROMA indexes in the diagnosis of ovarian cancer in different menopausal status women.MethodsAfter the gynecological mass was taken for pathological diagnosis, a total of 73 cases of ovarian cancer (ovarian cancer group,divided into early stage and late stage) and 66 cases of gynecological benign tumor (benign tumor group) were selected. 57 healthy women were selected as controls (control group). All groups were further divided into non-menopausal and postmenopausal groups. Serum levels of HE4 and CA125 were measured by chemiluminescence immunoassay and the ROMA index was calculated.Results① The serum levels of HE4, CA125 and ROMA in ovarian cancer group were significantly higher than those in benign tumor group and healthy control group (P<0.01). ② When benign tumor group and control group were taken as a reference, the receiver operating characteristic (ROC) curve analysis showed that the area under the curve (AUC) of HE4, CA125 and ROMA in the non-menopausal group and the postmenopausal group was (0.944, 0.822, 0.941vs. 0.994, 1.000, 1.000), respectively. ③ In non-menopausal group, HE4 has higher specificity and positive predictive value. The best cut off value was 75.92 pmol/mL, the diagnostic sensitivity and specificity were 73.1% and 100%. In postmenopausal group, CA125 has higher sensitivity, the optimum cut off value was 57.65 U/mL, the diagnostic sensitivity and specificity were 100% and 95.4%. ④ In the postmenopausal group, there was no significant difference in serum CA125 level between the early and late ovarian cancer patients (P>0.05).ConclusionIn the premenopausal group HE4 has a better differential diagnostic value. In postmenopausal group, the ROMA index could give consideration to both sensitivity and specificity, and had higher diagnostic efficacy. It plays roles in the diagnosis of ovarian cancer to establish the appropriate reference interval of HE4, CA125 and ROMA indexes according to the different menopausal status.
ovarian cancer; HE4; CA125; ROMA index
2017-01-14
2017-07-22
陈艳炯,副教授. E-mail: chenyanjiong@xjtu.edu.cn
优先出版:http://kns.cnki.net/kcms/detail/61.1399.R.20171205.1558.024.html(2017-12-05)
R446
A
10.7652/jdyxb201801017
(编辑 韩维栋)
