盐酸吡咯列酮对血红素氧合酶-1在动脉粥样硬化模型兔主动脉表达的影响
2018-01-10潘军强张殿新孙超峰西北大学生命科学学院预防基因组医学研究所陕西西安70069第四军医大学附属西京医院心血管内科陕西西安700西安交通大学第一附属医院心血管内科陕西西安7006
潘军强,张殿新,孙超峰,杨 进(. 西北大学生命科学学院预防基因组医学研究所,陕西西安 70069;. 第四军医大学附属西京医院心血管内科,陕西西安 700;. 西安交通大学第一附属医院心血管内科,陕西西安 7006)
◇基础研究◇
盐酸吡咯列酮对血红素氧合酶-1在动脉粥样硬化模型兔主动脉表达的影响
潘军强1,张殿新2,孙超峰3,杨 进1
(1. 西北大学生命科学学院预防基因组医学研究所,陕西西安 710069;2. 第四军医大学附属西京医院心血管内科,陕西西安 710032;3. 西安交通大学第一附属医院心血管内科,陕西西安 710061)
目的探讨盐酸吡格列酮对动脉粥样硬化模型兔主动脉血红素氧合酶-1表达的影响。方法36只遗传性高脂血症兔,随机分为对照组、高脂模型组、盐酸吡格列酮组3组(n=12) 。对照组及高脂模型组分别以普通饲料与高脂饲料喂养,盐酸吡格列酮组予以高脂饲料并吡格列酮[8 mg/(kg·d)]灌胃,持续饲养12周。免疫组织化学法、实时荧光定量PCR法及 Western blot法测定 3组兔主动脉中血红素氧合酶-1的表达。结果3组兔主动脉血管平滑肌与动脉粥样硬化斑块中明显可见血红素氧合酶-1的表达。盐酸吡格列酮组兔的主动脉壁中血红素氧合酶-1表达低于高脂模型组,较对照组显著增高(P<0.05)。结论盐酸吡格列酮可上调血红素氧合酶-1在主动脉的表达,进而减轻动脉粥样硬化的发展。
血红素氧合酶-1;盐酸吡格列酮;动脉粥样硬化;主动脉;兔
在临床上,动脉粥样硬化(atherosclerosis, AS)是最常见的心血管疾病,其特征性病理变化为动脉内膜增厚、变硬,动脉壁弹性减低及粥样斑块形成[1]。AS的发病机制极其复杂,研究表明:诸多危险因素如吸烟、脂质代谢紊乱、高血压及糖尿病等通过促发氧化应激反应,激活血管壁慢性炎症反应,最终促进AS的发生发展[2]。血红素氧合酶-1(hemooxygenase-1, HO-1)是热休克蛋白家族成员之一,又称热休克蛋白32(heat shock protein 32, HSP32),广泛存在于肝、脾及网状内皮系统和骨髓等组织,同时也是血管内皮细胞以及平滑肌细胞中一种重要的氧化酶。氧化应激、重金属、感染、缺血再灌注及其底物血红素均可诱导HO-1的表达[3-4]。HO-1高表达可通过抗氧化应急、抑制炎症反应、抑制黏附分子及免疫调节等途径延缓AS的发展。吡格列酮是一类临床常用的噻唑烷二酮类降糖药。研究提示,吡格列酮可通过调节众多细胞因子、氧化酶等的转录,进而发挥抗AS作用[5-8]。本研究以遗传性高脂血症(watanabe heritable hyperlipidemic, WHHL)兔为研究对象,建立AS模型,观察盐酸吡格列酮对兔AS斑块内HO-1表达的影响,探讨其抗AS的可能机制,为此类药物用于人类AS防治疗提供理论依据。
1 材料与方法
1.1实验动物及药品1月龄健康雄性WHHL兔36只,体质量(1.4±0.4)kg,随机分为3组:正常对照组(A组)、高胆固醇饮食组(B组)及吡咯列酮加高胆固醇饮食组(C组),每组各12只。A组:120 g/d正常饲料饲喂;B组:120 g/d高胆固醇饲料饲喂;C组:高胆固醇饲料(120 g/d)+吡格列酮[8 mg/(kg·d)]灌胃。饲喂8周后处死每组WHHL兔。盐酸吡格列酮片、高胆固醇饲料均由实验动物中心统一提供。
1.2试剂、仪器及标本留取实验中所需各种试剂盒、缓冲液、抗体稀释液及HO-1鼠抗兔多克隆抗体均购自北京中杉金桥生物技术有限公司。光学显微镜、病理图文分析系统、PCR仪及Gel Doc100 成像系统均由教育部西安交通大学心血管离子通道疾病重点实验室提供。饲喂8周后耳缘静脉注射戊巴比妥钠全身麻醉后处死实验动物,立即分离主动脉,清除杂质,生理盐水反复冲洗,中性甲醛溶液固定。
1.3组织学检查与图像分析Masson染色观察主动脉血管斑块内胶原纤维成分,经Masson染色后胶原纤维、黏液呈蓝色,纤维素、细胞质呈红色。免疫组织化学染色观察主动脉血管内皮HO-1表达水平。结果判定:HO-1阳性表达为细胞胞质中有棕黄色颗粒随机选取4个视野,200倍镜下观察,图象分析采用病理组织实时摄像显微镜系统摄像,并使用图像分析软件分析阳性面积百分比。
1.4实时荧光定量PCR及Westernblot技术测定主动脉血管组织中HO-1的mRNA与蛋白表达量提取各组动物的主动脉血管组织总RNA,逆转录成cDNA,而后行实时荧光定量PCR,得到HO-1的mRNA相对表达量。引物序列:HO-1上游引物5′-CAGTGCACACAGTTCAAC-3′,下游引物5′-TAAGGCAACCTCGGAAGC-3′;GAPDH上游引物5′-CCTCCTGCACCACCAACT-3′,下游引物5′-CTT-CTGGGT GGCAGTGATG-3′。提取主动脉血管组织总蛋白,BCA试剂盒测蛋白总浓度,绘出标准曲线,计算出样品实际浓度(μg/μL)。然后按照标准Western blot技术操作流程行主动脉血管组织中HO-1蛋白表达检测。Gel Doc100 成像系统进行图像处理,记录结果。采用目的条带与内参(β-actin)条带吸光面积积分的比值分析目的蛋白。
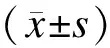
2 结 果
2.13组间主动脉AS程度的比较C组AS斑块面积与动脉内膜面积比值、内膜厚度、内膜/中膜厚度比均低于B组而高于A组,差异有统计学意义(P<0.05,表1)。
表13组斑块面积百分比及内膜厚度、内膜/中膜厚度比的比较

A组:正常对照组;B组:高胆固醇饮食组;C组:吡咯列酮加高胆固醇饮食组。与A组比较,★★P<0.01;与B组比较,☆P<0.05。
2.23组间动脉壁及AS斑块Masson染色的比较经Masson 染色后发现,A组动物主动脉组织中可见少量胶原纤维;B组动物主动脉组织中蓝色胶原纤维组织显著增生,内膜下、间质中胶原沉积表达量显著增多,胶原纤维呈条索状穿梭于红色的平滑肌细胞之间或迂曲包绕平滑肌细胞,平滑肌肌束被大量条索状胶原纤维所分隔;C组动物主动脉组织蓝色胶原纤维组织增生程度介于A、B组之间(图1)。

图13组间动脉壁及AS斑块的Masson染色情况
Fig.1 Masson staining of arterial wall and aortic AS plaque area (Masson staining, ×200)
A:正常对照组;B:高脂饮食组;C:高胆固醇饮食加吡咯列酮组。
2.33组间HO-1特异性染色表达阳性面积比的比较C组、B组和A组血管壁HO-1表达分别为:(27.45±2.92)%、(33.49±8.26)%、(16.71±3.72)%。经比较后发现,C组HO-1表达高于A组而低于B组,组间比较差异有统计学意义(P<0.05,图2)。

图23组间动脉壁及AS斑块HO-1的表达情况
Fig.2 Expression of HO-1 in aortic AS plaque area (Immunohistochemical staining, ×200)
A:正常对照组;B:高脂饮食组;C:高胆固醇饮食加吡咯列酮组。
2.43组间动脉壁及AS斑块组织HO-1蛋白和mRNA表达的比较应用Western blot技术检测3组间动脉壁及AS斑块组织HO-1蛋白水平。经分析发现,心房组织中HO-1的蛋白相对表达在A、B、C组分别为:0.652±0.093、1.957±0.237、1.082±0.163。实时荧光定量PCR测定3组间HO-1的mRNA相对表达(2-△△Ct值)。经检测发现,心房组织中HO-1的mRNA相对表达在A、B、C组分别为:0.861±0.086、1.936±0.347、1.142±0.183。经统计学处理后发现,C组HO-1的mRNA及蛋白表达均高于A组而低于B组,组间比较差异有统计学意义(P<0.05,图3)。
3 讨 论
HO-1是一种应激性反应蛋白,其通过抗氧化应激、抗细胞增殖、抗凋亡、抑制血小板聚集及炎症损伤、调节血管壁的紧张性和参加细胞内信号的传递等机制对心血管系统起着保护作用[9]。已有研究证实,冠心病患者的内皮细胞、AS斑块内以及平滑肌细胞内HO-1的表达增加[10];HO-1及HO-1的mRNA在AS发展的过程中表现出逐渐增加的趋势[11]。大量实验表明,PPAR-γ及其配体在体内多种细胞中均有表达,诸如巨噬细胞、血管内皮细胞及平滑肌细胞等,具有直接的血管效应,激活后可直接在血管壁水平拮抗上述病理作用[12-13]。吡格列酮是人工合成的特异性PPAR-γ激动剂,同时也作为一种口服治疗2型 糖尿病的降糖药在临床上广泛应用[14]。新近研究表明,吡格列酮抗AS的直接效应包括增加一氧化氮的生物利用度,减少白细胞和内皮细胞的相互作用,减少血管平滑肌细胞的迁移和增殖及巨噬细胞中胆固醇的外流[15]。此外,吡格列酮抗AS的间接效应为:吡格列酮激活PPAR-γ后,通过脂肪组织调控炎性因子的基因表达而发挥抗炎作用[16]。
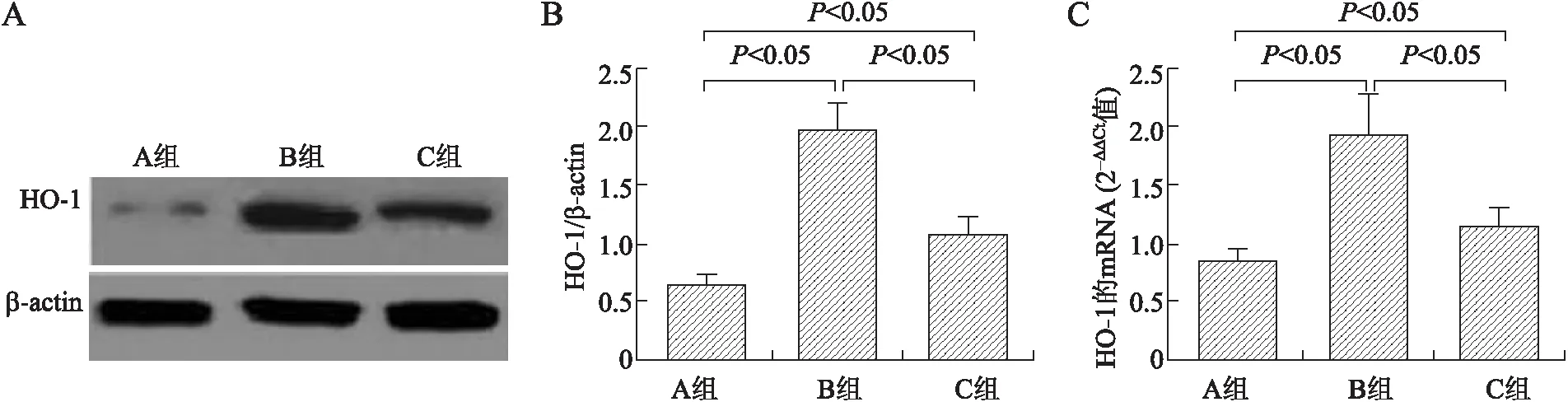
图33组间HO-1蛋白与mRNA的表达情况
Fig.3 Expressions of HO-1 mRNA and protein in each group
A:3组间HO-1蛋白表达;B:3组间HO-1蛋白表达的比较;C:3组间HO-1的mRNA表达的比较。A组:正常对照组;B组:高脂饮食组;C组:高胆固醇饮食加吡咯列酮组。
正常情况下HO-1在人体内基础表达量很低,但众多因素均可诱导HO-1的表达:如血红素、内毒素、一氧化氮、细胞因子、重金属等。HO-1作为热休克蛋白家族成员之一,主要作用是以限速酶的形式催化游离血红素降解为胆绿素、游离铁、一氧化碳等,胆绿素可迅速还原成胆红素,胆红素是细胞内目前发现的最强抗氧化剂之一。一氧化碳作为细胞内气体信号分子之一,具有抑制炎症反应、改善血管生物学活性、调节细胞代谢等作用。HO-1/胆红素/一氧化碳共同组成的内源性保护系统在血管内皮细胞、组织等对抗炎症及氧化应激损伤中发挥着重要作用,合理上调HO-1的表达将成为AS防治的重要靶点。吡格列酮进入心肌、骨骼肌及脂肪等组织细胞后,可能通过激活PPAR-γ,抑制脂肪细胞分泌炎症因子、血管粘附因子、纤溶激活酶抑制剂-1等细胞因子,促进脂联素、一氧化氮等分泌,而后者可诱导HO-1 表达。
本研究以AS易感动物WHHL兔为研究对象,建立兔AS模型,应用免疫组织化学法、实时荧光定量PCR法及Western blot法观察盐酸吡格列酮对兔AS斑块内HO-1表达的影响。实验结果显示,正常新西兰兔进食高胆固醇饲料后,主动脉血管壁HO-1表达阳性面积比明显升高,高胆固醇饮食加吡咯列酮组主动脉血管壁HO-1表达阳性面积少于高胆固醇饮食组,进一步证实了吡咯列酮可能通过上调HO-1的表达从而发挥其抗AS的作用,为此类药物用于人类AS防治提供了理论依据。随着对AS发病机制研究的不断深入,有关吡格列酮对HO-1的影响及在抗AS中的作用将成为新的研究热点。
[1] YANG L, LIU Y, WANG S, et al. Association between Lp-PLA2 and coronary heart disease in Chinese patients[J]. J Int Med Res, 2017, 45(1):159-169.
[2] GE P, CHEN Z, PAN R, et al. Synergistic effect of lipoprotein-associated phospholipase A2 with classical risk factors on coronary heart disease: A multi-ethnic study in China[J]. Cell Physiol Biochem, 2016, 40(5):953-968.
[3] MA L, GUO X, CHEN W. Inhibitory effects of oleoylethanolamide (OEA) on H2O2-induced human umbilical vein endothelial cell (HUVEC) injury and apolipoprotein E knockout (ApoE-/-) atherosclerotic mice[J]. Int J Clin Exp Pathol, 2015, 8(6):6301-6311.
[4] ZRELLI H, KUSUNOKI M, MIYAZAKI H. Role of hydroxytyrosol-dependent regulation of HO-1 expression in promoting wound healing of vascular endothelial cells via Nrf2 De Novo synthesis and stabilization[J]. Phytother Res, 2015, 29(7):1011-1018.
[5] LIU A, ABBASI F, KIM S, et al. Effect of pioglitazone on cardiometabolic risk in patients with obstructive sleep apnea[J]. Eur J Pharm Biopharm, 2017, 15(16):30638-30645.
[6] ZHANG J, WANG X, LIU X, et al. Protection against alcohol-induced neuronal and cognitive damage by the PPARγ receptor agonist pioglitazone[J]. Brain Behav Immun, 2017, 3(17):30023-30025.
[7] RICOTE M, LI AC, WILLSON TM, et al. Combination therapy with exenatide plus pioglitazone versus basal/bolus insulin in patients with poorly controlled type 2 diabetes on sulfonylurea plus metformin: The Qatar Study[J]. Diabetes Care, 2017, 40(3):325-331.
[8] MYLROIE H, DUMONT O, BAUER A, et al. PKCε-CREB-Nrf2 signalling induces HO-1 in the vascular endothelium and enhances resistance to inflammation and apoptosis[J]. Cardiovasc Res, 2015, 106(3):509-519.
[9] LU C, YANG Y, LI C, et al. Andrographolide inhibits TNFα-induced ICAM-1 expression via suppression of NADPH oxidase activation and induction of HO-1 and GCLM expression through the PI3K/Akt/Nrf2 and PI3K/Akt/AP-1 pathways in human endothelial cells[J]. Biochem Pharmacol, 2014, 91(1):40-50.
[10] SCHROTTMAIER W, OSKOLKOVA O, SCHABBAUER G, et al. MicroRNA miR-320a modulates induction of HO-1, GCLM and OKL38 by oxidized phospholipids in endothelial cells[J]. Atherosclerosis, 2014, 235(1):1-8.
[11] CALAY D, MASON J. The multifunctional role and therapeutic potential of HO-1 in the vascular endothelium[J]. Antioxid Redox Signal, 2014, 20(11):1789-1809.
[12] JIANG F, JIANG R, ZHU X, et al. Genipin inhibits TNF-α-induced vascular smooth muscle cell proliferation and migration via induction of HO-1[J]. PLoS One, 2013, 8(8):e74826.
[13] CHEN S, DING Y, TAO W, et al. Naringenin inhibits TNF-α induced VSMC proliferation and migration via induction of HO-1[J]. Food Chem Toxicol, 2012, 50(9):3025-3031.
[14] LIAO H, SAVER J, WU Y, et al. Pioglitazone and cardiovascular outcomes in patients with insulin resistance, pre-diabetes and type 2 diabetes: A systematic review and meta-analysis[J]. BMJ Open, 2017, 7(1):e013927.
[15] CHATTERJEE S, SANYAL D, DAS CHOUDHURY S, et al. Effect of pioglitazone on nerve conduction velocity of the median nerve in the carpal tunnel in type 2 diabetes patients[J]. World J Diabetes, 2016, 7(19):547-553.
[16] KURHE Y, MAHESH R. Pioglitazone, a PPARγ agonist rescues depression associated with obesity using chronic unpredictable mild stress model in experimental mice[J]. Neurobiol Stress, 2016, 18(3):114-121.
Effectsofpiogiltazoneontheexpressionofhemooxygenase-1inaorticatherosclerosisplaqueareainrabbits
PAN Jun-qiang1, ZHANG Dian-xin2, SUN Chao-feng3, YANG Jin1
(1. Institute of Genome-based Preventive Medicine, Life Sciences School of Northwest University, Xi’an 710069; 2. Department of Cardiovascular Diseases,Xijing Hospital of the Fourth Military Medical University, Xi’an 710032;3. Department of Cardiovascular Diseases, the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061, China)
ObjectiveTo investigate the effects of piogiltazone on the expression of hemooxygenase-1 in aortic atherosclerosis plaque area in rabbits.MethodsWe randomly divided 36 Watanabe heritable hyperlipidemic rabbits into 3 groups: control group, high-cholesterol diet group, and high-cholesterol diet with pioglitazone [8 mg/(kg·d)] group, with 12 in each. All the animals were fed for 12 weeks and then sacrificed. Rabbit aortic atherosclerosis pathological features were observed by Masson staining; the expression of hemooxygenase-1 in aortic atherosclerosis plaque area in rabbits was detected by immunohistochemistry, real-time quantitative PCR and Western blot techniques.ResultsHemooxygenase-1 expression was obvious in the smooth muscle in aortic vessels and atherosclerosis plaques in the three groups of rabbits. The expression of hemooxygenase-1 was lower in high-cholesterol diet with pioglitazone group than in high-cholesterol diet group and significantly higher than in control group (P<0.05).ConclusionPioglitazone can slow down the progression of atherosclerosis by up-regulating the expression of hemooxygenase-1.
hemooxygenase-1; pioglitazone; atherosclerosis; aorta; rabbit
2017-03-30
2017-06-13
国家自然科学基金资助项目(No.81270236)
Supported by the National Natural Science Foundation of China (No.81270236)
杨进,教授,博士生导师. E-mail: yangjin@nwu.edu.cn
优先出版:http://kns.cnki.net/kcms/detail/61.1399.R.20171204.1720.010.html(2017-12-04)
R743.1
A
10.7652/jdyxb201801006
(编辑 韩维栋)
