甲醛与DEHP联合染毒对小鼠学习记忆能力的影响
2018-01-09陆林洁安结然杜俊停丁书茂华中师范大学生命科学学院遗传调控与整合生物学湖北省重点实验室湖北武汉430079
陆林洁,蔡 洁,安结然,杜俊停,丁书茂 (华中师范大学生命科学学院,遗传调控与整合生物学湖北省重点实验室,湖北 武汉 430079)
甲醛(FA)是一种常见的装修型化学性室内空气污染物,其毒性作用越来越受到人们的重视.包括免疫毒性,神经毒性,生殖毒性和遗传毒性[1-4].甲醛作为确定的人类致癌物[5-6],与其他挥发性有机化合物具有协同作用[7].邻苯二甲酸酯(PAEs)是重要的聚氯乙烯塑料增塑剂,应用广泛于工业.大气,水体和土壤中均检测到 PAEs,极易挥发到空气中,已成为全球性污染物[8].其中邻苯二甲酸二乙基己酯(DEHP)是目前塑料工业中最主要的增塑剂之一,广泛应用于食品包装材料,医疗器械和儿童玩具生产等方面.研究发现,DEHP对人体的肝脏,生殖系统和神经系统方面造成毒性作用[9-11].Pitten等[12]研究表明,甲醛暴露组在水迷宫中寻找食物时间延长,出错次数增加,甲醛对小鼠有神经毒性作用.Malek等[13]发现暴露于甲醛蒸汽的鼠,其运动,活动度和探索能力均降低.低浓度的 DEHP能够对小鼠的学习记忆能力造成影响[14].甲醛与其他挥发性有机物具有协同作用,如苯,二甲苯等,亦多为常见的室内空气污染物.然而诸多研究表明,与发达国家相比,在 PAEs暴露水平测试中,我国室内空气中DEHP浓度最高,是美国的3.5倍.因此DEHP作为新型的室内空气污染物的毒性作用不可忽视.根据DEHP与高分子聚合物之间是物理性结合,具有较强挥发性这一特性,并结合人类往往是暴露于综合环境污染物中这一事实,因此有必要进行联合毒性的毒理学检测.同时从甲醛和DEHP的暴露途径来看,两者进入人体的方式基本一致.目前关于甲醛和DEHP单独毒性作用的研究较多,而对两者联合染毒所致神经毒性的研究报道较少.为了进一步探究甲醛与DEHP毒性作用及其机制,本文开展甲醛和 DEHP单独及联合暴露对小鼠学习记忆能力的影响研究,为综合评估甲醛和DEHP的安全性提供科学依据.
1 材料与方法
SPF级雄性纯系昆明小鼠(8周龄左右,(22±2)g体重),购买于湖北省预防医学研究院实验动物中心.为了减少小鼠个体之间的行为差异,保证结果的准确性,先进行行为功能筛选,水迷宫每天训练1次,训练3d,水温保持在(24±2)℃,保证实验环境和实验者相对位置不变记录第3d实验结果,按照90%区间去除两端极值,选出符合条件的昆明小鼠.饲养条件为12h光/暗周期的无病原体环境(温度 20~25℃,湿度 50%~70%),小鼠饮食饮水自由.实验开始前,小鼠进行至少 7d的环境适应.

表1 实验分组Table 1 Experiment groups
1.2 试剂与仪器
试剂包括甲醛(FA)原液(Sigma,4%),邻苯二甲酸二乙基己酯(DEHP,Sigma),硫代巴比妥酸(TBA,分析纯,国药集团),微量还原型谷胱甘肽(GSH)试剂盒(南京建成),小鼠 TNF-α酶联免疫吸附检测试剂盒(eBioscience, USA),小鼠 IL-1β酶联免疫吸附检测试剂盒(eBioscience, USA),小鼠Caspase-3活性检测试剂盒(碧云天生物公司,江苏),小鼠 5-HT酶联免疫吸附检测试剂盒(eBioscience, USA).仪器包括荧光酶标仪(FLx800).WH-2小型智能环境气候仓(武汉宇信科技开发公司),4160-2型气态甲醛浓度测定仪(美国Interscan公司).
1.3 实验方法
1.3.1 溶液配制 将DEHP与吐温80按照1:1助溶,并使用 0.9%的生理盐水配成浓度为 5,50,500mg/kg的染毒液.将VE用生理盐水配制成浓度100mg/mL,用作保护剂对照.
1.3.2 实验分组方案 分组方案见表1.研究表明,在从事化学、家具和木材生产的甲醛职业接触人群中,甲醛平均浓度一般在 0.20mg/m³以上,眼和呼吸道刺激症状的发生率明显增高.而动物学实验证明,0.5mg/m³甲醛对小鼠存在着直接的神经毒性.同时根据人群调查,居住在装修时间小于2a房屋的未成年人,成年人甲醛的日暴露量平均值分别为 2.67, 2.86mg/m3.此暴露量与大多数研究中有免疫毒性和致癌性等的剂量接近,因此本实验将甲醛的剂量定在0.5~3mg/m3范围内,同时甲醛的剂量反应关系是非线性,所以将甲醛的剂量设为0.5,1.0, 3mg/m3.DEHP主要表现为低剂量慢性毒性,很多国家对其最低毒副作用水平(LOAEL)进行了研究.欧盟和美国基于动物实验确定 DEHP不影响人体健康的极限值(NOAEL)为48mg/(kg·d).有报道指出每天需要通过医疗设施接触DEHP的人群其DEHP的暴露水平是普通环境中成年人暴露量的3 个数量级,通过输血和透析,可能进入人体的 DEHP最大摄入量为4mg/(kg·d).
因此,为了更好的评估DEHP的剂量毒性作用,将最低浓度设为 5mg/(kg·d).根据不影响人体健康的极限值 48mg/(kg·d),将中间浓度设为50mg/(kg·d).通常对邻苯二甲酸酯的毒理学研究采用的是远高于真实环境浓度水平的暴露剂量,为遵循剂量—效应线性关系,有效推导出正确的阈剂量,浓度设置成 10倍关系,最高剂量选取500mg/(kg·d).
对照组29例患者中达到显效标准者15例,有效8例,余者6例无效,对照组临床总有效率为79.31%;观察组29例患者中达到显效标准者16例,有效11例,无效2例,观察组临床总有效率为93.10%;观察组临床总有效率显著高于对照组,差异有统计学意义(P<0.05)。见表1。
小鼠按照不同分组进行不同方式染毒,暴露周期共计 14d. 2~4组甲醛职业暴露每天8h(5+2模式),5~7组每天经口灌胃DEHP染毒液,联合组同时进行甲醛和DEHP染毒,12~14组选用高浓度染毒剂量,用于第2阶段VE保护效应的检测.染毒5d后,用Morris水迷宫检测小鼠学习与记忆能力.
1.3.3 组织匀浆制备 第 15d采用脱颈法处死小鼠,收集小鼠脑组织,置于冰上,用电子天平称重,按 10mL/g添加 PBS(PH=7.5),采用玻璃匀浆器匀浆,制成脑组织匀浆液,然后在 4℃,10000r/min的条件下离心 10min,收集上清液置于-70℃环境中冷冻保存.
1.3.4 各项生物学指标的测定 Morris水迷宫实验:此实验参考文献[7]:Morris水迷宫由水池(直径 120cm,高 50cm,水深 30cm),平台(直径 9cm,高29cm),摄像头,电脑及视频分析系统构成.实验过程中水温始终保持26℃.
定位导航实验:每次实验保持小鼠的先后顺序,将小鼠面像池壁投入水中,并开始录像.记录小鼠在 60s内从不同象限爬上平台的时间,即逃避潜伏期.连续训练7d,如果小鼠在60s内未找到平台,时间记录为60s,测定小鼠空间学习能力.
空间探索实验:第 9d撤去平台,将小鼠投入水迷宫,记录其游泳路线,测定小鼠空间记忆能力.
ROS含量的测定:将匀浆液用 PBS稀释 20倍,DCFH-DA 荧光染料稀释 1000倍.取 100µL匀浆稀释液于酶标板,并加入 100µLDCFH-DA荧光染料染色,避光反应 20min.利用酶标仪在激发波长485nm和发射波长525nm下检测吸光值,根据标准曲线计算出ROS含量.
MDA含量的测定:采用硫代巴比妥酸(TBA)法,MDA 可与 TBA 缩合,形成红色产物,且在532nm 处有最大吸收峰.取 100µL 匀浆液,加入400µL0.6%TBA 溶 液,沸 水 浴 15min,离 心(10000r/min,10min,4℃),取上清液 200µL于酶标板,利用酶标仪检测在 450,532,600nm 波长下的吸光值,按照公式 C=[6.45(OD532nm-OD600nm)-0.56OD450nm]/prot计算出MDA含量(µmol/mg prot).
GSH含量的测定:用还原型谷胱甘肽(GSH)试剂盒来检测脑组织中含量,具体做法按照试剂盒说明书进行操作.
脑组织 TNF-α,IL-β,Caspase-3,8-OHDG 和5-HT含量的测定:采用酶联免疫吸附法(ELISA)检测脑组织中 TNF-α,IL-β,Caspase-3,8-OHDG和5-HT含量.
1.3.5 统计分析 实验数据均采用平均值±标准误表示.Origin 8.1,SPSS20.0统计分析软件对实验数据进行分析,应用单因素方差分析(one-way ANOVA)检验组间均值的差异,之后采用LSD检验进行两两比较,显著水平α定为P<0.05.
2 结果
2.1 甲醛和DEHP染毒对小鼠认知能力的影响

表2 甲醛、DEHP染毒对小鼠逃避潜伏期的影响(s)Table 2 The effect of formaldehyde and DEHP exposure on the escaping latency of mice (s)
表2结果显示,与相应对照组相比,甲醛1,3mg/m3和 DEHP500mg/kg及联合组 1mg/m3+50mg/kg和3mg/m3+500mg/kg小鼠逃避潜伏期延长,差异有统计学意义(P<0.05).与相同剂量联合染毒组比较,中、高剂量甲醛、DEHP单独染毒组小鼠逃避潜伏期缩短,差异有统计学意义(P<0.05);添加 VE 后,FA3.0mg/m3+ VE,DEHP500mg/kg+VE,FA3.0mg/m3+DEHP500mg/kg+VE较同等浓度未添加保护剂组逃避潜伏期明显缩短,差异有统计学意义(P<0.05).表 3结果显示,对照组在目标象限游泳的时间最长和游泳距离占总距离的百分比最高,0.5mg/m3FA其次,而 3.0mg/m3FA+500mg/kgDEHP所占百分比明显减少.图1结果显示,对照组小鼠和低浓度甲醛组具有一定记忆性,游泳轨迹带有很强目的性,游泳轨迹集中于 SE象限,随着染毒剂量的升高,小鼠的游泳轨迹逐渐出现不规则性和无目的性,更多地表现为无效搜索,3.0mg/m3FA+500mg/kgDEHP组表现更明显,无规则性较强,轨迹混乱,不能有效的集中于 SE象限.而阻断剂组较同等剂量染毒组比较游泳轨迹相对规则.

表3 甲醛、DEHP染毒小鼠水迷宫空间探索实验结果Table 3 The space exploration results of formaldehyde and DEHP exposure in water maze
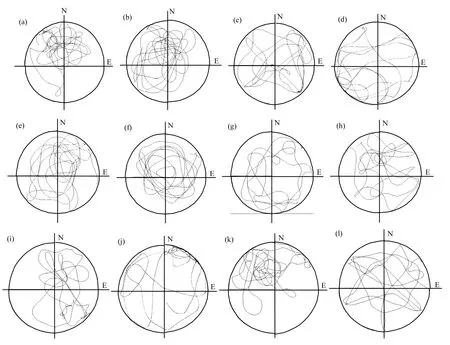

图1 小鼠在空间探索实验中的游泳轨迹Fig.1 The swimming trajectory of mice in water maze experiment
2.2 小鼠的体重变化
实验结束后称量每组小鼠体重,见图2.结果显示,与A组相比,甲醛染毒组和DEHP染毒组体重均有不同程度下降.B和D组小鼠体重下降趋势明显(P<0.05),而C与A组小鼠体重相比没有显著差异.DEHP组随着染毒剂量的增高,体重逐渐下降,G组小鼠和对照组相比呈现出明显的降低(P<0.05).联合染毒组中,H组小鼠体重与A组相比具有显著性差异(P<0.05),J组小鼠体重下降十分明显,和 A组相比具有极显著性(P<0.01).而且较甲醛和DEHP同等剂量单独染毒组,联合组小鼠体重也相对偏低.

图2 甲醛和DEHP单独及联合染毒对小鼠体重的影响Fig.2 Weight changes of mice in single and combined of formaldehyde and DEHP exposure
2.3 脑组织氧化损伤
甲醛和 DEHP暴露后小鼠脑组织中的氧化损伤如图3所示.与 A组相比,1.0mg/m3和3.0mg/m3的甲醛,50mg/kg和500mg/kg的DEHP单独染毒组中,ROS含量均有显著性差异(P<0.01);联合染毒组中,I和J组与A组相比出现极显著性升高,且较同等浓度的单独染毒组也分别出现了显著(P<0.05)和极显著性的升高(P<0.01).与A组相比,中高浓度甲醛和DEHP单独染毒组中MDA的含量有显著性差异.C和D组浓度分别出现显著性(P<0.05)和极显著性的升高(P<0.01),F和G组呈极显著性升高(P<0.01).联合染毒组中只有 J组较同等浓度的单独染毒组具有极显著性,而 I组较同等浓度染毒组则没有显著性.GSH含量在 C,D组分别出现显著性(P<0.05)和极显著性的下降(P<0.01),F和G组呈极显著性下降(P<0.01),联合组中,I和J组呈极显著性下降(P<0.01),I组较C,F组出现显著性下降(P<0.05),J组分别较 D,G 组出现显著性下降(P<0.05)和极显著性下降(P<0.01).
2.4 脑组织炎症,细胞凋亡和神经递质指标的测定结果
图4显示,甲醛和DEHP暴露后脑组织炎症、细胞凋亡和神经递质的变化.由II可知,与A组相比,C和 D分别具有显著性(P<0.05)和极显著性的升高(P<0.01),DEHP组只有G组具有统计学意义(P<0.01).联合组中 TNF-α含量上升更明显,I组与F组相比具有极显著性(P<0.01),J组与D和G 组分别具有显著性(P<0.05)和极显著性(P<0.01).I,III,IV显示,与A组相比,甲醛,DEHP和联合组的中高浓度均出现显著性升高(P<0.05).IV联合组8-OHDG的含量在H,I,J组中较单独染毒组均出现了显著性提高(P<0.05).由V可知,与A组相比,D组和G组具有极显著性(P<0.01),F组出现显著性下降(P<0.05),联合组均出现显著下降,I和J组与同等浓度的甲醛C,D组相比分别具有显著性(P<0.05)和极显著性(P<0.01).

图3 甲醛和DEHP单独及联合染毒对小鼠脑组织氧化损伤的影响Fig.3 The oxidative damage changes in single and combined of formaldehyde and DEHP exposure

图4 甲醛和DEHP单独及联合染毒对小鼠脑组织炎症、细胞凋亡和神经递质的影响Fig.4 The changes of inflammation, apoptosis and 5-HT in single and combined of formaldehyde and DEHP exposure
2.5 添加VE后甲醛和DEHP暴露实验结果

图5 添加VE后小鼠体重的变化Fig.5 Weight changes of mice by adding VE
2.5.1 添加VE后小鼠体重的变化 如图5所示,添加 VE之后,小鼠体重出现了小幅度的增长,N组和J组相比具有显著性(P<0.05).
2.5.2 添加 VE后小鼠脑组织氧化损伤 添加VE之后,脑组织氧化损伤见图6. L组小鼠脑组织中ROS水平较D组有显著性下降(P<0.05),N和J相比具有显著性(P<0.05). L和M组MDA含量出现显著降低(P<0.05),N和J相比出现极显著性降低(P<0.01).L和 M 组 GSH含量出现显著性升高(P<0.05),N和J相比出现极显著性升高(P<0.01).
2.5.3 添加VE后小鼠脑组织炎症、细胞凋亡和神经递质指标的变化 添加 VE之后,脑组织炎症,细胞凋亡和神经递质指标的变化见图7.其中,L和M组IL-1β含量出现显著性下降(P<0.05),N和J相比出现极显著性下降(P<0.01).II中L组小鼠脑组织中TNF-α水平较D组有显著性下降(P<0.05),M组较G组和N组较J组均有显著性(P<0.05).另外,N和J相比caspase-3含量出现极显著性降低(P<0.01).L组小鼠脑组织中 8-OHDG水平较D组有显著性下降(P<0.05),N较J具有极显著性(P<0.01).L组小鼠脑组织中 5-HT含量较D组有显著性升高(P<0.05),N较J也具有显著性(P<0.05).

图6 添加VE后小鼠脑组织氧化损伤的变化Fig.6 The oxidative damage changes in mice by adding VE

图7 添加VE后小鼠脑组织炎症、细胞凋亡和神经递质的变化Fig.7 The changes of inflammation, apoptosis and 5-HT in mice by adding VE
3 讨论
虽然研究认为甲醛是一种神经紊乱因子[15],但是少有事实能够令人信服地证实甲醛具有神经毒性.现有的大多数证据都来自临床调查和流行病学研究,但是在实际的生活环境中甲醛都是与其它的环境污染物共同作用,因此研究两者的联合神经毒性效应及其发生机制具有重要意义.本研究用 Morris水迷宫实验检测甲醛和 DEHP联合染毒对小鼠学习记忆能力的影响,结果显示,在定位导航实验中,各剂量组小鼠逃避潜伏期随训练次数的增加而呈现下降趋势,其中低浓度甲醛组逃避潜伏期的长短和空白对照组相似,甚至出现比空白组还短的情况,推测低浓度的甲醛对神经系统可能有兴奋作用.有研究报道,低浓度的甲醛(10μmol/L)对细胞的生长具有促进作用,高浓度甲醛(62.5μmol/L浓度及以上)抑制细胞的生长[16].中高浓度的甲醛和DEHP染毒组小鼠逃避潜伏期相对较长,联合组更加明显.在空间探索实验中,空白对照组,在目标象限游泳的时间最长和游泳距离占总距离的百分比最高,低浓度甲醛组次之.而联合染毒高剂量组所占百分比明显减少,更多地表现为无效搜索,说明甲醛和DEHP联合染毒对小鼠空间学习记忆能力的影响较单独染毒时更为明显.本实验发现,中高浓度的甲醛和DEHP染毒可使小鼠学习记忆能力下降,高浓度染毒组表现更明显.与甲醛,DEHP单独染毒相比,联合染毒对小鼠学习记忆能力的影响比单独染毒明显.
好氧生物细胞新陈代谢会产生ROS,正常情况下,细胞内的ROS会被细胞内的抗氧化酶和一些非酶类还原性物质清除.在非正常情况下,细胞可能会产生过量的ROS,导致细胞内ROS生成和清除的失衡,这种情况即氧化应激[17].由于中枢神经系统,具有高耗氧量,高脂含量,低抗氧化能力,所以中枢神经系统相对其他组织器官来说对氧化应激更为敏感[18].甲醛可以影响脑组织氧化/抗氧化系统,并最终导致氧化损伤[19].本实验结果显示,中高浓度的甲醛和DEHP单独作用使脑组织中氧化损伤指标GSH,MDA和ROS含量发生了明显的变化,差异具有显著性(P<0.05),高浓度联合染毒组具有极显著性(P<0.01).氧化应激可能导致DNA、蛋白质、脂质等大分子受损,进而引起细胞和组织受损[21-22].根据氧化应激水平的强弱以及对生物体造成损伤的严重程度,氧化应激可以分为多个层次[23].高水平的氧化应激可以导致炎症反应,炎症因子TNF-α和IL-1β的表达量升高,引起线粒体功能紊乱,最终导致细胞凋亡或坏死,以及炎症因子TNF-α和IL-1β的表达量升高[24-25].本实验结果显示中高浓度的甲醛和DEHP染毒组小鼠TNF-α和IL-1β的表达量明显升高(P<0.05),联合组较同等剂量单独染毒组表达量更高.实验中甲醛和DEHP暴露后小鼠脑组织中 Caspase-3活性出现了显著上升,说明甲醛和DEHP可能激活了细胞的凋亡途径.此外,甲醛可以间接对 DNA造成损伤[26].实验中8-OHDG的含量在中高浓度的甲醛和DEHP染毒及联合作用中显著升高.大脑中氧化代谢活动的利率高,抗氧化酶活动低,因此,神经元更容易受到毒性作用或中枢神经系统缺血性事件[20].而由于氧化应激造成了神经细胞的损伤,凋亡或坏死,可能会影响到神经递质5-HT的合成与释放.本实验中神经递质 5-HT的含量随着染毒剂量的增加及联合作用呈现出明显的下降趋势,在高浓度联合组小鼠脑组织中含量最低,这与水迷宫的行为学测试一致,进一步说明甲醛和DEHP联合染毒可能会对小鼠的学习记忆能力产生影响.同时有研究指出,DEHP可以干扰神经系统两大类细胞(神经元和神经胶质细胞)的增殖分化过程,提示神经递质含量的下降可能与此相关.可以给进一步研究神经毒性的分子机制提供启发.实验结果显示,甲醛和DEHP联合作用对小鼠脑组织神经毒性作用更显著,提示甲醛和DEHP具有协同作用.推测氧化应激可能导致形成 DNA损伤,进而引起细胞毒性,造成细胞和组织受损,发生炎症反应,引起细胞凋亡或坏死.因此氧化应激可能是甲醛和 DEHP导致神经毒性的机制之一.VE具有脂溶性,对氧敏感,是最主要的抗氧化剂之一,对由甲醛引起的脑组织氧化损伤有很好的修复作用[27].因此本实验选用 VE作为氧化应激的阻断剂,探究VE能否对甲醛和DEHP暴露中的小鼠脑组织进行保护以及保护机制.
实验结果显示,添加阻断剂之后,小鼠由于甲醛和DEHP暴露产生的损伤得到了有效的缓解.阻断组小鼠与暴露组相比,表现出逃逸潜伏期缩短和 SE象限滞留时间延长,说明小鼠的认知能力有了恢复.同时小鼠氧化应激水平(ROS,MDA水平下降,GSH升高),炎症因子(TNF-α和IL-1β下降),细胞凋亡水平(Caspase-3活性下降),神经递质(5-HT含量升高),说明VE对脑组织损伤进行了有效的保护.
4 结语
本实验结果显示,中高浓度甲醛(1.0mg/m³和3.0mg/m³),DEHP(500mg/kg) 以及联合组(1.0mg/m³+50mg/kg 和 3.0mg/m³+500mg/kg)可对小鼠脑组织产生神经毒性,造成小鼠学习记忆能力下降.高浓度甲醛(3.0mg/m³)和 DEHP(500mg/kg)可显著性加重脑组织氧化损伤(P<0.05),炎症反应,细胞凋亡和神经递质含量的下降下降,进一步说明甲醛和DEHP暴露具有神经毒性.而联合染毒较单独染毒作用更明显,这说明两者联合染毒对神经毒性具有协同作用.同时 VE在一定程度上可以通过降低氧化应激水平减少脑组织损伤.
[1] Tang X, Bai Y, Duong A, et al. Formaldehyde in China:Production, consumption, exposure levels, and health effects [J].Environment International, 2009,35(8):1210-1224.
[2] Sul D, Kim H, Oh E, et al. Gene expression profiling in lung tissues from rats exposed to formaldehyde [J]. Archives of Toxicology, 2007,81(8):589-597.
[3] 李 慧,张玉超,柯玉洁,等.甲醛对原癌基因c-myc, MDM2及抑癌基因p53的影响 [J]. 中国环境科学, 2013,33(8):1483-1486.
[4] 柯玉洁,秦晓丹,李 兰,等.甲醛对小鼠骨髓组织的毒性作用[J]. 中国环境科学, 2012,32(6):1129-1133.
[5] Kerns W, Pavkov K, Donofrio D, et al. Carcinogenicity of formaldehyde in rats and mice after long-term inhalation exposure [J]. Cancer research, 1983,43(9):4382-4392.
[6] Arts J, Rennen M, De Heer C. Inhaled formaldehyde: evaluation of sensory irritation in relation to carcinogenicity [J]. Regulatory Toxicology and Pharmacology, 2006,44(2):144-160.
[7] 肖 芸,陈钧强,周华仕,等.挥发性有机化合物甲醛,苯联合细胞毒性作用 [J]. 中国公共卫生, 2006,22(9):1095-1096.
[8] 任 仁.警惕邻苯二甲酸酯污染 [J]. 大学化学, 2003,18(6):33-36.
[9] Takashima K, Ito Y, Gonzalez F, et al. Different mechanisms of DEHP-induced hepatocellular adenoma tumorigenesis in wild-type and Pparα-null mice [J]. Journal of Occupational Health, 2008,50(2):169-180.
[10] Manikkam M, Tracey R, Guerrero-Bosagna C, et al. Plastics derived endocrine disruptors (BPA, DEHP and DBP) induce epigenetic transgenerational inheritance of obesity, reproductive disease and sperm epimutations [J]. PloS One, 2013,8(1):583-587.
[11] Lu X, Liu Q, Jin C, et al. Study on neurotoxicity and lipid peroxidation of brain after exposure to DEHP in rats] [J]. Journal of Shenyang Medical College, 2008,4(2):198-201.
[12] Pitten F, Kramer A, Herrmann K, et al. Formaldehyde neurotoxicity in animal experiments [J]. Pathology-Research and Practice, 2000,196(3):193-198.
[13] Malek F, Möritz K, Fanghänel J. Effects of a single inhalative exposure to formaldehyde on the open field behavior of mice [J].International Journal of Hygiene and Environmental Health,2004,207(2):151-158.
[14] 程静菲,尚 帅,何贵波,等.DEHP诱导的氧化应激致小鼠学习记忆能力的下降和维生素 E的保护作用 [J]. 医学研究杂志,2012,12(5):24-28.
[15] Act C E P. Priority substances list assessment report:formaldehyde [R]. Environment Canada, Health Canada, 2007.
[16] 柯玉洁.甲醛暴露对离体细胞活性及其内源性甲醛含量变化的影响 [J]. 武汉:华中师范大学学报, 2013.
[17] 李肖云,兰希发.粒细胞集落刺激因子对血管性痴呆大鼠海马神经细胞凋亡的影响 [J]. 中国组织工程研究与临床康复, 2011,15(27):5044-5047.
[18] Halliwell B. Oxidative stress and neurodegeneration: where are we now? [J]. Journal of Neurochemistry, 2006,97(6):1634-1658.
[19] Reviews of environmental contamination and toxicology [M].Springer, 2012.
[20] Irmak M, Fadillioglu E, Sogut S, et al. Effects of caffeic acid phenethyl ester and alpha- tocopherol on reperfusion injury in rat brain [J]. Cell Biochemistry and Function, 2003,21(3):283-289.
[21] Das M, Babu K, Reddy N, et al. Oxidative damage of plasma proteins and lipids in epidemic dropsy patients: alterations in antioxidant status [J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2005,1722(2):209-217.
[22] Gałażyn-Sidorczuk M, Brzóska M, Jurczuk M, et al. Oxidative damage to proteins and DNA in rats exposed to cadmium and/or ethanol [J]. Chemico-Biological Interactions, 2009,180(1):31-38.
[23] Xiao G, Wang M, Li N, et al. Use of proteomics to demonstrate a hierarchical oxidative stress response to diesel exhaust particle chemicals in a macrophage cell line [J]. J. Biol. Chem., 2003,278(50):50781-50790.
[24] Brown D, Donaldson K, Borm P, et al. Calcium and ROS-mediated activation of transcription factors and TNF-α cytokine gene expression in macrophages exposed to ultrafine particles [J].American Journal of Physiology-Lung Cellular and Molecular Physiology, 2004,286(2):L344-L353.
[25] Shankar E, Vykhovanets E, Vykhovanets O, et al. High- fat diet activates pro -inflammatory response in the prostate through association of Stat-3and NF-κB [J]. The Prostate, 2012,72(3):233-243.
[26] Metz B, Kersten G, Hoogerhout P, et al. Identification of formaldehyde-induced modifications in proteins reactions with model peptides [J]. Journal of Biological Chemistry, 2004,279(8):6235-6243.
[27] Gurel A, Coskun O, Armutcu F, et al. Vitamin E against oxidative damage caused by formaldehyde in frontal cortex and hippocampus: biochemical and histological studies [J]. Journal of Chemical Neuroanatomy, 2005,29(3):173-178.
