太湖蓝藻聚集区沉积物硫形态的时空变异特征
2018-01-09朱瑾灿吴雨琛尹洪斌中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室江苏南京210008中国科学院大学北京100049江南大学食品学院江苏无锡214122
朱瑾灿 ,吴雨琛 ,尹洪斌 (1.中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏 南京210008;2.中国科学院大学,北京 100049;.江南大学食品学院,江苏 无锡 214122)
“黑水团”又称湖泛,是由于蓝藻大量堆积,在较高的温度和一定水平的风浪扰动下,藻类聚集、腐烂、沉降,厌氧微生物和底泥相互作用引起的[1].近几年来,太湖、巢湖、滇池等富营养化湖泊均频繁的出现过黑水团事件.在黑水团发生过程中,水体变黑且伴随着刺激性异味,对城市环境造成严重的影响,不仅损害城市容貌,影响周边居民的生活环境,危害人体健康,还会破坏复杂的湖泊生态系统,污染水源,加剧水资源的危机,引起人们对“黑水团”问题的广泛关注.
为应对“黑水团”现象引发的环境问题,相关学者已进行了初步的研究探讨.通过实时监测太湖近年来发生的湖泛现象[2],发现湖泛产生的主要原因有湖体内藻类死亡、污染负荷增大、气象变化[3]等因素.对美国一发生黑臭的湖泊进行研究[4],认为还原态硫(S2-)和铁(Fe2+)生成的铁硫化物是造成湖水变黑的主要原因.湖泛发生时的主要致臭物质是挥发性硫化物(VSC),例如硫化氢(H2S)、甲硫醇(MeSH)、二甲基三硫醚(DMTS)等,且通过一系列监测结果表明,这些致臭物质中以有机硫化物为主[5](VOCs).可见,硫作为沉积物-水界面的敏感性元素,当界面处氧化还原条件改变时,不同形态的硫化物之间相互转化,与黑水团形成过程中的黑臭现象密切相关.
一系列室内模拟实验表明, 湖泛的发生是底泥与蓝藻共同作用的结果[6].湖泛发生所必须的铁硫主要来源于底泥,底泥中有机碳和铁含量会影响还原性无机硫的形成[7-8].蓝藻聚集是湖泛发生的主要诱因[9],藻类爆发时沉积物内铁硫等敏感元素会从原有高价态还原为低价态,并通过间隙水向上覆水体中释放,其中间隙水内二价硫最高可到达未加藻处理的56倍[1],同时产生大量的挥发性有机硫化物[10].但就目前而言,关于蓝藻水华堆积对沉积物内各种形态硫时空变化的影响研究较少,尤其是黑水区沉积物内硫形态组分的变化鲜有涉及.
沉积物中硫元素以复杂的有机和无机形式存在,无机硫主要由酸可挥发性硫(AVS)、黄铁矿硫(Pyrite-S)、单质硫(ES)和 SO42-组成,有机硫组成复杂,主要是酯硫和碳基硫[11].硫形态分析技术一直在不断地发展和完善,目前国内外研究者普遍接受并使用化学连续提取法[12],依次提取沉积物中 AVS、Pyrite-S、ES、富里酸硫、腐殖酸硫等硫形态.化学分级法可以获得不同硫形态的定量信息,但由于有机硫具有多样性和复杂性,只能粗略计算有机硫中腐殖质硫的含量,沉积物中还会残留一部分不能被碱溶液提取的有机硫,与实际有机硫含量存在一定误差,且不能提供有机硫的化学组成及氧化态的信息.同步辐射X射线近边吸收结构(XANES)可以同时分析样品中各种硫价态的相对含量,灵敏度高,可以做到对样品的无损分析[13],近些年来得到广泛的应用.
本研究根据近几年来太湖蓝藻爆发的水域,以太湖蓝藻聚集区(聚藻区)和非聚藻区为研究对象,并在区域内各选择一处采样点,通过对研究区域进行季节性采样,结合使用微电极分析技术、硫形态连续提取技术以及 XANES分析技术,对沉积物中微界面环境、硫化学结合态以及分子结合态进行分析提取,定量测定沉积物中各种还原性硫含量,分析硫形态组分的变化特征与规律,揭示蓝藻聚集对沉积物中硫元素转化的影响,为进一步揭示黑水团现象发生的机理提供理论依据.
1 材料与方法
1.1 样品采集与处理样品
本文以竺山湾为聚藻区研究对象.竺山湾是太湖北部的一个典型聚藻区,每年蓝藻爆发季节均有大量藻类聚集[14].选择太湖焦山区域为非聚藻区,该区域位于太湖湖心,污染相对较少,蓝藻聚集现象发生概率较小.于2014年4月和8月[15]分别在竺山湾(31°18′26″N;119°57′1″E)和焦山(31°16′37″N;120°8′1″E)使用重力采样器(Rigio,Japan)各采集柱状沉积物样品 3根.样品采集后于 4℃保存并运回实验室.按 0~2,2~4,4~6,6~8,8~10,10~15,15~20,20~25cm 间隙对沉积物进行分层,分层后的样品置于4℃冰箱中保存待分析.
1.2 沉积物微界面环境以及硫形态提取
在沉积物采集后 4h内,采用微电极系统(MM-METER,Unisense),以 100μm 为步长,选取外径为25μm的Eh和pH电极,测定采样柱内沉积物-水界面处的Eh和pH值.沉积物Fe2+的含量采用厌氧草酸法提取,通过 Ferrozine 比色法测定[16].向提取的上清液中加入 10%的盐酸羟胺溶液,可将 Fe3+还原为 Fe2+,Ferrozine 比色后可得TFe的含量,Fe3+的含量则取TFe与Fe2+的差值.
通过冷扩散法[17]对沉积物中还原性无机硫(RIS)进行分析,采用3步法逐步将各个形态的还原性无机硫(RIS)转化为硫化锌沉淀,再通过用亚甲基兰比色法测定,可分别得到单质硫(ES)、酸可挥发性硫(AVS)和黄铁矿硫(Pyrite-S)的含量,对这3种硫的提取效率均可达到95%以上[17].
沉积物有机硫在3步提取去除AVS、ES及硫酸盐后,通过0.1mol/L NaOH提取,碱提取有机硫也称为腐殖质硫.腐殖质硫是沉积物中总有机硫的主要存在形式[12],因此被认为可近似代表沉积物中总有机硫的含量.将滤液酸化并静置沉淀,所得的沉淀为腐殖酸硫(HS),滤液为富里酸硫(FS).腐殖酸沉淀烘干、研磨后加入艾氏卡试剂煅烧,将有机硫转化为 SO42-;富里酸清液用30%H2O2氧化转化为 SO42-,将 SO42-沉淀为BaSO4,用重量法测定腐殖酸硫 HS和富里酸硫FS的含量[11].
1.3 沉积物内硫形态同步辐射分析(XANES)
将从太湖聚藻区和非聚藻区取回的柱状沉积物按上述间距分层,分层后的沉积物样品放入密封的塑料袋中,冷冻干燥后取出,研磨并过 100目筛,在北京同步辐射装置 4B7A中能站采用荧光模式采集硫的K边XANES谱.试验时同步辐射储能环能量2.5GeV,电流强度为80~180mA,采用 Si(Ⅲ)平面双晶单色器获得 X射线.试验选取硫化亚铁(FeS)、黄铁矿(FeS2)、硫片(S)、蛋氨酸、L-半胱氨酸、亚硫酸钠(Na2SO3)、硫酸钠(Na2SO4)作为标样.图1为标样化合物中硫的K边XANES图谱,作为识别底泥样品中不同形态硫化合物的依据.用Athena软件对硫的K边XANES谱进行背景扣除和归一化,并对图谱进行拟合分析得到硫的形态和相对含量.

图1 标样硫的K边XANES图谱Fig.1 Sulfur K-edge spectra of sulfur standard compounds
1.4 数据质量与分析方法
本文使用 SPSS19.0对数据进行统计分析,利用皮尔逊相关系数分析各变量之间的相关性,采用独立样本 T检验分析两组数据之间的差异显著性.绘图制作使用Origin8.5,在绘制的垂直剖面图中,0cm处为水泥界面,以负值代表上覆水的距离,正值代表沉积物的深度.
2 结果与讨论
2.1 聚藻区沉积物中Eh、pH值的变化
图2是非聚藻区和聚藻区4月、8月表层沉积物的Eh、pH值.沉积物内Eh值随着深度的增加而下降,除了非聚藻区4月份外, Eh值均开始时变化缓慢,到达1.25cm处Eh值显著降低.非聚藻区4月表层沉积物的Eh值大于400mV,明显高于聚藻区4月份的Eh水平.聚藻区8月水土界面处的Eh值为406.79mV,随着沉积物深度增加到2cm,Eh值也随着降低为137.29mV.而非聚藻区8月表层沉积物的Eh值范围为302.16~443.86mV. Eh值表征着沉积物的氧化还原性,是评价沉积环境良好的重要指标.沉积物内Fe、S等多价态元素的转化与Eh值的高低密切相关[18-19].
与非聚藻区相比,聚藻区 Eh值明显偏低(P<0.01).蓝藻爆发会大量消耗沉积物内溶氧,沉积物内还原性物质增多,使得聚藻区沉积物 Eh值降低.4月份时聚藻区 Eh值低于非聚藻区,说明聚藻区由于多次爆发蓝藻,使得沉积物中有机质含量增加,有机质的降解使得沉积物内 Eh值常年较低.
有研究表明,当Eh<100mV时,才会发生硫酸盐还原作用[20].聚藻区表层沉积物的Eh值不利于SO42-还原所需的 Eh值,但相比非聚藻区还原性增强,且随着深度的增加,会加强沉积物内的还原性环境,从而使得以硫酸盐还原菌(SRB)为代表的微生物更趋向于利用 SO42-作为电子受体,SO42-的还原作用更强[21].
图2c、d是两处表层沉积物的pH值,聚藻区和非聚藻区的pH剖面图相似,从沉积物-水界面处随着深度增加pH值减小,在0.75cm左右达到最小值.从沉积物深度0.75cm处往下pH开始上升,这是因为在水土表面附近沉积物中有机质会降解产生 CO2,同时产生小分子酸,使得 pH值降低,随后由于与有机物和硫氧化物耦合的铁锰氧化物还原性溶解,pH值升高[22],但 8月聚藻区的pH值在1.25cm处又出现下降趋势.
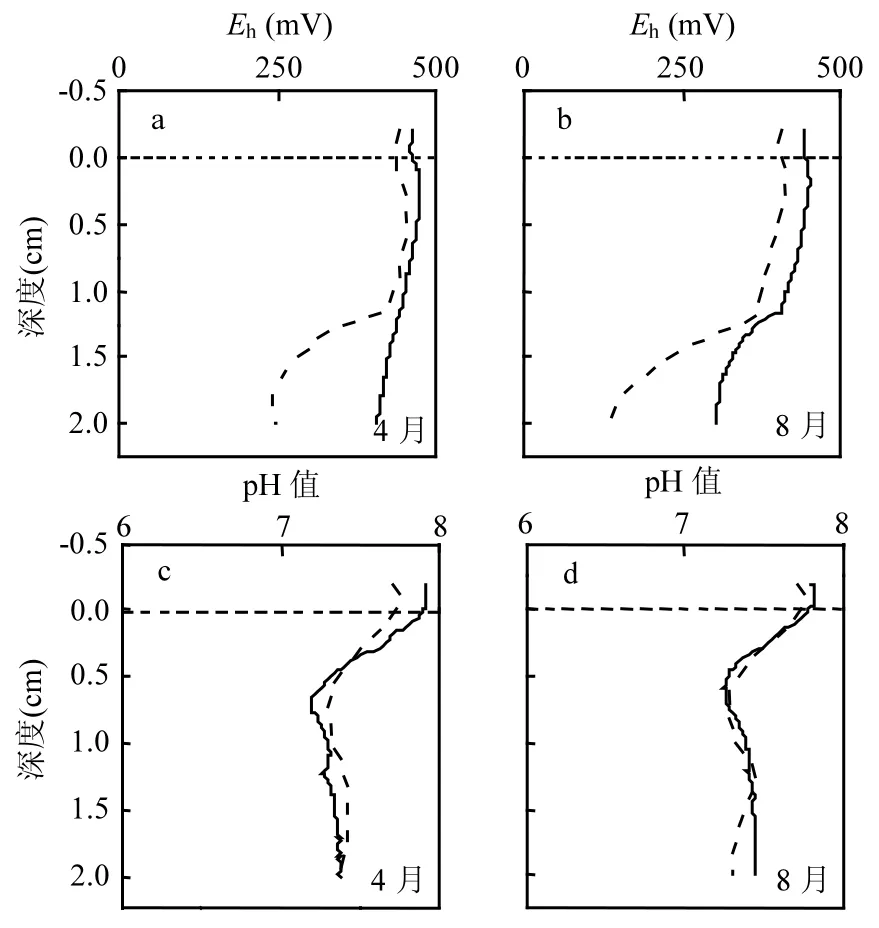
图2 聚藻区和非聚藻区4、8月表层沉积物的Eh、pH值Fig.2 Eh、pH of surface sediments of algae accumulation and non algae accumulation zones in April and August

2.2 聚藻区沉积物中铁形态的变化
沉积物中Fe的形态与致黑物质FeS的形成有密切关系,Fe2+与 Fe3+之间的溶解平衡受沉积物内氧化还原条件的影响.用草酸提取的铁主要包括无定形态铁(FeS、FeS2、FeCO3、Fe3O4)及弱结晶态铁氧化物(Fe3+)[23].非聚藻区和聚藻区Fe2+含量季节性变化不明显(图3),但聚藻区 Fe2+含量是非聚藻区的1.3倍(P<0.05).这主要是因为聚藻区外源性污染的排入以及蓝藻聚集引起沉积物内还原性增强,Fe3+会还原形成 Fe2+.非聚藻区4月和8月Fe3+含量变化不大,都在7mg/g左右.聚藻区4月Fe3+浓度范围为8.98 ~ 10.93mg/g,但 8月时 Fe3+含量增加了近一倍.这是因为藻类的大量聚集形成一个强还原环境,沉积物中 Fe2+会诱导弱结晶态 Fe3+氧化物转化为无定形态铁,使可被草酸提取的 Fe3+氧化物含量大大增加.另外,冯紫艳等[21]研究发现,随蓝藻的聚集沉降,铁还原细菌的密度也会逐渐降低,Fe3+向 Fe2+转化的能力也随之减弱.

图3 聚藻区和非聚藻区4、8月沉积物内Fe2+、Fe3+含量剖面Fig.3 Profiles of Fe2+、Fe3+ content in sediments of algae accumulation and non algae accumulation zones in April and August

2.3 聚藻区沉积物中有机碳含量的变化特征
图4d为聚藻区和非聚藻区4、8月沉积物内有机碳含量剖面图.实验结果表明,沉积物内有机碳含量随着深度增加逐渐减少,变化范围均在 1.8%~3.4%之间.4~8月非聚藻区沉积物内有机碳平均含量相对减少了 17.4%,聚藻区增加了11.68%.这主要是非聚藻区9月温度增加带来了有机碳降解增多,但短短几个月有机碳不可能降解了17%左右,可能是4、8月采样的地点之间存在一定的偏差.聚藻区8月由于蓝藻的聚集死亡沉降,补充了大量的有机碳源,有机碳含量反而上升,聚藻区有机碳含量剖面图相对非聚藻区更为平滑,这是因为聚藻区内有机质主要来源于沉降堆积到沉积物表面的蓝藻逐渐向沉积物深处渗透.
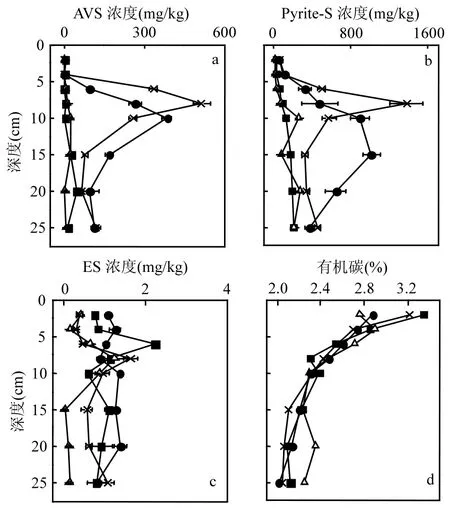
图4 聚藻区和非聚藻区4、8月沉积物内AVS、Pyrite-S、ES、有机碳浓度剖面Fig.4 Profiles of reduced inorgainc sulfur, organic carbon content in sediments of algae accumulation and non algae accumulation zones in April and August

2.4 聚藻区沉积物中无机硫形态变化
酸可挥发性硫(AVS)是同一类型复杂硫化物的混合物,但并不等同于FeS,分别包括FeS晶簇、四方硫铁矿(Fe3S4)、马基诺矿等[24].由于AVS的组成主要是铁硫化物,易受环境中氧化还原条件的影响[25],是沉积物中铁硫元素迁移转化的重要指标.图4a是非聚藻区和聚藻区4、8月不同深度沉积物中AVS的含量分布,聚藻区的AVS浓度与非聚藻区差异显著(P<0.01).在沉积物表层处AVS的浓度都比较低,这是由于表层沉积物处Eh值较高,且常有生物扰动和底泥再悬浮现象,AVS难以大量累积.随着深度增加,AVS含量逐渐增加,到达10cm左右时,由于SO42-的渗透深度有限,可被还原的 SO42-含量减少,或可能是活性有机质的含量降低,FeS向FeS2转化率也增加[26],AVS含量也随之减少.非聚藻区8月AVS浓度与4月相比略低,主要因为8月温度升高,水体内溶氧减少,沉积物的还原性增加,低 Eh的环境条件会更利于AVS向Pyrite-S转化,由于非聚藻区属于非污染区,没有外界硫源污染, AVS的前体SO42-浓度有一定的限制,同时AVS向Pyrite-S转化的速率增快,所以非聚藻区8月AVS含量表现的比4月份略低.聚藻区的 AVS平均浓度与非聚藻区的12.73倍,这是由于聚藻区蓝藻聚集形成的厌氧环境,导致硫还原细菌(SRB)大量繁殖,还原SO42-还原形成HS-,更容易形成酸可挥发性硫.
黄铁矿(FeS2)是沉积物中最稳定的铁硫化合物,是还原性环境中铁硫的最终积累形式和保存形态[27].沉积物内 Pyrite-S的变化如图4b所示.4~8月,非聚藻区沉积物中 Pyrite-S含量增加了10.62%,但聚藻区沉积物内Pyrite-S含量减少了4.89%.Pyrite-S的垂直分布与AVS的浓度剖面图相似,均表现为先增加后降低,且聚藻区4、8月Pyrite-S峰值出现的深度与AVS峰值出现的深度相同,这说明沉积物中FeS是黄铁矿形成的主要前体.为了更好的评价AVS向Pyrite-S转化的效率,通过计算出沉积物中AVS与Pyrite-S的比值.Gagnon 等[28]认为,当 AVS/Pyrite-S<0.3时,AVS可以有效的向Pyrite-S转化.图5a为沉积物样品中AVS/Pyrite-S的比值分布.通过图5a可知,非聚藻区4、8月沉积物中的AVS/Pyrite-S均小于 0.3,证明了非聚藻区的 AVS可以有效的转变为 Pyrite-S,但由于 8月温度升高形成的低还原环境,AVS向Pyrite-S转化的效率增强,所以非聚藻区8月相对4月Pyrite-S含量增加,AVS含量减少.图5a中聚藻区8月的AVS/Pyrite-S比值大于聚藻区4月,接近0.3或大于0.3,说明聚藻区8月AVS向Pyrite-S的转化效率不高,导致聚藻区4~ 8月Pyrite-S含量减少了4.89%,这可能是ES的含量限制了AVS向Pyrite-S转化.
聚藻区和非聚藻区沉积物内 ES浓度都在1mg/kg左右,聚藻区4月的ES浓度值最大,同一区域4月的ES浓度相对8月份偏高.图5b是单质硫占总还原性无机硫的比例,ES含量较低,所占比例均不大于4%.ES主要是沉积物内硫化物被 O2、NO3、Fe3+、Mn4+等氧化剂不完全氧化而生成[29].非聚藻区4月ES所占比例最高,这是因为非聚藻区未受污染,沉积物内 Eh值和氧化剂含量(O2)高,O2、Fe3+等氧化剂氧化硫化物生成的ES相对较多.根据表1相关性分析,说明单质硫是黄铁矿形成的重要的中间态硫,沉积物内的FeS可以与单质硫(S0)反应,生成更稳定的黄铁矿硫(FeS2),聚藻区8月的ES/RIS比值最低,会使沉积物内 AVS向 Pyrite-S的转化受到抑制,解释了上文中聚藻区8月Pyrite-S浓度相对聚藻区4月减少.
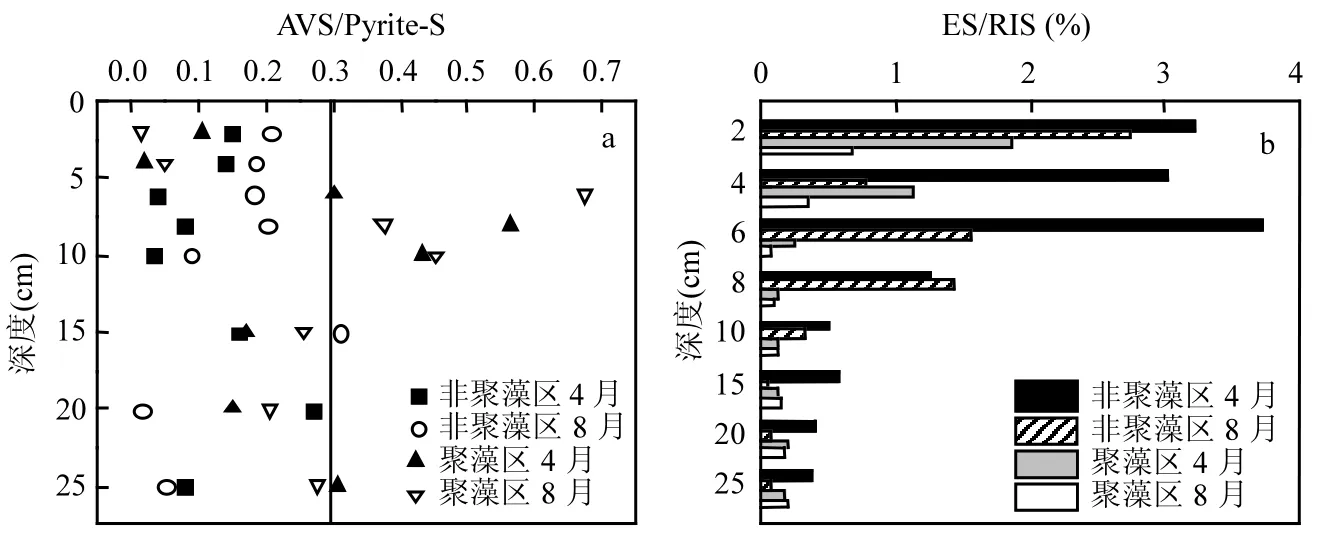
图5 非聚藻区和聚藻区4、8月不同深度AVS与Pyrite-S比值及ES占无机硫的比例Fig.5 Values of AVS/Pyrite-S,ES/RIS in sediments of algae accumulation and non algae accumulation zones in April and August

图6 XANES测定聚藻区和非聚藻区4、8月沉积物内FeS、FeS2、ES的百分比含量Fig.6 Percentage of FeS, FeS2, ES in sediments of algae accumulation and non algae accumulation zones in April and August by XANES

图7 XANES测定非聚藻区、聚藻区4、8月沉积物内SO42-的百分比含量Fig.7 Percentage of SO42- in sediments of algal-loaded and non algal-loaded zones in April and August
S-XANES分析结果表明(图6),聚藻区沉积物内FeS、FeS2和ES的平均百分比含量明显高于非聚藻区(P<0.01).从沉积物深度 10cm 处往下,FeS的百分比含量逐渐升高,非聚藻区4月时FeS的百分比含量趋于零,到 8月时大幅增加,聚藻区4~ 8月时沉积物内FeS的百分比含量变化不大.但经化学提取法测得AVS浓度从10cm处逐渐下降,且非聚藻区8月AVS浓度与4月相比略低,结合 2种方法分析表明,由于沉积物深处的强还原性环境,相比于其他类型的 AVS,SO42-会优先被还原形成 FeS,甚至其他形态的AVS转化为FeS,更有利于AVS向Pyrite-S的转化.4~8月非聚藻区和聚藻区FeS2的平均百分比含量都增加了近1.5倍,但图4b中聚藻区沉积物内Pyrite-S含量减少了4.89%,这可能是聚藻形成的厌氧环境中,SO42-还原形成的 H2S气体会向上覆水迁移并逸散到空气中,导致聚藻区8月时沉积物中硫总量减少,FeS2的百分比含量会有一定的增加.非聚藻区8月ES的平均百分比含量最少,只有3.29%,聚藻区4月ES的平均百分比含量最高,可达到 18.02%.随着深度增加,沉积物内 ES的百分比含量均先增加后降低.虽然经这两种方法获得的硫定量数据具有一定的差异,但所反映的蓝藻聚集时沉积物中各种无机硫形态组成及变化趋势总体上较为一致,在蓝藻聚集形成的还原性环境中,沉积物中硫酸盐还原生成酸可挥发性硫、黄铁矿硫等还原性硫化物.
除了还原性无机硫外,还有氧化性无机硫SO42-.图7是经 XANES分析得到的 SO42-百分比浓度.正常的太湖非聚藻区 SO42-浓度可达总硫50%,8月时非聚藻区因为温度升高溶氧减少引起了 SO42-的部分还原, SO42-浓度略有降低.聚藻区4月SO42-因为长期的外源污染处于较高的水平,8月时 SO42-浓度有了明显的下降,这是蓝藻生长需要从环境中吸收大量的 SO42-营养盐,或是蓝藻沉降后引起的还原环境,硫还原细菌(SRB)会大量繁殖并利用 SO42-生成酸可挥发性硫.
2.5 聚藻区沉积物中有机硫变化研究
图8为沉积物内富里酸硫(FS)和腐殖质硫(FS+HS)浓度剖面图,聚藻区沉积物内腐殖质硫(FS+HS)含量与非聚藻区差异显著(P<0.01).腐殖质硫在深度上表现为先降低后增加,在 10~25cm处浓度几乎没有变化.FS的浓度范围为131.37~1041.38mg/kg,总腐殖质硫(FS+HS)的浓度范围大致为 273.15~1849.12mg/kg.可以看出,沉积物中 FS的浓度远高于腐殖酸硫(HS),腐殖质硫(FS+HS)的浓度主要由富里酸硫(FS)的浓度决定.聚藻区沉积物内腐殖质硫(FS+HS)的平均含量是非聚藻区的 1.53倍.这是由于聚藻区多次发生蓝藻聚集,蓝藻残体沉降输入沉积物内,使聚藻区的有机硫含量大大增加.4~8月非聚藻区和聚藻区沉积物内腐殖质硫(FS+HS)各层平均含量均增加,非聚藻区增加了 16.99%,聚藻区增加了 27.38%.这主要是温度上升导致生物繁殖速度加快,聚藻区由于蓝藻的聚集沉降补充了有机硫,使沉积物内腐殖质硫(FS+HS)含量增加的更快.
图9是XANES测得的沉积物内3种有机硫百分比含量,硫醚、硫醇和磺酸盐.其中硫醚和硫醇是还原性有机硫,磺酸盐是氧化性有机硫.非聚藻区和聚藻区沉积物 4月时硫醚的相对含量都较低,8月时均明显增高.硫醇和磺酸盐的相对含量在 10~25cm 处都变化不大.在非聚藻区 4、8月和聚藻区 4月的沉积物中,硫醇的相对含量都较接近,大约在15%左右,聚藻区8月沉积物表层处硫醇含量可达到38%.除了非聚藻区4月磺酸盐相对含量达到30%,非聚藻区4月和聚藻区4、8月磺酸盐相对含量都在 12%左右.因此,非聚藻区 4月沉积物内硫醚相对含量较低,硫醇和磺酸盐是有机硫的主要组分.非聚藻区4~ 8月时,沉积物内硫醇含量大致不变,但硫醚含量大量增加,磺酸盐相对含量减少,这可能是溶氧降低引起有机质的硫化作用.聚藻区由于多次爆发过蓝藻,4月时虽无蓝藻爆发,但相对非聚藻区沉积物内磺酸盐的含量较低,硫醇含量较高.聚藻区8月沉积物表层 2~6cm处硫醚和硫醇的相对含量均高于非聚藻区,并随着深度增加逐渐降低,但是磺酸盐含量相比于非聚藻区较低.说明蓝藻聚集沉降在沉积物表面,会使表层沉积物的有机硫含量增加,并以还原态硫化物为主.

图8 聚藻区和非聚藻区4、8月沉积物内FS、HS+FS浓度剖面Fig.8 Profiles of FS,FS+HS in sediments of algae accumulation and non algae accumulation zones in April and August

图9 XANES测定聚藻区和非聚藻区4、8月沉积物内硫醇、硫醚、磺酸盐的百分比含量Fig.9 Percentage of mercaptan,thioether,sulfonate in sediments of algae accumulation and non algae accumulation zones in April and August
2.6 蓝藻聚集过程中硫指标相关性分析
为了进一步说明太湖发生藻类聚集时硫不同形态之间的相互关系,对聚藻区8月的S、Fe、有机碳进行了相关性分析.根据相关性分析结果(表1).Pyrite-S与 AVS、ES呈极显著正相关(P<0.01),说明Pyrite-S的形成与AVS和ES密切相关,在发生蓝藻聚集时,由于藻类繁殖与降解形成的强还原环境,AVS作为黄铁矿生成的主要前体,ES作为转化所必须的中间反应物,形成还原环境中还原性铁硫的最终积累形式黄铁矿.有机碳与腐殖质硫(FS+HS)之间呈极显著正相关(P<0.01),还与腐殖酸硫(FS)呈显著相关性(P<0.05),说明聚藻区内沉积物中有机碳与有机硫都主要来源于蓝藻死亡沉降.

表1 聚藻区8月蓝藻聚集过程中各指标相关性分析Table 1 Correlation analysis of each index in sediments of algae accumulation zones in August
3 结论
3.1 湖泊内蓝藻大量聚集时,表层沉积物的 Eh值显著降低,硫酸盐还原生成酸可挥发性硫、黄铁矿硫等还原性硫化物,聚藻区的AVS、Pyrite-S平均浓度分别是非聚藻区的12.73、4.16倍,FeS、FeS2百分比含量也明显高于非聚藻区.由于外源性污染和蓝藻聚集,聚藻区 Fe2+含量是非聚藻区的1.3倍,致黑物质FeS的大量形成,使湖泊水体环境急剧恶化,出现黑水团现象.
3.2 蓝藻聚集沉降到沉积物表面,会带来大量有机碳和有机硫,导致聚藻区的腐殖质硫平均含量是非聚藻区的1.53倍.沉积物中硫醇、硫醚等还原态有机硫含量增加,加剧水体黑臭的发生.
3.3 聚藻区多次爆发蓝藻,在4月蓝藻爆发之前沉积物内部仍处于弱还原环境,使沉积物内还原性硫化物含量常年较高,这对湖泊水体生态造成了严重的危害.
3.4 因此,在湖泊水体黑臭事件中,应加大对聚藻区沉积物的治理,改善沉积物内黑臭厌氧环境,对沉积物中的还原性硫组分进行有效控制.
[1] 刘国锋,范成新,张 雷,等.藻源性黑水团环境效应Ⅲ:对水-沉积物界面处 Fe-S-P循环的影响 [J]. 中国环境科学, 2014,(12):3199-3206.
[2] 陆桂华,马 倩.太湖水域“湖泛”及其成因研究 [J]. 水科学进展, 2009,20(3):438-442.
[3] Chen Y Y, Liu Q Q. On the horizontal distribution of algal-bloom in Chaohu Lake and its formation process [J]. Acta Mechanica Sinica, 2014,30(5):656-666.
[4] Duval B, Ludlam S D. The Black Water Chemocline of Meromictic Lower Mystic Lake, Massachusetts, U.S.A. [J].International Review of Hydrobiology, 2015,86(2):165-181.
[5] Zhang X J, Chen C, Ding J Q, et al. The 2007 water crisis in Wuxi, China: analysis of the origin [J]. Journal of Hazardous Materials, 2010,182(1-3):130.
[6] Yin H B, Wu Y C. Factors Affecting the Production of Volatile Organic Sulfur Compounds (VOSCs) from Algal-Induced Black Water Blooms in Eutrophic Freshwater Lakes [J]. Water, Air, &Soil Pollution, 2016,227(9):356.
[7] Sheng Y Q, Sun Q Y, Shi W J,et al. Geochemistry of reduced inorganic sulfur, reactive iron, and organic carbon in fluvial and marine surface sediment in the Laizhou Bay region, China [J].Environmental Earth Sciences, 2015,74(2):1151-1160.
[8] Hou L J, Liu M, Stephen A, et al. Transformation and fate of nitrate near the sediment—water interface of Copano Bay [J].Continental Shelf Research, 2012,35(1):86-94.
[9] 蔡 萍,吴雨琛,刘 新,等.底泥和藻体对太湖湖泛的诱发及水体致黑物的供应潜力 [J]. 湖泊科学, 2015,27(4):575-582.
[10] Liu C, Shen Q S, Zhou Q L, et al. Precontrol of algae-induced black blooms through sediment dredging at appropriate depth in a typical eutrophic shallow lake [J]. Ecological Engineering, 2015,77:139-145.
[11] Zhu M X, Hao X C, Shi X N, et al. Speciation and spatial distribution of solid-phase iron in surface sediments of the East China Sea continental shelf [J]. Applied Geochemistry, 2012,27(4):892-905.
[12] Brüchert V, Pratt L M. Contemporaneous early diagenetic formation of organic and inorganic sulfur in estuarine sedimentsfrom St. Andrew Bay, Florida, USA [J]. Geochimica Et Cosmochimica Acta, 1996,60(60):2325-2332.
[13] Jalilehvand F. Sulfur: Not a “Silent” Element Any More [J].Cheminform, 2007,38(18):1256.
[14] Duan H T, Steven Arthur Loiselle, Zhu L, et al. Distribution and incidence of algal blooms in Lake Taihu [J]. Aquatic Sciences,2015,77(1):9-16.
[15] 邵世光,薛联青,刘 成,等.藻源性湖泛发生过程的季节差异[J]. 中国环境科学, 2015,35(8):2511-2516.
[16] Joel E Kostka, George W, Luther Iii. Partitioning and speciation of solid phase iron in saltmarsh sediments [J]. Geochimica Et Cosmochimica Acta, 1994,58(7):1701-1710.
[17] Hsieh Y P, Yang C H. Diffusion methods for the determination ofreduced inorganic sulfur species in sediments [J]. Limnology &Oceanography, 1989,34(6):1126-1130.
[18] Calmano W, Hong J, Förstner U. Binding and Mobilization of Heavy Metals in Contaminated Sediments Affected by pH and Redox Potential [J]. Water Science & Technology, 1993,28(8/9):223-235.
[19] Yang C M, Wu Y Q, Zhang F, et al. Pollution characteristics and ecological risk assessment of heavy metals in the surface sediments from a source water reservoir [J]. Chemical Speciation& Bioavailability, 2016,28(1-4):133-141.
[20] Otero X L, Ferreira T O, Vidal-Torrado P, et al. Spatial variation in pore water geochemistry in a mangrove system (Pai Matos island, Cananeia-Brazil) [J]. Applied Geochemistry, 2006,21(12):2171-2186.
[21] Feng Z Y, Fan C X, Huang W Y, et al. Microorganisms and typical organic matter responsible for lacustrine "black bloom"[J].Science of the Total Environment, 2014,s470—471:1-8.
[22] Vopel K, Gibbs M, Hickey C W, et al. Modification of sediment—water solute exchange by sediment-capping materials: effects on O2and pH [J]. Marine & Freshwater Research, 2008,59(12):1101-1110.
[23] Phillips, Elizabeth J P, Lovley, Derek R. Determination of Fe (III)and Fe (II) in Oxalate Extracts of Sediment [J]. Soil Science Society of America Journal, 1987,51(4):938-941.
[24] Rickard D, Morse J W. Acid volatile sulfide (AVS) [J]. Marine Chemistry, 2005,97(3):141-197.
[25] Spratt H G, Morgan M D, Good R E. Sulfate reduction in peat from a new jersey pinelands cedar swamp. [J]. Applied &Environmental Microbiology, 1987,53(7):1406.
[26] Wijsman J W M, Middelburg J J, Herman P M J, et al. Sulfur and iron speciation in surface sediments along the northwestern margin of the Black Sea [J]. Marine Chemistry, 2001,74(4):261-278.
[27] Wilkin R T, Barnes H L. Pyrite formation by reactions of iron monosulfides with dissolved inorganic and organic sulfur species[J]. Geochimica Et Cosmochimica Acta, 1996,60(21):4167-4179.
[28] Gagnon C, Mucci A, Pelletier É. Anomalous accumulation of acid-volatile sulphides (AVS) in a coastal marine sediment,Saguenay Fjord, Canada [J]. Geochimica Et Cosmochimica Acta,1995,59(13):2663-2675.
[29] Canfield D E, Bo T. Fate of elemental sulfur in an intertidal sediment [J]. Fems Microbiology Ecology, 2010,19(2):95-103.
