低温生物除铁除锰工艺快速恢复试验
2018-01-09王玉林曾辉平北京工业大学水质科学与水环境恢复工程北京市重点实验室北京004哈尔滨工业大学城市水资源与水环境国家重点实验室黑龙江哈尔滨50090
王玉林,李 冬*,杨 航,曾辉平,张 杰, (.北京工业大学水质科学与水环境恢复工程北京市重点实验室,北京 004;.哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 50090)
生物除锰固锰工艺因其高效、成本低、无需添加药剂等优势在许多国家均有工程实践应用的报道[1-6],兰西县水厂、哈尔滨松北水厂、沈阳开发区水厂、佳木斯江北水厂等的投产运行则是生物除铁除锰技术在中国应用实践的典型代表[7-9].然而生物除铁除锰工艺运行过程中难免遭到破坏或停运,例如进水水质的变化,长期高浓度进水锰的巨大冲击负荷导致生物滤层锰中毒,其除锰能力急剧下降甚至丧失[10-14];日常运行或反冲不当,亚铁离子会溶解锰的生物氧化生成物,长此以往会破坏已成熟的生物除锰滤层结构[15-16];水厂日常运行中的滤池检修、管道维护、设备保养、换井等意外情况的发生导致滤池停运时间较长等[9,15],生物除铁除锰滤层一旦破坏后很难恢复[17],因此对于破坏失稳后的生物除铁除锰滤层“如何使其高效地恢复”是生物除铁除锰技术工程应用上必须要解决的难题.然而,目前文献中提到的对低温生物除铁除锰工艺进行恢复的研究还很少.滤层恢复与启动的最大区别在于滤层结构的不同,启动时的滤层为全新的滤料,而恢复时的滤层为包含铁锰氧化物及失活的铁锰氧化菌等失稳的微生物系统,其滤料粒径等也发生了很大变化.所以如果采用与启动相似的提升温度[9]、接种高浓度菌液[18-20]、采取低反冲洗强度[21-22]的方式进行恢复,对于寒冷地区且铁锰浓度较高的地下水及条件有限地区不切实际或很难达到.温度是限制铁锰氧化菌非常重要的指标[23].目前国外文献报道水温相对较高,大约 12~16.5℃[24],国内文献报道中应用生物技术净化含铁锰水体的最低温度一般8℃[25],其中黑龙江佳木斯市主要以含高铁锰地下水作为供水水源冬季水温低至 3~5℃,低温会抑制微生物的活性[23],增加了生物滤层培养的难度,部分地区光培养时间就长达 4~9个月[9].显然,对于净化 3~5℃低温地下水生物滤层破坏后的快速恢复将会是极大的挑战.
本文采用3根由于之前锰极限浓度探求试验导致滤层锰中毒及长时间停运导致滤层除锰性能失效的生物滤柱(1#、2#、3#),1#采用不同流向恢复方式,2#采用不同铁锰浓度常规恢复方式,3#采用添加无机碳恢复方式,并对恢复时间和恢复后稳定性进行比较,以期得出最佳恢复方式,为低温生物除铁除锰工艺的工程应用提供技术支持.,
1 材料与方法
1.1 试验装置与方法
试验在佳木斯市某地下水厂进行,试验装置采用 3根滤层除锰性能失效的有机玻璃滤柱,直径为250mm,高为3000mm.滤柱内填充双层滤料,上层为 300mm 厚颗粒无烟煤滤料,粒径 1.5~2.5mm;下层为 1200mm 厚锰砂滤料,粒径 0.8~1.0mm;以1~3mm的卵石作垫层,垫层厚300mm;沿滤柱高度每隔100mm设一个取样口.试验装置如图1所示.
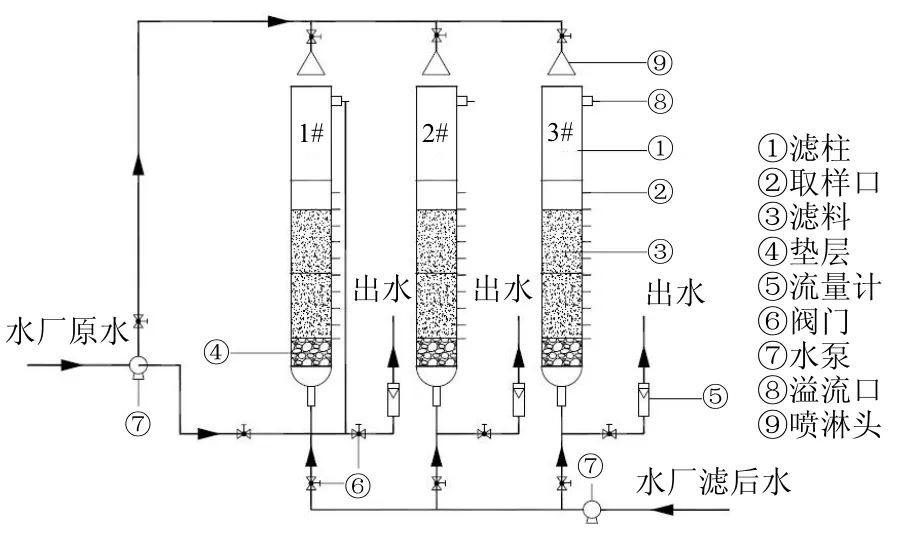
图1 试验装置示意Fig.1 Schematic diagram of experimental equipment
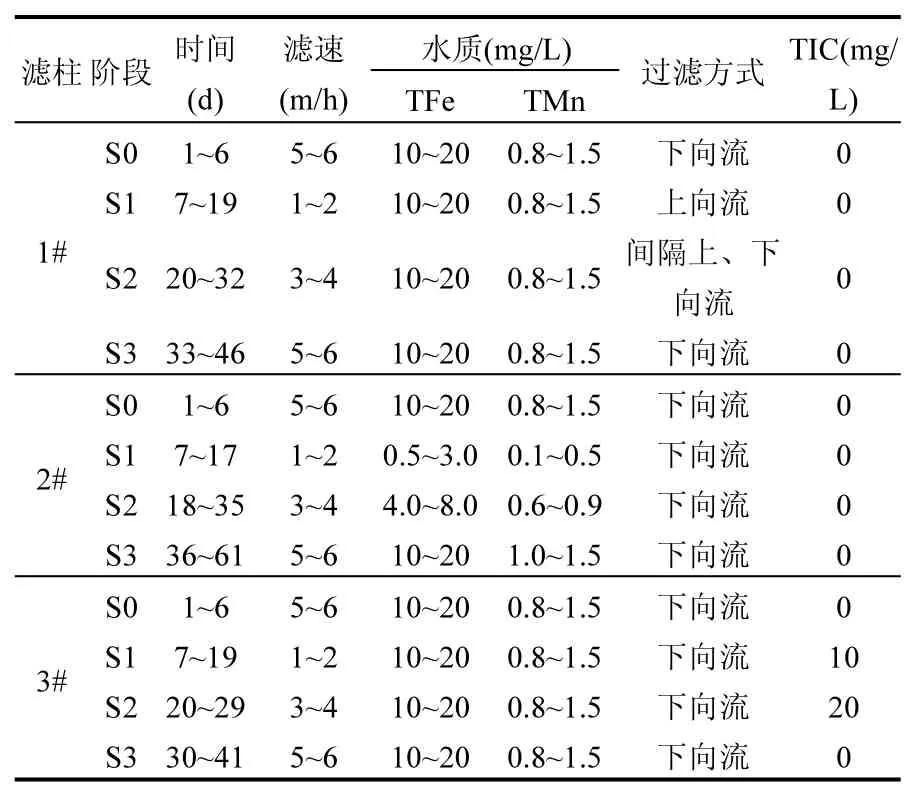
表1 各阶段反应器参数变化Table 1 The parameter variations of each stage
试验在水厂滤池间进行,室温8~10℃.如表1所示,试验分为S0、S1、S2、S3 4个阶段.S0阶段3根滤柱以正常滤速5~6m/h、原高浓度铁锰水质、下向流方式运行1周左右.3根滤柱恢复开始都采用0.5~1m/h慢滤速运行,各滤柱滤速2m/h之前为 S1阶段,滤速 2~4m/h为 S2阶段,滤速4~6m/h为 S3阶段.1#滤柱进水始终为原高浓度铁锰水质,2#滤柱始终为下向流过滤,3#滤柱始终为下向流、原高浓度铁锰水质过滤.S1阶段1#滤柱采用上向流过滤,2#滤柱采用低浓度铁锰水质过滤,3#滤柱采用添加10mg/L无机碳过滤;S2阶段1#滤柱采用间隔上、下向流过滤,2#滤柱采用中浓度铁锰水质过滤,3#滤柱采用添加 20mg/L无机碳过滤;S3阶段 1#滤柱采用下向流过滤,2#滤柱采用原高铁锰水质过滤,3#滤柱采用无添加无机碳过滤.各级滤速下待出水铁、锰合格并稳定 7~8d再逐级提升滤速,每次提升幅度不超过1m/h,同时随时调整相应的反冲洗周期、强度、时间.每周测2次沿程总铁、总锰的浓度,及时分析铁、锰的沿程去除情况,通过沿程锰去除量和除锰性能分析以此反映锰氧化菌(MnOB)的活性和滤柱除锰稳定性.各滤柱运行工况见表1.
1.2 试验水质
试验所用原低温高浓度铁锰地下水为佳木斯某水厂跌水曝气后的水,试验各阶段水质及运行参数见表1.
1.3 检测项目和方法
总铁(TFe):二氮杂菲分光光度法;亚铁(Fe2+):二氮杂菲分光光度法;总锰(TMn):原子吸收分光光度法;DO、pH:便携式测定仪(WTW);TIC:非色散红外吸收TOC测定仪[26].
为了加深对英语词汇的理解,必须了解其所对应的文化背景,而许多单词正是经由希腊罗马神话才进入英语词汇库。神话所引申出来的词汇可分为普通词汇与专业术语,前者多与神、英雄、鬼怪等名称有关,可利用其隐喻特征引申并拓展词义。例如含义为长期艰辛的旅途odessay,这一单词就是由神话中的著名英雄奥德修斯Oldysseus衍生而来,并且1月(January)和3月(March)也来自于神话故事中的两面神janus和战神mars。专业术语与自然科学有关,例如在天文学中许多星体的名称都是由神话故事而来,故事中的战神和爱与美之神分别对应的是火星Mars和金Venus。

生物锰氧化动力方程为:式中:进水在生物滤层中的接触氧化时间与公式左侧成线性关系,k0为生物滤层的除锰能力,通过线性拟合可得知其值,其值越大,表明生物滤层的除锰能力越强.
2 结果与讨论
2.1 滤柱恢复期TFe的去除效果
研究表明,因锰中毒及长时间停运造成失效的生物除锰滤柱,滤层内含有大量铁锰氧化物及死去的铁锰氧化菌(FeOB、MnOB),滤层堵塞严重[9,18,24],所以相对启动新滤柱采用较弱的反冲洗强度而言[14,22,27],本试验恢复初期宜采取较大的反冲洗强度和时间,从而彻底清洁滤层,为残存FeOB、MnOB的生长创造良好条件.
各滤柱恢复前和恢复期对 TFe的去除效果如图2所示,前5d为下向流、原水过滤,各滤柱恢复前出水 TFe浓度均较高,平均达 2.92mg/L.S1阶段1#、3#滤柱开始出水TFe浓度较高,最高达到3.5mg/L左右,但分别仅经过5d和4d出水TFe浓度降至 0.3mg/L以下;2#滤柱由低铁浓度开始恢复,出水TFe浓度低于0.3mg/L.S2、S3阶段出水TFe浓度均合格.滤柱出水TFe仅几天就合格,表明破坏滤层对TFe的去除影响较小.研究表明滤层因锰中毒及长时间停运造成失效的生物除锰滤柱滤料表面的铁质活性滤膜遭受损坏[7,14],且FeOB数量很少,故而起始几天出水TFe不合格;在pH中性域条件下, Fe2+很容易被空气氧化生成新的FeOOH触酶而将TFe去除[9,14,28],图2中进水 TFe与 Fe2+浓度的差异表明原水中大部分 Fe2+离子在进入滤层之前已被氧化,剩余的Fe2+离子继续在滤层内部被氧化去除.
2.2 滤柱恢复期TMn的去除效果
各滤柱恢复前和恢复期对TMn的去除效果如图3所示,崩溃阶段滤柱出水 TMn浓度很高,甚至高于进水锰浓度,滤层除锰性能很差.
由图3可知,1#、3#滤柱S1阶段都较长,均持续2周左右.1#滤柱第7~13d出水TMn浓度很高,甚至高于进水TMn浓度,分析认为一方面MnOB数量很少、活性较低;另一方面滤层长时间被高浓度铁锰水浸泡,高浓度 Fe2+与高价锰离子发生氧化还原反应,置换出部分Mn2+[9,16],加上上向流的作用,与滤层中夹杂的铁锰氧化物一起被带出滤层.研究表明上向流过滤方式时三价铁氧化物能够到达滤层上部,反冲洗期间水头损失较小,铁泥可以轻易的被粉碎从而与反冲洗水一起排出滤层,增大了滤层的渗透空间和间隙,有助于细菌的广泛分布并增加与过滤介质接触的机会[29].所以第15d出水TMn已合格,在1~2m/h的低滤速下出水TMn浓度稳定达标.3#滤柱恢复开始出水TMn一直呈下降趋势,仅经过6d出水TMn合格,且滤速稳步提升至2m/h.因为3#滤柱S1阶段添加10mg/L无机碳,滤层残存的MnOB处于饥饿状态,快速摄取碳源并除锰.
[10,17].而2#滤柱S1阶段相对较短,在10d以内.因为其进水TMn仅为0.4~0.5mg/L,低滤速加上弱反冲强度,出水TMn浓度5d后合格且滤速稳步提升.

图2 各滤柱进出水TFe/Fe2+浓度及滤速变化Fig.2 Variation of iron concentration and filtration rate of the biological filter
S2阶段 1#、3#滤柱逐渐显示出优势,其时间已略短于2#滤柱.经过S1阶段的运行,各滤柱滤层已恢复为良好的除锰环境.所以 S2阶段主要是MnOB增长和富集.由图3可知,各滤柱出水 TMn基本合格.1#滤柱此阶段既不失上向流的优势,又能为过渡到下向流做准备,出水 TMn浓度偶尔出现波动,但整体低于0.1mg/L.研究表明频繁和高强度的反冲洗不利于MnOB的生长繁殖[7,9],而间隔上、下向流过滤方式一定程度上减弱了反冲洗强度,既为 MnOB增殖创造最大空间,又减少了其数量的流失.此阶段用时不到2周.3#滤柱此阶段 TMn去除较稳定,基本低于0.1mg/L,分析认为至 S2阶段,3#滤柱此阶段无机碳浓度的进一步增加,为 MnOB提供了充足的碳源,极大地刺激了其活性和数量的增殖,此阶段用时 10d左右.2#滤柱此阶段进水 TMn浓度提升为 0.8mg/L左右.此阶段开始出水 TMn浓度出现波动,达到 0.2mg/L,主要原因还是MnOB数量较少,对于进水 TMn负荷的提升一时难以适应,经过 4~5d的低滤速的运行,出水TMn浓度才逐渐合格.此阶段用时 18d,约是 S1阶段的2倍左右,比1#、3#滤柱长36%左右.
S3阶段3个滤柱已都为下向流、原低温高浓度铁锰水质过滤.由图3可知3#滤柱S3阶段用时最短,其次是1#和2#滤柱.3#滤柱S3阶段之所以用时最短,主要因为3#滤柱S2阶段MnOB数量得以快速增值,MnOB为贫营养性细菌,在本地下水中的碳源微乎其微的水质下,营养的缺乏势必会成为铁锰氧化菌生长的限制因子[14,27],因此在无机碳的强化和刺激下,MnOB快速生长.但由图3可知,1#、3#滤柱进入 S3阶段后出水TMn浓度合格后又出现波动现象,除锰并不稳定,分析认为这两个滤柱进入S3阶段后失去上向流和无机碳的作用,滤层重新进入下向流过滤模式、贫营养环境,MnOB生存空间被压缩,此外1#、3#滤柱此时的滤层并没有形成良好的生物除铁锰体系,从而导致出水TMn浓度波动.2#滤柱S3阶段进水 TMn浓度提升至 1.0~1.3mg/L,因为随着滤速的缓慢提升,进水负荷的提高会导致滤层上部铁泥的积累,反洗不当会导致滤层内部形成过滤水短路或水流通道,甚至会使滤层内部出现负压导致气体阻塞,最终破坏滤层的处理能力[7-9],所以本阶段将反冲强度提升至 10~12L/(s·m2),较高的反冲强度能够清洗掉滤层中细菌代谢积累的产物,有利于细菌在滤料表面的牢固附着,从而增强滤层的抗负荷冲击能力[14].由图3可知2#滤柱此阶段只是初始几天出水TMn不合格,但很快稳定低于0.1mg/L.相比于1#、3#滤柱波动较小,主要因为 2#滤柱经过 S1、S2阶段长达 35d的培养,MnOB数量有了很大积累,活性上适应低温水质,生物滤层形成了良好的除铁锰体系,且随着铁锰含量的逐渐提升,生物滤层越来越稳固.2#滤柱S3阶段长达多于 20d,为前 2个阶段总用时的80%左右.
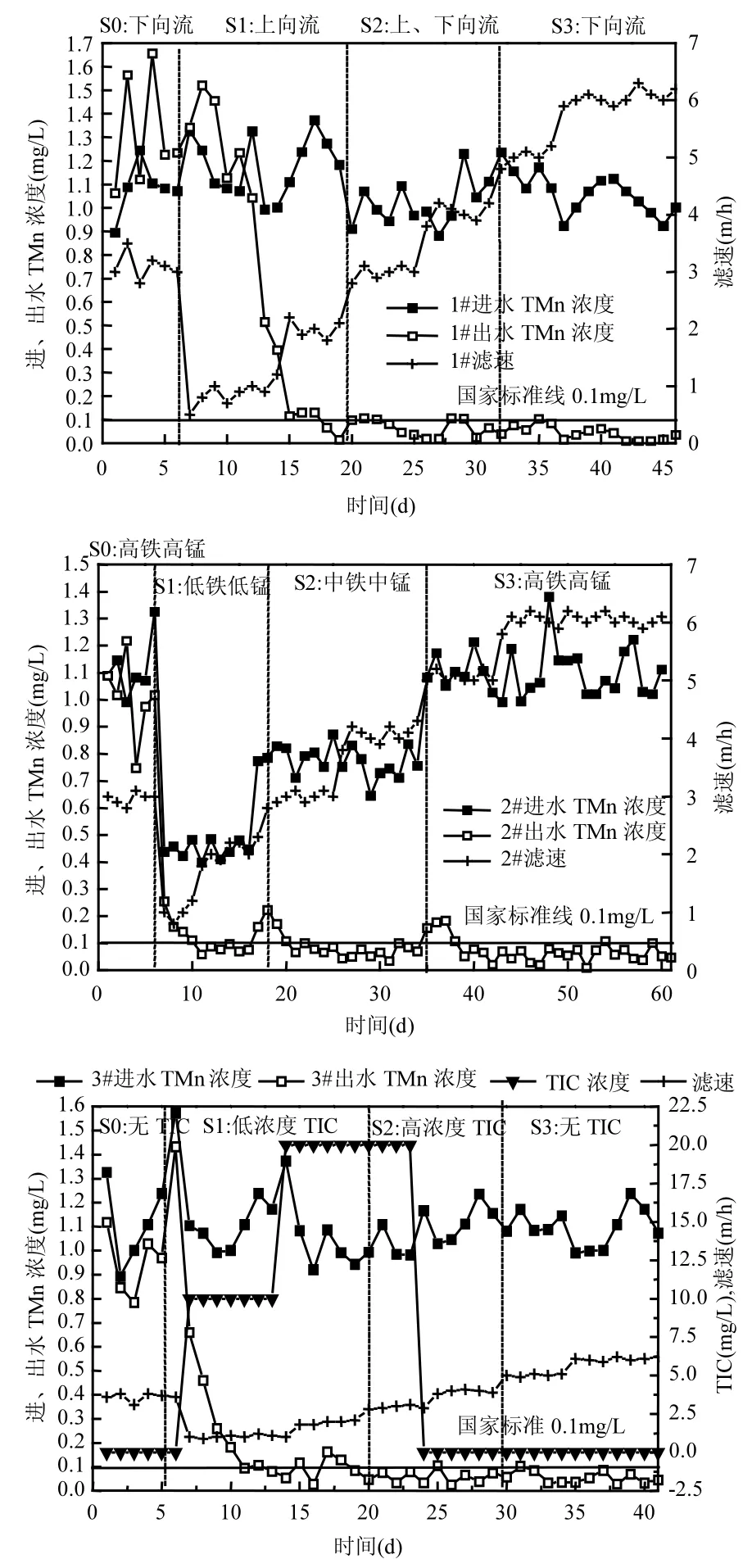
图3 各滤柱进出水TMn浓度及滤速变化Fig.3 Variation of manganese concentration and filtration rate of the biological filter
综上可知,以上 3种恢复方式都有较好的效果,以达到设计滤速6m/h且出水铁锰稳定合格视为滤柱恢复成功,1#、2#、3#滤柱分别仅经过40、54、35d恢复成功.
2.3 铁锰沿程变化及除锰性能分析
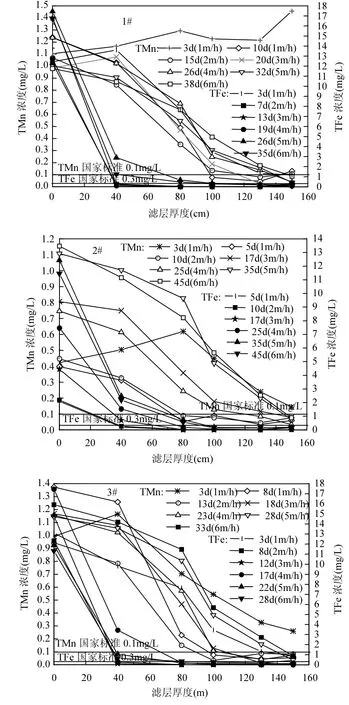
图4 滤层TMn、TFe沿程变化分析Fig.4 Analysis along filter bed of TMn、TFe
滤柱恢复期TFe沿程变化如图4所示,3根滤柱进水TFe在滤层40cm深处去除率达80%以上,并且滤速在3m/h之前40cm处TFe浓度已降至 0.3mg/L以下.S1阶段 1#滤柱上向流过滤,其TFe去除效果相较于 2#、3#滤柱较差.2#滤柱为低铁恢复,其TFe去除效果非常好,3#滤柱起始恢复时TFe去除效果不好,但去除率也达到85%以上.这主要跟滤柱刚恢复运行滤层的结构、温度、水质条件等有关.1#滤柱起始恢复时滤层中 TFe浓度出现先升高后降低的现象,归因于上向流使得滤料颗粒之间的空隙较大,水流冲刷掉一部分滤料表面铁氧化物的同时,削弱了滤层对铁氧化物的截留能力[7,9];S2、S3阶段各滤柱TFe去除效果较好,在滤层50cm处TFe去除率几乎达到了100%.
滤柱恢复期TMn沿程变化如图4所示,各滤柱各阶段 TMn沿程去除差别较大.S1阶段初始(3d、1m/h)各滤柱TMn沿程去除呈现同一现象:随滤层深度的增加TMn浓度先升高后降低,滤层0.4m处TMn浓度高于进水TMn浓度0.2mg/L左右,尽管2#滤柱初始TMn只有0.4mg/L左右,但同样表现出此现象,因为破坏的滤层 Fe2+与高价锰离子发生还原反应而溶出Mn2+,以及滤料表面锰氧化物的释放[9],尤其1#滤柱S1阶段上向流更甚.2#、3#滤柱S1阶段初始运行TMn浓度随滤层升高后再降低,出水尽管还不合格,但也只有0.2~0.3mg/L,而 1#滤柱初始运行 TMn浓度沿程逐渐升高,出水甚至高于进水0.4mg/L左右,可见上向流对去除锰的影响远大于对去除铁的影响.S1阶段各滤柱单位时间单位滤层的锰去除量都很低,出水锰不合格.由图4可知,2#、3#滤柱S1阶段除锰带主要在 0.4~0.8m 之间,1#滤柱在0.4~1.0m之间,3个滤柱S1阶段0.4~0.8m的锰平均去除量分别为 0.517,0.248,0.832mg/L,可见 1#滤柱 S1阶段除锰带范围略宽于 2#、3#滤柱,3#滤柱锰去除量略大于1#滤柱,因为2#滤柱锰浓度较低,3#滤柱无机碳强化了 MnOB氧化锰能力,而1#滤柱上向流过滤,虽然增大了MnOB与介质的接触空间,但MnOB数量和活性有限,微生物作用微弱. S2阶段各滤柱已重新适应低温水质条件,MnOB在恢复活性的同时数量开始急剧增长.由图4可知, 1#、2#滤柱S2阶段在滤层1.0m处锰浓度均不合格,3#滤柱S2阶段在滤层0.8m处也不合格,表明随着滤速的提升 3个滤柱的除锰带均下移.此时各滤柱除锰带分别处于0.4~1.2m、0.4~ 1.1m、0.5~1.0m,S2 阶段各滤柱0.6~1.0m的锰平均去除量分别为0.832、0.528、0.933mg/L. 1#滤柱除锰带最宽,主要由于1#滤柱S2阶段采取间隔上下向流过滤方式,水流流向的改变使得MnOB最大程度分布于全部滤料表面和间隙;3#滤柱除锰带最窄,锰平均去除量最高,表明此阶段 3#滤柱 MnOB的除锰能力最强.S2阶段锰平均去除量明显高于S1阶段,表明尽管滤速提升,但各滤柱MnOB活性和数量都得到很大程度的提升.S3阶段各滤柱的运行状态、水质条件相同,由图4可知,除锰带进一步下移,在 6m/h滤速、低温高浓度铁锰进水水质下,各滤柱除锰带基本都处于 0.6~1.3m 之间,甚至在滤层 1.3m处出水锰还不合格,只能依靠剩余的滤层进一步去除. 各滤柱S3阶段0.8~1.2m滤层的锰平均去除量分别为 0.425、0.558、0.664mg/L,由此可知1#、3#滤柱锰平均去除量由于滤速的提升而降低,2#滤柱锰平均去除量则相对稳定.
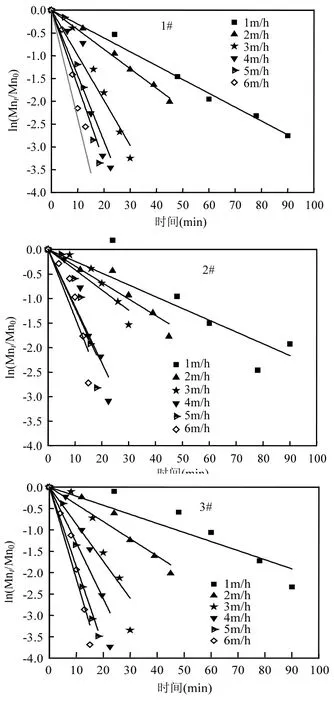
图5 滤柱不同滤速下氧化除锰线性拟合Fig.5 Linear fitting of manganese oxidation under different filtration rates
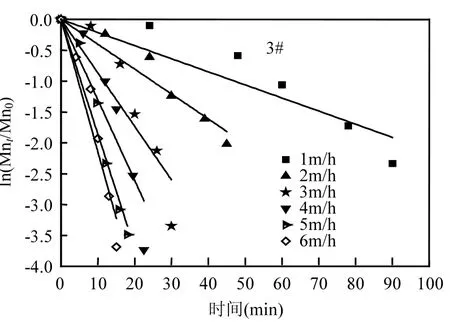
图5 滤柱不同滤速下氧化除锰线性拟合Fig.5 Linear fitting of manganese oxidation under different filtration rates
对滤层进行沿程除锰动力学分析,将图4中各滤速梯度下滤层的沿程锰去除量利用公式(1)进行拟合,其结果如图5所示.图4中滤层沿程锰浓度变化数据经拟合后,呈现良好的线性关系,表2中各R2值均大于0.9,表明式1能够表征滤层的除锰性能.低温条件下,1#、2#、3#滤柱在恢复过程中分别在1~6m/h滤速下稳定合格时的k0值分别为:0.021、0.041、0.087、0.133、0.185、0.215;0.024、0.030、0.041、0.115、0.119、0.138; 0.030、0.042、0.098、0.140、0.166、0.238.由此可知 1#、3#滤柱随着滤速的提升,k0逐渐增大,3m/h后的k0均值分别为0.178、0.181,除锰性能逐渐快速增强;而2#滤柱随着滤速的提升k0变化出现拐点,3m/h之前k0变化不大,均值只有0.032,而3m/h之后k0同样变化不大且逐渐趋于恒定,均值为 0.124,虽远小于 1#、3#滤柱3m/h后的k0值,但除锰性能得以显著提高.
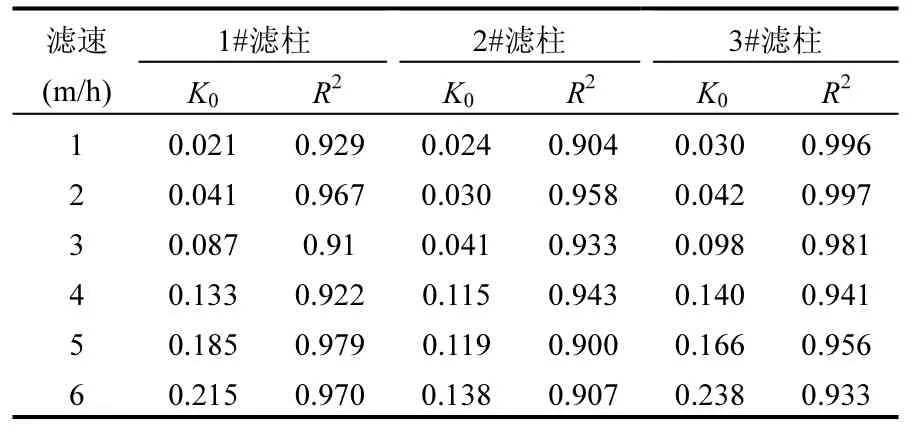
表2 各滤柱线性拟合参数值统计Table 2 The numerical simulation of the linear fitting parameters of each filter column
试验表明 1#、3#滤柱的恢复方式能够最大限度的缩短恢复时间和提高除锰性能,可能针对本地下水质除锰性能还有富余;而2#滤柱的恢复时间虽长于1#、3#滤柱,但2#滤柱升至3m/h后除锰性能较稳定.
3 结论
3.1 采用不同流向过滤方式、改变进水铁锰浓度、添加无机碳 3种方式均能够有效缩短低温(3~5℃)生物滤柱的恢复时间,其分别为 40、54和35d,相比2#滤柱常规恢复方式,1#、3#滤柱恢复时间分别缩短了26%、35%.
3.2 S1、S2阶段表明上向流、适量无机碳能够快速富集 MnOB,并提高除锰性能;S3阶段表明不同流向过滤方式和添加无机碳的方式恢复的滤柱除锰性能较高,但除锰稳定性不如采取改变进水铁锰浓度的方式.
3.3 从恢复效果和经济合理性综合考量,最佳恢复方式建议为铁锰浓度由低升高并在滤速提升至2~3m/h时添加无机碳的方式.
[1] Pacini V A, María Ingallinella A, Sanguinetti G. Removal of iron and manganese using biological roughing up flow filtration technology [J]. Water Research, 2005,39(18):4463-4475.
[2] Katsoyiannis I A, Zouboulis A I. Biological treatment of Mn(II)and Fe(II) containing groundwater: kinetic considerations and product characterization [J]. Water Research, 2004,38(7):1922-1932.
[3] Burger M S, Krentz C A, Mercer S S, et al. Manganese removal and occurrence of manganese oxidizing bacteria in full-scale biofilters [J]. Journal of Water Supply Research and Technology,2008,57(5):351-359.
[4] Štembal T, Markić M, Briški F, et al. Rapid start-up of biofilters for removal of ammonium, iron and manganese from ground water. [J]. Journal of Water Supply Research and Technology,2004,53(7):509-518.
[5] Thapa C R, Suzuki I, Takezaki J, et al. Bacterial Diversity in Biological Filtration Plant for the Removal of Iron and Manganese from Groundwater [J]. Journal of Water and Environment Technology, 2013,11(1):33-47.
[6] Abu Hasan H, Sheikh Abdullah S R, Tan Kofli N, et al. Effective microbes for simultaneous bio-oxidation of ammonia andmanganese in biological aerated filter system [J]. Bioresource Technology, 2012,124(1):355-363.
[7] 张 杰,李 冬,杨 宏,等.生物固锰除锰机理与工程技术 [M].北京:中国建筑工业出版社, 2005:1-27.
[8] 李 冬,张 杰,陈立学,等.生物除铁除锰在地下水处理厂的应用 [J]. 中国给水排水, 2004,20(12):85-88.
[9] 李 冬,曾辉平.高铁锰地下水生物净化技术 [M]. 北京:中国建筑工业出版社, 2015.
[10] Tang Y, Wu W, He Y, et al. Low-temperature domestication of an iron and manganese oxidizing bacteria [J]. Advanced Materials Research, 2012,374—377:826—830.
[11] D A Ratkowsky, R K Lowry, T A, et al. McMeekin, A. N. Stokes,R. E. Chandler, Model for bacterial culturegrowth rate throughout the entire biokinetic temperaturerange, [J]. Bacteriol, 1983,154:1222—1226.
[12] Ratkowsky D A, Olley J, T. A, et al. McMeekin, A. Ball,Relationship between temperature and growth rate ofbacterial cultures, [J]. Bacteriol, 1982,149:1—5.
[13] Cai Y A, Li D, Liang Y, et al. Operational parameters required for the start-up process of a biofilter to remove Fe, Mn, and NH3-N from low-temperature groundwater [J]. Desalination and Water Treatment, 2016,(57):3588-3596.
[14] 李 冬.生物除铁除锰理论与工程应用技术研究 [D]. 北京:北京工业大学, 2004.
[15] 曾辉平.生物除铁除锰滤池长期运行后除锰能力下降原因的探究 [D]. 哈尔滨:哈尔滨工业大学, 2007.
[16] 张 杰.生物滤层中Fe2+的作用及对除锰的影响 [J]. 中国给水排水, 2001,(9):14-16.
[17] Atta S Kh, Mojammed S A, Van Cleemput O, et al.Transformations of iron and manganese under controlled Eh,Eh-pH conditions and addition of organic matter r [J]. Soil Technology, 1996,9:223-237.
[18] 曾辉平.含高浓度铁锰及氨氮的地下水生物净化效能与工程应用研究 [D]. 哈尔滨:哈尔滨工业大学, 2010.
[19] Cahyani V R, Murase J, Ishibashi E, et al. Bacterialcommunities in manganese nodules in rice field subsoils: estimation using PCRDGGE and sequencing analyses [J]. Soil Sci. Plant Nutr,2007,53(5):575—584.
[20] Carmichael M J, Carmichael S K, Santelli C M, et al. Mn(II)-oxidizing bacteria are abundant and environmentally relevant members of ferromanganese deposits in caves of the upper Tennessee River Basin.Geomicrobiol [J]. Geomicrobiology Journal, 2013,30(9):779-800.
[21] Cai Y A, Li D, Liang Y, et al. Effective start-up biofiltration method for Fe, Mn, and ammonia removal and bacterial community analysis [J]. Bioresource Technology, 2015,176:149-155.
[22] 李 冬,路 健,等.低温生物除铁除锰工艺快速启动与滤速的探求 [J]. 中国环境科学, 2016,36(1):82-86.
[23] Tekerlekopoulou A G, Pavlou S, Vayenas D V. Removal of ammonium, iron and manganese from potable water in biofiltration units: a review [J]. Journal of Chemical Technology and Biotechnology, 2013,88(5):751-773.
[24] 程庆峰.高铁锰氨氮地下水净化工艺优化及菌群结构研究 [D].哈尔滨:哈尔滨工业大学, 2014.
[25] Hoyland V W, Knocke W R, Falkinham J O, et al. Effect of drinking water treatment process parameters on biological removal of manganese from surface water [J]. Water Research,2014,66:31-39.
[26] GB/T5750-2006 生活饮用水标准检验方法 [S].
[27] 蔡言安.含铁锰氨氮地下水生物净化试验研究 [D]. 北京:北京工业大学, 2015.
[28] Huang S Q F M, et al. Fe (II) and Mn (II) removal from drilled well water: A case study from a biological treatment unit in Harbin [J]. Desalination, 2009,245(1-3):183-193.
[29] Yang H, Li D, Zhang J, et al. Design of biological filter for iron and manganese removal from water [J]. Journal of Environmental Science & Health Part A Toxic/hazardous Substances &Environmental Engineering, 2006,39(6):1447.
