应用转LUX报告基因重组发光菌监测评价DNA损伤毒性污染物
2018-01-08黄新新何宇平娟郭德华强吴頔
黄新新 何 苗 何宇平 杨 娟郭德华 蔡 强吴頔
(1.上海出入境检验检疫局 上海 200135;2.清华大学;3.浙江清华长三角研究院)
1 前言
近些年随着水环境状况的恶化,我国城市的饮用水水源普遍存在有机物污染。污染物进入环境及食品后,对生态系统在各级生物学水平上产生不良影响[1]。由于水中有机化合物常与混合方式联合作用于人体,其遗传毒性与致癌性之间存在一定的相关性,因此在目前水资源极其短缺的情况下,对水中有机污染物进行调查并对其遗传毒性的研究已迫在眉睫,而利用生物效应的原理检测环境污染物的毒性效应对水环境及食品质量的评价具有重要的价值。
鱼类、水蚤类、藻类等生物毒性测试方法,检测周期长,对应标准中检测时间都在24 h以上,不适用于毒性的快速检测和评估。而微生物法,尤其是发光细菌法,因其快速、灵敏、简便、廉价的优点,受到越来越多的关注。
本研究基于基因工程技术,以含有发光基因LuxC、LuxD、LuxA、LuxB、LuxE 为 基 础 的 PUCD615构建诱导型重组工程菌。Lux作为一种新的报告基因,具有快速、灵敏以及简便的优点。诱导型重组菌的特色表现为对特定化合物或诱导物的存在作出响应,可实现对单一化合物或一类化合物的特异灵敏检测。
N′-甲基-N′-硝基亚硝基胍(MNNG)是一种在环境中广泛存在的化学诱变剂和致癌剂,属于可直接与DNA作用的遗传毒物,通过直接靶定DNA而诱发细胞产生遗传毒性应激;丝裂霉素C(MMC)则可使细胞的DNA解聚,同时阻碍DNA的复制。本研究探讨构建的两种对DNA损伤污染物敏感的诱导型重组发光菌THSH1711、THSH1712(含pUCD-uvrA、pUCD-alkA载体),对MNNG及 MMC有特异响应作用。
2 材料与方法
2.1 材料
2.1.1 试剂
质粒pUCD615[2](含有无启动子的luxCDABE全基因盒,Amp+、Kan+):美国 Tennessee 大学 Sayler教授惠赠;E coli W3110[3]、E.coli DH5α:本实验室保存;大肠杆菌RFM443[4]:美国DuPont研究与发展实验中心Saari教授惠赠;EcoR I、BamH I限制性内切酶:购自宝生物工程(大连)公司;MMC、MNNG:购自Roche公司;氨苄青霉素、卡那霉素及CaCl2:购自上海生工生物工程有限公司。
2.1.2 仪器
PCR仪:Bio-Rad公司;水质毒性快速检测仪:型号BHP9511,北京滨松光子技术股份有限公司;高速冷冻离心机、恒温金属浴:德国Eppendorf公司。
2.2 方法
2.2.1 pUCD-uvrA、pUCD-alkA重组发光菌载体构建
取1.5 mL E coli W3110菌液,用DNA抽提试剂盒提取细菌总DNA。以此DNA为模板,扩增uvrA、alkA基因。将测序鉴定正确的uvrA、alkA片段由 EcoR I、BamH I酶切,与同样经双酶切的PUCD615连接,电转化入JM109菌株。挑取克隆,酶切及测序鉴定插入片段的正确性[5]。
2.2.2 THSH1711、THSH1712重组发光菌构建
2.2.2.1 RFM443菌种复苏
用无菌铂丝蘸取-20℃甘油肉汤保存的RFM443大肠杆菌接种于LB肉汤,37℃振荡培养过夜后取少量菌液在LB琼脂平板上分区划线;倒扣平皿37℃培养过夜,形成单个菌落。
2.2.2.2 制备RFM443感受态细胞及转化质粒
挑取上述RFM443单菌落转移到2 mL LB培养液中,37℃摇菌培养过夜;按常规化学法用CaCl2制作感受态细胞;转化时各加1 μL PUCD-uvrA、PUCD-alkA质粒,取100 μL菌液均匀涂布于氨苄青霉素和卡那霉素双抗性的LB培养皿表面;转化入PUCD-uvrA、PUCD-alkA质粒的重组发光菌分别命名为 THSH1711,THSH1712。
2.2.3 毒性测试
平板挑取单克隆THSH1711、THSH1712菌落,加入 LB 肉汤培养基(Amp+、Kan+,25 μg/mL),26℃振荡培养过夜。次日,取1 mL培养液加入1 mL新鲜肉汤,继续振荡培养2~3 h,加入相应浓度梯度的污染物待测。
将水质毒性快速检测仪BHP9511预热30 min,取1 mL待测液加入测试管中,依次放入仪器内,第一管为不加毒性污染物的重组发光菌对照;每隔一段时间检测菌液的发光强度,检测温度在26℃左右;保存纪录,输出数据,整理结果。样品读出的结果为相对于对照的百分数。
3 结果
3.1 PUCD615载体及uvrA、alkA PCR产物酶切结果
PUCD615质粒由EcoR I、BamH I双酶切后出现拖尾现象,表明已经切开。
uvrA、alkA PCR产物扩增片段经 EcoR I、BamH I双酶切后两端出现平直现象。
3.2 pUCD-uvrA、pUCD-alkA重组发光菌载体测序结果
pUCD-uvrA、pUCD-alkA重组载体测序结果与GenBank中的uvrA、alkA 序列进行BLAST比对,同源性为100%,表明扩增序列正确。经比对,序列的上下游正确出现相关的酶切位点,表明uvrA、alkA基因已正确地插入到pUCD615的多克隆位点,方向和读码框正确,重组发光菌载体构建成功。
3.3 THSH1711,THSH1712重组发光菌对毒性污染物的响应作用
3.3.1 THSH1711、THSH1712重组发光菌对MNNG的响应作用
THSH1711重组发光菌对MNNG的响应作用结果见图1。
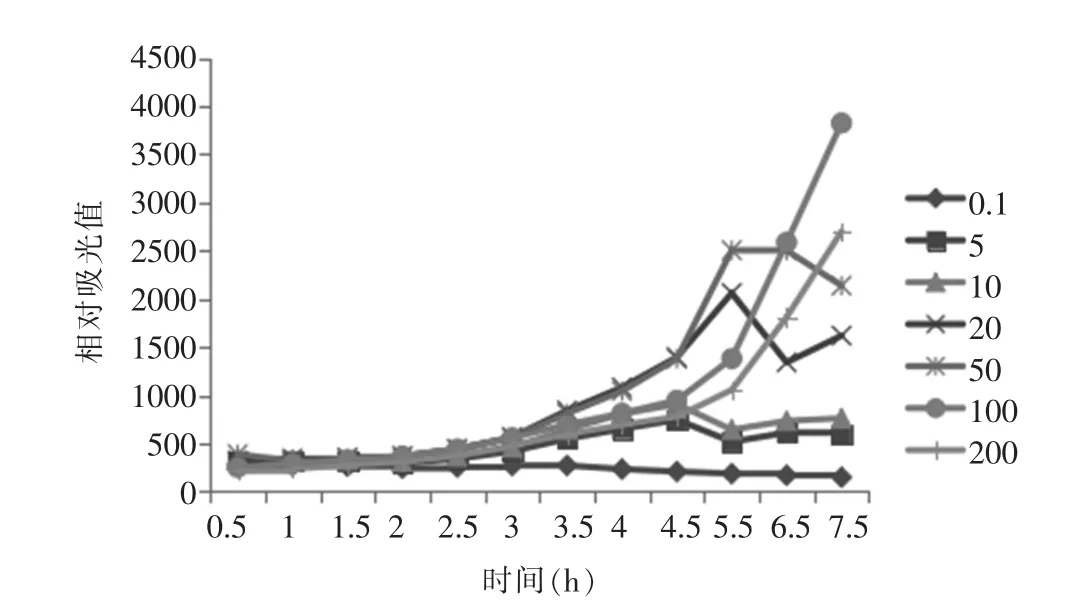
图1 THSH1711重组发光菌对MNNG的响应作用
图1显示,除了在0.1 mg/L浓度时THSH1711菌株对MNNG的响应不明显外,其余随着时间的延长及浓度的递增,逐渐上升。MNNG在5~50 mg/L范围时,THSH1711菌株对其响应在5.5 h时达到高峰,以后趋于平稳或逐渐下降;MNNG超过50 mg/L后,随着浓度上升THSH1711菌株对其响应则会开始下降,但依旧随着作用时间的延长响应值逐步上升,直至22 h响应值才明显下降(结果未显示)。
THSH1712重组发光菌对MNNG的响应作用结果见图2。
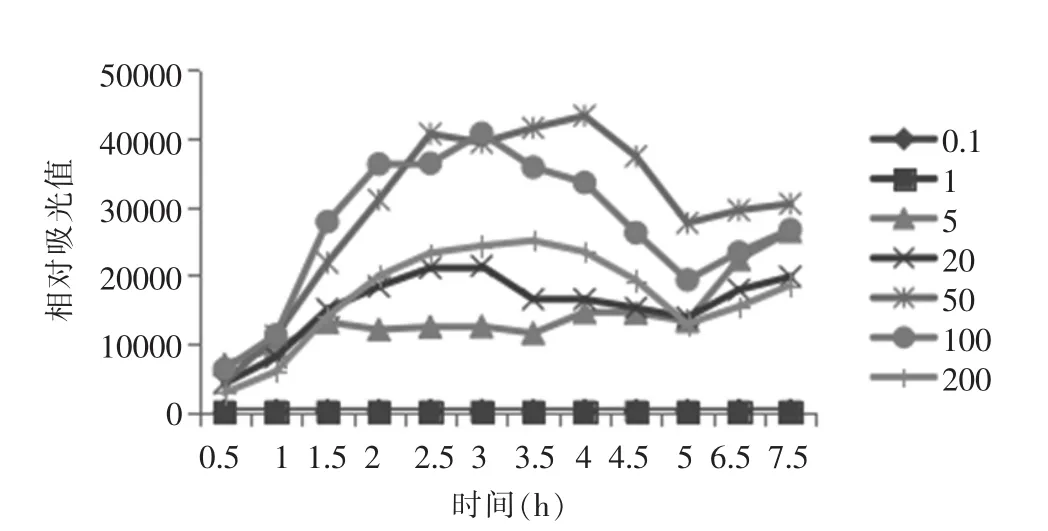
图2 THSH1712重组发光菌对MNNG的响应作用
图2显示,THSH1712菌株在MNNG浓度为0.1 mg/L和1 mg/L时几乎没有响应,相对吸光值在125左右。而在浓度为5 mg/L以上时,作用0.5 h即有明显响应,在作用至3.5 h及4 h时达到高峰;对MNNG的最佳响应浓度为50 mg/L,超过该浓度则开始下降。各浓度在5 h以后基本趋于平稳。
3.3.2 THSH1711、THSH1712重组发光菌对 MMC的响应作用
THSH1711重组菌对MMC的响应作用呈现很好的浓度及时间线性关系。当MMC浓度在0.1~5 mg/L之间时,THSH1711在2 h后对其响应随着浓度及时间明显上升;在MMC浓度为5 mg/L、作用3 h时为最佳响应,随后逐渐下降(图3)。

图3 THSH1711重组发光菌对MMC的响应作用
THSH1712重组发光菌对MMC没有特别明显的响应作用,MMC浓度在0.1~5 mg/L之间时,相对吸光值几乎没有变化;只有在MMC达到10 mg/L以上时,作用3 h后出现较大响应(图4)。

图4 THSH1712重组发光菌对MMC的响应作用
4 讨论
目前国内对发光细菌的研究仍局限于筛选天然菌株进行毒性检测,而构建基因工程菌有如下优势:测试条件更温和,可应用于传感器,实现现场连续、在线监测;对毒性的响应更灵敏;构建不同的菌株,实现不同要求的毒性评价。除了能实现水质毒性的连续在线及自动化检测,也可携带至野外的现场检测,实现对水质的实时监测[6]。
本研究构建的重组发光菌THSH1711及THSH1712经测试能对DNA损伤污染物MNNG、MMC有特异性响应,而对其余非DNA损伤污染物或重金属等未有响应。构建的重组发光菌测试线性范围宽,对MNNG的响应浓度为5~200 mg/L,对MMC的响应浓度为0.1~10 mg/L,并能在响应高峰维持相当长的时间,将水样进行一定程度的处理浓缩即可快速、稳定测定毒性效应。THSH1711对MMC的响应只需0.1 mg/L,并在3 h时达到反应高峰。本实验室构建的另一株含PUCD-recA载体的重组发光菌对MMC的响应的灵敏度达到了0.01 mg/L[7],高于其他用天然发光菌检测灵敏度达1 mg/L的毒性检测仪[8]。THSH1712对MNNG的响应作用非常明显,虽然发生响应需该试剂浓度达到5 mg/L,但作用0.5 h即有很高的相对吸光值6949,作用4 h时最高峰时更是达到了43 294,上升了6倍之多,远远超过了对MMC或其他重组发光菌对MNNG及MMC的响应作用。
除了测试条件及具有特异性响应特点以外,重组发光菌响应原理是基于转化的重组发光载体对特异污染物的反应作用,载体无论在保存还是运输过程中,都相当稳定。相比于天然发光菌极易受冷冻或运输途中保存不当而影响光强,重组发光菌在操作的便利性方面具有很大优势,更适用于生物毒性在线监测。而且其克服了理化检测的局限性和连续取样的繁琐性,快速获得水质毒性资料,达到早期预警目的,发展前景广阔。
5 结论
成功构建了两种重组发光载体pUCD-uvrA、pUCD-alkA,转化入RFM443菌株后能对DNA损伤污染物有很好的特异响应作用。此方法在操作便捷性及实验经济性方面具有较大优势,更适合生物毒性的实时在线监测。
[1]王晓辉,金静,任洪强,等.水质生物毒性检测方法研究进展[J].河北工业科技,2007,24(1):58-62.
[2]Rogowsky P M,Close T J,Chimera J A,et al.Regulation of the vir genes of Agrobacterium tumefaciens plasmid pTiC58[J].J Bacteriol,1987,169(11):5101-5112.
[3]Ernsting B R,Atkinson M R,Ninfa A J,et al.Characterization of the regulon controlled by the leucine-responsive regulatory protein in Escherichia coli[J].J Bacteriol,1992,174(4):1109-1118.
[4]Drolet M,Phoenix P,Menzel R,et al.Overexpression of RNase H partially complements the growth defect of an Escherichia coli delta topA mutant:R-loop formation is a major problem in the absence of DNA topoisomerase I [J].Proc Natl Acad Sci USA,1995,92(8):3526-3630.
[5]黄新新,何苗,施汉昌,等,用于环境污染物遗传毒性评价的重组发光细菌载体的构建[J].环境科学,2008,28(11):3159-3165.
[6]唐雪惠,谢海英,刘艺,等,发光菌综合毒性在线分析仪的应用研究[J]. 供水技术,2015,9(3):55-59.
[7]黄新新,何苗,施汉昌,等.PUCD-recA重组发光菌构建及对遗传毒性污染物的响应作用[J].环境科学,2009,(6):164-168.
[8]何祥长,张荣福,吴晓,等.水质综合毒性在线检测仪设计[J].电子测量技术,2016,39 (11):1-5.
