孕妇及其新生儿端粒长度的影响因素分析
2018-01-08杜江波靳光付沈洪兵胡娅莉
翁 侨, 杜江波, 俞 飞, 靳光付, 沈洪兵*, 胡娅莉*
1. 南京大学医学院附属鼓楼医院妇产科,南京 210008 2. 南京医科大学公共卫生学院流行病学系,南京 211166
孕妇及其新生儿端粒长度的影响因素分析
翁 侨1, 杜江波2, 俞 飞2, 靳光付2, 沈洪兵2*, 胡娅莉1*
1. 南京大学医学院附属鼓楼医院妇产科,南京 210008 2. 南京医科大学公共卫生学院流行病学系,南京 211166
目的全面评估孕期各种因素对孕妇及新生儿端粒长度的影响,为探讨端粒在疾病发生和发展中的作用机制提供依据。方法2015年3月—2016年2月在南京大学医学院附属鼓楼医院出生444例新生儿,对其母亲进行问卷调查、体格检查和临床相关指标检测,并采集新生儿脐静脉血及其配对的母体外周血样本。采用定量PCR法测量各样本的相对端粒长度。然后采用配对t检验比较母儿端粒长度,采用一般线性模型分析新生儿与母亲端粒长度等连续性变量之间的相关性,采用方差分析法和t检验分析不同亚组间相对端粒长度的差异。结果新生儿相对端粒长度(均数为0.358)明显大于母亲相对端粒长度(均数为0.309,P<0.001),未发现母儿端粒长度之间有明显的相关性(r2=0.004,P=0.174)。母亲受教育程度越高,新生儿相对端粒长度越长(P=0.022);而孕周、分娩方式、新生儿性别和出生体质量均与母婴端粒长度无明显相关性。孕期摄入奶制品较多,母体相对端粒长度较短(P=0.048);孕期摄入蔬菜水果、肉制品、动物内脏、鱼虾、豆制品、煎烤及腌制食品、叶酸及多种维生素不同组之间,新生儿和母体的相对端粒长度差异均无统计学意义;孕期饮用咖啡,新生儿相对端粒长度较短(P=0.011);孕期二手烟暴露、饮酒及饮茶情况对母体和新生儿相对端粒长度均无明显影响;孕期经常参加体育锻炼的母体相对端粒长度较不锻炼或很少锻炼者长(P=0.01),新生儿相对端粒长度未见明显差异(P=0.187)。结论受教育程度以及孕期摄入奶制品、饮用咖啡和参加体育锻炼可能影响孕妇或新生儿的端粒长度,为进一步揭示端粒在疾病发生发展中的作用提供了线索。
端粒缩短;孕妇;胎血;影响因素
端粒是特异性结合蛋白与真核细胞染色体末端TTAGGG六碱基重复序列串联组成的复合体,与衰老和疾病风险高度相关。端粒长度主要取决于出生时端粒长度和出生后氧化应激的程度[1]。因此,对出生时端粒长度开展研究,有助于预测疾病发生风险以及阐明端粒相关疾病的发病机制。
有研究发现,孕期母亲的精神压力与新生儿脐血单核细胞端粒长度线性相关,并且可能通过胎盘血流改变或代谢改变对子代产生影响[1];孕早期母亲血清叶酸浓度每增加10 ng/mL,新生儿脐血白细胞端粒长度可延长5.8%[2];而母亲吸烟等生活方式会导致新生儿端粒缩短[3]。极低体质量早产儿的端粒长度长于低体质量早产儿,且随着孕周增加,端粒长度明显缩短[4]。随后Cross等[5]研究发现,新生儿脐血端粒长度与父亲年龄、孕周、母亲吸烟、母亲社会剥夺指数、新生儿出生体质量、脐血炎性反应标志物水平均无相关性。Imam等[3]研究发现,母亲外周血白细胞端粒长度与新生儿脐血端粒长度正相关;然而Njajou等[6]基于人群的家族研究则发现,父亲的寿命和端粒长度与子代端粒长度相关,但母亲的寿命和端粒长度与其子女端粒长度无明显相关性。由此可见,有关出生时端粒长度的影响因素,目前的研究结论尚不一致。因此,采用大样本量和更加严谨设计的研究策略对新生儿出生时母婴端粒长度的影响因素进行深入分析,就显得十分必要。
本研究采用一般线性模型深入分析444例配对的孕妇外周血及其新生儿脐静脉血端粒长度与各种环境因素的相关性,以期明确新生儿出生时端粒长度的影响因素,为了解及预测端粒相关疾病提供依据。
1 资料与方法
1.1 一般资料 本研究入组病例为2015年3月—2016年2月在南京鼓楼医院进行孕检及生产的444例产妇。所有病例均为单胎妊娠,28周以后分娩,排除死胎、死产。本研究采用横断面研究,对444例产妇外周血及相应新生儿脐血的端粒长度进行检测,采用一般线性模型分析各种社会人口学因素、环境因素与端粒长度的相关关系。
1.2 研究方法
1.2.1 流行病学调查 为实现流行病学调查过程的标准化并保证调查质量,本研究针对调查问卷内容制定了专门的调查手册,由妇产科学专业和流行病学专业的研究人员进行问卷调查,并使用统一设计的生育状况记录表。调查内容主要包括一般人口学资料,个人健康状况,职业暴露情况,孕期吸烟、饮酒等生活方式,遗传病史及疾病家族史等;妊娠及分娩相关信息以及临床诊治资料从病历档案中摘录。其中,关于受教育程度:初等教育是指最高学历为小学或以下;中等教育是指最高学历为中学,包括初级中学、高级中学或中等专科学校;高等教育是指最高学历为大学或以上。根据世界卫生组织对二手烟暴露的定义,以孕妇在家庭或工作场所每周被动吸烟15 min以上判定为存在二手烟暴露,否则定义为非二手烟暴露。
所有参与的调查人员在现场调查开展前需接受统一培训及预调查。所有的研究对象由经过培训的调查人员进行面访调查,调查开始前需征求调查对象同意,并由调查对象填写参与本次研究的知情同意书。调查问卷经过质量控制评估合格后,使用EpiData 3.0软件进行双轨录入。
1.2.2 脐血和外周血DNA端粒长度检测 使用美国Life Technologies公司的TaqMan 9700 PCR扩增仪扩增端粒重复序列的拷贝数(telomere repeat copy number,T)和单拷贝基因36B4的拷贝数(single copy gene 36B4 copy number,S),通过T/S比值相对定量母体外周静脉血及新生儿脐静脉血基因组DNA的相对端粒长度(relative telomere length,RTL)。引物序列见表1。RTL是由PCR扩增获得的Ct值计算所得[7]:RTL=2-(ΔCt1-ΔCt2)。其中,ΔCt1是待测样本DNA的端粒扩增Ct值与单拷贝基因36B4扩增的Ct值之差,而ΔCt2是标准DNA端粒扩增的Ct值与单拷贝基因36B4扩增的Ct值之差。

表1 端粒长度测量所需引物相关信息
1.3 统计学处理 采用STATA version 9.2(STATA Corp LP)软件进行数据分析。母血和脐血之间端粒长度的比较采用t检验,不同亚组间端粒长度差异的比较采用方差分析和t检验;采用一般线性模型分析母血、脐血端粒长度之间的相关性,以及与其他连续性变量之间的相关性。检验水准(α)为0.05。
2 结 果
2.1 母婴端粒长度的分布情况及二者相关性 444例配对的母体外周静脉血和新生儿脐静脉血样本中,母血提取的DNA平均含量为99.7 ng/μL、D260/D280为1.88,脐血提取的DNA平均含量为101 ng/μL、D260/D280为1.86,两者差异无统计学意义(P<0.05)。母血和脐血RTL均呈近似正态分布(图1);母血RTL(均数为0.309)明显短于新生儿脐血RTL(均数为0.358,P<0.001;图2);母血和脐血RTL之间无明显相关性(r2=0.004,P=0.174;图2)。
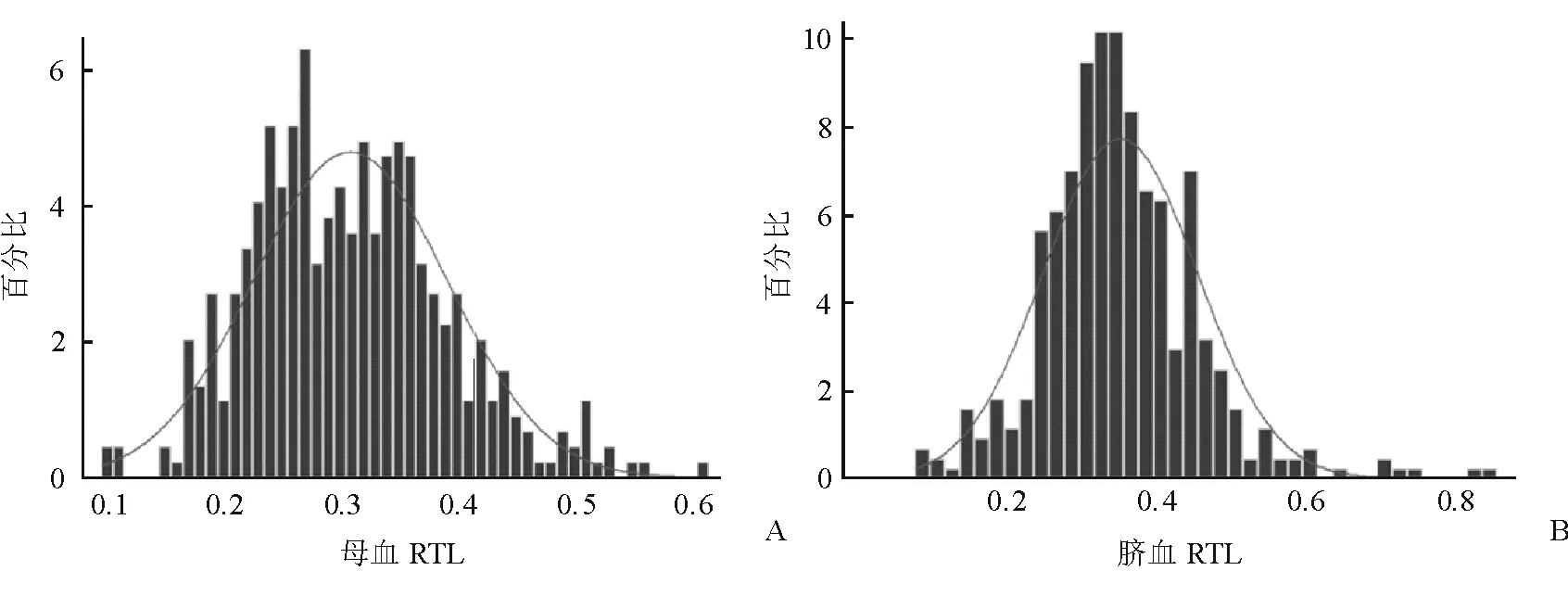
图1 产妇外周血(A)和新生儿脐带血(B)端粒长度分布的直方图
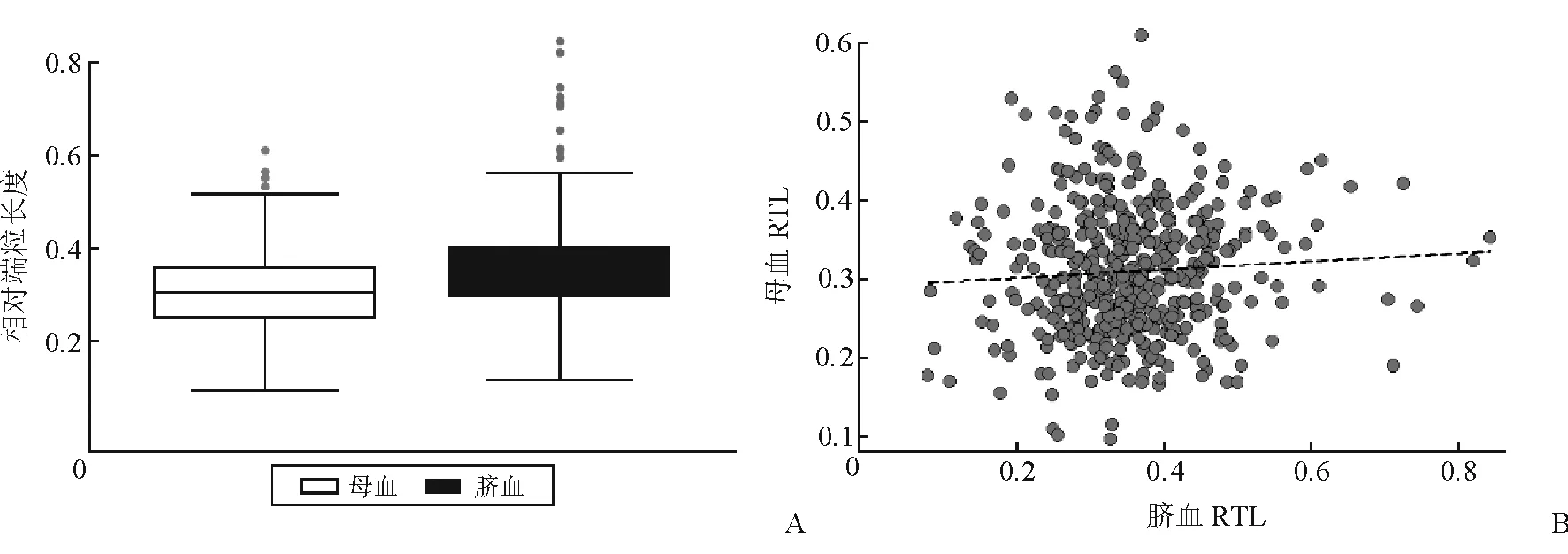
图2 产妇外周血和新生儿脐带血相对端粒长度的比较(A)以及相关性分析(B)
2.2 环境因素与母血及脐血端粒长度的关联研究
2.2.1 产妇一般情况亚组间RTL的比较 结果(表2)表明:不同产妇年龄阶段的母血和脐血RTL差异均无统计学意义。母亲受教育程度越高,母血端粒长度越短,差异无统计学意义;对应的新生儿脐血端粒长度越长,差异有统计学意义(P=0.05)。分娩孕周越大,母亲端粒长度越短,差异无统计学意义;脐血端粒长度未见明显改变。剖宫产和阴道分娩组母血、脐血RTL差异均无统计学意义。
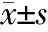
表2 产妇一般情况亚组间母血及脐血相对端粒长度的比较 N=444,
2.2.2 新生儿一般情况亚组间RTL的比较 结果(表3)表明:女性新生儿组母血及脐血RTL均略长于男性新生儿组,但差异无统计学意义;不同新生儿出生体质量组的母血及脐血RTL差异也无统计学意义。
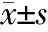
表3 新生儿一般情况亚组间母血及脐血相对端粒长度的比较 N=444,
2.2.3 母儿一般情况与RTL的回归分析 结果(表4)表明:产妇年龄与母血及脐血RTL没有相关性;产妇受教育程度与母血RTL无明显相关性,但与脐血RTL明显正相关(P=0.022);分娩孕周与母血及脐血RTL无明显相关性;新生儿出生体质量与母血及脐血RTL也无相关性。
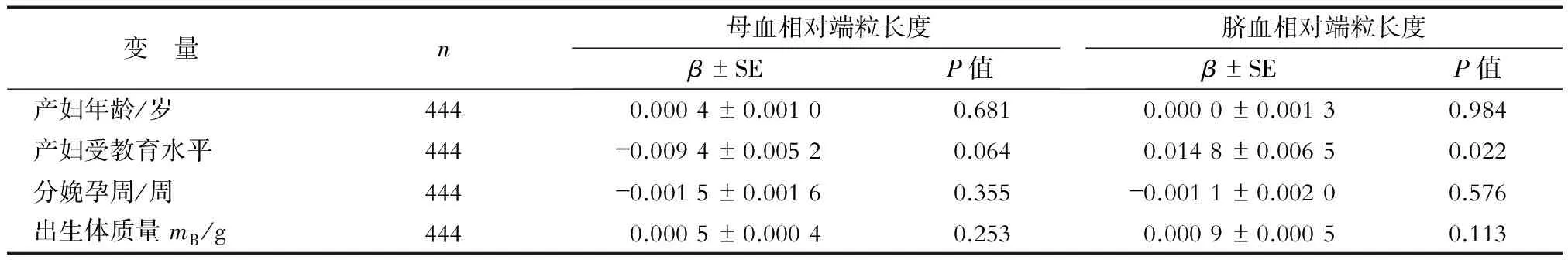
表4 母血及脐血相对端粒长度与母儿一般情况的回归分析
2.2.4 孕期膳食摄入亚组间RTL的比较 结果(表5)表明:孕妇摄入蔬菜水果、肉制品和动物内脏、鱼虾、豆制品、煎烤及腌制食品不同亚组之间,母血和脐血RTL均未见明显差异;孕妇摄入奶制品较多组母血RTL较摄入奶制品较少组短(P=0.048),但两亚组脐血RTL差异无统计学意义。
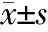
表5 孕期膳食摄入不同亚组间母血及脐血相对端粒长度的比较 N=444,
2.2.5 孕期膳食补充剂摄入亚组间RTL比较 结果(表6)表明:在叶酸以及多种维生素补充摄入不同亚组之间,母血和脐血RTL差异均无统计学意义。
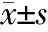
表6 孕期膳食补充剂摄入不同亚组间母血及脐血相对端粒长度的比较 N=444,
2.2.6 孕期生活方式亚组间RTL的比较 结果(表7)表明:孕期存在二手烟暴露与没有二手烟暴露两亚组间,母血和脐血RTL差异均无统计学意义;孕期饮酒和饮茶不影响母血和脐血RTL;孕期饮用咖啡组脐血RTL短于不饮用咖啡组(P=0.011),两亚组母血RTL差异无统计学意义;孕期经常参加体育锻炼组母血RTL长于不锻炼或很少锻炼组(P=0.010),脐血RTL差异无统计学意义。
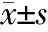
表7 相对端粒长度在孕期生活方式亚组间比较 N=444,
3 讨 论
既往基于人群的研究[8-10]已证实,端粒长度与年龄负相关。本研究发现,新生儿端粒长度比母亲端粒长度长15%;这也证实了端粒在细胞分裂过程中呈进行性缩短,这一特性使其成为记录人体衰老进程的“生物时钟”[11]。然而,本研究尚未发现产妇的端粒长度与年龄负相关的证据,这可能与本研究入组产妇的年龄跨度较小有关。本研究中产妇年龄为19~42岁,大多数为20~40岁。已有大量研究[12-14]证实,随着年龄增长,端粒长度并非呈线性缩短,端粒缩短的速率在儿童期和老年期较快,而在成年期相对稳定。Aubert等[15]研究还发现,出生后第1年端粒缩短的速率是1~18岁的10倍,是19岁以后的28倍,而到了50岁以后,端粒缩短的速率再度增加[16-17]。由此可见,在本研究对象中,端粒缩短的速率处于最微弱状态,年龄间的差异极小。另外,孕妇更加倾向于健康的生活方式并且尽可能减少不良的外在暴露,也是端粒缩短不明显的重要原因。近期一项经过5年随访的前瞻性研究[18]发现,通过改善生活方式能够增加端粒长度。因此,本研究中入组产妇在孕期采取健康的生活方式很可能一定程度上稀释了年龄的端粒损耗。本研究还发现,新生儿端粒长度与母亲端粒长度没有明显的线性相关性;这与Imam[3]的研究结论相反,但与Njajou等[6]和Nordfjall等[19]的研究结果一致,今后还需更大样本量的独立研究进行评估。
本研究发现,母亲受教育水平不同,新生儿端粒长度有明显差异。分析其原因,可能高学历的孕妇更可能有较高的收入水平,更可能在孕期保持健康的饮食和生活方式,因此孕妇的高学历可能是其子代保持较长端粒的有利因素。近期Wojcicki等[20]在拉丁美洲新生儿中也得到相似的结果。该研究发现,母亲受到高等教育的新生儿端粒长度明显长于母亲受低等教育的新生儿,并且母亲的受教育程度与社会经济状态正相关,而社会经济状况较低又与成人及儿童端粒长度较短明显相关。另外,也有多个研究证实,炎性反应状态会导致端粒缩短[21]。近期一项研究[22]报道,较低的受教育水平与炎性反应的生物标志物——C反应蛋白水平升高显著相关。
已有研究[12,23-26]报道,成年女性的端粒长度长于成年男性的端粒长度。近期,Benetos等[27]研究相同及不同性别的双胞胎时发现,性别之间端粒长度的差异主要是胎儿在子宫内就已经发生,这种差异与不同性别胎儿激素分泌不同有关。随后的一项研究也指出,男性新生儿出生时端粒长度较女性新生儿短,推测与宫内雌激素对端粒酶产生激活作用相关[20]。本研究中,尽管女性新生儿的端粒长度较男性新生儿长4%,但差异无统计学意义,这可能与本研究入组样本量较小有关。今后还需要进一步增加样本量以研究不同性别胎儿及其宫内环境对端粒长度的潜在影响。
关于奶制品摄入与端粒长度的关系,目前尚有争议。近期一项针对韩国中年人的队列研究发现,奶制品摄入与端粒长度正相关[28]。而Gu等[29]研究发现,非西班牙裔白人摄入奶制品增多与端粒长度缩短相关。Song等[30]对1 481名绝经后妇女的饮食情况进行研究,发现在调整了年龄、种族、体质指数、吸烟、饮酒和饮食等混杂因素的影响后,女性摄入非脱脂牛奶越多,端粒长度越短,而在1 228名摄入脱脂牛奶的妇女中则未见端粒长度有明显差异;推测其可能原因是,非脱脂牛奶的脂肪含量较高,造成氧化应激增加,从而导致端粒长度缩短。本研究也发现孕期奶制品的摄入与孕妇端粒长度负相关,这不排除与孕妇摄入的奶制品中相当一部分含脂较高有关。但是本研究没有发现孕期奶制品的摄入对新生儿端粒长度有明显影响。
对于蔬菜、水果、肉类、鱼虾、豆制品和维生素等摄入与端粒长度的相关性,既往的研究报道较少,而且已有的研究局限于欧洲人群,研究结论也不一致。有研究[7,29,31]发现,蔬菜水果摄入和端粒长度没有相关性;但也有研究得出相反的结论[28,32]。Nettleton等[33]研究发现,肉制品的摄入与端粒长度负相关;但是Mirabello等[34]的研究则没有相同发现。而本研究中也未发现孕期蔬菜、肉类、鱼虾、豆制品和维生素等摄入与母亲及新生儿端粒长度相关。以上研究结果不一致的原因可能为:(1)饮食的多样化使得仅用调查表无法准确定量食物摄入以及摄入的某种食物占全部饮食的比例;(2)不同种族和地区的人群对于食物组成的需求不同;(3)由于端粒长度的影响因素众多,尽管有许多研究已经调整了各种协变量,但是一些潜在的混杂因素无法完全排除,这也可能对研究结果造成影响。
咖啡被认为具有抗氧化作用,因此有助于维持端粒长度[28]。但本研究发现饮用咖啡对母血端粒长度没有明显影响,但脐血端粒长度明显缩短。本研究结果可能与样本量较小有关,还可能是由于在中国人群尤其是孕妇在孕期饮用咖啡并不多见,即使饮用,量也很少,因此无法得出与国外非孕人群一致的结论。孕期饮用咖啡说明不注意改善生活方式,这可能是本研究中孕期饮用咖啡者脐血端粒长度缩短的一个原因。国外关于咖啡摄入与端粒长度的关系研究也有不一致的结论。一项多中心研究共纳入包括美国白人、黑人、西班牙裔和华裔等840例研究对象,发现饮用咖啡并不影响端粒长度[33]。因此,未来还需要更大样本、涉及多个地区和种族的队列研究,进一步探讨饮用咖啡对端粒长度的影响。
本研究还发现,孕期经常保持体育锻炼的产妇端粒长度长,这与既往研究[35]结论一致。英国的双胞胎及遗传流行病学研究中心通过调查双胞胎志愿者的体育活动水平,发现孪生同胞中运动较多的比运动较少的端粒平均长88 bp;在调整年龄、性别、体质指数、吸烟情况和社会经济状态的影响后,二者仍然具有显著差异,由此认为久坐生活方式会缩短端粒长度,而规律的体育锻炼对于维持端粒长度有重要作用[35]。近年来一项5年随访研究还发现,通过坚持适度的有氧运动能够延长个体的外周血端粒长度。孕期健康的生活方式可能通过增加抗氧化蛋白的基因表达以及减少炎症因子的分泌来影响端粒长度[18]。
综上所述,本研究首次较全面地评估了孕期各种社会环境暴露对产妇及新生儿端粒长度的影响,发现受教育程度、摄入奶制品、饮用咖啡、体育锻炼频率影响母亲或新生儿端粒长度,这对于进一步全面评价母亲和新生儿端粒长度的影响因素提供了重要的依据,并为揭示端粒在疾病发生和发展过程中发挥作用的生物学机制提供了线索。
[ 1 ] ENTRINGER S, EPEL E S, LIN J, et al. Maternal psychosocial stress during pregnancy is associated with newborn leukocyte telomere length[J]. Am J Obstet Gynecol, 2013, 208(2): 134.e1-e7.
[ 2 ] ENTRINGER S, EPEL E S, LIN J, et al. Maternal folate concentration in early pregnancy and newborn telomere length[J]. Ann Nutr Metab, 2015, 66(4): 202-208.
[ 3 ] IMAM T, JITRATKOSOL M H, SOUDEYNS H, et al. Leukocyte telomere length in HIV-infected pregnant women treated with antiretroviral drugs during pregnancy and their uninfected infants[J]. J Acquir Immune Defic Syndr, 2012, 60(5): 495-502.
[ 4 ] FRIEDRICH U, SCHWAB M, GRIESE E U, et al. Telomeres in neonates: new insights in fetal hematopoiesis[J]. Pediatr Res, 2001, 49(2): 252-256.
[ 5 ] CROSS J A, TEMPLE R C, HUGHES J C, et al. Cord blood telomere length, telomerase activity and inflammatory markers in pregnancies in women with diabetes or gestational diabetes[J]. Diabet Med, 2010, 27(11): 1264-1270.
[ 6 ] NJAJOU O T, CAWTHON R M, DAMCOTT C M, et al. Telomere length is paternally inherited and is associated with parental lifespan[J]. Proc Natl Acad Sci USA, 2007, 104(29): 12135-12139.
[ 7 ] CHAN R, WOO J, SUEN E, et al. Chinese tea consumption is associated with longer telomere length in elderly Chinese men[J]. Br J Nutr, 2010, 103(1): 107-113.
[ 8 ] VALDES A M, ANDREW T, GARDNER J P, et al. Obesity, cigarette smoking, and telomere length in women[J]. Lancet, 2005, 366(9486): 662-664.
[ 9 ] BLASCO M A. Telomeres and human disease: ageing, cancer and beyond[J].Nat Rev Genet,2005,6(8): 611-622.
[10] ISHII A, NAKAMURA K, KISHIMOTO H, et al. Telomere shortening with aging in the human pancreas[J]. Exp Gerontol, 2006, 41(9): 882-886.
[11] BOJESEN S E. Telomeres and human health[J]. J Intern Med, 2013, 274(5): 399-413.
[12] NAWROT T S, STAESSEN J A, GARDNER J P, et al. Telomere length and possible link to X chromosome[J]. Lancet, 2004, 363(9408): 507-510.
[13] FRENCK R J, BLACKBURN E H, SHANNON K M. The rate of telomere sequence loss in human leukocytes varies with age[J]. Proc Natl Acad Sci USA, 1998, 95(10): 5607-5610.
[14] YAMAGUCHI H, CALADO R T, LY H, et al. Mutations in TERT, the gene for telomerase reverse transcriptase, in aplastic anemia[J]. N Engl J Med, 2005, 352(14): 1413-1424.
[15] AUBERT G, BAERLOCHER G M, VULTO I, et al. Collapse of telomere homeostasis in hematopoietic cells caused by heterozygous mutations in telomerase genes[J]. PLoS Genet, 2012, 8(5): e1002696.
[16] BAIRD D M, BRITT-COMPTON B, ROWSON J, et al. Telomere instability in the male germline[J]. Hum Mol Genet, 2006, 15(1): 45-51.
[17] CAWTHON R M, SMITH K R, O’BRIEN E, et al. Association between telomere length in blood and mortality in people aged 60 years or older[J]. Lancet, 2003, 361(9355): 393-395.
[18] ORNISH D, LIN J, CHAN J M, et al. Effect of comprehensive lifestyle changes on telomerase activity and telomere length in men with biopsy-proven low-risk prostate cancer: 5-year follow-up of a descriptive pilot study[J]. Lancet Oncol, 2013, 14(11): 1112-1120.
[19] NORDFJALL K, LAREFALK A, LINDGREN P, et al. Telomere length and heredity: Indications of paternal inheritance[J]. Proc Natl Acad Sci USA, 2005, 102(45): 16374-16378.
[20] WOJCICKI J M, OLVEDA R, HEYMAN M B, et al. Cord blood telomere length in Latino infants: relation with maternal education and infant sex[J]. J Perinatol, 2016, 36(3): 235-241.
[21] AIKATA H, TAKAISHI H, KAWAKAMI Y, et al. Telomere reduction in human liver tissues with age and chronic inflammation[J]. Exp Cell Res, 2000, 256(2): 578-582.
[22] DINWIDDIE G Y, ZAMBRANA R E, DOAMEKPOR L A, et al. The impact of educational attainment on observed race/ethnic disparities in inflammatory risk in the 2001-2008 National Health and Nutrition Examination Survey[J]. Int J Environ Res Public Health, 2016, 13(1): 42.
[23] FITZPATRICK A L, KRONMAL R A, GARDNER J P, et al. Leukocyte telomere length and cardiovascular disease in the cardiovascular health study[J]. Am J Epidemiol, 2007, 165(1): 14-21.
[24] BROUILETTE S W, MOORE J S, MCMAHON A D, et al. Telomere length, risk of coronary heart disease, and statin treatment in the West of Scotland Primary Prevention Study: a nested case-control study[J]. Lancet, 2007, 369(9556): 107-114.
[25] DU J, ZHU X, XIE C, et al. Telomere length, genetic variants and gastric cancer risk in a Chinese population[J]. Carcinogenesis, 2015, 36(9): 963-970.
[26] GARDNER M, BANN D, WILEY L, et al. Gender and telomere length: systematic review and meta-analysis[J]. Exp Gerontol, 2014, 51: 15-27.
[27] BENETOS A, DALGARD C, LABAT C, et al. Sex difference in leukocyte telomere length is ablated in opposite-sex co-twins[J]. Int J Epidemiol, 2014, 43(6): 1799-1805.
[28] LEE J Y, JUN N R, YOON D, et al. Association between dietary patterns in the remote past and telomere length[J]. Eur J Clin Nutr, 2015, 69(9): 1048-1052.
[29] GU Y, HONIG L S, SCHUPF N, et al. Mediterranean diet and leukocyte telomere length in a multi-ethnic elderly population[J]. Age (Dordr), 2015, 37(2): 24.
[30] SONG Y, YOU N C, SONG Y, et al. Intake of small-to-medium-chain saturated fatty acids is associated with peripheral leukocyte telomere length in postmenopausal women[J]. J Nutr, 2013, 143(6): 907-914.
[31] GARCIA-CALZON S, MOLERES A, MARTINEZ-GONZALEZ M A, et al. Dietary total antioxidant capacity is associated with leukocyte telomere length in a children and adolescent population[J]. Clin Nutr, 2015, 34(4): 694-699.
[32] TIAINEN A M, MANNISTO S, BLOMSTEDT P A, et al. Leukocyte telomere length and its relation to food and nutrient intake in an elderly population[J]. Eur J Clin Nutr, 2012, 66(12): 1290-1294.
[33] NETTLETON J A, DIEZ-ROUX A, JENNY N S, et al. Dietary patterns, food groups, and telomere length in the Multi-Ethnic Study of Atherosclerosis (MESA) [J]. Am J Clin Nutr, 2008, 88(5): 1405-1412.
[34] MIRABELLO L, HUANG W Y, WONG J Y, et al. The association between leukocyte telomere length and cigarette smoking, dietary and physical variables, and risk of prostate cancer[J]. Aging Cell, 2009, 8(4): 405-413.
[35] CHERKAS L F, HUNKIN J L, KATO B S, et al. The association between physical activity in leisure time and leukocyte telomere length [J]. Arch Intern Med, 2008, 168(2): 154-158.
Influence factors for maternal and neonatal telomere length
WENG Qiao1, DU Jiang-bo2, YU Fei2, JIN Guang-fu2, SHEN Hong-bing2*, HU Ya-li1*
1.Department of Obstetrics and Gynecology, Nanjing Drum Tower Hospital, Nanjing University Medical College, Nanjing 210008, Jiangsu, China 2.Department of Epidemiology, School of Public Health, Nanjing Medical University, Nanjing 211166, Jiangsu, China
Objective: To comprehensively investigate the environmental factors influencing maternal and neonatal telomere length at birth, and to provide evidences for exploring the role of telomere in pathogenesis and development of diseases.MethodsFrom March 2015 to February 2016, 444 newborns and their mothers in Nanjing Drum Tower Hospital were enrolled. Questionnaire surveys, physical examinations and clinical assessments were conducted in pregnant women, and the maternal peripheral blood samples as well as their matching umbilical venous blood samples were collected. The relative telomere length was measured by quantitative PCR method. The maternal telomere length and neonatal telomere length were compared by pairedttest. The telomere length between different subgroups was compared by variance analysis andttest. The correlation between maternal telomere length and neonatal telomere length as well as the correlations of telomere length with other continuous variables were analyzed by using general linear model.ResultsThe overall telomere length of cord blood was significantly longer than that of maternal blood (0.358vs0.309,P<0.001), but there was no significant correlation between telomere length of maternal blood and telomere length of cord blood (r2=0.004,P=0.174). There was a significant positive correlation between maternal education level and the telomere length of cord blood (P=0.022). There were no obvious correlations of maternal and neonatal telomere length with gestational age, delivery mode, newborn sex and birth weight . The more dairy intake during pregnancy, the shorter maternal telomere length (P=0.048). There were no significant differences of maternal and neonatal telomere length among different subgroups intaking fruits, vegetables, meat, animal offal, fish, shrimp, bean products, baked and preserved food, folic acid and vitamins. Coffee drinking during pregnancy was significantly associated with shorter neonatal telomere length (P=0.011). Second hand smoke exposure, alcohol consumption and tea drinking during pregnancy were not significantly associated with maternal and neonatal telomere lengths. Longer maternal telomere length was observed in those taking physical exercise during pregnancy (P=0.01), but no significant difference was observed in neonatal telomere length (P=0.187).ConclusionsVarious environment exposures such as education level, intake of dairy products, coffee drinking and physical exercise during pregnancy have significant effects on maternal and neonatal telomere length. This study provides valuable clues for further revealing the role of telomere in diseases.
telomere shortening; pregnant women; fetal blood; influencing factors
2017-09-10接受日期2017-11-14
中央高校基本科研专项资金(021414380319). Supported by the Fundamental Research Funds for the Central Universities (021414380319).
翁 侨,博士,主治医师. E-mail: shuishangfanyi@sina.com
*通信作者(Corresponding authors). Tel: 025-86869077,E-mail: hbshen@njmu.edu.cn;Tel:025-83106666,E-mail: glyyhuyali@163.com
10.12025/j.issn.1008-6358.2017.20170777
R 394.1
A
[本文编辑] 叶 婷,张艺鸣
