供氮浓度对白桦幼苗生物量、碳氮含量与储量的影响
2018-01-06李海霞张妍妍白卉邢亚娟
李海霞+张妍妍+白卉+邢亚娟

摘要: 研究了不同供氮水平(1、4、8、16 mmol/L)对温室内沙培白桦幼苗根、茎、叶生物量、叶绿素含量、氮含量以及碳氮储量和器官分配的影响。结果表明,供氮水平对白桦幼苗不同器官干生物量、叶绿素含量、氮含量以及碳氮储量的影响不同。地上部分和地下部分生物量在高氮(16 mmol/L)条件下达最大;在N8水平下,叶绿素a、叶绿素b、叶绿素a+b总量以及类胡萝卜素含量比低氮(N1)分别增加了99.2%、70.0%、89.5%和83.8%;幼苗根、茎、叶中的全氮含量在N8水平下达最大,但碳、氮储量由于受生物量影响,均是在高氮供应下达最大。总体来看,增加氮的供应有助于白桦幼苗的生长,生长末期幼苗大部分的营养分配到了根部。
关键词: 白桦;供氮水平;生物量;碳氮储量
中图分类号: Q945.12;S792.153.05 文献标志码: A
文章编号:1002-1302(2017)22-0156-03
氮是植物生长所必需的大量营养元素,在植物生长、发育和繁殖等过程中有着重要的作用。自然状态下,很多生态系统生产力都表现为氮限制、磷限制或者氮磷共限制 。氮素的供应量及其有效性制约着林木的生长速度及生长状态,比其他任何一种营养元素更能限制植物的生产力[3-4],明显影响植物对碳同化物质的分配格局。
白桦(Betula platyphylla)属桦木科(Betulaceae)桦木属(Betula L.)植物,在我国14个省区有分布。白桦生长快、适应性强、材质优良,是造纸、胶合板材和家具制造的重要原料,也是培育单板类人造板材速生丰产林的首选树种之一[5-8]。本研究以白桦幼苗为试验材料,研究供氮水平对白桦幼苗不同器官生长、生理以及碳、氮储量与分配的影响,进一步明确不同氮浓度对白桦幼苗生长的影响机制,旨在为白桦幼苗合理施肥提供依据。
1 材料与方法
1.1 材料来源
试验所用苗木为1年生白桦播种苗。本试验在全自动温室中进行,室内温度25 ℃左右,湿度50%~60%。
1.2 研究方法
1.2.1 试验设计与处理方法
2015年4月将白桦幼苗根部用清水洗净后,用高锰酸钾溶液进行消毒,再用蒸馏水清洗3遍后装至盛有河沙的钵中栽培,钵底径10.0 cm,上口径 15.0 cm,高10.0 cm,钵上沿空出2~3 cm,以便浇水和浇灌营养液,每钵移植白桦幼苗1株。营养液中各成分及浓度如下:4 mmol/L NH4NO3,1 mmol/L CaCl2·6H2O,1 mmol/L KH2PO4,0.6 mmol/L MgSO4·7H2O,1 mmol/L KCl,0.021 mmol/L FeCl3·6H2O,6 μmol/L MnCl2·4H2O,0.016 mmol/L H3BO3,0.3 μmol/L ZnCl2,0.3 μmol/L Na2MoO4·2H2O,0.3 μmol/L CuCl2·2H2O,用Ca(OH)2或H2SO4把pH值调整到5.5左右。
5月末进行不同供氮水平处理。设置4个梯度:1 mmol/L(N1)、4 mmol/L(N4)、8 mmol/L(N8)、16 mmol/L(N16),通過调节NH4NO3浓度来实现。各个处理均为15株,3次重复。在进行不同处理时,其他营养成分不变。每周二和周五08:00—09:00时浇1次营养液,每次每钵浇50 mL。除周二和周五外每天上午和下午分2次浇水,每次每钵约100 mL[9]。
1.2.2 测定指标与方法
9月中旬,将处理的白桦幼苗从钵中取出,用流水将河沙冲洗干净,将处理过的苗木带回实验室用电子天平分根、茎和叶称量鲜质量,然后置于75 ℃烘箱里烘干至恒质量,测量干质量,每个处理均取3株幼苗,单株重复,重复3次。
叶绿素含量的测定:称取0.1 g剪碎的新鲜叶片,加少量石英砂和碳酸钙粉及2 mL 95%乙醇,研成匀浆;再加乙醇 10 mL,继续研磨至组织变白;倒入25 mL棕色容量瓶中,用乙醇定容,离心;以95%乙醇为空白,取上清液用T6紫外可见分光光度计分别测定470、649、665、652 nm处的吸光度(D),各叶绿素含量计算公式如下:
每处理均取3株幼苗,单株重复,重复3次。
碳氮含量的测定:将白桦幼苗分根、茎和叶烘干粉碎,用浓H2SO4-H2O2进行消煮,滤液定容到100 mL容量瓶,用德国耶拿multiN/C2100s碳氮分析仪测定全氮。碳含量的测定采用固体燃烧法,选取100 mg粉碎样品,在1 100 ℃高温下充分燃烧,测定样品中的全碳含量。每处理均取3株幼苗,单株重复,重复3次。碳(氮)储量=碳(氮)浓度×生物量。
1.3 数据处理
所有数据采用Microsoft Excel软件整理作图,采用SPSS 16.0软件进行方差分析。
2 结果与分析
2.1 氮处理对白桦幼苗生物量的影响
植物生态系统生物量大小受到土壤中可利用营养元素、土壤pH值、温度、降水等多种理化因子的影响[10]。其中氮是许多生态系统中限制植物生长最关键的营养元素,因此氮输入的增加可提高土壤中可利用氮的含量,消除或缓解氮的限制,促进植物的生长。
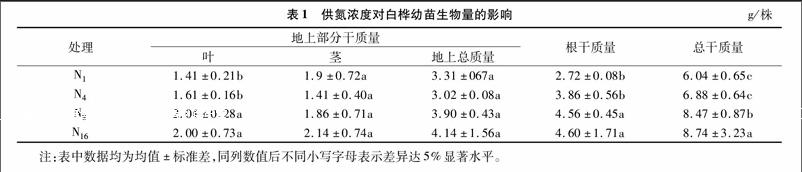
由表1可知,随着供氮浓度的增加,白桦叶的生物量逐渐增加,在N8时达到最大,为2.04 g/株,比N1增加了 30.88%。在高氮(N16)供应时,叶的生物量有所下降,但差异不显著(P=0.536>0.05)。茎生物量在N16供应下达最大,为2.14 g/株,地上总生物量也在N16水平下达最大,为 4.14 g/株。根生物量与地上部分变化相似,在N16水平下达最大,为4.60 g/株。endprint
经方差分析,不同供氮浓度对根、叶以及总干质量的影响差异显著(根P<0.05,叶P<0.05,总质量P<0.05)。根、茎和叶这3个器官生物量的变化最终导致白桦幼苗全株总生物 量在1~16 mmol/L的供氮范围内在N16时达最大,为 8.74 g/株, 比N1、N4、N8分别增加了30.93%、21.24%和3.09%。
2.2 氮处理对白桦幼苗叶片色素含量的影响
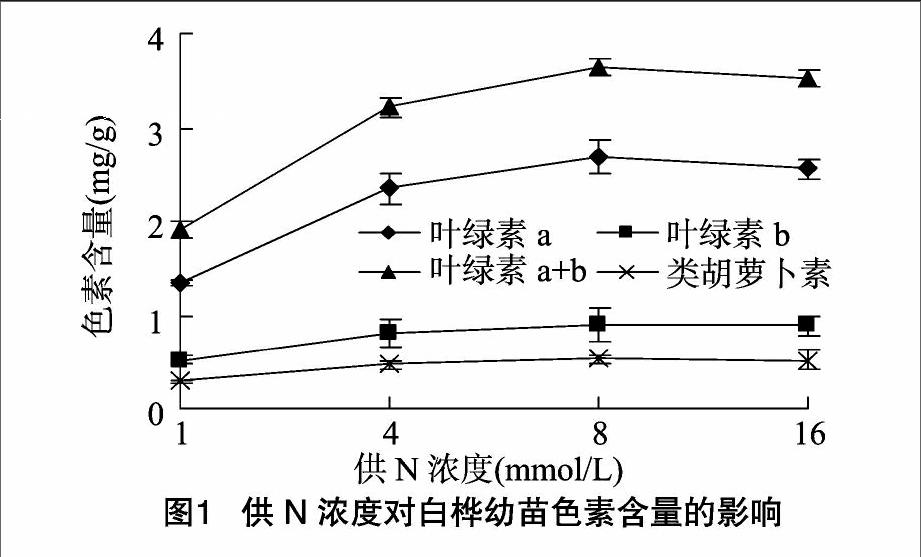
由图1可以看出,随供N浓度的提高白桦幼苗叶中叶绿素a、叶绿素b、叶绿素a+b总量、类胡萝卜素含量均增加,在供N浓度为 8 mmol/L(N8)时达最大,叶绿素a、叶绿素b、叶绿素a+b总量、类胡萝卜素含量分别为2.68、0.88、3.63和0.53 mg/g,与N1相比净增加幅度为99.2%、70.0%、89.5%和83.8%。当超过N8时,叶绿素含量有所下降。
2.3 氮处理对白桦幼苗全氮含量的影响
氮是限制植物生长最重要的大量元素之一[11],它直接限制着森林生产力[12-14]。有研究表明植物根系的氮吸收能力与根系内部含量呈负相关[15],当土壤中的养分含量非常丰富或者施肥量过高时,叶片和根系的氮含量与土壤养分供给量不成正比[16],但当其成为限制性资源时,根系中的养分含量和叶片中的养分含量也相应降低。
在本研究中,随着氮素供应量的增加,白桦幼苗根、茎、叶中氮的浓度均呈上升趋势(图2)。相对于其他器官,叶片中氮浓度最高,根次之,茎最低,可见幼苗吸收的氮素主要分配到了幼苗的叶部分。根中全氮浓度在N16(16 mmol/L)处理下达到了最大值,为14.72 mg/g,分别比N1、N4、N8增加了40%、18.6% 和20.5%,但茎中氮的浓度在正常供氮N8(8 mmol/L)最高,超过正常供氮,反而有所下降,由正常供氮的12.45 mg/g降为10.8 mg/g。叶中全氮浓度的变化与茎相似,这说明增加氮的供应量可导致幼苗根、茎、叶中氮的积累。
2.4 供氮水平对白桦幼苗碳含量的影响
从图3可以看出,白桦幼苗茎中碳含量最高,叶次之,根最低。经方差分析可知,在本试验中,不同的供氮浓度对全碳含量的影响差异不显著。
2.5 供氮水平对白桦幼苗氮、碳积累量的影响
氮在苗木体内不同器官的积累分配反映苗木的营养状态。由图4-A可以看出,在不同供氮浓度下,白桦幼苗根中氮积累量最大,叶次之,茎最少。随着供氮浓度的增加,氮积累量逐渐增加。白桦幼苗体内氮积累量在不同供氮浓度下差异显著(根、茎、叶P<0.05)。根中氮积累量在N16下达最大,为67.76 mg/株,分别是N1、N4、N8的2.36、1.41、1.21倍,这主要是由生物量引起的。茎和叶中氮积累量均在N8水平下达最大,分别为23.09 mg/株和36.96 mg/株,N8茎中氮含量是N1、N4的1.38和1.69倍,N8叶片中氮积累量是N1、N4、N16的1.64、1.31、1.10倍。这主要是由氮浓度和生物量共同作用导致的。
白桦幼苗各器官(根、茎、叶)碳积累量在不同供氮水平下差异显著(P<0.05)(图4-B)。根和茎随着供氮水平的升高,积累量逐渐增加,在N16水平下达最大,分别为 1 650.80 mg/株 和858.22 mg/株,其中根部N16水平下碳积累量是N1、N4、N8的1.81、1.25、1.09倍,N16莖中碳积累量是N1、N4、N8的1.09、1.50、1.13倍,而叶的碳积累量在N8水平下达最大,为768.62 mg/株。
3 结论与讨论
在自然条件下,土壤中的矿质元素受到限制或有效性降低,都会限制树木的生长。因此, 在氮养分缺乏的土壤中,加大氮的供应会促进树木生长。但如果氮供应过量,则可能对幼苗生长产生抑制作用[17]。在本研究中,白桦幼苗中叶的生物量在高氮供应下有所降低,可能就是由于高氮供应抑制了叶片的生长。根和茎的生物量超过正常供氮虽仍在增加,但增加幅度逐渐降低。营养成分的供应不仅影响生物量的大小,而且还与生物量的分配有关。有研究表明,供应养分受到限制时,光合物质的分配更有利于地下生长[18]。在本研究中,不同氮浓度供应下白桦幼苗根的生物量占总生物量的45.1%~56.1%。
在本试验中,白桦幼苗根系、茎和叶中全氮浓度均因供氮水平的增加而提高,说明树木对氮的吸收与供氮水平密切相关。但幼苗组织中全氮浓度在高氮水平下又有所降低,说明高氮供应对幼苗营养的吸收有一定程度的抑制。幼苗中叶片和根系的全氮浓度比茎要高,这主要是因为根系和叶片作为营养器官,其组织中的养分含量相对较高,而茎作为运输功能的组织,其养分含量相对较低[19]。
植物根系中碳的积累与分配主要取决于茎中的碳向根系中的转运量,而茎所能转运的碳量的多少又与植物的光合作用关系密切[20]。根系中,碳的积累量的增加导致根生长加快,并最终表现在生物量的增高上,这也导致白桦幼苗根系中的碳氮积累量大于茎和叶。在本研究中,供氮水平 与白桦幼苗组织碳含量没有呈现出有规律的变化,有待下一步补充研究。
参考文献:
[1] Elser J J,Bracken M E,Cleland E E,et al. Global analysis of nitrogen and phosphorus limitation of primary producers in freshwater,marine and terrestrial ecosystems[J]. Ecology Letters,2007,10(12):1135-1142.
[2]Vitousek P M,Porder S,Houlton B Z,et al. Terrestrial phosphorus limitation:mechanisms,implications,and nitrogen-phosphorus interactions[J]. Ecological Applications,2010,20(1):5-15.endprint
[3]Cassman K G,Kropff M J,Gaunt J,et al. Nitrogen use efficiency of rice reconsidered:what are the key constraints?[J]. Plant and Soil,1993,155-156(1):359-362.
[4]Crawford N M,Glass A D. Molecular and physiological aspects of nitrate uptake in plants[J]. Trends in Plant Science,1998,3(10):389-395.
[5]李天芳,姜 静,杨传平,等. 我国白桦育种研究概况[J]. 江苏林业科技,2008,35(2):47-49.
[6]刘福妹,姜 静,刘桂丰. 施肥对白桦树生长及开花结实的影响[J]. 西北林学院学报,2015,30(2):116-120.
[7]郁书君,汪 天,金宗郁,等. 白桦容器栽培试验(Ⅰ)[J]. 北京林业大学学报,2001,23(1):24-28.
[8]俞天珍. 白桦在青海省育苗成功的技术措施[J]. 甘肃科技纵横,2005,34(4):59.
[9]李海霞,李正华,郭树平,等. 不同氮磷水平对红松幼苗碳氮积累与分配的影响[J]. 西北林学院学报,2013,28(5):24-29.
[10] Chapin F I,Matson P A. Principles of terrestrial ecosystem ecology[M]. 2nd ed. New York:Springer-Verlag,2011.
[11]Ludovici K H,Morris L A. Responses of loblolly pine,sweetgum and crab grass roots to localized increases in nitrogen in two watering regimes[J]. Tree Physiology,2004,16(11_12):933-939.
[12]Zhao M,Xiang W,Tian D,et al. Effects of increased Nitrogen deposition and rotation length on long-term productivity of Cunninghamia lanceolata plantation in southern China[J]. PLoS One,2013,8(2):e55376.
[13]Lu X K,Mo J M,Gundersern P,et al. Effect of simulated N deposition on soil exchangeable cations in three forest types of subtropical China[J]. Pedosphere,2009,19(2):189-198.
[14]Miller A J,Fan X R,Orsel M,et al. Nitrate transport and signalling [J]. Journal of Experimental Botany,2007,58(9):2297-2306.
[15]Jones H E,Ohlsson H. Nutrient assessment of a forest fertilization experiment in northern Sweden by root bioassays[J]. Forest Ecology and Management,1991,64:59-69.
[16]berg P H. Lars hgbom and helga schinkel.nitrogen-related root variables of trees along an n-deposition gradient in Europe[J]. Tree Physiology,1998,18(12):823-828.
[17]范志強,王政权,吴 楚,等. 不同供氮水平对水曲柳苗木生物量、N分配及其季节变化的影响[J]. 应用生态学报,2004,15(9):1497-1501.
[18]肖文发,徐德应. 森林能量利用与产量形成的生理生态基础[M]. 北京:中国林业出版社,1999:34-39.
[19]Lareher W. Plant ecophysiology[M]. Germany:Verlag Eugen Ulmer Gmbh and Co,1993.
[20]那守海,郝铁钢,阎秀峰. 供氮水平对落叶松根系碳,氮积累与分配的影响[J]. 东北林业大学学报,2007,35(11):19-22.endprint
