微流控芯片在肿瘤仿生模型构建中的应用
2018-01-06刘婷姣
刘婷姣
(大连医科大学 口腔医学院 口腔病理学教研室,辽宁 大连 116044)
专家述评
微流控芯片在肿瘤仿生模型构建中的应用
刘婷姣
(大连医科大学 口腔医学院 口腔病理学教研室,辽宁 大连 116044)
微流控芯片是一种在微米尺度下对流体进行精确操控的新技术,已被证明是对哺乳动物细胞及其微环境进行操控的理想平台。本文拟围绕肿瘤转移过程中的一些关键环节,对微流控芯片在肿瘤仿生模型构建中的应用作一综述。目前,基于微流控芯片技术构建的肿瘤仿生模型主要包括:肿瘤原发灶模型、肿瘤细胞诱导血管新生模型、肿瘤细胞内渗模型、肿瘤细胞外渗模型、肿瘤多器官转移模型等。相对于传统的体外研究方法,这些仿生模型很大程度上再现了体内的肿瘤微环境,逐渐成为肿瘤研究极重要的平台。
微流控芯片;肿瘤;仿生模型
微流控芯片(microfluidic chip)又称芯片实验室(lab on a chip),是一种可在微米尺度下精确操控流体的新技术,具有微型化和高通量的特点,并兼具可单元组合和功能集成的优势[1-4]。微流控技术可以同时处置分子、细胞、组织、器官,显示物理量、化学量和生物量,已经被证明是对哺乳动物细胞及其微环境进行操控的理想平台,它消耗低、通量高、仿生性强。得益于现代化的微加工技术和微通道内精准的流体控制,研究者已经可以在微流控芯片上构建微米量级且相对封闭的细胞培养、刺激、分选、裂解、分析等操作单元,并把这种成功延伸到组织和器官的仿生模拟[4]。目前,微流控芯片仿生肺、仿生肝、仿生肾、仿生心脏、仿生肠等已见诸报道,这些研究从学术角度证明,在一块仅有几平方厘米的薄片上模拟人体生理结构,实现所谓芯片器官(organ on a chip)已经可行[5-9]。
肿瘤是全球性疾病,在导致人类死亡的疾病中位居第二,仅次于心血管疾病,远处转移是导致患者死亡的最主要原因。肿瘤转移是个复杂的过程,以血行转移为例通常包括以下几个步骤:(1)瘤细胞在原位增殖、侵袭;(2)原发灶瘤细胞进入血管,即内渗;(3)瘤细胞逃避免疫监视在血液循环中存活下来,成为循环肿瘤细胞(circulating tumor cell, CTC);(4)CTC在远处器官黏附于内皮细胞并穿出血管,即外渗;(5)进入远处器官的瘤细胞克隆性增殖形成转移灶[10-13]。本课题组是国内较早从事医学与微流控芯片学科交叉研究的科研团队,我们以微流控芯片为技术平台成功构建了多个肿瘤模型。以下将围绕肿瘤转移过程中的一些关键环节对微流控芯片在肿瘤仿生模型构建中的应用做一简单介绍。
1 肿瘤原发灶模型
肿瘤原发灶是一个复杂的包括多种细胞(如瘤细胞和肿瘤间质细胞)、细胞外基质(extracellular matrix, ECM)和细胞因子的组织微环境,肿瘤微环境对瘤细胞的生长、侵袭和转移等发挥重要的调控作用[14-15]。基于微流控芯片的肿瘤原发灶模型主要是将瘤细胞、间质细胞、ECM和细胞因子等集成于一块芯片,模拟肿瘤微环境。
传统细胞培养器材包括培养皿、培养瓶和孔板等,常常对细胞进行贴壁培养,即二维(two dimentional, 2D)细胞培养。但是,越来越多的研究结果证实当细胞处于由ECM组成的三维(three dimentional, 3D)微环境中时,其生物学行为及所表达的基因更接近于体内状况,由此导致体外3D细胞培养被越来越多的研究者所重视并采纳[16-19]。目前常用的ECM替代物包括商品化的基底膜样物质,例如BD公司的Matrigel TM和R&D公司的Cultrex PathClear Basement Membrane Extract(BME)。此外,I型胶原也常被用于细胞3D培养。在微流控芯片上进行的细胞3D培养,不但为细胞提供ECM支架,还可以利用微流控技术在ECM内形成生长因子的浓度梯度,考察癌细胞在生长因子诱导下的侵袭过程(图1A)[20]。3D培养的肿瘤细胞还常常表现出对化疗药物的耐药性增加[21-23]。因此,基于微流控芯片的细胞3D培养有可能成为筛选化疗药物的一个重要平台[24-26]。
除ECM以外,肿瘤微环境中的间质细胞对肿瘤发生发展发挥重要的调控作用[27-29]。研究者利用微流控芯片的多维网络结构为不同种类的细胞构建培养空间,在芯片上实现异种细胞的3D共培养,考察细胞间的相互作用。例如,本课题组在微流控芯片平台上实现了癌相关成纤维细胞(carcinoma-associated fibroblasts, CAFs)与唾液腺癌细胞的非接触式3D共培养(图1B),发现在CAFs的诱导下癌细胞的侵袭能力明显增强,以细胞团的形式侵入邻近基质内[30]。Jeong SY等[31]研究者将结直肠癌细胞与成纤维细胞共培养,结果发现癌细胞的增殖活性和基因表达与单独3D培养的癌细胞比较均发生明显的变化。Kobayashi A等[32]利用微流控芯片细胞图案化功能将肝癌细胞和成纤维细胞排列成紧密相邻的条带,结果表明肝癌细胞分泌白蛋白的功能显著增强。这些实验结果均表明癌细胞与间质细胞的3D共培养为癌细胞提供了一个与体内接近的微环境,这些微流控芯片有望成为肿瘤研究的理想平台。
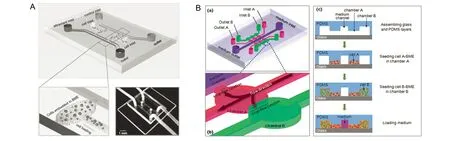
A:细胞3D培养微流控芯片;B:细胞3D共培养微流控芯片图1 细胞3D培养及3D共培养微流控芯片[20, 30]Fig 1 Tumor cells 3D culture and co-culture on microfluidic chips[20,30]
2 肿瘤细胞诱导血管新生模型
血管新生(angiogenesis)是指从原有血管通过“芽生”的方式形成新的腔状毛细血管的过程,涉及ECM的降解及血管内皮细胞的增殖[33]。出芽的内皮细胞包括位于最前端的端细胞(tip cells)和紧随其后的茎细胞(stalk cells)及方阵细胞(phalanx cells)。端细胞具有长的丝足,侵袭能力较强,能够引导其他内皮细胞朝着有血管生成刺激因素的方向生长;茎细胞紧随端细胞之后,具有较强的增殖能力,可以形成新的管腔;在发育成熟的血管中,内皮细胞增殖活力较弱,紧密排列成方阵样,有利于血流的顺利通过,此处的内皮细胞称为方阵细胞。
肿瘤组织的微血管密度常常高于正常组织,这是由于肿瘤细胞具有活跃的诱导血管新生能力[34-35]。体外构建肿瘤诱导的血管新生模型至少需要包括肿瘤细胞、血管内皮细胞、ECM、血管新生诱导因子等要素,并为血管新生提供适当的空间。本课题组以微流控技术为主要手段构建了一个肿瘤细胞诱导的血管新生体外模型,在微流控芯片上模拟肿瘤原发灶和微血管,二者之间以血管新生通道相连。研究结果表明瘤细胞的分泌物在血管新生通道内扩散形成浓度梯度,诱导血管内皮细胞出芽生长,产生具有长丝足的端细胞,位于新生血管的前沿。为进一步验证微流控模型的可靠性,我们比较了不同肿瘤细胞在微流控模型和裸鼠皮下移植瘤模型中的诱导血管新生能力,结果表明体外模型与体内模型的结果具有一致性,提示该微流控模型可以部分取代动物模型[36]。Shin Y等[37]详细描述了一种微流控芯片的设计,以及如何在芯片上进行肿瘤细胞和内皮细胞的3D-2D联合培养,进而诱导血管新生。Kim S等[38]研究者构建了一个具有5条平行通道的微流控芯片,通道间以微柱相隔,在不同的通道内分别接种血管内皮细胞、周细胞、成纤维细胞和癌细胞,培养一段时间后,内皮细胞向ECM通道出芽生长,形成了具有管腔的微血管,这些微血管表达VE-cadherin、CD31、ICAM-1等正常微血管的标志物,而且具有血管的屏障功能,并在一定时间内保持稳定(图2)。最近,该研究小组利用微流控技术精确控制生长因子的浓度和空间分布、内皮细胞-间质细胞相互作用、间隙流对淋巴管内皮细胞的机械刺激等多种化学和机械因素,在与上述研究结构相同的微流控芯片上成功再现了淋巴管新生。间隙流是指在ECM间隙内流动的液体,可以在毛细血管、淋巴管、ECM之间进行物质传递,这种缓慢流动的液体还对位于ECM内的细胞产生剪切力刺激,从而影响细胞的增殖和分化等。上述研究在微流控平台上证明间隙流对淋巴管的出芽和生长具有重要的调控作用[39]。
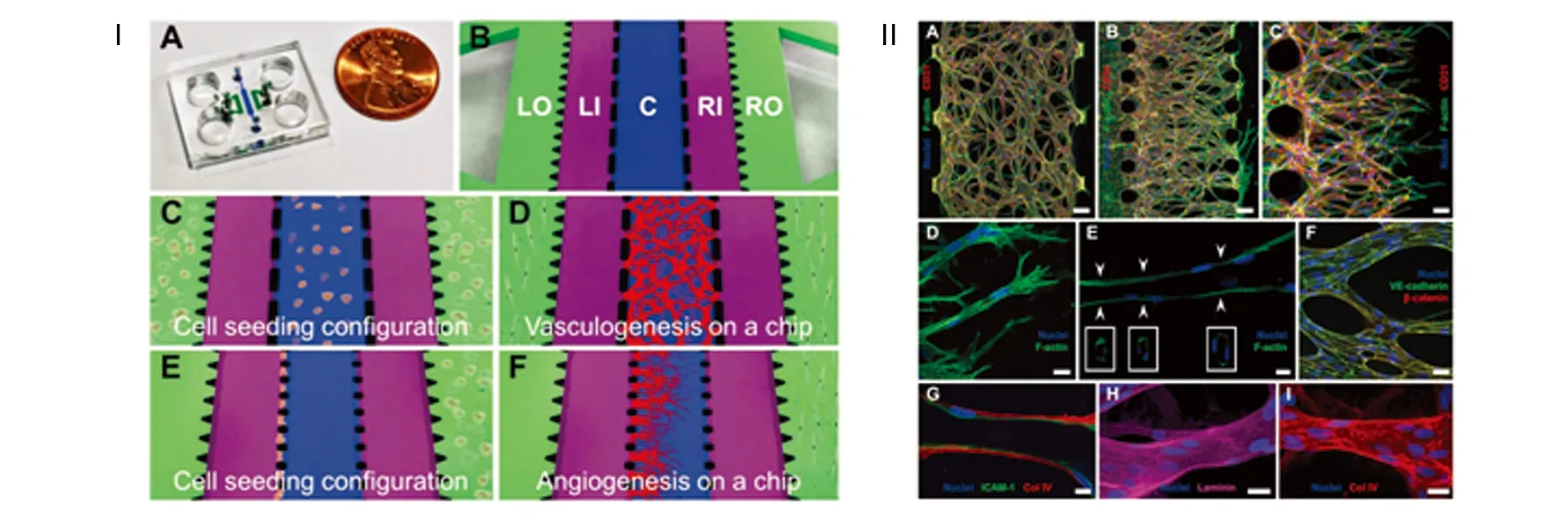
Ⅰ:微流控芯片照片及示意图;Ⅱ:新生血管免疫荧光照片图2 基于微流控芯片的血管新生[38]Fig 2 Angiogenesis on a microfluidic chip[38]
3 肿瘤细胞内渗模型
肿瘤细胞从原发灶侵入血管的内渗过程是肿瘤转移的一个重要环节,动物模型研究很难抓住到这一短暂的关键点。Zervantonakis IK等[40]研究人员构建了用于研究肿瘤细胞内渗的微流控芯片,该芯片由3条平行的通道组成,之间以微柱相隔,中间通道充满ECM替代物,两侧分别用于模拟微血管和肿瘤组织。研究者在该芯片上实时考察了肿瘤细胞与内皮细胞相互作用、瘤细胞穿过内皮细胞进入血管的动态过程,进一步发现巨噬细胞分泌的肿瘤坏死因子可以损伤血管内皮细胞的屏障功能,导致内渗肿瘤细胞数目显著增加。Lee H等[41]在微流控芯片上将血管内皮细胞、成纤维细胞、肿瘤细胞接种于不同的空间,模拟体内肿瘤微环境,改变肿瘤细胞的培养方式(2D培养或3D培养)和生长空间,肿瘤细胞表现出不同的生物学行为。例如将癌细胞进行3D培养时可以诱发血管新生,而将癌细胞进行2D培养时,可有诱发肿瘤细胞的内渗。
4 肿瘤细胞外渗模型
CTC经血液循环到达远处器官,黏附于血管内皮细胞,穿出血管壁的过程称为外渗,是肿瘤转移过程中的一个重要限速步骤。体外构建肿瘤细胞外渗模型至少需要集成CTC、血管、特异性血管周围组织等单元。生物学研究已经证实肺、肝、骨等器官高表达趋化因子CXCL12,乳腺癌细胞高表达CXCL12的受体CXCR4,CXCL12/CXCR4生物轴在乳腺癌的血行转移中发挥重要作用[42-43]。本课题组在微流控芯片上构建了内衬血管内皮细胞的微血管、具有CXCL12浓度梯度的管周基质,然后将高表达CXCR4的肿瘤细胞团加入微血管单元,实时考察了肿瘤细胞团在趋化因子诱导下穿过血管内皮细胞进入管周组织的内渗过程及其影响因素[44]。Bersini S等[45]在微流控芯片上诱导骨髓间充质干细胞分化为成骨细胞,用于模拟骨髓微环境,然后在邻近骨髓微环境的微血管通道内加入乳腺癌细胞,考察癌细胞穿过血管内皮细胞屏障进入骨髓微环境的外渗过程(图3)。
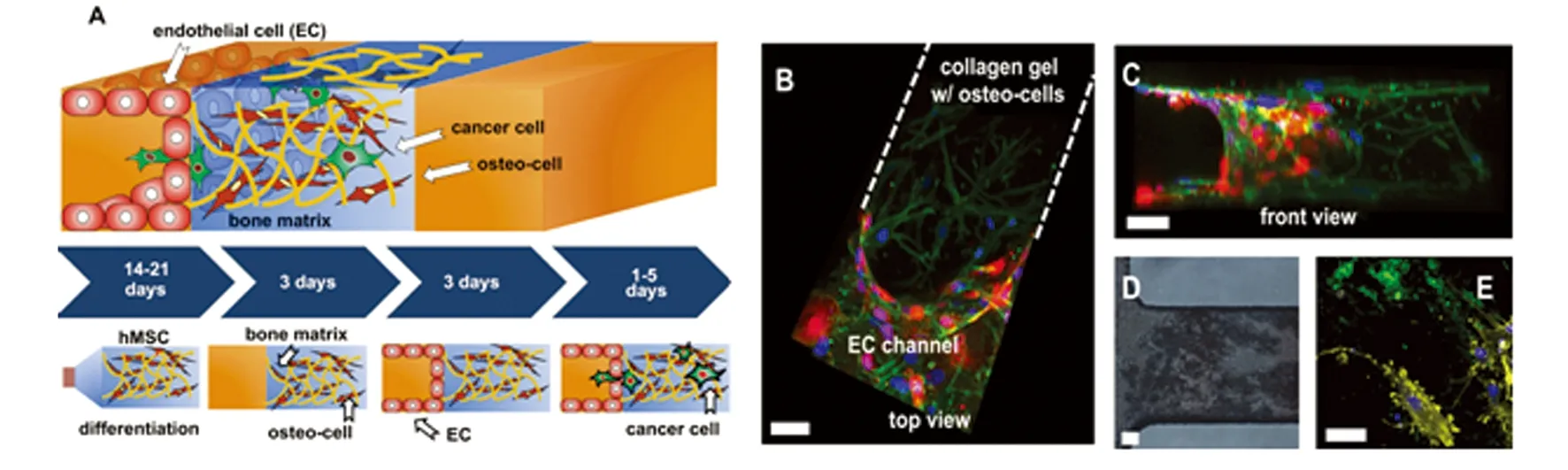
A:微流控芯片上细胞分布示意图;B:芯片上面观;C:芯片前面观;D:茜素红染色显示成骨细胞分化;E:成骨细胞分泌骨钙蛋白(绿色)图3 基于微流控芯片的肿瘤细胞外渗研究[45]Fig 3 Tumor extravasation on a microfluidic chip[45]
5 肿瘤多器官转移模型
肿瘤晚期可以发生多器官转移,体外构建肿瘤多器官转移模型有助于明确影响肿瘤转移的相关因素,以及筛选抗肿瘤转移药物。本课题组以微流控芯片为平台构建了肿瘤肺、肝、骨等多器官转移模型。该模型包括两个主要功能模块,上层模块包含4条分枝状的微通道,用于模拟血管;下层模块包括4个培养池,可以接种不同的细胞或组织,用于模拟不同的器官。我们在芯片模型上考察了肺、肝、骨、骨骼肌等原代细胞诱导的肿瘤转移,结果表明肿瘤细胞趋向于转移至仿生肺、肝、骨等单元,而很少转移至仿生骨骼肌单元。通过与肺转移动物模型相比较,肿瘤细胞在芯片模型上的转移能力与在动物模型上基本一致,提示该芯片模型有望在某种程度上取代动物模型[46]。
6 展 望
实验动物一直是肿瘤临床前研究的重要模型,但是动物模型价格昂贵,实验周期长,而且与人类存在种属差异性,极大地限制了肿瘤基础研究的发展和抗肿瘤药物的研发。随着材料学和微加工技术的不断发展,微流控技术在仿生模型上的应用越来越广泛,肿瘤仿生模型已逐渐克服以往细胞种类单一、功能简单等缺陷,逐步发展成为多器官和多功能的系统模型。我们期待微流控肿瘤仿生模型在将来能够逐渐替代实验动物,推动肿瘤研究的发展。
[1] Whitesides GM. The origins and the future of microfluidics[J]. Nature, 2006, 442 (7101): 368-373.
[2] 林炳承,秦建华.微流控芯片实验室[M]. 第1版.北京:科学出版社,2006.
[3] 林炳承. 微纳流控芯片实验室[M]. 第1版.北京:科学出版社,2017.
[4] Polini A, Prodanov L, Bhise NS, et al. Organs-on-a-chip: a new tool for drug discovery[J]. Expert Opin Drug Discov, 2014, 9(4):335-352.
[5] Huh D, Matthews BD, Mammoto A, et al. Reconstituting organ-level lung functions on a chip[J]. Science, 2010, 328(5986):1662-1668.
[6] Toh YC, Lim TC, Tai D, et al. A microfluidic 3D hepatocyte chip for drug toxicity testing[J]. Lab Chip, 2009, 9(14):2026-2035.
[7] Jang KJ, Suh KY. A multi-layer microfluidic device for efficient culture and analysis of renal tubular cells[J]. Lab Chip, 2010, 10(1):36-42.
[8] Ren L, Liu W, Wang Y, et al. Investigation of hypoxia-induced myocardial injury dynamics in a tissue interface mimicking microfluidic device[J]. Anal Chem, 2013, 85(1):235-244.
[9] Sung JH, Yu J, Luo D, et al. Microscale 3-D hydrogel scaffold for biomimetic gastrointestinal (GI) tract model[J]. Lab Chip, 2011, 11(3):389-392.
[10] Bidard FC, Mathiot C, Degeorges A, et al. Clinical value of circulating endothelial cells and circulating tumor cells in metastatic breast cancer patients treated first line with bevacizumab and chemotherapy[J]. Ann Oncol, 2010, 21(9):1765-1771.
[11] Kim MY, Oskarsson T, Acharyya S, et al. Tumor self-seeding by circulating cancer cells[J]. Cell, 2009, 139(7):1315-1326.
[12] Meng S, Tripathy D, Frenkel EP, et al. Circulating tumor cells in patients with breast cancer dormancy[J]. Clin Cancer Res, 2004, 10(24):8152-8162.
[13] Miller MC, Doyle GV, Terstappen LW. Significance of Circulating Tumor Cells Detected by the Cell Search System in Patients with Metastatic Breast Colorectal and Prostate Cancer[J]. J Oncol, 2010, 2010:617421.
[14] Hui L, Chen Y. Tumor microenvironment: Sanctuary of the devil[J]. Cancer Lett, 2015, 368(1):7-13.
[15] Ansell SM, Vonderheide RH. Cellular composition of the tumor microenvironment[J]. Am Soc Clin Oncol Educ Book, 2013,33:e91-e97.
[16] Weaver VM, Petersen OW, Wang F, et al. Reversion of the malignant phenotype of human breast cells in three-dimensional culture and in vivo by integrin blocking antibodies[J]. J Cell Biol, 1997, 137(1):231-245.
[17] Abbott A. Cell culture: biology's new dimension[J]. Nature, 2003, 424(6951):870-872.
[18] Jorgens DM, Inman JL, Wojcik M, et al. Deep nuclear invaginations are linked to cytoskeletal filaments - integrated bioimaging of epithelial cells in 3D culture[J]. J Cell Sci, 2017, 130(1):177-189.
[19] Simian M, Bissell MJ. Organoids: A historical perspective of thinking in three dimensions[J]. J Cell Biol, 2017, 216(1):31-40.
[20] Liu T, Li C, Li H, et al. A microfluidic device for characterizing the invasion of cancer cells in 3-D matrix[J]. Electrophoresis, 2009, 30(24):4285-4291.
[21] Bingel C, Koeneke E, Ridinger J, et al. Three-dimensional tumor cell growth stimulates autophagic flux and recapitulates chemotherapy resistance[J]. Cell Death Dis, 2017, 8(8):e3013.
[22] Wang K, Kievit FM, Erickson AE, et al. Culture on 3D Chitosan-Hyaluronic Acid Scaffolds Enhances Stem Cell Marker Expression and Drug Resistance in Human Glioblastoma Cancer Stem Cells[J]. Adv Healthc Mater, 2016, 5(24):3173-3181.
[23] Fischbach C, Chen R, Matsumoto T, et al. Engineering tumors with 3D scaffolds[J]. Nat Methods, 2007, 4(10):855-860.
[24] Jin D,Ma X, Luo Y, et al. Application of a microfluidic-based perivascular tumor model for testing drug sensitivity in head and neck cancers and toxicity in endothelium[J]. RSC Adv, 2016, 6(35):29598-29607.
[25] Xu Z, Gao Y, Hao Y, et al. Application of a microfluidic chip-based 3D co-culture to test drug sensitivity for individualized treatment of lung cancer[J]. Biomaterials, 2013, 34(16):4109-4017.
[26] Lee DH, Bae CY, Kwon S, et al. User-friendly 3D bioassays with cell-containing hydrogel modules: narrowing the gap between microfluidic bioassays and clinical end-users' needs[J]. Lab Chip, 2015, 15(11):2379-2387.
[27] Orimo A, Gupta PB, Sgroi DC, et al. Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion[J]. Cell, 2005, 121(3):335-348.
[28] Kalluri R, Zeisberg M. Fibroblasts in cancer[J]. Nat Rev Cancer, 2006, 6(5):392-401.
[29] Ostman A, Augsten M. Cancer-associated fibroblasts and tumor growth-bystanders turning into key players[J]. Curr Opin Genet Dev, 2009, 19(1):67-73.
[30] Liu T, Lin B, Qin J. Carcinoma-associated fibroblasts promoted tumor spheroid invasion on a microfluidic 3D co-culture device[J]. Lab Chip, 2010,10(13):1671-1677.
[31] Jeong SY, Lee JH, Shin Y, et al. Co-Culture of Tumor Spheroids and Fibroblasts in a Collagen Matrix-Incorporated Microfluidic Chip Mimics Reciprocal Activation in Solid Tumor Microenvironment[J]. PLoS ONE, 2016, 11(7):e0159013.
[32] Kobayashi A, Yamakoshi K, Yajima Y, et al. Preparation of stripe-patterned heterogeneous hydrogel sheets using microfluidic devices for high-density coculture of hepatocytes and fibroblasts[J]. J Biosci Bioeng, 2013, 116(6):761-767.
[33] Potente M, Gerhardt H, Carmeliet P. Basic and therapeutic aspects of angiogenesis[J]. Cell, 2011, 146(6):873-887.
[34] Zhao C, Yang H, Shi H, et al. Distinct contributions of angiogenesis and vascular co-option during the initiation of primary microtumors and micrometastases[J]. Carcinogenesis, 2011, 32(8):1143-1150.
[35] Hillen F, Griffioen AW. Tumour vascularization: sprouting angiogenesis and beyond[J]. Cancer Metast Rev, 2007, 26:489-502.
[36] Liu L, Xie Z, Zhang W, et al. Biomimetic tumor-induced angiogenesis and anti-angiogenic therapy in a microfluidic model[J]. RSC Adv, 2016, 6(42):35248-35256.
[37] Shin Y, Han S, Jeon JS, et al. Microfluidic assay for simultaneous culture of multiple cell types on surfaces or within hydrogels[J]. Nat Protoc, 2012, 7(7):1247-1259.
[38] Kim S, Lee H, Chung M, et al. Engineering of functional, perfusable 3D microvascular networks on a chip[J]. Lab Chip, 2013, 13(8):1489-1500.
[39] Kim S, Chung M, Jeon NL. Three-dimensional biomimetic model to reconstitute sprouting lymphangiogenesis in vitro[J]. Biomaterials, 2016, 78:115-128.
[40] Zervantonakis IK, Hughes-Alford SK, Charest JL, et al. Three-dimensional microfluidic model for tumor cell intravasation and endothelial barrier function[J]. Proc Natl Acad Sci USA, 2012,109(34):13515-13520.
[41] Lee H, Park W, Ryu H, et al. A microfluidic platform for quantitative analysis of cancer angiogenesis and intravasation[J]. Biomicrofluidics, 2014, 8(5):054102.
[42] Müller A, Homey B, Soto H, et al. Involvement of chemokine receptors in breast cancer metastasis[J]. Nature, 2001, 410(6824):50-56.
[43] Teicher BA, Fricker SP. CXCL12 (SDF-1)/CXCR4 pathway in cancer[J]. Clin Cancer Res, 2010, 16(11):2927-2931.
[44] Zhang Q, Liu T, Qin J. A microfluidic-based device for study of transendothelial invasion of tumor aggregates in realtime[J]. Lab Chip, 2012, 12(16):2837-2842.
[45] Bersini S, Jeon JS, Dubini G, et al. A microfluidic 3D in vitro model for specificity of breast cancer metastasis to bone[J]. Biomaterials, 2014, 35(8):2454-2461.
[46] Kong J, Luo Y, Jin D, et al. A novel microfluidic model can mimic organ-specific metastasis of circulating tumor cells[J]. Oncotarget, 2016, 7(48):78421-78432.
Biomimetictumormodelsbasedonmicrofluidicchips
LIU Tingjiao
(DepartmentofOralPathology,CollegeofStomatology,DalianMedicalUniversity,Dalian116044,China)
Microfluidic chips, a new technology for precisely manipulating fluids at the micron scale, have proven to be ideal platforms for manipulating mammalian cells and their microenvironments. This article aims to review the application of microfluidic chips in the construction of tumor biomimetic models around some key parts of tumor metastasis. Currently, tumor biomimetic models based on microfluidic chip technology mainly include tumor primary tumor model, tumor cell induced angiogenesis model, tumor cell infiltration model, tumor cell extravasation model and tumor multi-organ metastasis model. Compared with the traditional in vitro research methods, these bionic models reproduce the in vivo tumor microenvironment to a large extent and gradually become an important platform for tumor research.
microfluidic chip; tumor; biomimetic model
国家自然科学基金项目(30700955, 30872897, 81171425, 81571767);辽宁省教育厅项目(LR201013);辽宁省科技厅项目(20071080);中国博士后科学基金项目(20080441105);大连市优秀青年科技人才基金项目(2008J23JH037)
刘婷姣,教授,博士生导师。研究方向:基于微流控芯片的肿瘤仿生模型的构建和应用。E-mail: tingjiao@dmu.edu.cn
10.11724/jdmu.2017.06.01
R737. 33
A
1671-7295(2017)06-0521-06
刘婷姣.微流控芯片在肿瘤仿生模型构建中的应用[J].大连医科大学学报,2017,39(6):521-526.
2017-10-08;
2017-11-10)
