乳腺癌组织中CD68、VEGF的表达变化及意义
2018-01-06阎红琳吴昊高利昆饶洁袁静萍
阎红琳,吴昊,高利昆,饶洁,袁静萍
(武汉大学人民医院,武汉430060)
乳腺癌组织中CD68、VEGF的表达变化及意义
阎红琳,吴昊,高利昆,饶洁,袁静萍
(武汉大学人民医院,武汉430060)
目的探讨CD68和血管内皮生长因子(VEGF)在乳腺癌组织中的表达变化及其临床意义。方法采用免疫组化法检测230例份乳腺癌组织及相应癌旁组织中CD68和VEGF的表达,分析二者表达与乳腺癌临床病理参数、乳腺癌复发的关系以及二者表达的相关性。结果乳腺癌组织中CD68蛋白、VEGF蛋白阳性表达率均高于癌旁组织(P均<0.01)。CD68蛋白阳性表达与乳腺癌患者的临床分期、淋巴结转移、雌激素受体(ER)相关(P<0.05)。VEGF蛋白阳性表达与乳腺癌患者的ER相关(P<0.05)。CD68与VEGF蛋白在乳腺癌复发患者中的阳性表达率均高于未复发者(P均<0.05)。CD68蛋白与VEGF蛋白的表达呈正相关(rs=0.397,P<0.01)。结论乳腺癌组织CD68蛋白、VEGF蛋白表达升高,其二者可能协同参与了乳腺癌的发生、发展及复发。
乳腺癌;CD68;血管内皮生长因子;肿瘤微环境
乳腺癌是女性最常见的恶性肿瘤。肿瘤的侵袭转移是造成乳腺癌患者死亡的主要原因,而肿瘤微环境在癌细胞的侵袭转移过程中扮演了重要角色。免疫细胞是肿瘤微环境中重要的组成成分,肿瘤相关巨噬细胞(TAMs)作为免疫细胞浸润的代表,与癌细胞相互作用,促进肿瘤新生血管及淋巴管的形成,在癌侵袭转移过程中发挥重要作用[1]。血管内皮生长因子(VEGF)具有促进新生血管形成的作用,同时增加血管通透性,是肿瘤侵袭和转移的基础[2]。2017年5月,本文通过应用免疫组化SP法检测乳腺癌组织和相应癌旁组织中CD68(标记TMAs)和VEGF的表达,分析二者表达与乳腺癌临床病理参数、乳腺癌复发的关系以及二者表达的相关性,从而探讨其在乳腺癌发生发展中的作用,为临床治疗提供客观理论依据。
1 资料与方法
1.1 临床资料 选择武汉大学中南医院、武汉大学人民医院、武汉市中心医院三家医院2005年10月~2010年10月230例份乳腺癌组织及其癌旁组织(距离癌组织2 cm),均经病理检查确诊。患者均为女性,年龄29~78岁、平均48.9岁,术前未行放、化疗及内分泌治疗。包括乳腺浸润性导管癌 175 例、浸润性小叶癌27例、其他癌28例;组织学分级:G1 37例,G2 135 例,G3 58例;TNM分期:Ⅰ期14例,Ⅱ期148例,Ⅲ期68例。随访时间:随访自诊断之日开始计算,由乳腺癌导致的死亡视为第一终点,疾病复发作为第二终点,随访时间5年以上。复发标准:局部复发:乳腺癌术后在同侧乳腺内或同侧胸壁、锁骨上或下、腋窝或内乳淋巴结区域发现新的病灶,经病理诊断确诊;远处转移:癌细胞转移至对侧乳腺、颈部淋巴结、肺、骨、肝脏、脑等器官,经病理、B 超、胸腹部CT、骨扫描、X线检查等确诊。按照术后5年内是否复发将230例乳腺癌患者分为复发组(87例)和未复发组(143例)。
1.2 乳腺癌组织及癌旁组织中CD68、VEGF蛋白的检测 采用免疫组化SP法。操作步骤按说明书进行。 脱蜡、水化 ,PBS洗2次各5 min, 用蒸馏水或PBS配制新鲜的3% H2O2,室温封闭5~10 min,用蒸馏水洗3次,然后进行抗原修复,PBS洗5 min,滴加正常山羊血清封闭液,室温20 min,甩去多余液体,滴加Ⅰ抗50 μL,室温静置1 h或4 ℃过夜或37 ℃ 1 h、PBS洗3次各2 min。滴加生物素化Ⅱ抗,20 ℃20 min,PBS洗3次各2 min 。滴加试剂SABC 20 ℃ 20 min, PBS洗4次各5 min, DAB显色:试剂盒或自配显色剂显色,脱水、透明、封片、镜检。 即用型鼠抗人CD68单克隆抗体,即用型兔抗人VEGF多克隆抗体,即用型免疫组化超敏SP试剂盒,DAB显色试剂盒均购自DAKO公司。以PBS缓冲液代替一抗作为阴性对照,已知阳性切片作为阳性对照。CD68蛋白和VEGF蛋白在乳腺癌组织中主要定位于细胞质,呈棕黄色或棕褐色颗粒。根据阳性细胞数和着色深度计分,每例均随机观察计数5个高倍视野(×400) ,确定每个视野的阳性率,取平均数,按下列计分:阳性细胞≤5%为0分,>5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。阳性细胞表达的着色深度:基本不着色为0分,黄色为1分,棕黄色为 2分,棕褐色为3分。将2项积分相乘: ≥1 为阳性,<1为阴性。
1.3 统计学方法 采用SPSS22.0统计软件。计数资料以频次或百分比表示,比较采用χ2检验。相关性采用Spearman相关性分析法。P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌组织及癌旁组织CD68、VEGF蛋白的表达 CD68蛋白在乳腺癌组织中弥漫性或散在表达于癌巢、肿瘤间质或瘤周间质的巨噬细胞的胞膜或胞质,呈棕黄色或褐色颗粒。230例份乳腺癌组织中CD68阳性表达162例份(70.4%),癌旁组织中CD68阳性表达91例(39.6%),两者CD68阳性表达率比较,χ2=44.278,P<0.01。VEGF蛋白在乳腺癌组织中主要表达于细胞质,呈棕黄色颗粒。230例份乳腺癌组织中VEGF阳性表达157例份(68.3%),癌旁组织中VEGF阳性表达97例份(42.2%),两者VEGF阳性表达率比较,χ2=31.649,P<0.01。
2.2 乳腺癌组织中CD68、VEGF蛋白表达与患者临床病理参数的关系 CD68蛋白阳性表达与乳腺癌患者的临床分期、淋巴结转移、雌激素受体(ER)相关(P均<0.05),与年龄、绝经状态、组织学分级、人表皮生长因子受体2(HER-2)无关(P均>0.05)。VEGF蛋白阳性表达率与乳腺癌患者ER相关(P<0.05),与年龄、绝经状态、临床分期、组织学分级、淋巴结转移、HER-2无关(P均>0.05)。见表1。
2.3 CD68、VEGF蛋白表达与乳腺癌复发的关系 复发组乳腺癌组织中CD68、VEGF阳性表达率分别为79.3%(69/87)、77.0%(67/87),未复发组分别为65.0%(93/143)、62.9%(90/143),两组CD68、VEGF阳性表达率比较,χ2分别为5.293、4.946,P均<0.05。
2.4 CD68蛋白表达与VEGF蛋白表达的相关性分析 Spearman等级相关性分析结果显示,CD68 蛋白与VEGF蛋白的表达呈正相关(rs=0.397,P<0.01)。
3 讨论
乳腺癌是世界范围内最常见恶性肿瘤,它是导致女性癌症相关死亡的主要原因。TNM分期、组织学分级以及以ER、PR、HER2等为代表的乳腺癌分子分型是目前公认的乳腺癌治疗及预后的判断依据,但乳腺癌是一种高度异质性疾病,即使TNM分期、组织学分级或分子分型相同的不同乳腺癌患者间,其预后也可能完全不同。近年研究认为,乳腺癌的研究不能只局限于癌细胞,肿瘤微环境也是肿瘤进展的重要参与者,具有潜在的治疗价值。肿瘤微环境包括免疫细胞(如巨噬细胞和淋巴细胞)、内皮细胞、成纤维细胞、肌成纤维细胞,间充质干细胞、脂肪细胞、细胞外基质等[3]。在这些细胞中,巨噬细胞,尤其是TAMs是乳腺癌肿瘤微环境中的主要成分。巨噬细胞是免疫反应中的下游效应关键的执行者,在癌症发生过程中,巨噬细胞对于肿瘤微环境中的炎症反应具有重要的影响。基于肿瘤微环境的特性,巨噬细胞被极化成两种不同的表型:经典活化(M1)或替代活化(M2)巨噬细胞。传统上,M1型巨噬细胞有抗肿瘤活性,可准确地识别癌细胞并通过吞噬作用和细胞毒性杀死它们;M2型巨噬细胞则加速组织修复和生长。因此,肿瘤中M1型巨噬细胞的增加与肿瘤侵袭性降低有关,而M2型巨噬细胞的增加则促进肿瘤生长并导致预后不良[4]。还有一些巨噬细胞同时表现出M1和M2的行为,这主要取决于特定的生理病理条件以及肿瘤微环境[4]。一般情况下,TAMs被认为更接近于M2型巨噬细胞,在炎症与癌症发生中发挥重要作用。临床病理研究表明,肿瘤中TAMs聚集与临床预后差有关,特别是在乳腺癌中,高TAM密度与预后不良密切相关[5]。减少TAMs聚集或逆转巨噬细胞细胞的表型(M2表型向M1表型逆转)已在小鼠乳腺癌模型中被证实能够抑制肿瘤进展[6]。近年,关于TAMs在乳腺癌进展中的研究已经证实TAMs能够诱导血管生成,重塑细胞外基质,帮助肿瘤细胞免疫逃逸,以及招募免疫抑制白细胞至肿瘤细胞微环境[5]。近年开发出的各类抗肿瘤疗法(化疗、放射性治疗、靶向药物、免疫疗法等)其最终的效应大多是通过TAMs的功能实现的,因此基于TAMs的靶向治疗策略越来越受到研究者的关注[5]。CD68是标记TAMs最好的标记物,普遍用于各种肿瘤预后的预测,如甲状腺癌、胰腺癌、肺癌和肝细胞癌等[7]。本研究中CD68在乳腺癌中的阳性表达率高于癌旁组织,其表达与乳腺癌患者的临床分期、淋巴结转移、ER密切相关,同时是乳腺癌复发的因素之一,与国内外目前的研究基本相符,提示TAMs的表达与乳腺癌的发生发展及复发密切相关。
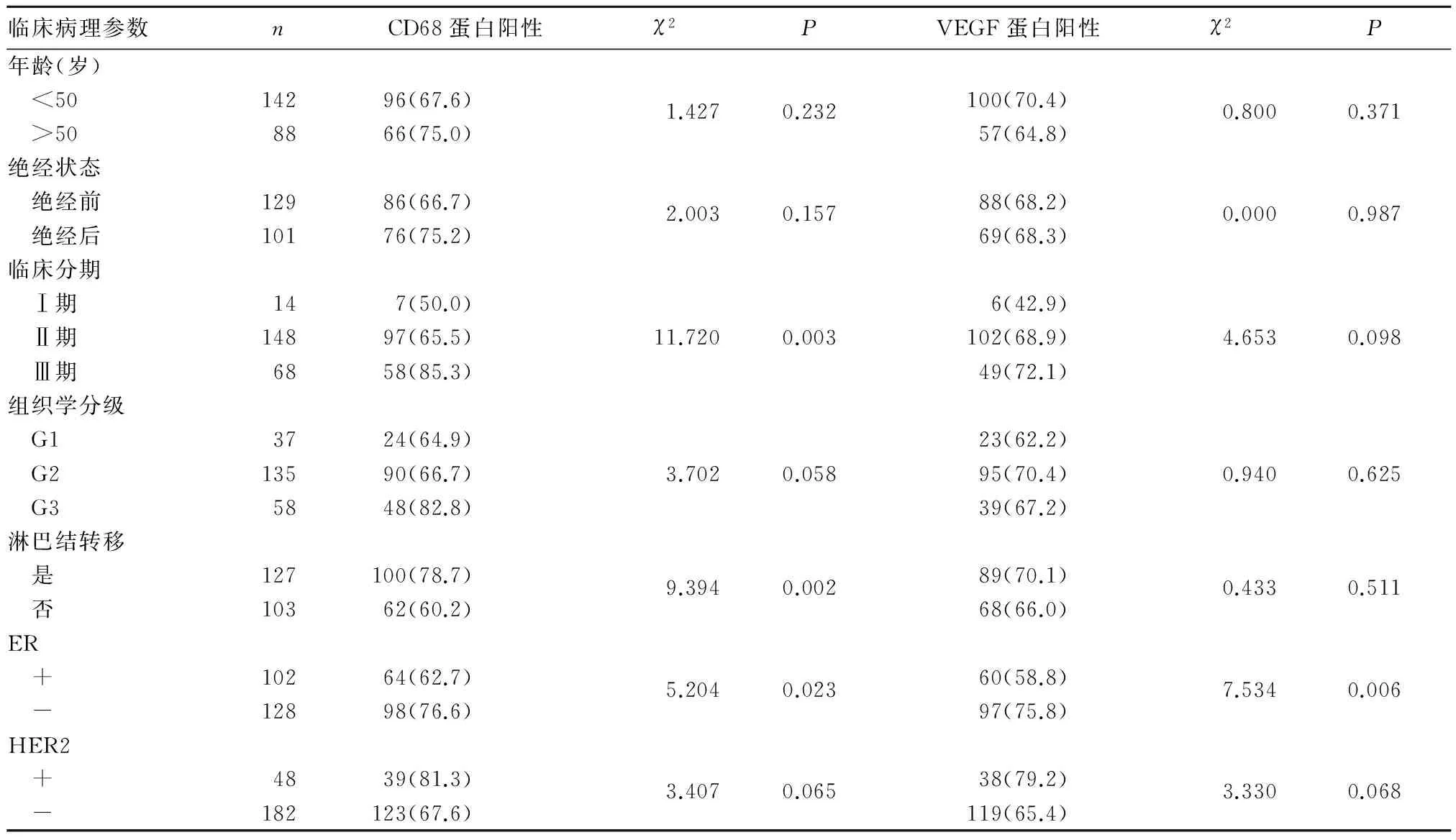
表 1 CD68、VEGF蛋白表达与乳腺癌患者临床病理参数的关系[例(%)]
TAMs促进乳腺癌进展的主要机制之一是促血管生成,而TAMs促进血管生长的能力是通过上调和释放一些促血管生成因子来介导的。VEGF是TAMs释放的主要促血管生成因子,包括VEGF-A、VEGF-B、VEGF-C、VEGF-D和胎盘生长因子等[8]。肿瘤血管生成主要包括三个步骤:血管周围细胞外基质的降解,内皮细胞的迁移、增殖,以及毛细血管的分化吻合[9]。VEGF能够诱导纤溶酶原激活物和胶原酶的产生,降解血管周围细胞外基质;能够与血管内皮细胞膜上的受体结合,促进内皮细胞分裂、迁移和增殖;此外VEGF还能够增加血管的通透性[9]。在浸润性乳腺癌中,VEGF蛋白呈高表达,且与血管生成的增多及早期复发有一定相关性[10]。采用抗VEGF治疗可封闭已分泌的VEGF,抑制新生血管生成,同时使紊乱的血管恢复正常化生长,降低瘤内缺氧状态[11]。本研究中VEGF在乳腺癌中的阳性表达率高于癌旁组织,且VEGF在ER阴性患者中阳性表达率较高,提示VEGF是不良预后因子,可作为乳腺癌治疗的靶点之一。同时VEGF表达还与5年是否复发密切相关,说明VEGF在乳腺癌中的高表达可能是引起肿瘤复发的因素之一。
有研究指出,乳腺癌的平均血管密度和巨噬细胞指数与乳腺癌有相关性,而VEGF的表达和巨噬细胞浸润也有相关性[12]。缺氧诱导因子脑信号蛋白3A通过VEGF受体1招募巨噬细胞,导致乳腺癌肿瘤缺氧区的TAMs聚集,同时TAMs的浸润也能增加VEGF的表达[13]。另一个常见的TAMs诱导产生的细胞因子——转化生长因子β1(TGF-β1),也是促进VEGF表达增多的因素之一,TGF-β1通过激活HIF-1α/β和Smad3/4,诱导VEGF高表达,促进血管内皮细胞分泌胶原酶和纤溶酶原降解血管基底膜,从而有利于肿瘤细胞散播。此外,VEGF可结合细胞外基质,而这种结合可被基质金属蛋白酶(MMPs)降解,已有研究证实TAMs对这一过程有重要影响。在卵巢癌的小鼠模型中,TAMs被发现是MMP9的主要来源,此外,MMP9表达阳性的TAMs与肿瘤血管生成、肿瘤的生长以及VEGF的表达水平密切相关。总之,大多数的研究表明,TAMs通过直接或间接作用于VEGF诱导肿瘤血管生成。在本研究中CD68与VEGF蛋白的表达在乳腺癌中的表达均高于癌旁组织,且二者表达呈正相关,与文献报道一致,进一步说明了二者在乳腺癌进展过程中的协同作用。
综上所述,乳腺癌组织中CD68和VEGF的表达升高,且其协同参与乳腺癌的进展和复发,检测二者对于指导乳腺癌治疗及预后具有重要参考意义。
[1] Ruffell B, Affara NI, Coussens LM. Differential macrophage programming in the tumor microenvironment[J]. Trends Immunol, 2012,33(3):119-126.
[2] Liu L, Tong Q, Liu S, et al. ZEB1 upregulates VEGF expression and stimulates angiogenesis in breast cancer[J]. PLoS One, 2016,11(2):e0148774.
[3] Yang L, Zhang Y. Tumor-associated macrophages, potential targets for cancer treatment[J]. Biomark Res, 2017,5:25.
[4] Komohara Y, Jinushi M, Takeya M. Clinical significance of macrophage heterogeneity in human malignant tumors[J]. Cancer Sci, 2014,105(1):1-8.
[5] Choi J, Gyamfi J, Jang H, et al. The role of tumor-associated macrophage in breast cancer biology[J]. Histol Histopathol, 2017,6:11916.
[6] Poindexterl NJ, Sahin A, Hunt KK, et al. Analysis of dendritic cells in tumor-free and tumor-containing sentinel lymph nodes from patients with breast cancer[J]. Breast Cancer Res, 2004,6(4):R408-R415.
[7] Ruffell B, Au A, Rugo HS, et al. Leukocyte composition of human breast cancer[J]. Proc Natl Acad Sci U S A, 2012,109(8):2796-2801.
[8] Santos LV, Cruz MR, Lopes Gde L, et al. VEGF-A levels in bevacizumab-treated breast cancer patients: a systematic review and meta-analysis[J]. Breast Cancer Res Treat, 2015,151(3):481-489.
[9] Arjaans M, Schroder CP, Oosting SF, et al. VEGF pathway targeting agents, vessel normalization and tumor drug uptake: from bench to bedside[J]. Oncotarget, 2016,7(16):21247-21258.
[10] Toi M, Yamashiro H, Tsuji W. Risk reduction of distant metastasis in hormone-sensitive postmenopausal breast cancer[J]. Breast Cancer, 2009,16(3):207-218.
[11] Ferrara N, Adamis AP. Ten years of anti-vascular endothelial growth factor therapy[J]. Nat Rev Drug Discov, 2016,15(6):385-403.
[12] Leek RD, Lewis CE, Whitehouse R, et al. Association of macrophage infiltration with angiogenesis and prognosis in invasive breast carcinoma[J]. Cancer Res, 1996,56(20):4625-4629.
[13] Casazza A, Laoui D, Wenes M, et al. Impeding macrophage entry into hypoxic tumor areas by sema3a/Nrp1 signaling blockade inhibits angiogenesis and restores antitumor immunity[J]. Cancer Cell, 2013,24(6):695-709.
ExpressionandclinicalsignificanceofCD68andVEGFinbreastcancertissues
YANHonglin,WUHao,GAOLikun,RAOJie,YUANJingping
(RenminHospitalofWuhanUniversity,Wuhan430060,China)
ObjectiveTo investigate the expression and clinical significance of CD68 and vascular endothelial growth factor (VEGF) in breast cancer tissues.MethodsImmunohistochemistry was used to detect the expression of CD68 and VEGF in 230 cases of breast cancer tissues and the corresponding adjacent tissues. The relationship of the expression of two proteins with the clinicopathological parameters and the recurrence of breast cancer was analyzed. Meanwhile, the correlation between the two proteins was also analyzed.ResultsThe positive rates of CD68 and VEGF in the breast cancer tissues were significantly higher than those in the adjacent tissues (bothP<0.01). The positive rate of CD68 protein in the breast cancer was closely related to the clinical stage, lymph node metastasis, and ER status of breast cancer patients (P<0.05). The positive rate of VEGF protein in the breast cancer was closely related to the ER status of breast cancer patients (P<0.05). The positive rates of CD68 and VEGF proteins in the recurrent patients were significantly higher than those in the non recurrent patients (bothP<0.05). The expression of CD68 protein was positively correlated with the expression of VEGF (rs=0.397,P<0.01).ConclusionThe expression of CD68 protein and VEGF protein increase in the breast cancer tissues, and they may be involved in the occurrence, development, and recurrence of breast cancer.
breast carcinoma; CD68; vascular endothelial growth factor; tumor microenvironment
10.3969/j.issn.1002-266X.2017.45.003
R737.9
A
1002-266X(2017)45-0009-04
国家自然科学基金资助项目(31600866)。
阎红琳(1988-),女,主管技师,主要研究方向为肿瘤微环境在乳腺癌发生发展及预后中的作用。E-mail:honglin1229@163.com
袁静萍(1974-),女,主任医师,主要研究方向为肿瘤微环境在乳腺癌发生发展及预后中的作用。E-mail:yuanjingping2003@aliyun.com
2017-09-01)
