氢溴酸西酞普兰预处理对大鼠局灶脑缺血再灌注损伤的影响*
2018-01-05李爱华李宝丽
李爱华,李 倩,郭 静,李宝丽
(1.唐山职业技术学院,河北唐山 063004;2.华北理工大学医学实验研究中心,河北唐山 063009;3.唐山市协和医院神经内科,河北唐山 063004)
氢溴酸西酞普兰预处理对大鼠局灶脑缺血再灌注损伤的影响*
李爱华1,李 倩2△,郭 静2,李宝丽3
(1.唐山职业技术学院,河北唐山 063004;2.华北理工大学医学实验研究中心,河北唐山 063009;3.唐山市协和医院神经内科,河北唐山 063004)
目的观察氢溴酸西酞普兰预处理对大鼠局灶脑缺血再灌注损伤所致脑梗死体积、海马CA1区细胞凋亡及超微结构的影响。方法将90只SD大鼠分为假手术组、缺血再灌注组(模型组)、氢溴酸西酞普兰预处理高、中、低剂量组(给药剂量分别为20、10、5 mg/kg,每天灌胃给药1次,持续7 d),末次灌胃2 h后采用线栓法制作大脑中动脉缺血2 h再灌注模型,再灌注24 h后,红四唑氮(TTC)染色法检测脑梗死体积,透射电镜观察损伤侧海马CA1区细胞超微结构,TUNEL法检测损伤侧海马CA1区细胞凋亡并采用激光共聚焦显微镜进行观察和数据测定。结果经氢溴酸西酞普兰预处理各剂量组与模型组相比,大鼠脑梗死体积减小,差异有统计学意义(P<0.05);海马CA1区凋亡细胞表达明显减弱,差异有统计学意义(P<0.05);透射电镜观察可见氢溴酸西酞普兰预处理各剂量组大鼠损伤侧脑海马CA1区细胞超微结构损伤较模型组明显减轻;以上改变高剂量预处理组效果更为明显。结论氢溴酸西酞普兰预处理可减少脑缺血再灌注损伤所致细胞凋亡和梗死面积,具有脑保护作用。
氢溴酸西酞普兰;再灌注损伤;细胞凋亡;海马CA1区
缺血性脑卒中是老年人群的常见病,可造成老年人认知和躯体功能障碍,严重者可导致死亡。缺血性脑卒中在疾病发展或后期的治疗过程中常因局部脑血流再通发生再灌注损伤,缺血再灌注损伤可引发神经元细胞发生两种形式的死亡:即缺血中心区的坏死和缺血半暗区的生理性死亡(凋亡)[1],目前减少缺血半暗区凋亡的发生是缺血性脑卒中治疗的研究热点。选择性5-羟色胺再摄取抑制剂即SSRI类药物,是精神科临床用于改善抑郁情绪的药物,近年来有研究报道此类药物对脑缺血具有神经保护作用[2-4]。其代表药物氢溴酸西酞普兰由于该药对5-羟色胺再摄取抑制的选择性相对较高,对其他神经递质影响较小,因此药物不良反应少,临床应用广泛。目前关于氢溴酸西酞普兰在神经保护方面的研究报道较少,故本研究应用氢溴酸西酞普兰对大鼠进行预处理干预治疗,之后行大脑中动脉阻断(middle cerebral artery occlusion,MCAO)缺血制作缺血再灌注模型,通过检测大鼠脑梗死体积、海马CA1区神经元细胞凋亡和超微结构的变化,观察氢溴酸西酞普兰预处理对大鼠局灶性脑缺血再灌注损伤是否具有保护作用,为氢溴酸西酞普兰在临床上的应用提供有意义的实验依据。
1 材料与方法
1.1动物与分组 将清洁级健康雄性SD大鼠90只[体质量250~350 g,动物许可证号SCXK(京)2010-0013,购自北京维通利华实验动物技术有限公司]分为5组:假手术组,缺血再灌注组(模型组),氢溴酸西酞普兰预处理高、中、低剂量组每组18只。在屏障环境动物实验室喂养1周后进入实验。
1.2药物、试剂和仪器 氢溴酸西酞普兰(商品名为喜普妙,丹麦灵北制药公司生产,批号:国药准字J20080021,20 mg/片),红四氮唑(TTC)染色剂(购自美国Sigma公司),TUNEL检测试剂盒(购自北京中杉金桥生物技术有限公司),透射电子显微镜(日立H-7650)及激光共聚焦显微镜(日本Olympus公司FV1000型)由华北理工大学医学实验研究中心提供。
1.3干预方法 氢溴酸西酞普兰灌胃给药(高剂量组20 mg/kg、中剂量组10 mg/kg、低剂量组5 mg/kg),每天1次,持续7 d,末次给药2 h后大鼠行缺血再灌注模型制作,术后停止给药。假手术组及模型组大鼠给予生理盐水灌注。
1.4模型制作及判定标准
1.4.1模型制作 禁食12 h,10%水合氯醛(300 mg/kg)腹腔注射麻醉。手术过程中监测大鼠体温并保持在37.0~37.5 ℃(采用肛温探头连接多功能监测仪Spacelab,USA)。参照曹勇军等[5]改进的Longa线栓法制作MCAO缺血再灌注模型,阻断2 h后,麻醉状态下将线栓抽出10 mm行再灌注。假手术组线栓不阻断大鼠大脑中动脉血流,插入深度不能超过9 mm。
1.4.2模型判定及入组标准 对照Zea Longa 5分法[4](神经功能无缺损0分;左前爪不能伸直1分;行走时向左侧转圈2分;行走时向左侧倾倒3分;意识丧失4分),观察大鼠缺血再灌注24 h的动作表现,进行神经功能评分,得分为1~3分的大鼠进入后续试验,按随机原则补充被剔除的大鼠,保证数量不变。
1.5脑组织梗死体积测定 各组随机选取缺血再灌注24 h大鼠6只,麻醉,留取脑组织冷冻0.5 h,从额极至枕极连续切取厚度为2 mm的冠状脑片5片,37 ℃避光恒温条件下用2% TTC磷酸缓冲液浸泡孵育30 min后,用4%多聚甲醛液固定2 h。正常脑组织TTC染色呈红色,梗死脑组织呈白色。数码相机拍摄图像后应用AutoCAD 2000系统图像分析软件进行分析获取数据,脑梗死面积=损伤对侧半球的面积-损伤侧TTC染色正常的面积,脑梗死体积=∑全部脑片梗死面积×脑片厚度,最后算出脑梗死体积占全脑体积的百分率。
1.6细胞凋亡检测及观察 各组随机选取缺血再灌注24 h大鼠6只进行细胞凋亡的检测,操作过程严格按照TUNEL法试剂说明书逐步进行,然后参照《大鼠脑组织立体定位图谱》,在共聚焦显微镜下定位海马CA1区,采用波长为488 nm氩离子激光激发FITC荧光染料产生绿色荧光,观察细胞凋亡发生情况,在相同的参数下扫描取图,各组图像TUNEL表达的荧光D值数据由共聚焦显微镜应用分析软件FV10-ASW采集获得。
1.7超微结构观察 各组随机选取缺血再灌注24 h大鼠6只,麻醉,低温冰盒上取出脑组织,留取0.5~1.0 mm3损伤侧海马CA1区脑组织,2.5%戊二醛固定,1%四氧化锇后固定,乙醇、丙酮梯度脱水、环氧树脂包埋、超薄切片、载网、醋酸双氧铀及枸橼酸铅双重染色后,应用透射电镜观察损伤侧海马CA1区脑组织超微结构变化并取图拍照。

2 结 果
2.1脑梗死体积测定结果 大脑中动脉血流被阻断后,大鼠损伤侧的部分脑组织缺血梗死,梗死部位主要为基底节和皮层。实验中可见,假手术组大鼠脑组织无梗死,模型组大鼠发生大面积脑梗死,梗死脑组织水肿明显,较正常侧体积增大,颜色苍白,沟回变平、变浅;与模型组比较,氢溴酸西酞普兰预处理各剂量组大鼠脑梗死体积均有不同程度的减少,差异有统计学意义(P<0.05),高剂量组效果最为显著,见表1。
2.2细胞凋亡检测结果 TUNEL阳性判定:绿色荧光颗粒或明亮的绿色荧光团块为凋亡产物,主要分布于细胞核内。假手术组无绿色荧光出现,对各组(图1)的D值(表1)进行统计学分析可见,氢臭酸西酞普兰预处理各剂量组大鼠海马CA1区神经元D值较模型组明显减少,差异有统计学意义(P<0.05);且高剂量组的凋亡抑制作用最为显著。

表1 各组大鼠脑梗死体积与凋亡检测比较
a:P<0.01,与假手术组比较;b:P<0.05,c:P<0.01,与模型组比较;-:此项无数据
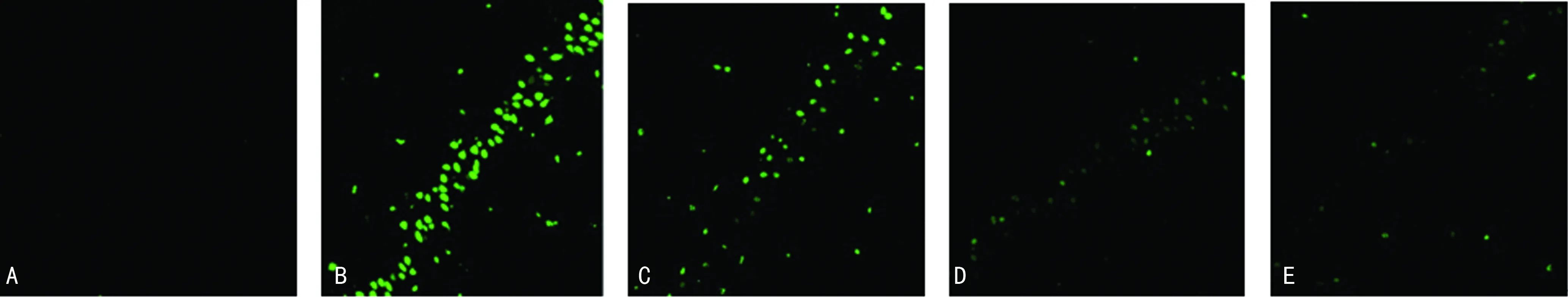
A:假手术组;B:模型组;C:低剂量组;D:中剂量组;E:高剂量组
图1各组大鼠海马CA1区细胞凋亡(激光共聚焦显微镜×400)

A:假手术组;B:模型组;C:低剂量组;D:中剂量组;E:高剂量组
图2各组大鼠海马CA1区脑组织超微结构(透射电镜×18 000)
2.3超微结构观察结果 假手术组大鼠海马CA1区神经元形态规整,呈圆形或椎体形;核膜清晰光滑,染色质分布均匀,核仁完整;细胞质内线粒体丰富,呈圆形或棒槌形,内嵴排列规则整齐,糙面内质网散在或平行排列,核糖体均匀游离分布或附着于内质网上(图2A)。模型组:海马CA1区神经元细胞正常圆形或椎体形态消失,外形不规则;细胞核核膜内陷或者呈现缺损,异染色质增多,呈现块状或新月状聚集于细胞核核膜下;细胞质内线粒体肿胀,嵴排列紊乱、断裂、减少甚至消失,呈现空泡样改变,内质网增加,板层状排列,游离核糖体增加(图2B)。氢溴酸西酞普兰预处理各剂量组:与模型组比较,可见海马CA1区部分神经元变性,胞体形态欠规整;细胞核核膜皱缩不明显,异染色质增多,部分区域可见异染色质轻度聚集,核仁水肿减轻;线粒体轻度水肿,嵴大部分完整或仅有轻微排列紊乱,内质网轻度肿胀扩张,以高剂量组效果改善最为明显(图2C~E)。
3 讨 论
对既往的实验研究进行统计发现,大鼠的脑皮质、纹状体、海马和丘脑等部位的脑组织是线栓法制作的MCAO 模型的易损区[5]。其中,对缺血缺氧更为敏感的是海马CA1区神经元,排列规则、分布集中是该区神经元的突出特点,这一特点不仅利于组织形态的观察还有利于实验数据的采取,并且鉴于海马对于学习、记忆等高级认知功能的重要性,因此,本课题选取海马CA1区为实验观察的部位。
TUNEL检测技术用于凋亡细胞染色,发展成熟,学术界公认可靠。激光共聚焦显微镜的优势在于不仅可对检测细胞进行定位和形态观察,还可以通过荧光的强弱进行定量测定和图像定量分析[6]。因此,本项目将两种方法有效结合, TUNEL染色后在激光共聚焦显微镜下观察凋亡并扫描测定荧光D值。结果发现,与模型组相比,氢臭酸西酞普兰预处理各剂量组大鼠缺血再灌注24 h后海马CA1区神经元细胞凋亡程度均明显减弱(P<0.05),说明氢溴酸西酞普兰预处理可以不同程度地抑制大鼠脑缺血再灌注损伤所致的细胞凋亡。
抗抑郁药可能是通过减轻神经元损害,减少细胞凋亡,促进缺血区神经修复,而起到了改善卒中患者的抑郁状态及促进神经功能康复的作用[7],以上是既往的研究发现。本实验中,模型组损伤侧海马CA1区神经元外形不规则,线粒体结构破坏,可见特征性的凋亡小体形成;较之于模型组,氢溴酸西酞普兰预处理各组脑组织的神经元受损改变均明显减轻,线粒体结构改变不明显。脑缺血再灌注损伤诱导凋亡发生的途径复杂多样,主要有氧自由基损伤、钙离子超载、内质网应激途径及线粒体途径等[8]。参与细胞凋亡的基因众多,其中Bcl-2 家族主要通过调节线粒体膜上的通透性转换孔,改变线粒体膜的通透性来实现对凋亡过程的调控[9-10]。本研究结果显示氢溴酸西酞普兰预处理可以抑制凋亡及线粒体结构的改变,但具体机制有待研究。
综上所述,本研究结果表明氢溴酸西酞普兰预处理可减少脑缺血再灌注损伤后凋亡的发生和脑梗死面积,对脑缺血再灌注损伤起到保护作用,该作用与其抗凋亡机制相关,为临床上氢溴酸西酞普兰预防和治疗缺血性脑卒中提供了更坚实的理论依据。
[1]王来,祝世功.线粒体生成与脑缺血再灌注损伤的研究进展[J].中国病理生理杂志,2016,32(8):1478-1483.
[2]Julian HR,Ria U,Francesca R,et al.Direct inhibition of retinoic acid catabolism by fluoxetine[J].J Neural Transm(Viemna),2015,122(9):1329-1338.
[3]Yoo DY,Kim W,Nam SM,et al.Chronic effects of pyridoxine in the gerbil hippocampal CA1region after transient forebrain ischemia[J].Neurochem Res,2012,37(5):1011-1018.
[4]李爱华,李倩,白桂春,等.参附注射液预处理对大鼠急性脑缺血再灌注损伤的保护作用[J].中成药,2015,37(8):1818-1820.
[5]曹勇军,程彦斌.线栓法建立大鼠局灶性脑缺血/再灌注模型的改进与探讨[J].《中国应用生理学杂志》,2001,17 (2) :198-200.
[6]俞丽华,王健,吕磊,等.激光扫描共聚焦显微镜技术原理在脑血管疾病实验研究中应用[J].医学理论与实践,2014,27(11):1426-1427.
[7]Shamas DA,Bindner S,Chi X,et al.Distinct lipid effects on tBid and Bim activation of membrane permeabilization by pro-apoptotic Bax [J].Biochem J,2015,467(3):495-505.
[8]邓文祥,潘继兴,黄惠勇,等.中药对大鼠脑缺血再灌注损伤细胞凋亡机制的研究进展[J].湖南中医药大学学报,2015,35(6):64-68.
[9]Tait SW,Green DR.Mitochondria and cell death:outer membrane permeabilization and beyond[J].Nat Rev Mol Cell Biol,2010,11(9):621-632.
[10]Shortt J,Johnstone RW.Oncogenes in cell survival and cell death [J].Cold Spring Harb Perspect Biol,2012,4(12):1-10.
河北省科学技术研究与发展项目(132777218);河北省唐山市科学技术研究与发展项目(12130268b)。
李爱华(1977-),讲师、主治医师,硕士,主要从事脑血管病基础与临床研究。△
,E-mail:340154235@qq.com。
10.3969/j.issn.1671-8348.2017.34.023
R532
B
1671-8348(2017)34-4824-04
2017-08-25
2017-09-29)
