A型肉毒素预防人瘢痕成纤维细胞增生机制的初步研究*
2018-01-05郝荣涛李宗超
郝荣涛,李宗超,陈 兴,叶 伟
(重庆市中医院皮肤美容科 400021)
论著·临床研究
A型肉毒素预防人瘢痕成纤维细胞增生机制的初步研究*
郝荣涛,李宗超,陈 兴,叶 伟△
(重庆市中医院皮肤美容科 400021)
目的探究不同浓度A型肉毒素(BTX-A)对瘢痕成纤维细胞的影响,初步阐释BTX-A治疗瘢痕及预防术后瘢痕增生的相关分子作用机制。方法选取人瘢痕成纤维细胞,以不同浓度的BTX-A(0.01、0.10、1.00 U/L 及10.00 U/L)作用24 h后,激光共聚焦显微镜观察细胞黏附及骨架变化,并采用MTT及流式技术检测其增殖、凋亡及周期变化,同时采用实时荧光定量PCR(qRCR)及蛋白免疫印迹(Western blot)方法,探究TGF-β、基质金属蛋白酶(MMP)-1、 MMP-2及MMP-9基因及蛋白的表达变化。结果随着BTX-A剂量的升高,其细胞黏附数量及骨架荧光强度逐渐减弱;细胞增殖能力减弱且主要阻断在细胞G0/G1期;此外其凋亡也随着BTX-A剂量增大而逐渐增强。qPCR及Western blot结果显示,随着BTX-A剂量增大,MMP-1及MMP-2基因及蛋白均呈现高表达,而TGF-β及MMP-9呈现出低表达。结论BTX-A通过阻断瘢痕细胞G0/G1期抑制其增殖,同时提高MMP-1及MMP-2的表达来减轻瘢痕形成,对瘢痕的治疗起着积极的作用。
肉毒杆菌毒素,A型;瘢痕细胞;成纤维细胞;分子机制
瘢痕是当今国内外医学界一直未攻克的难题,由于其发病率及术后复发率高,对患者的身心健康影响较大,且尚无行之有效的治疗手段[1-4]。当前注射治疗的药物主要为曲安奈德等激素,有效率较高,但药物本身有较多的不良反应[5-6]。而A型肉毒素(botulinum toxin type A,BTX-A)的安全性得到了大量临床研究的证实,不良反应较小,应用于手术切口能促进切口愈合,并且可以减轻伤口瘢痕或瘢痕增生的程度[7];但BTX-A对瘢痕成纤维细胞具体的影响及其对瘢痕细胞调控的分子及其机制目前还尚不清楚。本实验通过不同浓度的BTX-A作用于瘢痕成纤维细胞,初步探究其影响及分子作用机制,为BTX-A在瘢痕防治领域的临床运用提供理论依据。
1 材料与方法
1.1材料与试剂 本研究选用的细胞为原代培养的人瘢痕成纤维细胞,培养血清为杭州四季青有限公司胎牛血清,DMEM低糖培养基购自Hyclone公司。实验中采用的BTX-A购于兰州生物制品研究所有限责任公司(国药准字S10970037),四甲基偶氮唑蓝(MTT)试剂为美国Sigam公司产品,免疫荧光中细胞骨架抗体Actin-tracker Green为上海碧云天生物有限公司产品。引物由上海生物有限公司合成,PCR采用的反转录及相关试剂盒均购于美国Promega公司。蛋白免疫印迹(Western blot)中需要的一抗及货号信息见表1,细胞凋亡Annexin V/碘化丙啶(PI)试剂盒、辣根过氧化物标记的山羊抗鼠及山羊抗兔二抗均购于武汉博士德生物有限公司。
1.2方法
1.2.1细胞培养 将前期原代培养的瘢痕成纤维细胞复苏,并在含10%的胎牛血清,100 U/mL青霉素,100 μg/mL链霉素的DMEM低糖培养基中孵箱2~3 d后传代,用于后续实验。
1.2.2细胞增殖 取生长及形态良好的细胞,胰酶消化重悬后以每孔1×105/100 μL的密度接种到96孔板中,当细胞生长到50%融合后去除培养基,用无菌磷酸盐缓冲液(PBS)清洗,加入提前配置好的含有不同浓度BTX-A的培养基,分别是0、0.01、0.1、1.0 U/L及10 U/L,继续培养24 h后采用MTT检测细胞增殖。每组设置6个复孔,检测其570 nm吸光度(A)值。
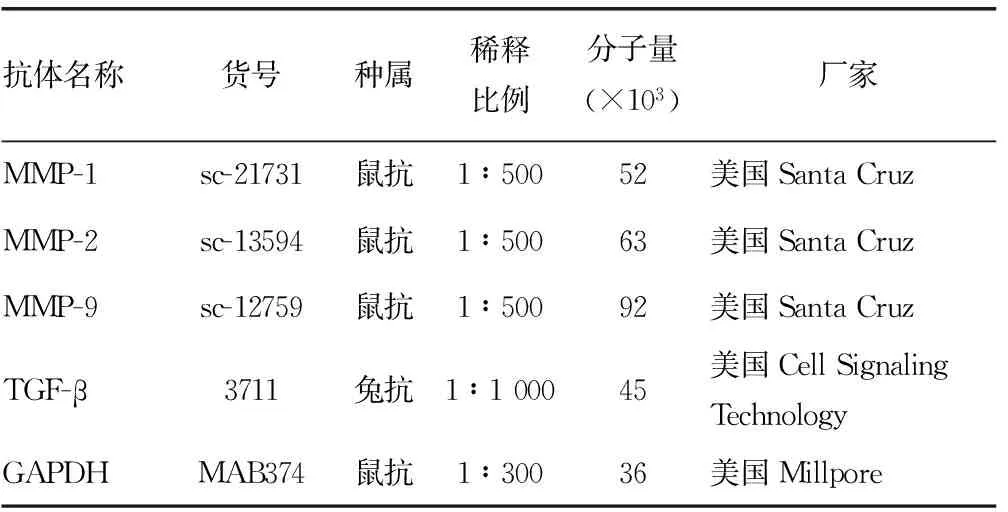
表1 一抗相关信息
1.2.3细胞形态变化观察 取生长及状态良好的瘢痕成纤维细胞消化重悬后接种于铺有无菌盖玻片的24孔板中,待细胞生长到70%融合后去除培养基,无菌PBS清洗后加入不同浓度梯度BTX-A的培养基。继续培养24 h后移去培养基,无菌PBS清洗,4%多聚甲醛固定15 min,0.1%Triton-X处理10 min,加入正常山羊血清封闭30 min,不洗加入稀释比例为1∶100的Actin-tracker Green,保湿暗盒放置2 h,PBS清洗,DAPI染核5 min,抗荧光猝灭剂封片,置于激光共聚焦显微镜下观察并拍照。
1.2.4细胞周期及凋亡检测 细胞培养及处理方法同前,细胞经过不同浓度的BTX-A处理后,4 ℃低温离心5 min收集细胞,预冷的PBS清洗细胞3次,继续离心,调整细胞浓度为1×105/mL。然后去除上清液,加入70%的乙醇固定3 h,PBS清洗后加入RNAse A,并在37 ℃水浴30 min,最后加入400 μL的碘化丙啶(PI)液混匀,避光0.5 h后上机检测周期变化。细胞在计数后,加入500 μL结合缓冲液用于凋亡检测,用5 μL Annexin V-FITC和10 μL的PI保湿湿暗盒中孵育5 min后400目筛网过滤后上机检测,Winmdi软件分析细胞凋亡率。
1.2.5qPCR检测相关基因表达 细胞经不同浓度BTX-A处理后采用 Trizol 试剂提取总RNA,电泳鉴定 RNA,紫外分光光度计测定浓度,以1 μg RNA总量反转录合成cDNA;在 PE5700 实时荧光定量 PCR 仪上进行实时定量扩增。反应总体系 20 μL,qPCR Master Mix 10 μL,上、下游引物各1.0 μL,cDNA 2.0 μL,ddH2O 6 μL。反应条件:94 ℃ 5 min;93 ℃ 30 s,60 ℃ 30 s,72 ℃ 20 s,40个循环。每个实验重复3次,采用相对定量2-ΔΔCt法比较各组细胞相关基因水平。引物序列见表2。
1.2.6Western blot检测相关蛋白表达 细胞经不同浓度BTX-A处理后,用细胞裂解液提取细胞总蛋白,使用 BCA 蛋白浓度检测试剂盒检测样品蛋白浓度,取 30~50 μg 总蛋白进行十二烷基硫酸钠-聚丙酰胺凝胶电泳(SDS-PAGE),湿转法转移至聚偏氟乙烯(PVDF)膜上,用 5%脱脂奶粉封闭 2~4 h,一抗于4 ℃条件下过夜,二抗室温孵育2 h。其后采用ECL 显色试剂盒于凝胶成像仪中观察相关蛋白表达情况。最后采用Image J软件对Western blot条带进行分析。

表2 引物序列
2 结 果
2.1BTX-A影响细胞黏附及形态变化 与BTX-A相比,BTX-A各处理组细胞形态发生明显变化。0 U/L组细胞贴附较好,铺展较开,呈现出规律排列。随着BTX-A剂量的升高,细胞贴附面积逐渐变小且具有逐渐脱落的趋势,整体细胞形态相比0 U/L组细小。从各个视野细胞核的数量来看,随着BTX-A剂量的增加其细胞数量逐渐减少,见图1。
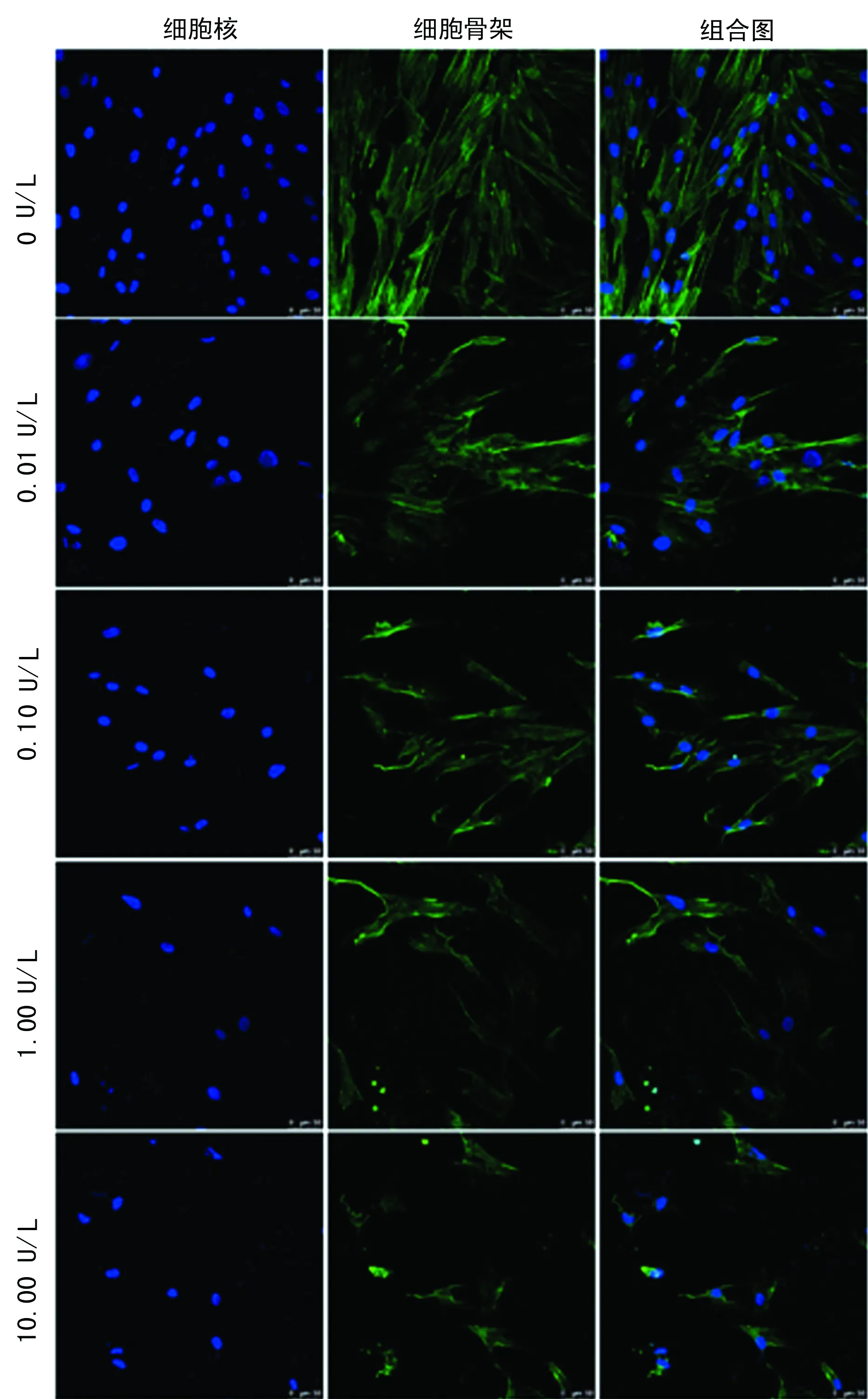
图1 激光共聚焦显微镜观察不同浓度BTX-A作用
2.2细胞增殖变化情况 在不同浓度BTX-A处理后,细胞增殖具有较大变化。与0 U/L组比较0.01 U/L组细胞增殖能力具有轻微增加的趋势,但差异无统计学意义(P<0.05)。当浓度达到0.10 U/L时,细胞增殖明显降低,且随着BTX-A剂量的增加,增殖能力进一步降低,各组与0 U/L组比较差异有统计学意义(P<0.01),见图2。
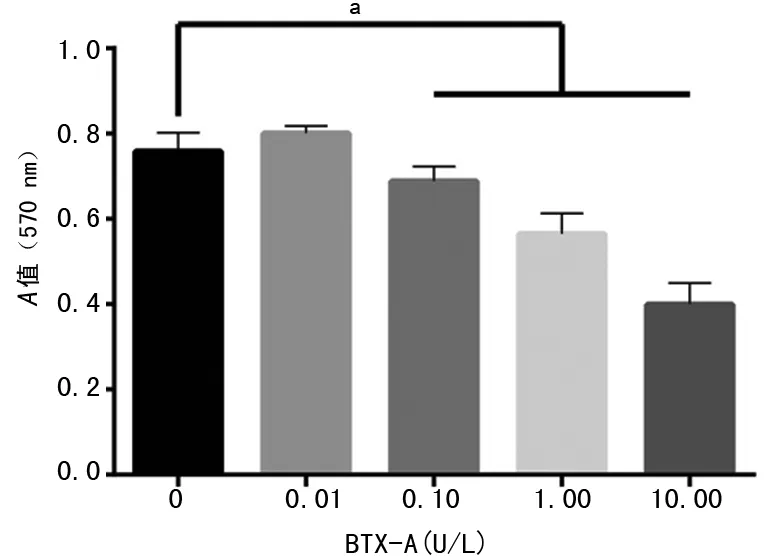
a:P<0.01
图2不同浓度BTX-A作用瘢痕成纤维细胞后细胞增殖能力变化情况
2.3细胞周期变化及凋亡情况 与0 U/L组相比,BTX-A各处理组细胞G0/G1期明显增多,差异有统计学意义(P<0.01),见表3。BTA-A各处理组细胞总凋亡率与0 U/L组比较增加,差异有统计学意义(P<0.01),但早期凋亡率差异无统计学意义(P>0.05),见表4。
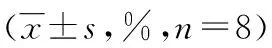
表3 各处理组细胞周期变化情况
a:P<0.01,与0 U/L组比较
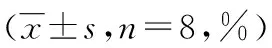
表4 各处理组细胞凋亡变化情况
a:P<0.01,与0 U/L组比较
2.4基因表达变化情况 瘢痕细胞经BTX-A处理后,MMP-1与MMP-2的表达逐渐升高。当BTX-A浓度达到1.00 U/L时,与0 U/L组相差异有统计学意义(P<0.01)。而TGF-β及MMP-9的表达随着BTX-A浓度的增加而出现低表达的趋势,且具有明显的剂量效应,差异有统计学意义(P<0.01),见图3。
2.5蛋白表达变化情况 BTX-A各处理组MMP-1蛋白的表达与0 U/L组比较明显增加,差异有统计学意义(P<0.01);但其余各浓度梯度组之间差异无统计学意义(P>0.05)。MMP-2蛋白的表达也呈现出高表达趋势,与0 U/L组比较差异有统计学意义(P<0.01);此外,1.00 U/L组与10.00 U/L组表达量也明显较0.01 U/L及0.10 U/L高。BTX-A各处理组TGF-β及MMP-9均有表达降低的趋势,但BTX-A各处理组MMP-9表达与0 U/L组比较差异无统计学意义(P>0.05),然而0.10 U/L组TGF-β与0 U/L组比较差异有统计学意义(P<0.01),见图4。
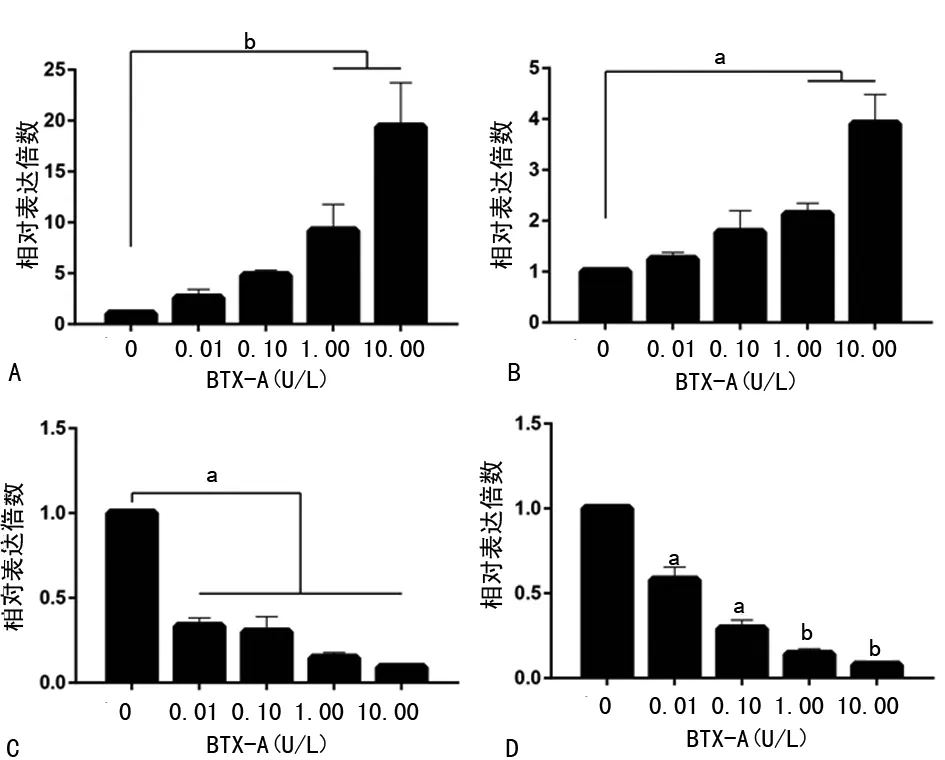
A:MMP-1;B:MMP-2;C:MMP-9;D:TGF-β;a:P<0.05;b:P<0.01,与0 U/L比较
图3不同浓度BTX-A作用瘢痕成纤维细胞后MMP-1、MMP-2、MMP-9及TGF-β基因表达
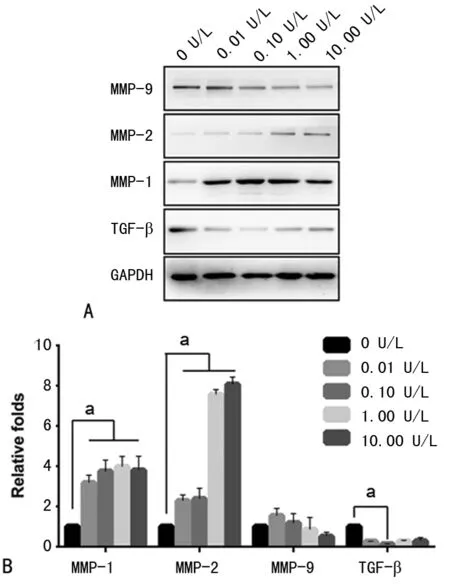
A:Western blot;B:半定量分析结果;a:P<0.01
图4不同浓度BTX-A作用瘢痕成纤维细胞后MMP-1、MMP-2、MMP-9及TGF-β蛋白表达变化
3 讨 论
正常的创伤后瘢痕为平坦的、相对狭窄的线性瘢痕。当伤口过度修复,发生增生性病变,便发展为增生性瘢痕和瘢痕疙瘩[8-9]。瘢痕疙瘩为皮肤损伤后,结缔组织过度增生和透明变性而引起的良性皮肤肿瘤,为机体异常愈合的一种形式,有类似肿瘤无限增殖生长的方式[10]。其表现为皮肤损伤后,以胶原和大量细胞外基质的形成,在局部过度沉积。其原因为瘢痕疙瘩中胶原酶的活性高于正常皮肤,如Ⅰ型胶原的合成增加,使大量胶原沉积[11]。目前还不能确定其精确的发病机制。本研究发现,采用BTX-A作用于瘢痕成纤维细胞后细胞形态及黏附能力明显发生变化,其增殖能力降低。这对预防瘢痕的过度增生有着积极的作用。
BTX-A是肉毒梭状芽孢杆菌在繁殖过程中分泌的毒性蛋白质,为一种细胞外毒素,能特异性阻断乙酰胆碱释放,未稀释的原药具有很强的神经毒性[12]。根据抗原性的不同,可将其分为A、B、C、D、E、F、G 共7个亚型,而用于皮肤美容的为BTX-A。其相对分子质量为90×103,属于高分子蛋白质[13]。现有研究表明,BTX-A能抑制人增生性瘢痕成纤维细胞增殖和胶原蛋白的合成[1]。应用于手术切口能降低局部张力,促进切口愈合,可以减轻伤口瘢痕或瘢痕增生的程度。在不影响创面愈合的时间和速度的情况下,可下调大鼠TGF-β的表达[14],同时也能影响人瘢痕组织TGF-β的生成[15]。在本研究中发现,BTX-A作用瘢痕成纤维细胞后其细胞骨架牵张力明显变小,细胞骨架与对照组相比呈现出明显的收缩状。这也证实了BTX-A对瘢痕成纤维细胞牵张力的影响。同时本研究还发现,BTX-A作用瘢痕细胞后,TGF-β基因及蛋白的表达均明显下调。此外从MMP-1、MMP-2及MMP-9基因及蛋白的表达情况来看,前两者出现明显高表达,然而的表达下降。
MMPs是一种锌依赖性的中性蛋白酶家族,便于细胞在基质中的迁移,参与组织重塑,对疙瘩形成过程中细胞外基质的合成及降解的调控有重要作用,维持细胞外基质的动态平衡,参与人体许多病理及生理过程[16-17]。在瘢痕的形成过程中,MMPs起着十分重要的作用,特别是MMP-1、MMP-2和MMP-9等,是影响胶原降解的主要因素[18]。MMP-1和MMP-2在瘢痕的形成过程中被成纤维细胞稳定表达,以降解细胞外基质,便于细胞在基质中的迁移,参与组织重塑[19-21]。本研究发现,瘢痕成纤维细胞在BTX-A作用下,MMP-1与MMP-2明显高表达,然而MMP-9表达出现下调,推测BTX-A作用下瘢痕成纤维细胞通过降低TGF-β的表达,进一步促进MMP-1及MMP-2的表达来增强细胞外基质的降解,进而降低瘢痕成纤维细胞胶原过度沉积的问题,对瘢痕疙瘩等的预防起到积极的作用。
综上所述,BTX-A通过降低瘢痕成纤维细胞细胞骨架牵张力,抑制TGF-β的表达,进一步促进MMP-1与MMP-2的表达增强瘢痕组织细胞胞外基质及组织的重塑,从而对瘢痕的预防及治疗起着积极的作用。但本研究仅对MMPs等分子进行了初步研究,TGF-β是如何对MMP-1与MMP-2调控,以及是否还有其他分子参与该过程还有待进一步研究。
[1]Al-attar A,Mess S,Thomhennes JM,et al.Keloid pathogenesis and treatment [J].Plast Reconstr Surg,2006,117(1):286-300.
[2]He Y,Deng Z,Alghamdi M,et al.From genetics to epigenetics:new insights into keloid scarring [J].Cell Prolif,2017,50(2):e12326.
[3]Jumper N,Paus R,Bayat A.Functional histopathology of keloid disease [J].Histol Histopathol,2015,30(9):1033-1057.
[4]Seifert O,Mrowietz U.Keloid scarring:bench and bedside [J].Arch Dermatol Res,2009,301(4):259-272.
[5]Shaffer JJ,Taylor SC,Cook-bolden F.Keloidal scars:a review with a critical look at therapeutic options [J].J Am Acad Dermatol,2002,46(2 Suppl):S63-97.
[6]马林枭,鲍济洪,陈斌.瘢痕:评估、防治、早期干预方法的研究与进展 [J].中国组织工程研究,2015,19(20):3253-3257.
[7]Sherris DA,Gassner HG.Botulinum toxin to minimize facial scarring [J].Facial Plast Surg,2002,18(1):35-39.
[8]Shih B,Bayat A.Genetics of keloid scarring [J].Arch Dermatol Res,2010,302(5):319-339.
[9]Viera MH,Vivas AC,Berman B.Update on Keloid Management:Clinical and Basic Science Advances [J].Adv Wound Care,2012,1(5):200-206.
[10]Jones CD,Guiot L,Samy M,et al.The Use of Chemotherapeutics for the Treatment of Keloid Scars [J].Dermatol Reports,2015,7(2):5880.
[11]付小兵,程飚.进一步重视病理性瘢痕发生机制的研究 [J].中国修复重建外科杂志,2005,19(1):1-5.
[12]Carr LK.More data are needed to use BTX A as first-line treatment [J].Can Urol Assoc J,2011,5(3):209.
[13]Felber ES.Botulinum toxin in primary care medicine [J].J Am Osteopath Assoc,2006,106(10):609-614.
[14]王琳,邰宁正,陈蕊,等.A型肉毒素对大鼠皮肤中神经肽SP、CGRP及创面组织表达TGF-β1和α-SMA的影响 [J].组织工程与重建外科杂志,2009,5(4):202-204.
[15]Kim S,Ahn M,Piao Y,et al.Effect of Botulinum Toxin Type A on TGF-beta/Smad Pathway Signaling:Implications for Silicone-Induced Capsule Formation [J].Plast Reconstr Surg,2016,138(5):821e-829e.
[16]Kapoor C,Vaidya S,Wadhwan V,et al.Seesaw of matrix metalloproteinases(MMPs) [J].J Cancer Ther Res,2016,12(1):28-35.
[17]Singh D,Srivastava SK,Chaudhuri TK,et al.Multifaceted role of matrix metalloproteinases(MMPs) [J].Front Mol Biosci,2015,2(1):19.
[18]Lee WJ,Choi IK,Lee JH,et al.Relaxin-expressing adenovirus decreases collagen synthesis and up-regulates matrix metalloproteinase expression in keloid fibroblasts:in vitro experiments [J].Plast Reconstr Surg,2012,130(3):407e-417e.
[19]Kobayashi T,Kim H,Liu X,et al.Matrix metalloproteinase-9 activates TGF-beta and stimulates fibroblast contraction of collagen gels [J].Am J Physiol Lung Cell Mol Physiol,2014,306(11):L1006-1015.
[20]Lisboa RA,Lisboa FA,Castro SG,et al.Matrix metalloproteinase 2 activity decreases in human periodontal ligament fibroblast cultures submitted to simulated orthodontic force [J].In Vitro Cell Dev Biol Anim,2009,45(10):614-621.
[21]Suganuma K,Nakajima H,Ohtsuki M,et al.Astaxanthin attenuates the UVA-induced up-regulation of matrix-metalloproteinase-1 and skin fibroblast elastase in human dermal fibroblasts [J].J Dermatol Sci,2010,58(2):136-142.
ApreliminarystudyonthemechanismofbotulinumtoxintypeAinpreventingtheproliferationofkeloidfibroblastcells*
HaoRongtao,LiZongchao,ChenXing,YeWei△
(DepartmentofSkinCosmetology,TraditionalChineseMedicineHospitalofChongqingCity,Chongqing400037,China)
ObjectiveTo investigate the effects of different concentrations of botulinum toxin type A on hypertrophic scar fibroblasts,and to explore the molecular mechanism of botulinum toxin type A in the treatment of scar and prevention of postoperative scar hyperplasia.MethodsDifferent concentrations of botulinum toxin A(0.01,0.1,1 U/L and 10 U/L) were used on hypertrophic scar fibroblasts for 24 hours,to observe the changes of cell adhesion and cytoskeleton under laser confocal microscopy.MTT and flow cytometry were used to detect the proliferation,apoptosis and cycle of change,at the same time real time fluorescence quantitative PCR and Western blot were conducted to detected the expression of TGF-β,matrix metalloproteinase MMP-1,MMP-2 and MMP-9 gene and protein expression changes.ResultsWith the increase of botulinum toxin A dose,the number of cell adhesion and cytoskeletal fluorescence intensity decreased,cell proliferation ability decreased and mainly blocked at G0-G1phase,and the apoptosis also increased with the dose increased.The results of qPCR and Western blot showed that MMP-1 and MMP-9 gene and protein were highly expressed with the increase of botulinum toxin A dose,while TGF-β and MMP-9 showed low expression.ConclusionBotulinum toxin A can inhibit the proliferation of hypertrophic scar fibroblasts and inhibit the expression of MMP-1 and MMP-2,which can inhibit scar formation.It plays a positive role in the treatment of scar.
] botulinum toxin type A;keloid;fibroblast;molecular mechanism
10.3969/j.issn.1671-8348.2017.36.016
重庆市卫计委医学科研项目(20142071)。
郝荣涛(1982-),主治医师,硕士,主要从事瘢痕防治的临床及科研工作。△
,E-mail:cqzyyyw@sina.com。
R622
A
1671-8348(2017)36-5086-04
2017-08-22
2017-09-24)
