共沉淀法制备钙基脱氯剂及其脱氯性能研究
2018-01-05夏明桂邓国伟张腊梅王彩凤
李 锐,夏明桂,邓国伟,张腊梅,王彩凤
共沉淀法制备钙基脱氯剂及其脱氯性能研究
李 锐,夏明桂*,邓国伟,张腊梅,王彩凤
(武汉纺织大学 化学与化工学院,湖北 武汉 430200)
以廉价易得的氯化钙和氯化铝为原料,碳酸氢铵为沉淀剂采用共沉淀法制备一种钙基脱氯剂,并分别在120℃、300℃、700℃、950℃条件下对其进行处理,得到一系列样品。采用XRD、TG-DTG、N2吸附-脱附等手段对其进行表征,结果表明,制备的钙基脱氯剂孔隙率较高、存在较多的介孔和大孔、比表面积也较大,随着温度的升高会逐渐脱水、分解以及结晶化。采用自制的脱氯评价系统对其脱氯性能进行评价,结果表明,120℃处理的样品有最佳脱氯效果,在反应温度45℃、气体体积空速1000h-1、脱氯剂粒度为60-80目条件下穿透氯容可达33%。
共沉淀法;钙基脱氯剂;脱氯;穿透氯容
0 前言
在石油化工生产过程中,原油开采时为了提高开采出油的产率和产量,会在开采过程中投入部分含氯采油助剂,同时原料油中的含氯化合物可以引起多种催化剂或吸附剂中毒或性能波动,影响其吸附或催化能力从而使产品的产率及稳定性大幅度下降,对生产造成非常大的影响[1,2]。由于含氯化合物的存在,在预加氢的过程中会转化为HCl,在低温区和冷凝水混合后生成高腐蚀性的盐酸严重腐蚀设备。同时,若原料油中含有氮化合物,则会在换热器、循环压缩机、管件阀门中生成铵盐,引起铵盐堵塞影响生产的正常运行[3]。此外,HCl还可与净化系统中的锌化物形成低熔点化合物,致使脱氯剂、脱硫剂表面钝化及活性降低,影响正常生产。如果将氯化氢直接排放入大气,将造成环境污染,造成公害。因此,脱除油品中的HCl是非常必要的,选择一种合适的方法脱除HCl是脱氯技术的核心[4]。
目前,HCl脱除技术主要有两类:第一类是物理吸附法。适用于高含量氯化氢(质量分数>0.01%)的部分脱除。吸附剂一般采用比表面较大的活性氧化铝、分子筛等。因为它们内部孔道是高极性的,可将极性很强的HCl从非极性烃类混合物中有效除去[5]。第二类是化学吸收法。待净化原料中的HCl和脱氯剂中的有效金属组分M进行反应,生成稳定的金属氯化物而被固定下来,反应如下所示:MxOy+2yHCl= MxCl2y+yH2O此反应实际上是一个酸碱中和反应,只要M具有足够的能力与Cl-结合,并将Cl-固定下来,则M便是一种可以吸收氯的元素[6]。
豆斌林等[7]研究了以碱金属及碱土金属为活性组分的高效脱氯剂,在脱除高温煤气中的HCl时,具有较高的氯容以及较长的穿透时间;谢辛等[8]对钙基吸收剂脱除HCl技术的国内外研究进展进行了综述,介绍了不同类型钙基吸收剂的脱氯特性和提高钙基吸收剂脱除HCl性能的各种方法。由此可以看出,碱金属或碱土金属的化合物是高效脱氯剂中必不可少的活性组分。并且,对于气固相催化,反应物在催化剂内的扩散往往是控制因素[9],多孔材料中的介孔可以选择性地容纳客体分子,所具有的高比表面积有利于气体分子吸附[10]。
对于单组份钙基氧化物,是一种碱性强且廉价的固体碱吸收剂,但是其比表面积较小,对提升整体脱氯效果有不利影响[11]。所以,在脱除油气中HCl时,避免采用单组份碱金属或碱土金属氧化物。已有文献显示,以共沉淀法制备的二元金属氧化物不但比纯组分大得多的比表面积,而且机械强度较大。以Ca2+和Al3+为主要组分通过共沉淀法制备的钙铝类复合物具有稳定的结构,并且具有较强碱性和较大的比表面积和孔容,有利于脱氯过程的进行[12]。目前,关于以Ca2+和Al3+为主要组分合成脱氯剂的研究极少。
为此,本文以钙铝共沉淀法为基础,以碳酸氢铵为沉淀剂,在一定条件下制备钙基脱氯剂样品,并对样品进行不同温度的焙烧处理,之后对焙烧后的样品进行XRD、TG-DTG、N2吸附-脱附等表征分析,探究温度对脱氯剂比表面积和孔体积的影响。之后对各脱氯剂的脱氯效果进行评价,确定最佳脱氯工艺条件。
1 实验部分
1.1 实验试剂
CaCl2,AlCl3·6H2O,NH4HCO3,NaHCO3,K2CrO4,AgNO3,DOP,硝酸,硫酸,盐酸(均为分析纯,上海国药集团化学试剂有限公司),N2(分析纯)。
1.2 钙基脱氯剂的制备
①将CaCl2与AlCl3·6H2O以物质的量为0.7:1的比例在蒸馏水中进行搅拌混合,配置成1mol/L的溶液置入滴液漏斗中待用。
②按照n(HCO3-):[n(Al3+)+n(Ca2+)]=0.8:1的比例称取相应的NH4HCO3在蒸馏水中进行搅拌溶解,配置成1mol/L的溶液置入圆底烧瓶中待用。
③将②中的溶液置于45℃水浴中,到温后将①中溶液缓慢滴加到其溶液中,并强烈搅拌,严格控制反应温度和反应pH等参数。
④滴加完成后,陈化30min,之后恒温抽滤,并用蒸馏水恒温洗涤数次至滤液中无杂离子。
⑤将所得产物置于60℃减压干燥处理6h,冷却后敲碎过筛,制成一定粒度的前驱体样品CA-0。
⑥在N2氛围下分别将⑤所述产物置于120℃、300℃、700℃、950℃条件下焙烧,液压成型后敲碎过筛,制成一定粒度的四种样品CA-1、CA-2、CA-3、CA-4。
1.3 钙基脱氯剂的表征
XRD分析采用荷兰PANalytical, B.V公司的X'Pert PRO型X射线衍射仪,管电流30mA,管电压40kV,10°-80°扫描,速率5°/min。N2吸附-脱附分析采用北京精微高博科学技术有限公司的JW-BK112型比表面测定仪,在液氮环境下检测样品的孔结构,通过BET方法得到比表面积,BJH方法得到孔径和孔容数据。TG-DTG分析采用梅特勒托利多公司的TGA/DSC1同步热分析仪,测试范围50℃-1000℃,升温速率10℃/min。
1.4 脱氯性能评价
脱氯性能评价装置示意图见图1,原料N2气吹扫盐酸、硫酸后携一定浓度HCl以一定空速进入固定床微反系统,固定床为定制脱氯评价石英玻璃反应管,填料区的规格是外径7mm、内径5mm、长150mm。在填料区中按照高径比7∶9装入一定量脱氯剂,填料区上下端都装填少量石英砂。通过对进出口HCl含量C进、C出,气体实时体积空速S,脱氯剂的填装体积Vm等参数的测定,综合评价脱氯剂的脱氯性能。
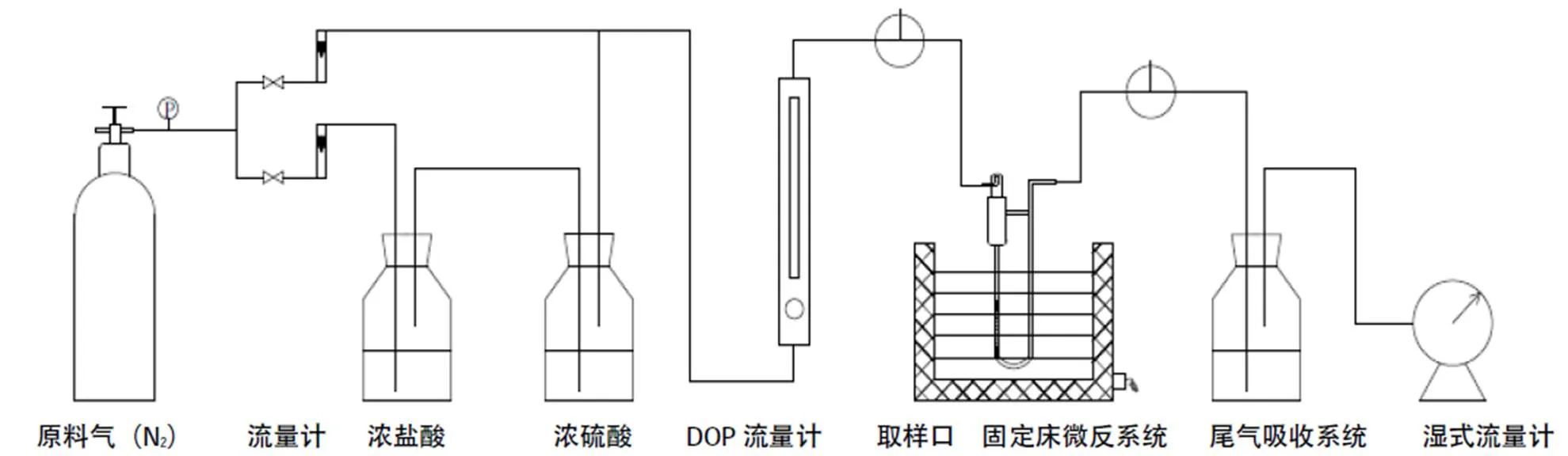
图1 脱氯性能评价装置示意图
脱氯剂吸收HCl的能力用氯容表示,即单位质量的脱氯剂所能吸收氯的质量。当反应器尾气中刚开始检测到有0.1ppm的HCl时,则认为该脱氯剂已穿透。分析尾气中的氯含量采用江苏姜堰市分析仪器厂LC-6型微库伦测定仪。
1.5 氯容分析方法
准确称取0.2g评价完成后的脱氯剂于150mL锥形瓶中,加入稀硝酸充分震荡摇匀并缓慢加热数10min使固体充分溶解。冷却至室温,加入一定量的NaHCO3将溶液调至中性,之后加入2-3滴铬酸钾指示剂充分摇匀,用1.000mol/L硝酸银溶液对溶液中的氯含量进行滴定。按下式计算氯容:
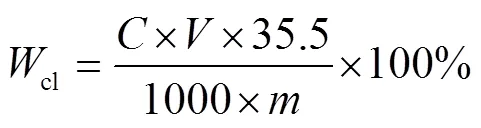
式中:C—硝酸银标准溶液的摩尔浓度,mol/L;
V—滴定所消耗的硝酸银标准溶液的体积,mL;
m—称取的脱氯剂质量,g。
2 结果与讨论
2.1 脱氯剂的表征
2.1.1 脱氯剂的XRD表征
四种钙基脱氯剂的XRD谱图见图2。
由图2可知,在120℃条件下处理的CA-1样品于23.13°、29.46°、48.56°出现了碳酸钙(CaCO3,PDF:86-0174)的特征衍射峰,在300℃条件下处理的CA-2样品也出现了上述碳酸钙的特征峰,并且更加尖锐明显,这是因为在300℃条件下脱水之后,样品中的碳酸钙的比例增加,碳酸钙衍射峰的强度也增加。在700℃条件下处理的CA-3样品于32.26°、37.37°、53.91°出现了氧化钙(CaO,PDF:43-1001)的特征峰,于39.50°、45.70°、66.99°出现了氧化铝(Al2O3,PDF:46-1131)的特征峰,同时碳酸钙的衍射峰强度明显降低,这是因为在700℃条件下脱氯剂中的碳酸钙及无定型氧化铝已经大量分解。在950℃条件下处理的CA-4样品于20.04°、25.51°、29.04°、34.63°、60.36°出现了二铝酸钙(CaAl4O7,PDF:76-0706)的特征峰,同时碳酸钙、氧化钙、氧化铝的衍射峰消失,这是因为在950℃条件下,脱氯剂结晶化形成了二铝酸钙晶体。
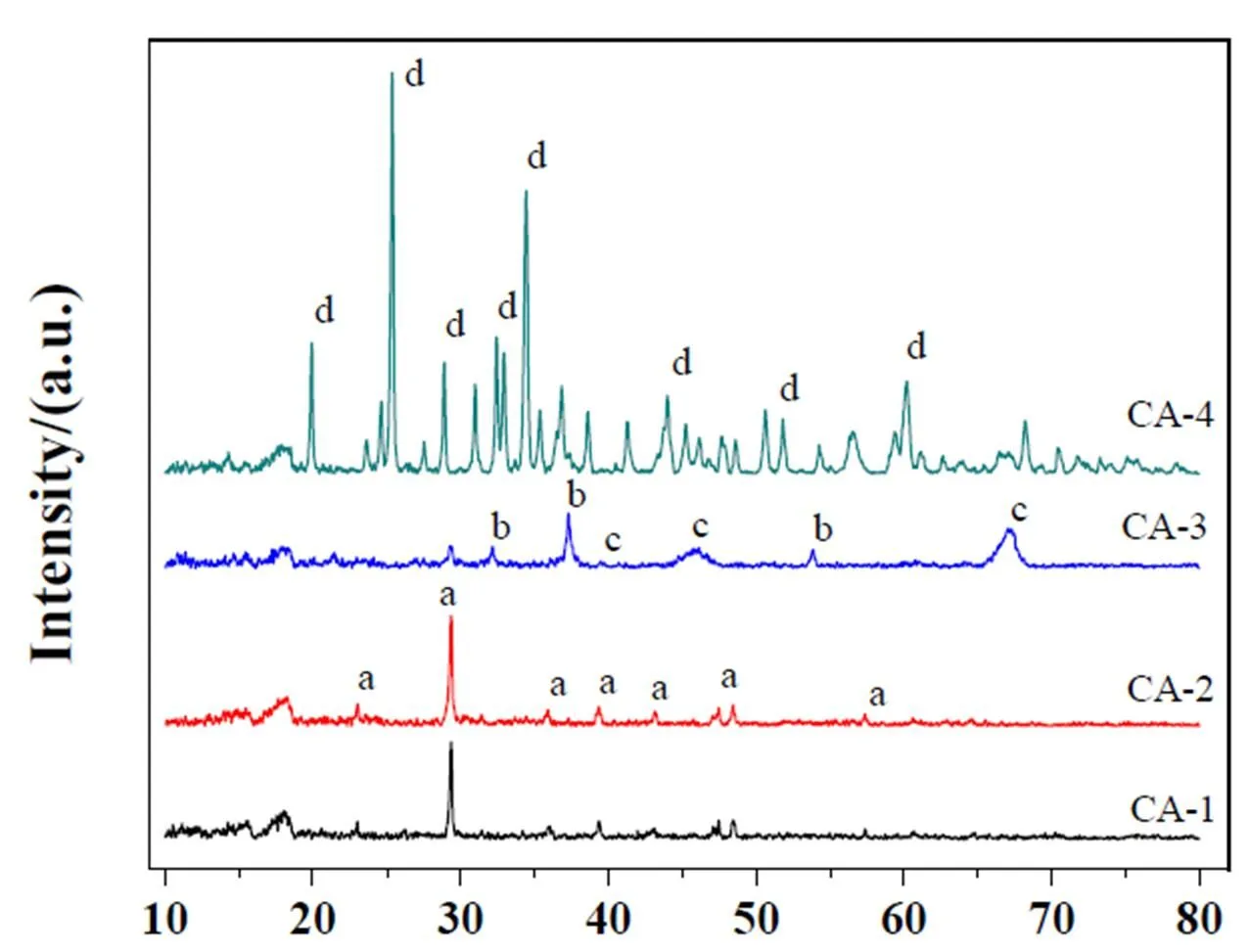
图2 不同温度处理后脱氯剂的XRD谱图
a:CaCO3;b:CaO;c:Al2O3;d:CaAl4O7
2.1.2 脱氯剂的TG-DTG表征
图3为CA-1样品的热重分析曲线,揭示了样品在氮气中受热后晶型结构转变的过程。由图4可知,样品的DTG(失重速率)呈三阶段失重。
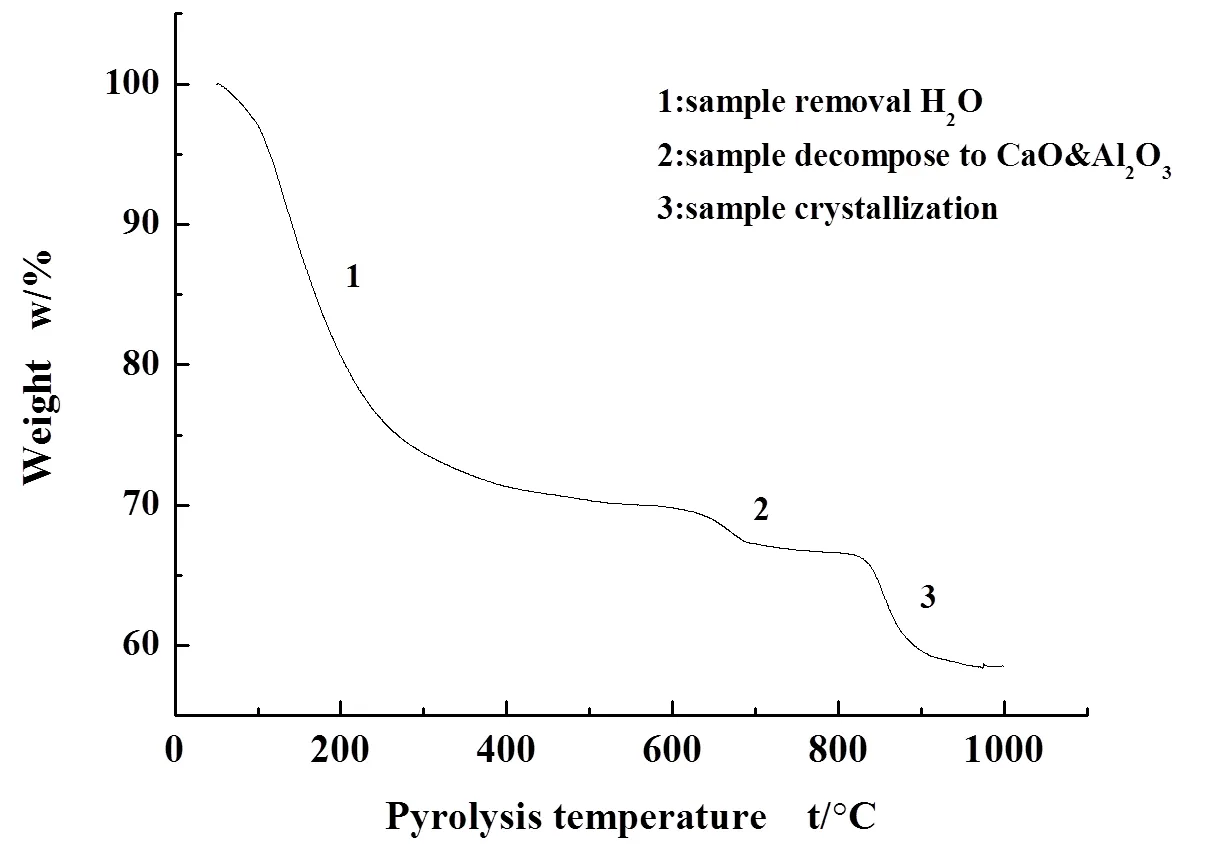
图3 脱氯剂的TG曲线
第一阶段失重发生在50-300℃,其中120℃时失重达到最快,这是由于样品中含有的水以及样品表面物理吸附水的脱除造成的;第二阶段失重发生在550-700℃,这部分失重对应于样品中碳酸钙的分解成CaO,同时样品中分解温度较低的物质失去羟基水形成Al2O3,这部分结构水的失去形成了部分孔道,增大了比表面积;第三阶段发生在800-950℃,这部分失重对应于样品中钙铝氧化物之间发生了晶化反应,结晶化程度升高生成了CaAl4O7。因此,对于CA-0样品,我们选取120℃脱水并且置于300℃、700℃、950℃条件对样品进行进一步焙烧处理,分别研究各个样品的性能。
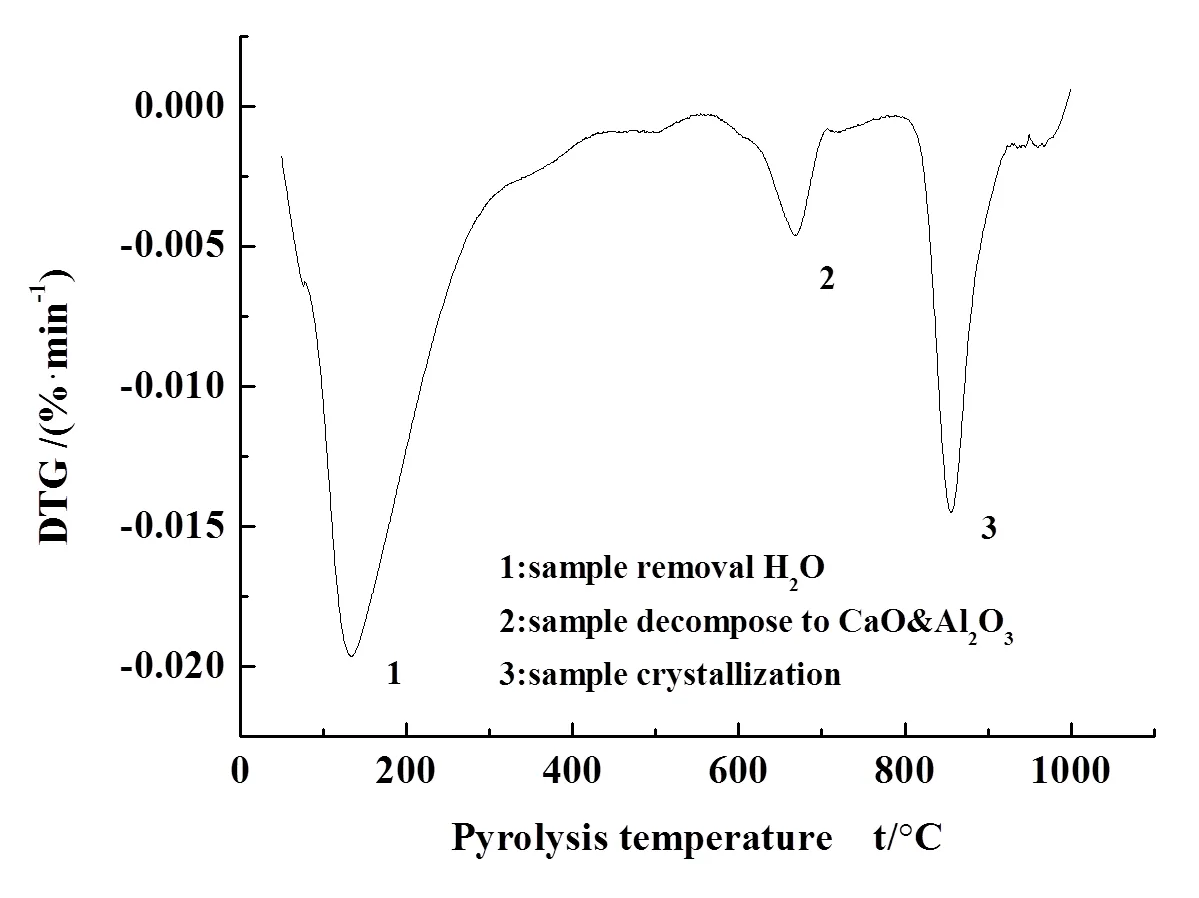
图4 脱氯剂的DTG曲线
2.1.3 脱氯剂的N2吸附-脱附表征
脱氯剂的比表面反映了吸附HCl反应过程的接触面积大小,而孔容、孔径则反映了HCl在脱氯剂中的扩散空间大小[13]。图5为四种脱氯剂在液氮环境中N2脱吸附等温曲线。
由图5可知,四种样品的等温线形状基本相同,根据IUPAC的分类,四种样品的脱吸附等温曲线为经典的IV型曲线形状,表明脱氯剂的孔结构相似并且主要为介孔材料,同时含有少量微孔。滞后环均属于deBoer五类滞后环[14]中的H3型。四种脱氯剂均随着氮分压(p/p0)的增加,吸附量也在增加。当氮分压达到0.8左右时,四种脱氯剂的吸附量均开始显著增加,这可能是因为颗粒间形成了狭缝;其中CA-1与CA-2的脱吸附曲线重合性很好,说明300℃的温度对于样品孔形状的影响很小。从四种脱氯剂的滞后环情况可以看出,CA-4的滞后环很小,说明其中的介孔不是很多,而CA-1,CA-2,CA-3的滞后环较大,说明其中存在较多的介孔。同时,四种脱氯剂在氮分压较高的位置出现了毛细凝聚现象,说明脱氯剂中还含有大孔。
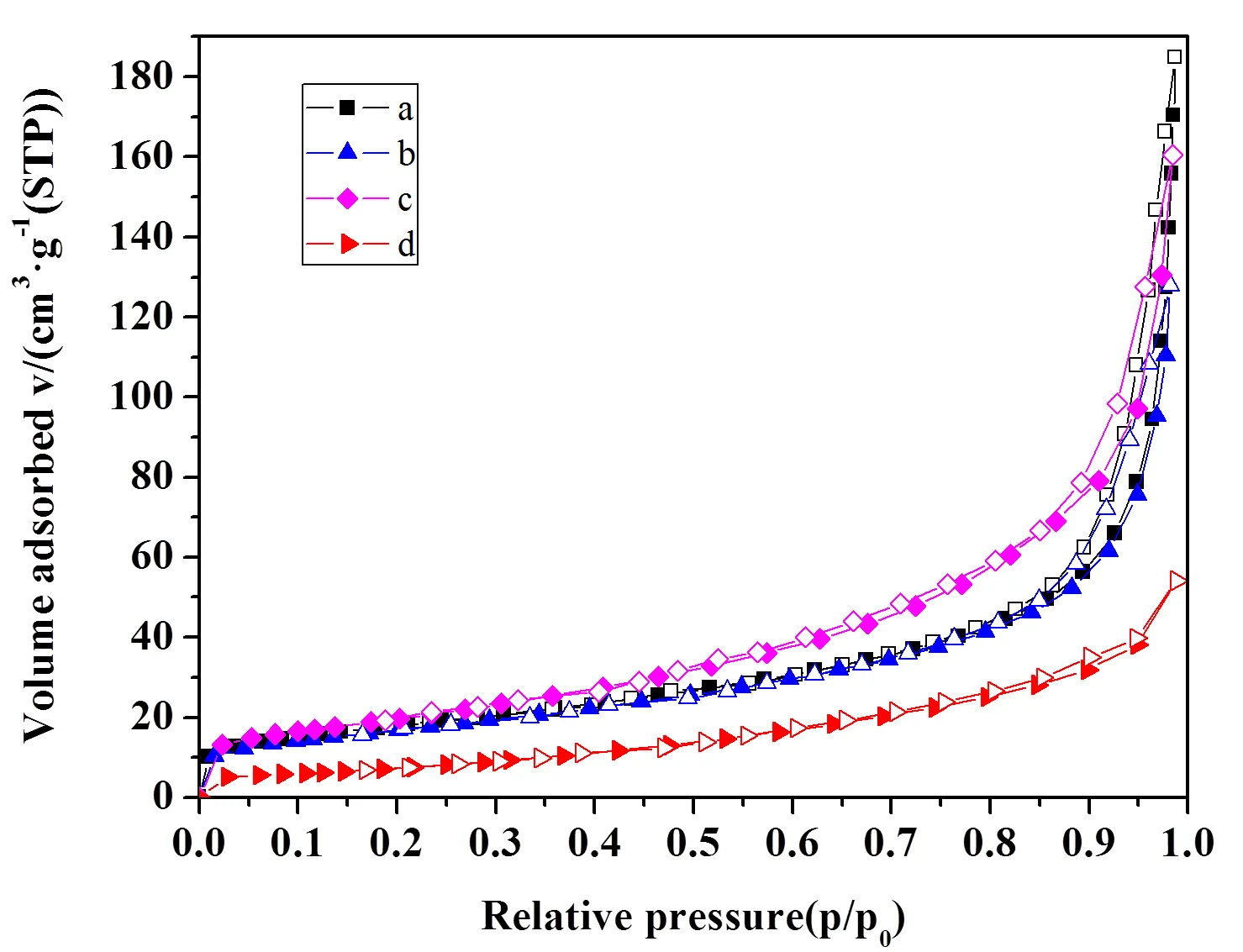
图5 四种样品的N2脱吸附等温曲线
a:CA-1; b:CA-2;c:CA-3;d:CA-4
表1为四种脱氯剂以及前驱体的比表面积、孔径、孔容的数据。由表1可知,脱氯剂在120℃部分脱水之后,比表面积、孔径、孔容都有所增大,说明样品吸附水的脱除打开了部分孔道;在300℃时样品大量失水导致部分孔道塌陷,从而比表面积、孔径、孔容都有所下降。脱氯剂在700℃转变为氧化钙、氧化铝之后,比表面积有明显的增加,但是孔径和孔容都有所减小,这是因为氧化铝具有多孔性,能够提供更多的比表面积,但是在高温条件下,碳酸钙的分解导致样品内部孔结构的塌陷,使孔径和孔容变小。脱氯剂在950℃转变为二铝酸钙之后,晶化程度大幅度增大,对样品的孔结构产生了很大影响,比表面积、孔径、孔容大幅度减少。
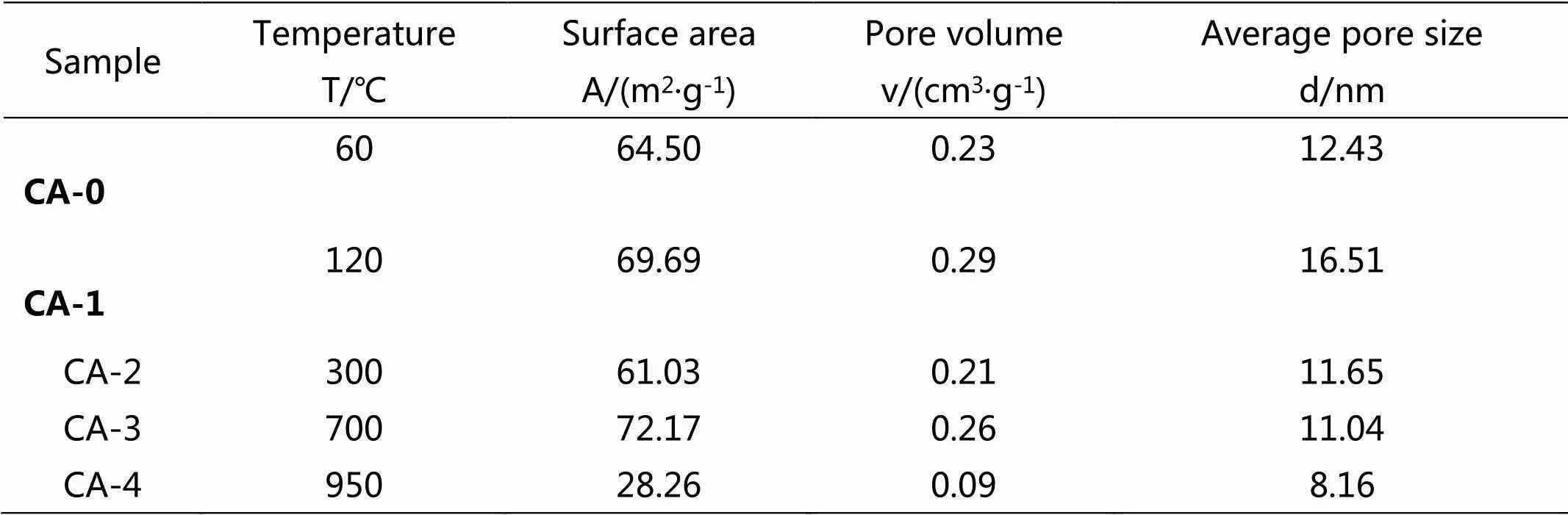
表1 四种脱氯剂及前驱体的物理性质
2.2 不同温度制备脱氯剂的脱氯效果
将成型完成的四种样品以及前驱体分别量取1mL装填到自制的固定床反应器中,在25℃、常压、空速1000h-1、脱氯剂粒度为60-80目的条件下进行脱氯性能测试。四种脱氯剂及前驱体脱氯效果见图6。由图6可知,在60℃以后四种不同温度下制备的脱氯剂的氯容随着温度的升高先上升后下降,在温度为120℃条件下制备的CA-1脱氯剂脱氯效果最好,其氯容可高达33%。CA-1样品的脱氯效果较其他样高,原因是其比表面积和孔径比CA-0、CA-3、CA-4较大,则HCl与活性组分接触的机会增大,脱氯效果明显。300℃失水之后的CA-2效果较差于CA-1,表明游离水和部分结合水有利于脱氯过程的进行。700℃分解之后的CA-3氯容突然减少,表明单纯的CaO-Al2O3组分在此条件下不利于脱氯过程的进行。950℃重新结晶生成的CaAl4O7组分基本上没有脱氯效果。
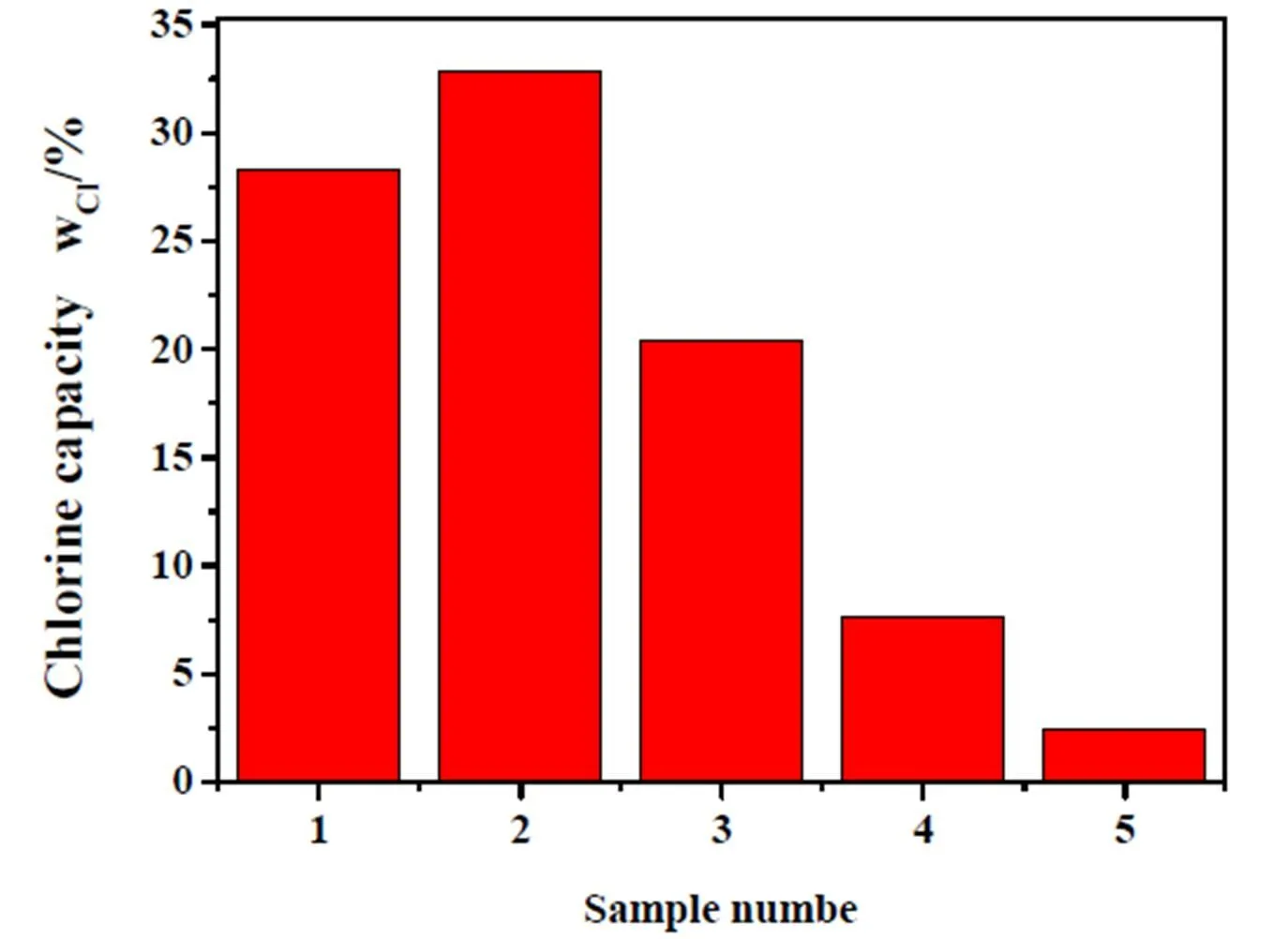
图6 四种脱氯剂及前驱体的氯容
1:CA-0; 2:CA-1; 3:CA-2; 4:CA-3;5:CA-4

图7 温度对CA-1脱氯剂氯容的影响
2.3 工艺条件对CA-1脱氯剂氯容的影响
2.3.1 温度对CA-1脱氯剂氯容的影响
在高径比为8:1、空速1000h-1、脱氯剂粒度为60-80目的条件下,研究温度对脱氯剂氯容的影响,具体见图7。由图7可知,随着温度的升高,脱氯剂的氯容整体呈上升趋势。脱氯剂对原料气中HCl的脱除过程是化学反应与物理扩散吸附等综合作用的结果,因此,推测氯容升高的原因是在一定范围内温度的升高促使化学反应的正向移动增加,同时有利于HCl在脱氯剂中的扩散,从而导致效果提升。但温度升高到45℃时氯容开始有下降趋势,原因是脱氯剂在吸附反应过程中放热,从热力学角度看,降低反应温度有利于脱氯反应进行,同时温度的升高导致脱氯剂吸附能力降低。综合以上两点分析及实验数据,推测脱氯反应最佳温度是在45℃左右。
2.3.2 粒度对CA-1脱氯剂氯容的影响
在高径比为8:1、空速1000h-1、反应温度45℃条件下,改变造粒时脱氯剂粒度的大小,研究催化剂粒度对脱氯剂氯容的影响,具体见图8。由图8可知,脱氯剂的氯容是随着颗粒尺寸的减小总体呈升高的趋势。当粒度由16-20目增加到60-80目时,氯容增加较大;当粒度由60-80目增加到100-120目时,氯容增幅减小;并且随着颗粒尺寸的减小,脱氯剂穿透时间显著增长。由此可以推断,气态HCl与脱氯剂中活性组分的反应主要在表面进行,即在一定粒度范围内反应主要受内扩散影响,反应物扩散到脱氯剂内部的阻力比较大。

图8 粒度对CA-1脱氯剂氯容的影响
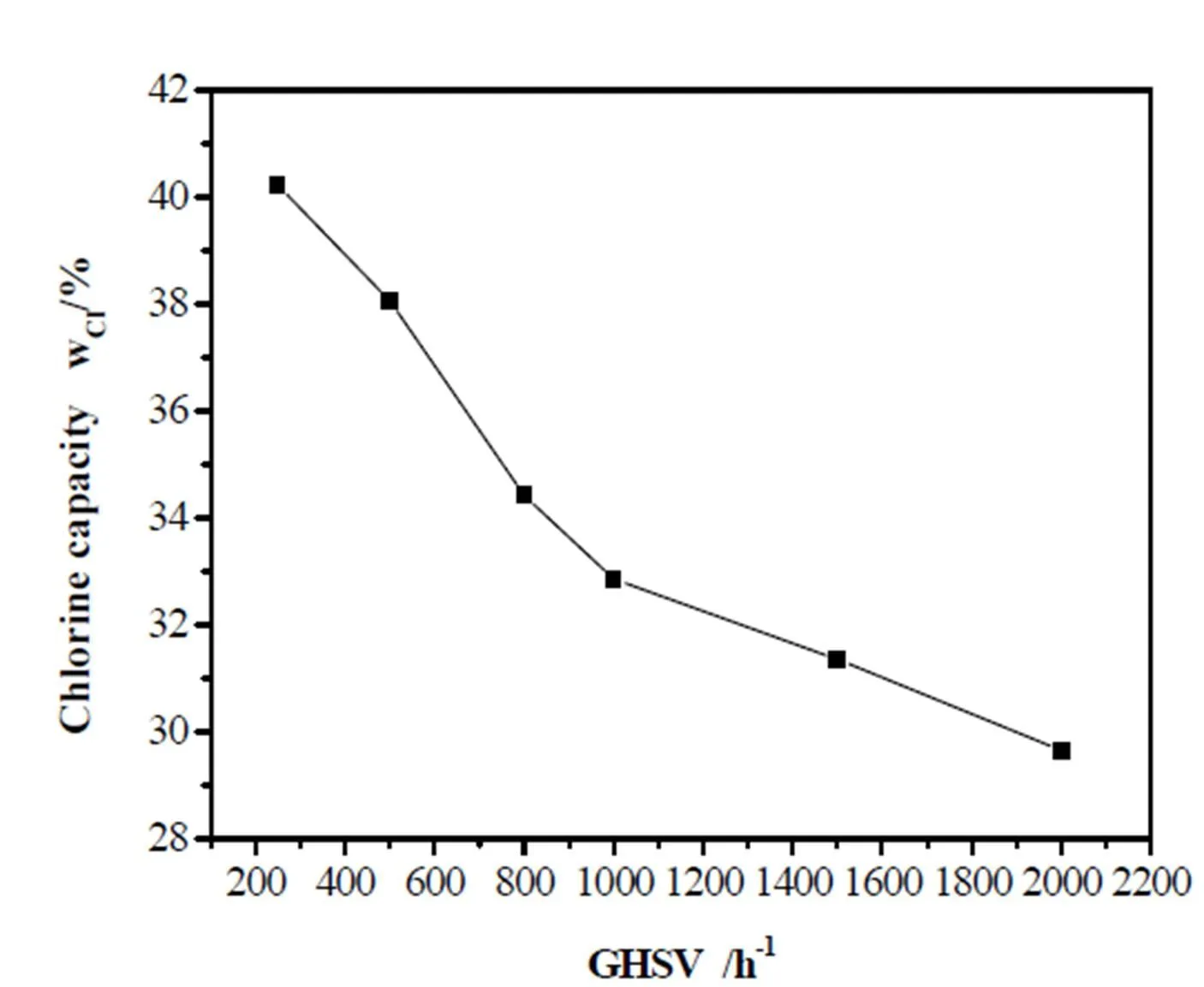
图9 空速对CA-1脱氯剂氯容的影响
2.3.3 空速对CA-1脱氯剂氯容的影响
在高径比为8:1、反应温度45℃、脱氯剂粒度60-80目的条件下,研究空速对脱氯剂氯容的影响,具体见图9。由图9可知,随着空速的增加,脱氯剂的氯容呈现快速下降的趋势。原因是随着原料气的流量加快,HCl在脱氯剂表面的停留时间缩短,使得床层利用效率下降,由此表明在一定空速范围内该过程是受外扩散影响。
2.4 CA-1与ET脱氯剂的氯容比较
将制备出的CA-1脱氯剂与目前市面上常用的ET-2、ET-3工业脱氯剂在相同的条件下进行评价,即在高径比8:1、空速1000h-1、脱氯剂粒度为60-80目的条件下,研究脱氯环境温度对三种脱氯剂氯容的影响,得出结果见图10。由图10可知,钙基脱氯剂CA-1的氯容高达33%,而工业脱氯剂ET-2、ET-3的氯容在不同温度条件下均低于CA-1,最高氯容分别为24%、28%。由此可知,制备出的钙基脱氯剂CA-1脱氯效果优于现有工业脱氯剂ET-2及ET-3。
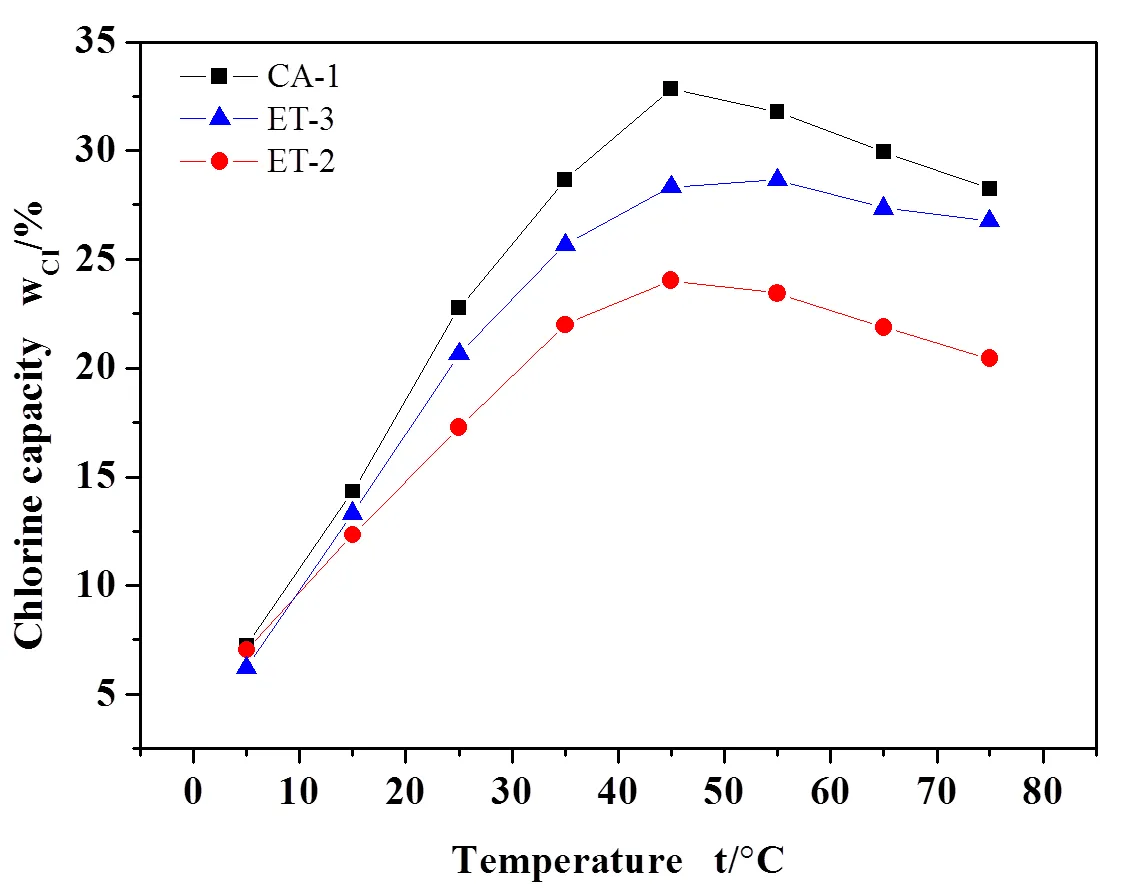
图10 CA-1脱氯剂与ET-2、ET-3脱氯剂在不同脱氯温度下的氯容
3 结论
以廉价易得的氯化铝和氯化钙为原料,碳酸氢铵作为沉淀剂,通过共沉淀法及焙烧制备的钙基脱氯剂。经过一系列的实验表征可发现,随着温度的升高样品会在60-300℃持续失水、700℃分解为CaO-Al2O3、950℃晶化为CaAl4O7,且样品在脱除一部分的水后脱氯效果以及比表面积、孔径、孔容升高,温度继续升高之后逐渐降低。不同温度下处理后的脱氯剂用于气相脱氯时,比表面积大、空隙率高的CA-1脱氯效果最好。而且该脱氯剂在脱氯反应温度45℃、脱氯剂粒度60-80目、原料气体积空速1000h-1的条件下,氯容可达33%。与现有的中国石化公司工业应用的ET-2,、ET-3脱氯剂相比,在相同脱氯条件下,制备出的钙基脱氯剂氯容更高。
[1] 李生运,杜彩霞.催化重整系列脱氯剂的研究与应用[J].石油炼制与化工,2006,37(2):24-29.
[2] 朱晓军,朱建华.脱氯技术现状与研究进展[J].化工生产与技术,2005,12(1):24-28.
[3] 赵春梅.HSD-T-1型高氯容脱氯剂的研制[J].化肥工业,2003,30(5):19-21.
[4] 李凤生.重整装置脱戊烷塔分离精度下降和空冷器腐蚀的原因及对策[J].石油炼制与化工,2004,35(7):65-67.
[5] 姚金森.催化重整装置氯腐蚀及防治[J].催化重整通讯,2002,(1):50-52.
[6] 夏敏,冯金松.催化重整装置预加氢系统的氯腐蚀及对策[J].河南化工,2003,(2):26-27.
[7] 豆斌林,高晋生,鲁军,等.高温煤气净化高效脱氯剂的研究[J].燃料化学学报,2000,28(3):206-209.
[8] 谢辛,李英杰.钙基吸收剂脱除HCl的研究进展[J].化工进展,2013,(8):1921-1928.
[9] 陈克勋,李新怀,吕小婉,等.常温脱氯剂与HCl气体反应动力学的研究[J].化肥工业,2005,32(5):33-35.39.
[10]刘有成,刘建,刘振义,等.新型高温脱氯剂的研制与应用[J].化学工程师,2003,(2):10-12.
[11]郑华艳,李茜茜,崔丽萍,等.Ca/Al固体碱催化菜籽油制备生物柴油[J].燃料化学学报,2012,40(3):331-336.
[12]杨锡尧,任韶玲,何辉,等.新型催化剂载体材料-镁铝复合氧化物的制备及其物理化学性质[J].分子催化,1996,10(2):88-94.
[13]庄超,宁建梅,李艺,等.多孔复合钙铝氧化物的制备、表征及在重整生成油中的脱氯应用[J].燃料化学学报,2015,43(6):740-746.
[14]DE BOER J H.The structure and properties of porous materials [M].London:Butterworth,1985.
Preparation and Performance of Ca-baseddechlorination Adsorbent by Co-precipition Process
LI Rui, XIA Ming-gui, DENG Guo-wei, ZHANG La-mei, WANG Cai-feng
(Chemistry and Chemical Engineering, Wuhan Textile University, Wuhan Hubei 430200, China)
A kind of Ca-based dechlorination sorbents by co-precipitation from low-price calcium chloride and aluminum chloride, ammonium bicarbonate as the precipitant agent. Then treated at 120℃ and 300℃, 700℃ and 950℃. Characterized by XRD, TG-DTG and N2 adsorption and ect., and the results show that the preparation of the adsorbents have highpore ratio, mesoporous and macroporous, the specific surface area is large, with the increase of temperature will gradually dehydration and decomposition and crystallization. The dechlorination of the evaluation system of homemade dechlorination performance evaluation results show that 120℃ treatment samples have the best effect of dechlorination, the breakthrough dechlorination capacity can reach to 33% at the reaction temperature 45℃, GHSV 1000h-1, 60-80 mesh size.
co-precipitation; Ca-basedsorbents; dechlorination; breakthrough dechlorination capacity
TQ426.94
A
2095-414X(2017)06-0059-07
通讯作者:夏明桂(1965-),男,教授,研究方向:石油化工.
武汉纺织大学绿色化工创新团队(201401022).
