藏灵菇乳清对鸡血细胞的保护作用的探究
2018-01-04李晓莉屈长青
刘 佳,李晓莉,屈长青,2*
(1.抗衰老中草药安徽省工程技术研究中心,安徽 阜阳 236037;2.阜阳师范学院 生物与食品工程学院,安徽 阜阳 236037)
藏灵菇乳清对鸡血细胞的保护作用的探究
刘 佳1,李晓莉1,屈长青1,2*
(1.抗衰老中草药安徽省工程技术研究中心,安徽 阜阳 236037;2.阜阳师范学院 生物与食品工程学院,安徽 阜阳 236037)
本文研究了藏灵菇乳清对经过氧化氢处理的鸡血细胞的保护作用。用藏灵菇乳清粉配制的三种不同浓度的乳清溶液(1 mg/mL、3 mg/mL、5 mg/mL)作为实验组,0.75%的生理盐水处理作对照组,孵育后台盼蓝染色鉴定细胞存活状态,MTT法测定鸡血细胞的成活率及测定细胞溶血度。结果显示不同浓度的乳清处理后的鸡血细胞的存活率均高于对照组,细胞溶血度均低于对照组,并且经3 mg/mL的乳清处理的细胞成活率和细胞溶血度与其他各组差异均显著,表明乳清对氧化损伤的鸡血细胞具有保护作用。
藏灵菇乳清;过氧化氢;MTT;保护作用;成活率
“西藏灵菇”(Tibetan mushroom)又名“西藏雪莲”,是源自西藏藏南的林芝地区和新疆天山天池以上海拔山区的特有珍稀菌种,是西藏林芝和新疆天山土生土长的有生命的菌类[1]。藏灵菇是一种非水溶性的呈乳白色、胶质状的颗粒,直径0.3~3.5 cm,其外形酷似米粒[2-3],不同来源的藏灵菇颗粒的菌群和组成成分有所不同,通常含有乳酸菌和酵母菌,少数含有由蛋白脂质多糖复合体固体基质包裹的乙酸菌,是一个微型共生菌落体[4]。用藏灵菇发酵酸奶的进程当中,只用藏灵菇和鲜牛奶,无需加热,不会影响酸奶中有效成份的活性,使发酵所得的酸奶含有100%的乳酸活菌,发酵进程不需添加任何添加剂(如增稠剂,添加剂,甜味素,防腐剂,调味素等)另外,藏灵菇有多种益生作用,藏灵菇中的微生物和多糖等活性成份具备调理肠道微生态平衡,改良肠道功效,其广谱的抑菌特征可以抑制病菌传染肠道,加强免疫调理等。藏灵菇菌群共生发酵发生的益生作用远远高于其所含的任何菌,所以在推重康健保健,免疫综合防治的当今,藏灵菇乳及其相干产物是优质的自然奶制饮品[5-6]。
乳清(Whey)是在酸奶生产过程当中,牛奶固结成凝乳块后分出的呈绿色的、半透明的液体,其构成成份最类似于母乳,利于人体的吸收。乳清中含有的营养成分基本上都是可溶的,如乳清卵白、磷脂、乳糖、矿物质和维生素等。新鲜的乳清经巴氏杀菌之后,再经过冷冻干燥成粉末状,这就是乳清粉[7-8]。乳清粉中除水分以外的其他成分的比例与新鲜的乳清一致。在美国,大约有2/3的乳清直接喷雾干燥成乳清粉或制成乳清浓缩液,其余的1/3的乳清进一步加工成其他的乳清产品,如脱盐乳清粉、低乳糖乳清粉、高乳糖乳清粉、乳糖、乳清浓缩蛋白(WPC)和乳清分离蛋白(WPL)。藏灵菇在发酵酸奶的过程中会产生大量的抗氧化类物质,这些物质分布于乳清中可使乳清具有抗氧化作用,而这是其他酸奶发酵工艺制备的酸奶所不具有的。正常情况下,生物体中的自由基能保护生物体避免有害微生物、细菌等侵害[9-11],但自由基过量时会与细胞中的蛋白,脂质和DNA等生物大分子反应,产生毒害效应,加速细胞的氧化衰老,缩短机体寿命[10],虽然正常细胞内存在清除自由基的防御系统,一定程度上可降低自由基对细胞的损伤,但这些系统不能完全有效的防止伤害。已有研究表明用抗氧化剂处理细胞则会减少细胞在代谢过程中自由基的形成,从而延缓细胞的衰老,所以通过适当的补充抗氧化剂可以减少机体氧化损伤,而藏灵菇乳清中的乳酸菌等抗氧化类物能减轻自由基对细胞危害[12-14]。
但由藏灵菇发酵所得的含有抗氧化成分的乳清在抗疲劳、抗氧化和免疫方面的研究较少,其抗氧化能力及效果等目前还尚不清楚,所以该产品的开发利用都受到了一定的影响,这些都使实验的研究具有一定的研究意义。其主要目标就是利用研究结果开发出对人体更加有利的保健产品。
1 材料与仪器
1.1 材料与试剂
藏灵菇菌种;伊利无菌砖纯牛奶;鸡血样本,清晨于菜市场采取新鲜的鸡血,置于4℃冰箱中保藏。DMEM高糖培养基美国Hyclone公司;DMSO美国Sigma-Aldrich公司;氯化钠、氯化钾、磷酸氢二钠,西陇化工有限公司。
1.2 实验仪器
AR224CN电子天平奥豪斯仪器上海有限公司;酶标仪美国BioTek公司;定温恒温干燥箱上海爱朗仪器有限公司;高压灭菌锅日本HIRAYAMA公司;低温离心机BECKMANCOULTER公司;ZD-9556-A水平脱色摇床太仓市科教器材厂;普通冰箱海尔集团有限公司;个人高速离心机德国eppendorf公司;冷冻干燥机。
2 试验方法
2.1 乳清的制作与提取
2.1.1 发酵剂的制备
将藏灵菇放置于3%(w/v)无抗纯牛乳中,37℃条件下发酵24 h,滤出藏灵菇菌,滤出液即为用于提取乳清的酸奶[21]。
2.1.2 乳清的提取
将发酵好的酸奶于55℃水浴30 min,呈现出上层酪蛋白与下层黄绿色乳清鲜明的两层,过滤出下清液至于真空抽滤泵粗提,再将粗提液于真空抽滤泵中细提取便可得到所需乳清。
2.1.3 乳清粉的制作
将提纯的乳清倒入培养皿内,保证高度不超过1 cm,-80℃急冻8 h之后,转移至真空冷冻干燥箱内,进行真空冷冻干燥12 h,收集冻干的乳清,用粉碎机将冻干样品打粉30 s,收集乳清粉用真空包装,放在通风干燥环境中保存。
2.2 红细胞悬液的制备
首先全血1 500 r/min离心5 min(离心后去上清液,加0.85%生理盐水,混匀,再弃去上清液后再离心,可重复这个操作,不超过3次,直至离心后上清液透亮)制备压积红细胞,然后取100 μL加入到9.9 mL的生理盐水中,缓慢吹打混匀,即是1%的红细胞悬液[22]。
2.3 台盼蓝染色鉴定细胞生死状态
取 200 μL、0.5%的 H2O2,加入到等体积的 1%的红细胞悬液中,并设置无H2O2的对照组混匀,室温条件下保温30 min。分别取400 μL的不同浓度的乳清溶液和生理盐水,加入到等体积的红细胞处理液中混匀,室温条件下保温30 min后,2 000 r/min,5 min离心两次。向沉淀中加入500 μL、0.85%生理盐水,轻轻吹打几次,制成细胞悬液。分别向每组悬液中加入2~3滴0.4%的台盼蓝染液,混合,染色2 min后镜检拍照。
2.3 MTT比色法测定鸡红细胞成活率
取 200 μL、0.5%的 H2O2,加入到等体积的 1%的红细胞悬液中,并设置无H2O2的对照组混匀,室温条件下保温30 min。分别取400 μL的不同浓度的乳清溶液和生理盐水,加入到等体积的红细胞处理液中混匀,室温条件下保温30 min后,2 000 r/min,5 min离心两次。最后使用微量吸样器,在96孔酶标板中,在含有样品的各孔中加入20 μL 的 MTT 液和 100 μL 的血细胞样本液,于37℃恒温培养箱中放置4小时后取出,再向各孔加入200 μL的二甲亚砜(DMSO),用全自动酶标仪于490 nm和530 nm处扫描测定OD值,测量前于水平振荡仪上振荡10 min[15-17]。
2.4 鸡红细胞溶血度的测定
将配成浓度为1%的红细胞悬液,于37℃温育5 min,然后加入终浓度为5%的H2O2引发溶血,再置37℃温育30 min。取反应混合液1 mL,用不同浓度的乳清2 mL稀释,2 000 r/min,离心10 min,取上清液再540 nm处测吸光值A;同样取1 mL反应混合液,用蒸馏水2 mL稀释使红细胞完全溶血,同样条件下离心后在540 nm处测吸光值B,按公式(A/B)×100%计算百分溶血度。
2.5 数理统计方法
实验数据利用SPSS18.0做差异性分析。采用Excel绘图。
3 实验结果
3.1 台盼蓝染色
台盼蓝为无毒染料,其氧化型为蓝色,还原型为无色。活细胞因具有较强的还原能力所以可以将蓝色的台盼蓝还原成无色状态,因此镜检时可见死细胞被染成蓝色。用不同浓度的乳清对0.5%H2O2处理的红细胞的保护作用的结果如图1,蓝色细胞所占比例越小说明细胞受损伤死亡越少。结果显示在不同处理下细胞均有死亡而当乳清浓度为3 mg/mL时,不论是在生理盐水处理组还是在0.5%H2O2处理蓝色比例均小于其他实验组,表明一定浓度的乳清对鸡血细胞的成活具有保护作用。

图1 不同浓度的乳清对H2O2损伤的保护作用 A~D为生理盐水对照组,其乳清样液浓度依次为0 mg/mL、1 mg/mL、3 mg/mL、5 mg/mL;E~H 为 H2O2处理组,其乳清样液浓度依次为 0 mg/mL、1 mg/mL、3 mg/mL、5 mg/mL
3.1 MTT测定
用不同浓度的乳清对0.5%H2O2处理的红细胞的保护作用的比较,在490 nm和530 nm处测OD值,实验结果如图2,横坐标表示不同条件下的乳清浓度,纵坐标表示不同条件下的光吸收值即OD值(间接反应活细胞数量),OD值越大表明活细胞数量越多,也就表明了此条件下的乳清抑制了过氧化氢对细胞的氧化损伤。图中结果表明,在过氧化氢氧化损伤的情况下,不同浓度的藏灵菇乳清均能抑制过氧化氢对鸡红细胞的氧化损伤作用,但1 mg/mL、3 mg/mL的乳清与空白组无显著性差异,5 mg/mL的乳清与其他各组均差异显著。综上所述,一定浓度的乳清可以提高鸡红细胞的抗氧化能力。
3.2 细胞溶血度的测定
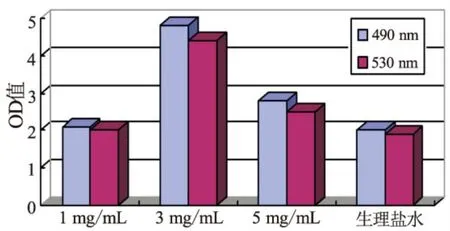
图2 不同浓度的乳清对抗H2O2诱导的氧化活性
溶血表明红细胞损伤破裂,血红蛋白逸出,而OD值即吸光值越大表明红细胞损伤越严重。如表 1,可以看出经浓度 1 mg/mL、3 mg/mL、5 mg/mL藏灵菇乳清处理的鸡血细胞的吸光值分别为0.791、0.623和 0.699,均低于空白组的吸光值0.833,证明经不同浓度的藏灵菇乳清处理后,鸡血细胞的细胞溶血度降低,且3 mg/mL组的细胞溶血度较空白组有显著性差异。但1 mg/mL组与5 mg/mL组的细胞溶血度与空白组无显著性差异,综上表明,浓度为3 mg/mL的藏灵菇乳清显著降低鸡血细胞的溶血度,即藏灵菇乳清对氧化损伤的细胞具有保护作用。

表1 不同乳清浓度对细胞溶血度的影响
4 讨论
1993年Yamaguchi T[18]等人就有相关研究,正常情况下,Hb在红细胞内主要以游离状态存在,也有小部分与红细胞膜结合,当Hb异常或者膜脂异常暴露以及药物作用时,均可引起Hb不可逆地与脂质层结合而导致细胞膜变形扭曲,红细胞膜脂质过氧化是最常见的红细胞损伤,导致细胞溶血,因此一定浓度的氧化物如过氧化氢处理红细胞后Hb释放增加。
同时,也有大量研究表明,无论是体内还是体外,过多的氧自由基可引发红细胞膜脂质过氧化,导致细胞氧化损伤,继而导致细胞氧化溶血,是发生溶血性疾病的重要原因之一。2003年刘慧明等基于此做了相关实验[19],研究槲皮素对过氧化氢诱导的人红细胞氧化损伤的影响,实验结果表明槲皮素对H2O2引发的红细胞氧化损伤有明显的保护作用。凌玉芳研究乳清蛋白酶解物对过氧化氢诱导的氧化损伤的保护作用,表明了乳清具有抗氧化作用[20]。
在此基础上,研究了藏灵菇乳清对鸡血细胞的保护作用。可以看出,与生理盐水对照组相比较,当乳清浓度为1、3、5 mg/mL时,鸡血细胞损伤均有不同程度的降低,但3 mg/mL的乳清对细胞的保护作用更为显著,由此说明一定浓度的藏灵菇乳清对氧化损伤的细胞具有保护作用。
藏灵菇乳清是一种很好的抗氧化剂,一定浓度的藏灵菇乳清能够有效的清除细胞内的氧自由基,降低细胞的损伤,进一步证明了乳清对细胞抗氧化具有一定的增强效果。但由于乳清成分多样复杂,提高细胞的抗氧化作用的具体成分还有待于进一步研究。
[1]Farnworth E R.Kefir a complex probiotic[J].Food Science&Technology Bulletin Functional Foods,2005(2):1-17.
[2]Zhou J Z,Dong M S,Jing H H.Study on microbial population structure of the molecular properties of Tibetan kefir,Microorganism,2006,33:31-31.
[3]Papavasiliou G,Kourkoutas Y,Rapti A,et al.Production of freeze-dried kefir culture using whey,International Dairy Journal,2008,18:247-254.
[4]Zhou J,Liu X,Jiang H,et al.Analysis of the microflora in Tibetan kefir grains using denaturing gradient gel electrophoresis[J].Food Microbiology,2009,26(8):770-775.
[5]Jiang A,Qi Z H,Tian X C,et al.Spiritual study on microbial population structures of molecular properties of Microbiology[J].HeiLongJiang Medicine Journa,2015:713-718.
[6]Li L Q,Wang C M,Song S X,et al.Tibetan kefir milk on intestinal microflora of mice with antibiotic-associated diarrhea effect[J].Chinese Journal of microecology,2004,16:197-197.
[7]Yue L H,Cheng G D,Luo Z W,et al.Tibetan kefir fermented milk on human-induced effect of thymus and spleen index of aging mic[J].Chinese gerontology,2014:5165-5167.
[8]Wolfe R R.Protein supplements and exercise[J].American Journal of Clinical Nutrition,2000,72:551S.
[9]Wu D,Cederbaum AI.Alcohol,oxidative stress and free radical damage[J].Proceedings of the Nutrition Society,2006,65:278-290.
[10]Speakman J R,Selman C.The free-radical damage theory:Accumulating evidence against a simple link of oxidative stress to ageing and lifespan[J].Bioessays News&Reviews in Molecular Cellular&Developmental Biology,2011,33:255-259.
[11]Gems D,Doonan R.Antioxidant defense and aging in:Is[C]//the oxidative damage theory of aging wrong?,2009,8:1681.
[12]Songisepp E,Kullisaar T,Hütt P,et al.A new probiotic cheese with antioxidative and antimicrobial activity[J].Journal of Dairy Science,2004,87(7):2017-2023.
[13]Saide J A,Gilliland S E.Antioxidative activity of lactobacilli measured by Oxygen radical absorbance capacity[J].Journal of Dairy Science,2005,88(4):1352-1357.
[14]Luo Z,Chen L S,Chen L J,et al.Tibetan kefir has good antioxidant activity of lactic acid bacteria in milk screening[J].Food Science,2015,36:109-113.
[15]Huang L K,Du P,Huo G C.MTT method for the determination of the number of bacillus bacteria in[J].Food Industry,2008(3):62-65.
[16]金凤慈,闵莉静.MTT法测定香菇多糖细胞毒性的研究[J].科技信息,2010,05:84-86.
[17]Wei C H,SuY,Li X J,et al.Effects of different concentrations of hydrogen peroxide to treat red blood cells on hemoglobin release[J].Progress in Veterinary Medicine,2014,35(3):64-67.
[18]Yamaguchi T,Kuranoshita K,Harano T,et al.Effects of drugs,salts,and phospholipid vesicles on hemoglobin release from hydrostatic pressure-treated human erythrocytes[J].Journal of Biochemistry,1993,113(4):513-518.
[19]Liu H M,Ding H,Hou G.Quercetin on oxidative damage induced by hydrogen peroxide in human erythrocytes inhibited[J].Journal of Guangdong Medical College,2003,(04):317-318.
[20]LingY F.Protective effect of whey protein hydrolysates on hydrogen peroxide-induced oxidative[D].Jiangnan University,2011.
[21]马海燕,蔡桂林,谷晓青.酸奶的发酵工艺优化[J].内蒙古科技与经济,2013(19):88-89.
[22]邓梅英.贮存期红细胞悬液质量变化及保存的研究概述[J].华夏医学,2009,22(4):783-785.
Protective effect ofTibetan mushroomwhey on chicken blood cells
LIU Jia1,LI Xiao-li1,QU Chang-qing1,2*
(1.Engineering Technology Research Center of Anti-aging Chinese Herbal Medicine,Fuyang Anhui236037,China;2.School of Biological Science and Food Engineering,Fuyang Normal University,Fuyang Anhui236037,China)
In this paper,the protective effect ofTibetan mushroomwhey on chicken blood cells treated with hydrogen peroxide was studied.Three different concentrations of whey solution(1 mg/mL,3 mg/mL and 5 mg/mL)were prepared from the whey powder as the experimental group,and 0.75%saline were used as control group.The survival status of the cells was determined by trypan blue staining method,and the method of MTT assay was used to determine the survival rate of the blood cells and the determination of hemolysis.The results showed that the survival rate of chicken blood cells in the experimental group of different concentrations was higher than those in the control group and 3 mg/mL of whey.Same concentration of whey cell hemolysis are lower than that in the control group,3 mg/mL whey difference with other groups,which shows that the whey's blood cells with oxidative damage are protective.
Tibetan mushroomwhey;H2O2;MTT;protective effect;survival rate
TQ929.2文献识别码:A
1004-4329(2017)04-045-05
10.14096/j.cnki.cn34-1069/n/1004-4329(2017)04-045-05
2017-10-20
安徽省省级科研平台委托专项项目(2014KSLZX01ZD);大学生创新创业项目(201610371060,201610371062);安徽省教育厅高校创新平台项目(2016)资助。
屈长青(1972- ),男,博士,教授,研究方向:中草药抗衰老机理。Email:qucq518@163.com。
