芍药化感作用对香椿种子生长发育的影响
2018-01-04张秋妍刘晓露陶恒港屈长青张静文
张秋妍 ,刘晓露 ,陶恒港 ,屈长青 ,*,张静文 ,陆 均
(1.阜阳师范学院 生物与食品工程学院,安徽 阜阳236037;2.抗衰老中草药安徽省工程技术研究中心,安徽 阜阳236037)
芍药化感作用对香椿种子生长发育的影响
张秋妍1,刘晓露2,陶恒港2,屈长青1,2*,张静文1,陆 均1
(1.阜阳师范学院 生物与食品工程学院,安徽 阜阳236037;2.抗衰老中草药安徽省工程技术研究中心,安徽 阜阳236037)
以香椿种子为材料,采用不同浓度芍药水提物(5%、10%)溶液,对香椿种子萌发进行人工处理,观测芍药水提物对香椿种子的生长发育的影响,并且通过硫代巴比妥酸法检测香椿根系中MDA的含量,从来判断出细胞膜脂过氧化程度和植物对逆境条件反应的强弱;通过TTC法定量测定香椿根系的活力,从而研究不同浓度芍药水提物对种子萌发及幼苗生理生化指标的影响。结果表明,不同浓度的芍药水提物对香椿种子的萌发均有一定的延缓作用,且对香椿种子的发芽率、根长以及根系活力有一定的抑制效果;而根系抗逆境条件反应越弱,其中10%芍药水提物抑制作用显著。
香椿种子;芍药水提物;化感作用;种子萌发;生理生化指标
香椿(Tooma sinensis)不仅是一种可食用的营养丰富的植物,而且它的提取物含有许多药用价值[1],胡敏等对香椿子正丁醇提取物对脑缺血后肝肺损伤的保护作用进行了研究,结果发现香椿子正丁醇提取物可通过其抗氧化应激效应对脑缺血介导的多器官功能障碍综合征发挥保护作用[2]。扶雄等从香椿叶中分离提取多酚,采用活性追踪法,运用多种分离纯化技术和色谱学分析,逐级筛选活性强的部位以及单体化合物[3]。研究表明,多酚是香椿叶的有效降血糖功能成分之一[4]。
据文献记载,人类很早就了解并记载植物对周围其他植物的生长产生抑制作用的现象[5],早在公元前77年已发现黑胡桃对周围邻近植物有毒害作用,德国科学家Molisch1937年首次把这种现象称为化感作用(allelopathy)[6]。1992年国家科学名词审定委员会把它正式定名为“化感作用”即植物之间(包括微生物)相互的化学关系对植物的生长产生抑制或促进的作用[7]。在我国,对于化感作用的关注较少,真正对作物化感作用的研究直到1970年后才开始,1980年后一段时间才提到化感作用和类似的概念[8],但近年来国内外许多学者通过利用植物对邻近其他植物的抑制作用进行杂草防治[9],并广泛应用于在农业生产中间、套作作物的选择、作物的连作障碍、作物轮作问题以及秸秆残茬覆盖等问题中[10]。化感作用的研究在保护生物多样性和减少化学污染负面影响等方面取得了重要进展,所以在科学领域中占有重要地位,为人类可持续发展奠定了基础[11]。
芍药(Paeonia lactiflora)是一种用于治疗多种疾病的传统中药[12]。在治疗炎症[13],癌症[14]以及阵痛方面具有很好的作用,但对于其抗干旱胁迫[15]方面的研究较少。本实验拟通过研究不同浓度芍药水提物对香椿种子萌发率及生理生化指标的影响,探究其在芍药化感方面的作用,以期为香椿的合理种植提供理论指导。
1 材料与方法
1.1 材料
供试香椿种子采自安徽阜阳太和,供试芍药采自安徽阜阳。
1.2 试剂
丙二醛(MDA)法的配制:三氯乙酸(质量分数5%),硫代巴比妥酸(6 g/L),石英砂。氯化三苯基四氮唑(TTC):TTC(10 g/L),乙酸乙酯,硫酸(1 mol/L),磷酸缓冲液(6 mmol/L,pH7.0),石英砂。
1.3 仪器
分光光度计(Nanodrop);离心机(LD4-2A);恒温水浴(北京东方精瑞科技发展有限公司);恒温箱(LHP-250HE);超纯水系统(Milli-Q);研磨器;容量瓶;烧杯;研钵;量筒;三角烧瓶;具塞试管;中药粉碎机(HX-200)。
1.4 实验方法
1.4.1 芍药水提物溶液的配制
取干燥的芍药若干,经中药粉碎机粉碎至粉末状备用,分别称取适量芍药粉末与超纯水配制成浓度为5%和10%的芍药水提物溶液,以清水为对照组。
1.4.2 香椿种子萌发实验
选取30粒种仁饱满、新鲜、大小一致的香椿种子,使用0.1%高锰酸钾溶液消毒5 min[16],用纯水将种子冲洗干净后置于55℃水中搅拌10~15 min,待水温降至30℃时停止搅拌。然后将香椿种子分别浸泡在清水、5%的芍药溶液、10%的芍药溶液中,置于温度为30℃的恒温水浴中,保温12 h。再均匀置于铺有一层预先用10 mL超纯水浸泡(稍有余液渗出)的滤纸的培养皿中。然后置于温度为25℃的光照培养箱中培养,待种子萌芽后,每天光照8 h。每个处理做3次重复。
试验期间,每天在实验组培养皿中滴加相应浓度的芍药提取液5 mL,对照组滴加相同体积的超纯水,以保持香椿种子湿润但又勿使种子浸在溶液中,2~4 d换1次滤纸,并及时清理发霉腐烂的种子,以防止感染其他种子,发霉腐烂的种子计作不发芽[16]。
2 测定方法
2.1 发芽率测定
以胚根长度等于种子长度的1/2作为发芽标准。当3个重复中有1个种子发芽,将这个时间记为该种子发芽的起始期,以后每天记录发芽种子的数量。当连续4 d没有种子发芽时,记为发芽的结束期。参照《种子生物学研究指南》计算发芽率。以发芽结束时对照的各项指标记作100%,计算胁迫处理各指标的相对值[17]。
2.2 上胚轴和胚根比例及根长的测定
测量香椿种子萌发后的胚根和上胚轴的长度以及根长,并进行相应的计算。
2.3 MDA的测定方法
硫代巴比妥酸法:取香椿根部材料0.2 g,洗净擦干,分别放入研钵中。待研磨彻底后转移到离心管,将离心管中的研磨液加到5 mL为止。再分别往各个离心管中加入0.5%的TBA 5 mL,即最后每个离心管中共10 mL液体。沸水浴10 min,冷却后离心(3 000 r/min,10 min)。测定上清液在450 nm、532 nm和600 nm处的吸光度值,并按公式C(µmol/g)=[6.452(A532-A600)-0.56 A450]*VT/(V0*W)算出单位鲜重组织中的MDA浓度C(µmol/g)。
2.4 根系活力的测定方法
实验采用TTC法测定根系活力,将香椿种子分别浸泡在清水、5%的芍药溶液、10%的芍药溶液中6 h后,沿果实顶端约纵轴长度1/5处横切,使露出果实的四室,然后沿与纵轴成30°角斜切种子以暴露出种胚,放入盛有四氮唑溶液的培养皿中。在20~30℃下染色,四氮唑的浓度分别为0.1%、1%(用磷酸缓冲液配制2,3,5-氯化三苯基四氮唑溶液,pH 6.5~7.5),染色时间为 15 min。染色后根据胚着色程度和部位鉴定种子的生活力,计算有生活力种子的百分率。每个处理设1组重复,每次重复用50粒[18]。
2.5 数理统计方法
实验数据利用SPSS18.0做差异性分析。采用Excel绘图。
3 结果与讨论
3.1 芍药提取液对种子发芽率及发芽势的影响
图1显示,不同浓度的芍药水提物都可抑制香椿种子的发芽率,其中浓度为10%芍药水提物对发芽率抑制作用明显。
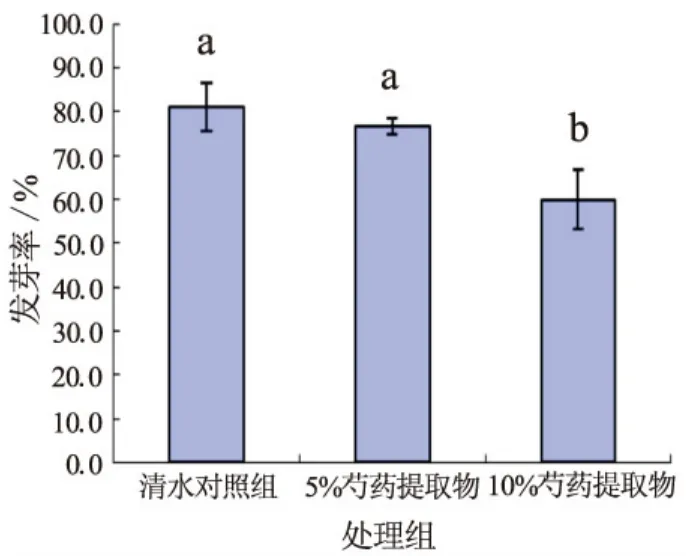
图1 不同浓度芍药水提物对香椿发芽率的影响 图中数据为平均值±标准误差,小写字母表示0.05水平上的差异,字母相同差异不显著,字母不同差异显著
3.2 芍药提取液对香椿种子根长的影响
两周后,浓度为5%和10%的芍药水提液均显示对香椿种子具有较强的抑制作用,而浓度为5%的芍药水提液相对10%的芍药水提液抑制作用较弱如图2。
3.3 芍药提取液对种子胚根和上胚轴比例的影响
在香椿种子生长初期,芍药水提物对香椿种子的胚根和上胚轴比例的延缓作用与对照组相比无显著差异如图3。
3.4 芍药提取液化感后种子发芽胚根MDA含量
由图4可知,不同浓度的芍药水提物处理后,香椿种子根系中的MDA含量与对照组呈现出明显差异,在供试范围内,随着芍药水提物浓度的增加,MDA值呈现上升趋势,质量分数为5%芍药水提物的MDA值比对照组高77.88%,质量分数为10%芍药水提物高84.21%。
3.5 芍药提取液化感后香椿种子根系活力(TTC)
通过TTC法来测定试验种子根系的还原活力,结果表明,芍药水提物浓度越高,种子根系活力越弱。

图2 不同浓度芍药水提物对香椿种子发芽总长的影响图中数据为平均值±标准误差,小写字母表示0.05水平上的差异,字母相同差异不显著,字母不同差异显著;大写字母表示0.01水平上的差异,字母相同差异未达极显著,字母不同差异极显著
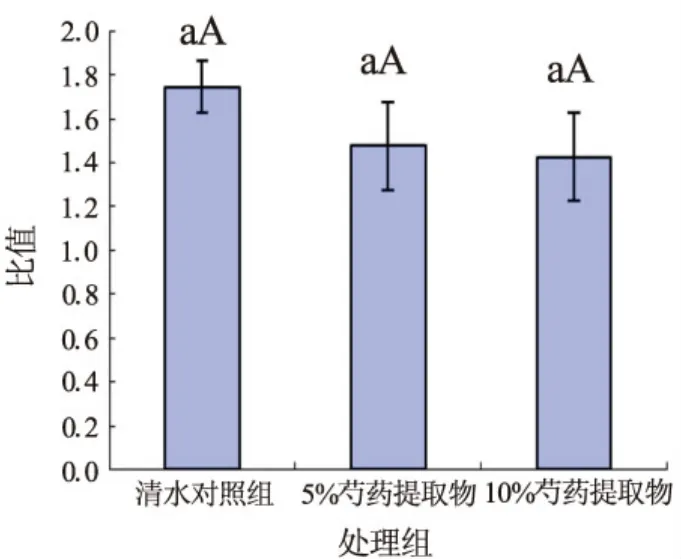
图3 不同浓度芍药水提物对香椿种子胚根和上胚轴比例的影响 图中数据为平均值±标准误差,小写字母表示0.05水平上的差异,字母相同差异不显著,字母不同差异显著;大写字母表示0.01水平上的差异,字母相同差异未达极显著,字母不同差异极显著
4 小结与讨论
植物的化感作用是指植物或微生物通过释放化学物质到环境中而产生对其它植物或微生物直接或间接的有害或有益作用,分泌的这些化学物质称为化感物质。目前有关化感物质对植物种子萌发的影响要集中在抑制植物种子萌发方面,许多化感物质能够显著抑制植物种子萌发,并影响以后幼苗的生长发育,研究显示化感物质主要通过调控种子萌发机制来达到抑制作用,包括抑制胚的生长,破坏种子细胞结构,干扰种子活性氧的产生与积累,影响种子萌发的代谢途径等。植物不同部位的化感物质对植物种子的影响有所不同,Yuan等的研究表明,加拿大一枝黄花水提液能够显著抑制鸡眼草,莴苣,萝卜等种子的萌发[19],Han等研究表明生姜的茎和叶的水提取液在多个浓度下均能抑制大豆及北葱种子萌发,但不同部位的提取液抑制效果有所差异[20]。芍药的研究主要集中在中医药方面,对于其抗干旱胁迫方面和对其他植物的化感作用方面的研究较少,罗小勇等研究了芍药不同器官的除草活性,研究表明芍药的果实,叶和花的抑制活性最强,而根和茎的抑制效果相对较弱[21]。
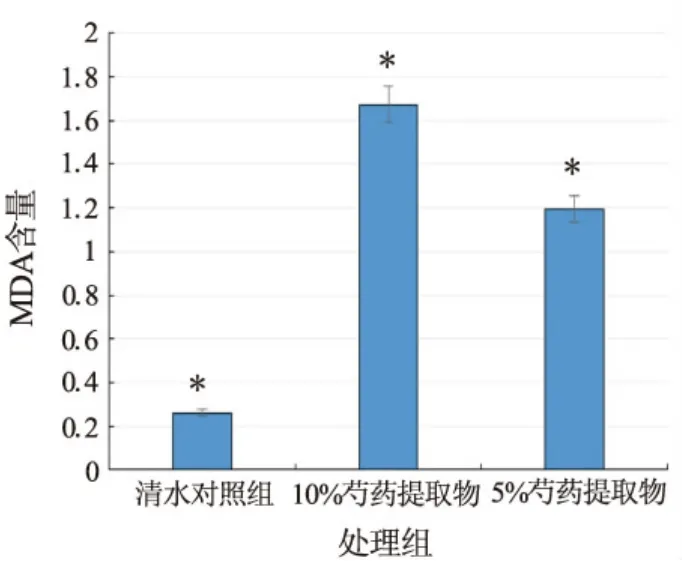
图4 不同浓度芍药水提物对香椿根系MDA含量的影响

图5 不同浓度芍药水提物对香椿根系活力的影响
本实验选取质量分数5%和10%的芍药水提物为实验组,清水为对照组,通过对香椿种子进行形态指标和生理指标测定。结果表明,在形态指标上,实验组对香椿种子的发芽率、根长以及根系活力有一定的抑制效果,且浓度越高抑制作用越明显,但是芍药水提物对香椿种子的胚根和上胚轴比例的延缓作用与对照组相比无显著差异,这说明10%浓度芍药水提物对香椿种子的胚根和上胚轴比例的形态学指标影响微弱,而且并非每类化感物质都能通过同时抑制胚根和上胚轴的伸长来抑制胚的生长。在生理指标上,实验组的MDA值均高于对照组,表明其细胞膜脂过氧化程度和对逆境条件反应的越弱,其中质量10%香椿水提物MDA值最高,膜发生膜脂过氧化程度最强;通过TTC法测定,质量分数为5%的芍药提取液处理后的香椿根系活力与对照组差异不明显,而质量分数1。
[1]赵玉山.香椿的药用价值[J].西南园艺,2000,28(1):27-28.
[2]胡 敏,陈 超,周 聪,等.香椿子正丁醇提取物对脑缺血后肝肺损伤的保护作用研究[J].2014(7):1560-1562.
[3]扶 雄,张 伟,朱思明,等.香椿叶多酚的提取分离及其体外对糖尿病关键酶活性的抑制作用[J].现代食品科技,2014(7):10-15.
[4]邢莎莎,陈 超.香椿子多酚对糖尿病大鼠早期肝损伤保护作用[J].中国实验方剂学杂志,2011,17(12):182-184.
[5]姜 男.芳香植物对杂草的化感抑制作用研究[D].哈尔滨:哈尔滨师范大学,2015.
[6]王建花,陈 婷,林文雄.植物化感作用类型及其在农业中的应用[J].中国生态农业学报,2013,10:1173-1183.
[7]张晓珂,姜 勇,梁文举,等.小麦化感作用研究进展[J].应用生态学报,2004,15(10):1967-1972.
[8]张爱华,郜玉钢,许永华,等.我国药用植物化感作用研究进展[J].中草药,2011,10:1885-1890.
[9]吕春霞,杨文权,慕小倩.植物化感作用及其在杂草防治中的应用[J].陕西农业科学,2002,12:18-20.
[10]李春杰,赵 丹,司兆胜,等.不同轮作系统中作物根渗出物对大豆种子萌发的化感作用[J].大豆科学,2013(2):206-210.
[11]左胜鹏,马永清,李秀维.植物化感作用与生物多样性[J].植物遗传资源学报,2006(4):494-498.
[12]金英善,陈曼丽,陶 俊.芍药化学成分和药理作用研究进展[J].中国药理学与毒理学杂志,2013,27(4):745-750.
[13]林小常.芍药汤调控炎症因子改善EMT防治结肠炎相关癌的机制研究[D].广州:南方医科大学,2015.
[14]卫 月.癌症病因病机的理论研究及芳香药物的应用探讨[D].北京:北京中医药大学,2010.
[15]曲 涛,南志标.作物和牧草对干旱胁迫的响应及机理研究进展[J].草业学报,2008(2):126-135.
[16]石贵玉,廖文雪,秦丽凤等.PEG模拟水分胁迫对香椿种子萌发的生理生化指标影响[J].福建林业科技,2009(4):142-145.
[17]潘春柳,邓志军,黄燕芬等.绞股蓝种子休眠机理及其破除方法研究[J].西北植物学报,2013(8):1658-1664.
[18]张志勇,卜晶晶,王素芳等.冠菌素对不同钾水平下TTC法测定的棉花根系活力的影响[J].植物生理学报,2015,05:695-701.
[19]Yuan Y G,Wang B,Zhang S S,et al.Enhanced allelopathy and competitive ability of invasive plant Solidago canadensis in its introduced range[J].JOURNAL OF PLANT ECOLOGY,2013,6(3):253-263.
[20]Han C M,Pan K W,Wu N,et al.Allelopathic effect of ginger on seed germination and seedling growth of soybean and chive[J].Scientia Horticulturae,2008,116(3):330-336.
[21]罗小勇,张英杰.芍药不同器官除草活性的研究[J].中国生态农业学报,2010,18(5):1148-1150.
Allelopathy effect ofPaeonia lactifloraaqueous extract on the growth ofToona sinensisseeds
ZHANG Qiu-yan1,LIU Xiao-lu2,TAO Heng-gang2,QU Chang-qing1,2*,ZHANG Wen-jing1,LU Jun1
(1.School of Biological and Food Engineering,Fuyang Normal University,Fuyang Anhui236037,China;2.Key Laboratory of Embryo Development and Reproductive Regulation in Anhui,Fuyang Anhui236037,China)
Allelopathy effect of different concentrations(5%and 10%)ofPaeonia lactifloraaqueous extract on the growth ofToona sinensisseeds were determined via laboratory bioassay,and the content of MDA in roots ofToona sinensiswas determined by sulfur acid method.The vitality of the roots ofToona sinensiswas determined by TTC method.The results showed that the different concentrations ofPaeonia lactifloraaqueous extract had a certain delaying effect on the germination ofToona sinensisseeds,and had some inhibitory effect on germination rate,root length,and root vigor ofToona sinensisseeds.The response of root system to the stress was weaker.The inhibitory effect of 10%Paeonia lactifloraaqueous extract was significant.
seed ofToona sinensis;Paeonia lactifloraaqueous extract;allelopathy effect;seed germination;physiological and biochemical indicators
Q948文献识别码:A
1004-4329(2017)04-041-04
10.14096/j.cnki.cn34-1069/n/1004-4329(2017)04-041-04
2017-10-10
安徽省省级科研平台委托专项项目(2014KSLZX01ZD);大学生创新创业项目(201610371060,201510371019,201610371062);安徽省教育厅高校创新平台项目(2016)资助。
屈长青(1972- ),男,博士,教授,研究方向:中草药抗衰老机理。Email:qucq518@163.com。
