三峡库区消落带重建植被下土壤微生物生物量碳氮含量特征
2018-01-04杨文航任庆水贺燕燕李晓雪李昌晓
杨文航,秦 红,任庆水,贺燕燕,李晓雪,李昌晓
西南大学生命科学学院, 三峡库区生态环境教育部重点实验室,重庆市三峡库区植物生态与资源重点实验室,重庆 400715
三峡库区消落带重建植被下土壤微生物生物量碳氮含量特征
杨文航,秦 红,任庆水,贺燕燕,李晓雪,李昌晓*
西南大学生命科学学院, 三峡库区生态环境教育部重点实验室,重庆市三峡库区植物生态与资源重点实验室,重庆 400715
为探究三峡库区消落带植被重建后,土壤微生物生物量含量特征及影响因素,对忠县消落带人工重建植被土壤及裸地土壤(作为对照)微生物生物量碳氮含量进行了调查研究。结果表明:(1)在消落带165—175 m高程土壤微生物生物量碳含量草地>林地>农耕地>裸地,微生物生物量氮含量规律与微生物生物量碳一致,农耕地明显提高;土壤微生物生物量总体呈现出草地最高、林地和农耕地次之,裸地最低的趋势,表明进行消落带植被恢复对土壤微生物生物量有显著的促进作用。(2)不同植被类型下,土壤微生物生物量碳氮比变化范围为8.02—10.25,土壤微生物生物量碳、氮占土壤有机碳、全氮的百分比范围分别是2.40%—4.60%和2.13%—3.58%,其中林地对土壤碳、氮库贡献显著高于裸地 (P<0.05)。(3)土壤微生物生物量碳、氮与土壤有机碳、全氮和pH值呈现显著相关性,与土壤含水量呈现极显著相关性,说明消落带重建植被土壤的这些理化性质对土壤微生物生物量碳、氮含量有强烈的影响。因此,在三峡库区消落带进行植被恢复重建能显著提高土壤微生物生物量及土壤质量,对加强三峡库岸生态系统的稳定性具有重要意义。
植被恢复;微生物生物量碳氮;三峡库区;消落带
三峡水库修建后,水位每年在145—175 m之间变动[1],形成垂直落差达30 m,总面积约348.93 km2的消落带[2]。“冬蓄夏排”的水位调节模式使消落带大量原有植被消亡,生物多样性降低,生态屏障功能减退[3]。为发挥消落带植被在防治水土流失和土地退化[4]、提高土壤肥力、降低水体污染等方面的重要作用,进行三峡库区消落带的植被恢复及生态系统重建是十分必要的[5]。消落带植被恢复近年来受到社会各界的广泛关注与重视[6],通过人工重建植被是恢复消落带植被的有效方法之一[7]。目前已筛选出了一批耐水淹植物,木本如:池杉(Taxodiumascendens)[8]、旱柳(Salixmatsudana)[9];草本如:扁穗牛鞭草(Hemarthriaaltissima)[10]、狗牙根(Cynodondactylon)[11]等,这些植物均能很好地适应三峡消落带的生态环境。选择适生的植物在三峡消落带进行人工植被恢复具有重大的生态效益。然而,消落带人工植被的恢复与重建需要土壤作为载体。消落带土壤是连接植物与水体的介质,土壤肥力及质量的演变对于消落带生态系统具有重要意义。
目前国内外对于土壤微生物生物量碳氮含量的研究报道已有很多,包括在不同用地类型下、不同植被类型下等[12- 13],而对于水库消落带这一特殊生境,相关研究多集中在自然恢复状态下[14],尤其对于消落带植被重建后土壤微生物生物量碳氮含量的变化研究匮乏。土壤微生物是生态系统的重要组成部分,土壤微生物生物量的多少及其变化是土壤肥力高低及其变化的重要依据之一[15]。相比土壤有机质的周转时间5—10年,土壤微生物生物量周转时间相对较快,少于1年[16]或1—3年[17]。在能够精确地测定土壤有机质(soil organic matter, SOM)变化之前,土壤微生物生物量动态是土壤变化趋势的早期指示[18]。由于土壤微生物生物量对外界反应的灵敏性,可以作为反映环境和管理措施变化的敏感标记,对土壤利用和管理具有重要的指示意义[19]。土壤微生物生物量中最重要的两个指标是土壤微生物生物量碳(SMBC)和土壤微生物生物量氮(SMBN)。土壤微生物生物量碳在土壤中的绝对数量不大,一般为土壤有机碳(SOC)的1%—5%[20],但其既能充当碳源,又能充当碳汇, 对土壤碳库甚至全球大气CO2浓度起着重要的调节作用[21];此外,土壤微生物生物量碳(SMBC)与土壤有机碳(SOC)总量的比值[18]被称为土壤微生物商(microbial quotient, MQ, SMBC/SOC),也可作为指示土壤碳动态变化的灵敏指标[22]。土壤微生物生物量氮是土壤氮素的一个重要储备库,也是土壤有机氮中最为活跃的组分,在土壤氮循环与转化过程中起着重要的调节作用[23]。对三峡库区消落带恢复重建植被下土壤微生物生物量碳氮含量特征进行研究,有利于了解植被重建之后土壤质量的演变,为消落带植被重建后土壤肥力和土壤质量的评价提供理论基础。
1 材料与方法
1.1 研究区概况
本研究区域位于重庆市中部、三峡库区腹心地带,远离重庆主城区。示范基地位于长江支流汝溪河流域,地处忠县共和村(107°32′—108°14′E,30°03′—30°35′N),面积13.3 hm2,属亚热带东南季风区山地气候。温热寒凉,四季分明,雨量充沛,日照充足。≥10℃年积温5787℃,年均温18.2℃,无霜期341 d,日照时数1327.5 h,日照率29%,年降雨量1200 mm,相对湿度80%;土壤主要为发育于亚热带地区石灰性紫色砂页岩母质的紫色土,母岩风化浅,土壤熟化度低,水土流失较为严重[24]。
消落带30 m落差内经历周期性水淹,研究周期内175 m高程短时间淹水约0 d,165 m高程中期淹水约175 d,155 m高程长期淹水约260 d。为进行三峡水库消落区的生态恢复,课题组于2012年3—4月在重庆忠县石宝镇汝溪河流域构建流域生态修复示范基地,示范基地原为弃耕梯田,在示范基地内165—175 m海拔高程按1 m × 1 m的株行距带状(垂直于河流方向)栽植落羽杉(Taxodiumdistichum)、旱柳(Salixmatsudana)木本植被林地,落羽杉和旱柳均为单一林地植被构建。所选岸坡样地平均坡度为26°,岸坡上接受光照辐射强度大致相同,土壤预热条件基本一致。所栽植苗木的规格均为两年生健康苗木。取样时苗木成活率均为100%,生长状况良好。利用狗牙根、扁穗牛鞭草进行草地植被构建,狗牙根以匍匐茎为繁殖体,行距为20 cm×20 cm;扁穗牛鞭草割取孕穗前的地上茎,埋土至3节位,行距为30 cm×30 cm。栽植时相同物种的生长状况基本一致。狗牙根和扁穗牛鞭草种植按块状混交模式进行。研究区域内,还有农耕地(Cropland)和裸地(Unplanted soil)不同用地类型,农耕地为当地人为管理的耕作地,裸地为原废弃梯田进行人工除杂后未进行人工植被恢复的遗留地。土壤取样时对各物种植被生长状况进行测定(表1)。

表1 植被生长状况(平均值±标准误)
1.2 样品采集测定与数据处理
于2016年6月在三峡库区消落带试验样地165—175 m海拔进行采样(图1),此时植被已恢复生长两个月。每种植被类型下随机选择5 m×5 m的样地,林地植被类型中包括落羽杉和旱柳两种乔木,共6块样地;草地植被类型中包括狗牙根和牛鞭草两种草本,共6块样地;农耕地为单一玉米种植地,3块样地;选裸地进行对照(CK),3块样地。采集表层(0—20 cm)土样,每块样地进行梅花形5点取样,剔除可见杂物后混合均匀,用四分法装袋迅速带回实验室,一部分土样自然风干,碾磨并过100目筛,用于测定土样含水量、pH值、有机碳及全氮等理化性质。另一部分土样过2 mm筛后,用蒸馏水调节至饱和持水量的40%,25℃、相对湿度100%条件下预培养10 d,用于分析土壤微生物生物量碳和氮。

图1 位于重庆忠县的三峡水库消落带样地分布示意图Fig.1 Sketch map of sampling sites of the hydro-fluctuation belt of the Three Gorges Reservoir in Zhong County, Chongqing Municipality
SMBC的测定采用氯仿熏蒸提取重铬酸钾氧化法,称取 25 g(烘干重)预培养土样,在真空干燥器中用去乙醇氯仿蒸汽熏蒸24 h后,再反复抽真空,除去熏蒸土样残存氯仿,每一份土样做不熏蒸对照,用80 mL 0.5 mol/L K2SO4溶液振荡提取30 min,过滤,用重铬酸钾法测定提取液中的有机碳[25];SMBN测定采用氯仿熏蒸提取凯氏定氮法,滤液用凯氏定氮仪蒸馏测氮[26]。土样中SOC和TN采用元素分析仪(Elementar Vario EL,Germany)[27]测定。采用土∶水=1∶2.5水浸提,酸度计法测定土壤pH值,采用环刀法测定土壤容重。采用烘干法测定土壤含水量[28]。试验数据采用SPSS 20.0 软件进行单因素方差(One-way ANOVA)统计分析,并用LSD法检验不同植被类型土壤间的差异性(α=0.05),土壤碳氮和微生物生物量碳氮的相关关系采用Pearson相关系数法评价,图像用Origin8.5制图。
结果计算:
土壤微生物量碳:
SMBC =EC/kEC
式中,EC= 熏蒸土壤提取的有机碳-不熏蒸土壤提取的有机碳;kEC为转换系数,本实验采用化学方法测定有机碳,取值0.38[29]。
土壤微生物量氮:
SMBN =EN/kEN
式中,EN= 熏蒸土壤提取的全氮-不熏蒸土壤提取的全氮;kEN为转换系数,目前大多数研究者都采用Jenkinson建议的kEN,取值0.45[25]。
2 结果与分析
2.1 消落带不同植被类型下土壤理化性质的差异
裸地和草地pH值无显著性差异,但均显著高于林地,农耕地与其他植被类型pH值均无显著性差异(表2)。土壤含水量趋势为草地>林地>农耕地>裸地,其中林地和农耕地土壤含水量差异不显著,裸地与其他植被类型土壤含水量均呈现出显著性差异。土壤容重裸地>林地>草地>农耕地,各植被类型间均呈现出显著性差异。土壤有机碳含量表现为草地>农耕地>裸地>林地,其中草地显著高于其他植被类型,农耕地和裸地差异不显著,但显著高于林地。土壤全氮含量在各植被类型间差异显著,草地全氮含量最高,裸地全氮含量最低。
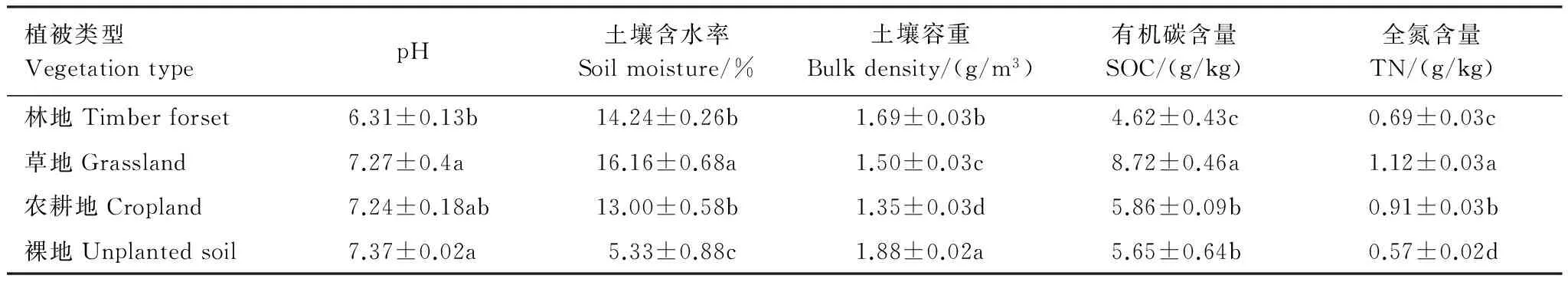
表2 消落带不同植被类型下土壤的理化性质(平均值±标准误)
SOC:有机碳,Soil organic carbon; TN:全氮,Total nitrogen;同列不同小写字母代表不同植被类型的土壤理化性质间差异显著(P<0.05)
2.2 消落带不同植被类型下土壤微生物生物量碳氮差异
不同植被类型土壤微生物生物量碳含量从裸地、农耕地、林地到草地呈递增趋势,草地与林地分别是裸地的1.95倍和1.61倍,但草地和林地之间微生物生物量碳差异性不显著(图2)。林地和农耕地土壤微生物生物量碳含量均显著高于裸地。对于土壤微生物生物量氮含量,除农耕地明显升高,递增规律与微生物生物量碳一致,其中草地与其他植被类型差异显著,农耕地和林地没有显著性差异,但均显著高于裸地。草地、林地和农耕地土壤微生物生物量氮含量分别为裸地的2.76、1.93倍和1.67倍。
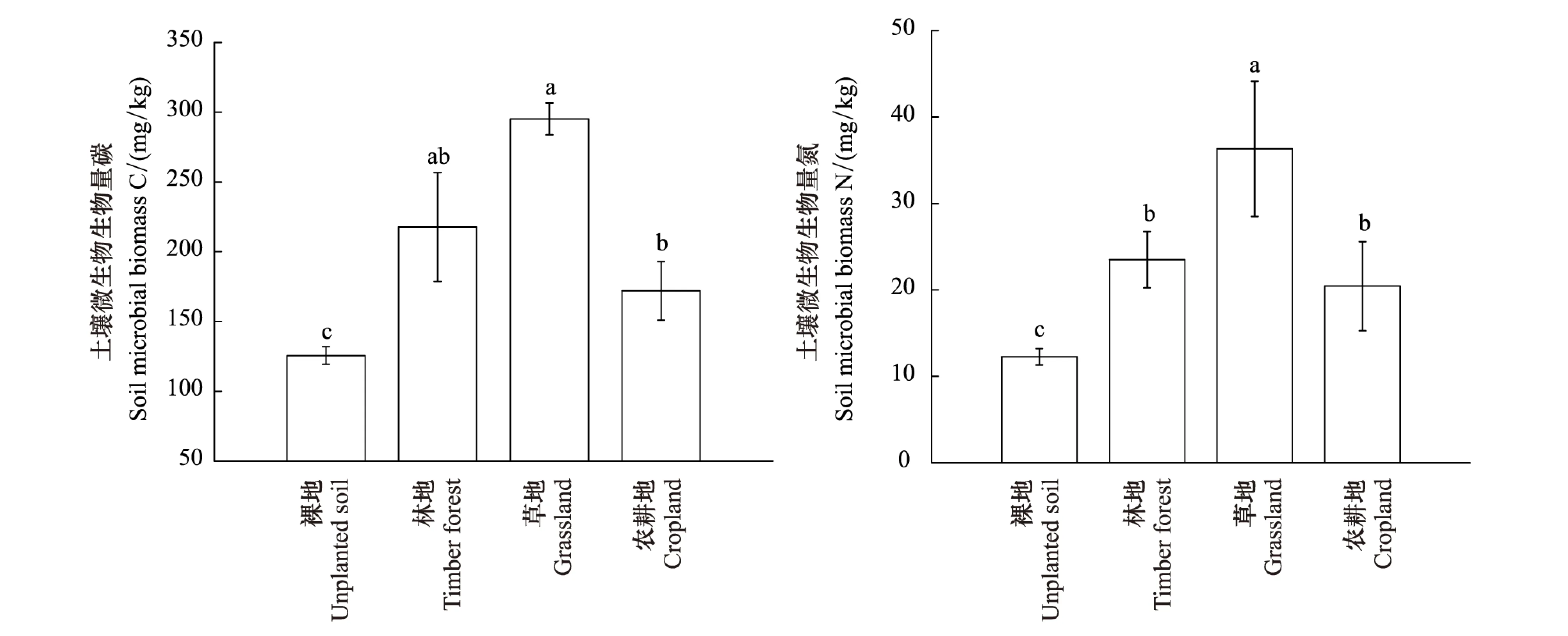
图2 消落带不同植被类型下土壤微生物生物量碳、氮Fig.2 The soil microbial biomass carbon and nitrogen under different vegetation typesUS:裸地,Unplanted soil; TF:林地,Timber forest; GL:草地,Grassland; CL:农耕地,Cropland; 不同小写字母代表不同植被类型间的差异显著(P<0.05)
2.3 消落带不同植被类型下土壤微生物生物量碳氮对土壤碳库和氮库的影响
在不同植被类型中,SMBC/SMBN表现为:草地、农耕地和裸地相互之间分别无显著性差异,但均显著高于林地(表3)。SMBC/SOC表现为 林地>草地>农耕地>裸地,林地显著高于其他植被类型;草地和农耕地之间无显著差异,但均显著高于裸地。SMBN/TN呈现与SMBC/SOC一样的规律,其中林地与草地差异不显著,农耕地和裸地差异不显著,但林地与草地SMBN/TN分别显著高于农耕地和裸地。SOC/TN裸地最高,显著高于其他植被类型,林地最低,且与草地差异显著。
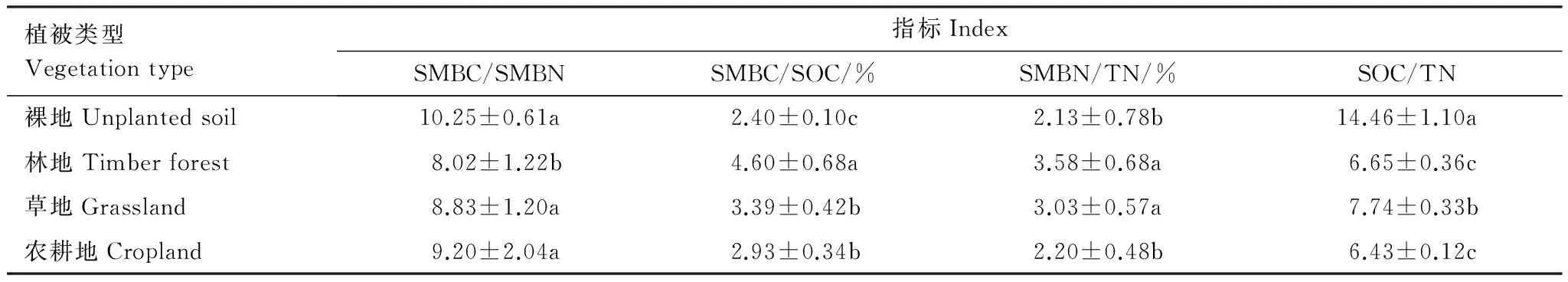
表3 消落带不同植被类型土壤微生物生物量对土壤碳库和氮库的影响(平均值±标准误)
SMBC:微生物生物量碳,Soil microbial biomass carbon; SMBN:微生物生物量氮,Soil microbial biomass nitrogen; SOC:有机碳,Soil organic carbon; TN全氮,Total nitrogen; 同列不同小写字母代表不同植被类型的土壤理化性质间差异显著(P<0.05)
2.4 微生物生物量碳与土壤有机碳及微生物生物量氮与土壤全氮的关系
如表4所示,SMBC和SMBN均与土壤含水率呈极显著正相关,与SOC、TN和pH值呈显著正相关;土壤微生物生物量碳氮含量和土壤容重均未达到显著相关。说明在消落带植被淹水后进行初期恢复生长的过程中,土壤微生物生物量碳氮含量与土壤含水率、SOC、TN和pH值存在紧密联系。
3 讨论
土壤微生物生物量是驱动植物养分转化和循环的关键,在植被恢复生态系统中起着重要作用。研究土壤微生物生物量对了解土壤肥力、土壤养分的转化和循环以及环境变化具有重要意义[30]。植被恢复对土壤微生物有积极影响,土壤微生物生物量的增加归因于土壤碳氮的增加[31]。何振立[32]、赵先丽等[33]研究表明,在各植被类型中,微生物生物量碳的顺序一般为:草地>林地>耕地,微生物生物量氮的顺序一般为:草地>耕地>林地。本研究中草地土壤微生物生物量碳氮含量最高,林地和农耕地次之,裸地最低,与一般规律相似。就消落带人工草地而言,在淹水期,草本面对不同水淹环境具有不同的适应策略以增加对水淹的耐受性。而在落干生长期,相比与林地与农耕地,草地种群密度大,凋落物更多,并且表层密集了发达的根系,根系的分泌物和衰亡的根更是微生物的能源物质,因此,向土壤微生物提供的能源是草地>林地>耕地>裸地,从而导致土壤微生物生物量的变化也是草地>林地>耕地>裸地[34]。但本研究中林地和农耕地土壤微生物生物量差异较小,这可能是由于在三峡水库水位退水初期,各人工植被处于生长恢复初期,涨落过程中,林地凋落物易悬浮在水体表面,并且随着水流离开土壤,生物量向地下的输出较少所致。而农耕地作物由于人为施肥管理等原因已经处于生长旺盛期,有机碳和全氮都维持在较高的水平,对于土壤微生物生物量贡献提高。
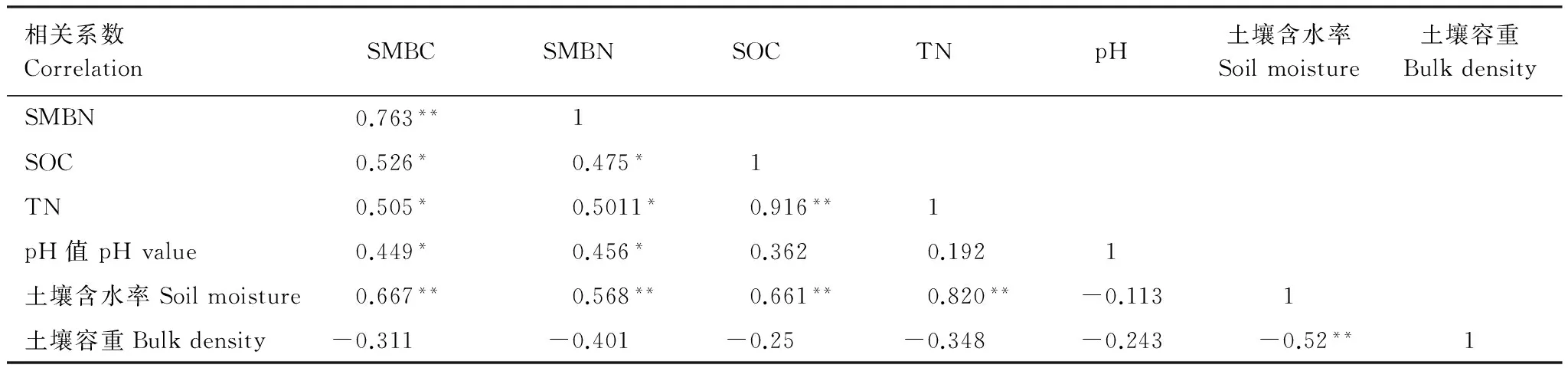
表4 不同植被类型下土壤微生物生物量碳氮含量与土壤碳氮相关性
**和*分别表示极显著(P<0.01)和显著(P<0.05)相关; SMBC:微生物生物量碳,Soil microbial biomass carbon; SMBN:微生物生物量氮,Soil microbial biomass nitrogen; SOC:有机碳,Soil organic carbon; TN:全氮,Total nitrogen
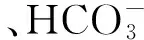
土壤微生物生物量碳氮在土壤碳库、氮库中所占比例较小,但至关重要[41],并且在标记土壤过程或土壤健康变化时要比单独使用微生物生物量或土壤养分的值更有效[42- 43]。首先,土壤微生物生物量碳氮比可以反映土壤微生物种类和区系[44],一般情况下,细菌碳氮比在5∶1 左右,放线菌在6∶1 左右,真菌在10∶1 左右[45- 46]。三峡库区消落带165—175 m高程植被恢复初期土壤微生物群落可能以真菌为主。本研究发现裸地的微生物生物量碳氮比高于其他植被类型,这可能归因于裸地生物量周转慢,氮素含量少,与杨予静等[38]的研究结果一致。其次,本研究中各植被类型土壤微生物生物量对土壤碳、氮库的贡献率与前人对碳、氮库的研究结果1.0%—5.3%、2.0%—7.8%相符[26,47]。本研究中林地的SOC最低,主要由于种植林木后消落带土壤亲水性及通透性增强,江水浸泡后易发生软化,江水、雨水的淘蚀冲击作用加大,极易导致土壤有机质的流出[37],进而降低土壤中SOC的含量,SMBC/SOC的比值变大。就SMBN/TN比值而言,农耕地由于人为施肥的干扰TN含量升高,裸地由于缺乏植被SMBN最低,进而直接导致后两处理组的SMBN/TN变小。总体上,因为植被类型的不同,输入有机物质的数量和质量不同,造成微生物种类和数量差异,导致恢复过程中土壤生物学质量差异[48]。
本研究中各植被类型土壤微生物生物量碳、氮与土壤有机碳和全氮之间具有显著正相关性,与已有研究结果一致[49]。进一步表明在消落带土壤微生物生物量碳、氮也可以作为土壤肥力的判断指标,为探究植被土壤肥力恢复效果提供依据。土壤微生物生物量碳与氮含量呈极显著正相关,这是由于土壤微生物生物量的大小决定土壤微生物对氮素的固持作用,土壤氮的输出主要是土壤中有机质的分解[50]。研究还发现,各植被类型土壤微生物生物量碳、氮均与土壤含水率呈极显著正相关,与pH值呈显著正相关,表明土壤微生物生物量除了受到有机物质的影响还与无机环境紧密相关,在消落带165—175 m高程中,合适的水分条件有利于微生物生物量的积累,然而pH值升高有助于微生物繁殖与以往研究结果有所不同[51],消落带土壤在水淹后pH值有从弱酸向中性发展的趋势,表明该区域土壤微生物可能更适应趋于中性的土壤环境,为深入阐明这一现象发生的机理,还需要对微生物种类进行具体的研究。
就研究工作而言,前期课题组进行了适生物种的筛选以及大面积的植被构建,经过5年原位生长,植被仍良好生长。针对构建植被对消落带环境的适应与响应,本课题组相继开展了一系列实验研究。在前期研究基础上,本研究重点探究消落带特殊生境下不同人工重建植被类型对土壤微生物生物量碳氮含量的影响(自然环境下消落带内不存在林地),以期为定量评价消落带植被恢复后土壤质量和肥力的变化提供依据。然而,本研究仅涉及到单一时间内取样测试,缺乏多时段的连续监测评价,因此开展长期的连续动态跟踪研究十分重要,这也是课题组目前正在进行的工作。
4 结论
在三峡库区消落带165—175 m高程,植被类型对土壤微生物生物量有显著影响,其中草地土壤微生物生物量最高,人工林地和农耕地次之,裸地最低。表明在消落带进行人工植被恢复能显著提高土壤微生物生物量,对土壤微生物资源具有重要意义。不同植被类型对土壤碳、氮库贡献差异显著;土壤微生物生物量碳、氮与土壤有机碳、全氮和pH值呈现显著正相关性,在适宜的水分条件下与土壤含水量呈现极显著正相关性,说明植被类型对土壤碳库和氮库的贡献有显著影响,并且消落带重建植被的土壤的这些理化性质对土壤微生物生物量也有强烈的影响。因此,在三峡库区消落带进行植被恢复重建能显著提高土壤微生物生物量及土壤质量,对加强三峡库岸生态系统的稳定性具有重要意义。
[1] 马朋, 李昌晓, 雷明, 杨予静, 马骏. 三峡库区岸坡消落带草地、弃耕地和耕地土壤微生物及酶活性特征. 生态学报, 2014, 34(4): 1010- 1020.
[2] Chen F Q, Xie Z Q. Reproductive allocation, seed dispersal and germination ofMyricarialaxiflora, an endangered species in the Three Gorges Reservoir area. Plant Ecology, 2007, 191(1): 67- 75.
[3] 王朝英, 李昌晓, 张晔. 水淹-干旱胁迫对南川柳苗木生长及生理特性的影响. 林业科学, 2013, 49(12): 164- 170.
[4] 董杰, 罗丽丽, 杨达源, 陈可锋. 三峡库区紫色土坡地土壤退化特征: 土壤养分贫瘠化. 地理与地理信息科学, 2007, 23(6): 58- 64.
[5] 王建超, 朱波, 汪涛. 三峡库区典型消落带淹水后草本植被的自然恢复特征. 长江流域资源与环境, 2011, 20(5): 603- 610.
[6] 吕明权, 吴胜军, 陈春娣, 姜毅, 温兆飞, 陈吉龙, 王雨, 王小晓, 黄平. 三峡消落带生态系统研究文献计量分析. 生态学报, 2015, 35(11): 3504- 3518.
[7] 樊大勇, 熊高明, 张爱英, 刘曦, 谢宗强, 李兆佳. 三峡库区水位调度对消落带生态修复中物种筛选实践的影响. 植物生态学报, 2015, 39(4): 416- 432.
[8] 李昌晓, 钟章成, 陶建平. 不同水分条件下池杉幼苗根系的苹果酸、莽草酸含量及生物量. 林业科学, 2008, 44(10): 1- 7.
[9] 罗芳丽, 曾波, 叶小齐, 陈婷, 刘巅. 水淹对三峡库区两种岸生植物秋华柳(SalixvariegataFranch.)和野古草(ArundinellaanomalaSteud.)水下光合的影响. 生态学报, 2008, 28(5): 1964- 1964, 1970- 1970.
[10] 钟荣华, 鲍玉海, 贺秀斌, 高进长, 阎丹丹, 李峪, 王铭锋. 三峡水库消落带4种草本根系抗拉特性及根系粘聚力. 水土保持学报, 2015, 29(4): 188- 194.
[11] 卢志军, 李连发, 黄汉东, 陶敏, 张全发, 江明喜. 三峡水库蓄水对消涨带植被的初步影响. 武汉植物学研究, 2010, 28(3): 303- 314.
[12] Reyes-Reyes B G, Alcántara-Hernández R, Rodríguez V, Olalde-Portugal V, Dendooven L. Microbial biomass in a semi arid soil of the central highlands of Mexico cultivated with maize or under natural vegetation. European Journal of Soil Biology, 2007, 43(3): 180- 188.
[13] 徐阳春, 沈其荣, 冉炜. 长期免耕与施用有机肥对土壤微生物生物量碳、氮、磷的影响. 土壤学报, 2002, 39(1): 83- 96.
[14] 柴雪思, 雷利国, 江长胜, 黄哲, 范志伟, 郝庆菊. 三峡库区典型消落带土壤微生物生物量碳、氮的变化特征及其影响因素探讨. 环境科学, 2016, 37(8): 2979- 2988.
[15] Makarov M I, Malysheva T I, Maslov M N, Kuznetsova E Y, Menyailo O V. Determination of carbon and nitrogen in microbial biomass of southern-Taiga soils by different methods. Eurasian Soil Science, 2016, 49(6): 685- 695.
[16] Paul E A. Dynamics of organic matter in soils. Plant and Soil, 1984, 76(1/3): 275- 285.
[17] Nair A, Ngouajio M. Soil microbial biomass, functional microbial diversity, and nematode community structure as affected by cover crops and compost in an organic vegetable production system. Applied Soil Ecology, 2012, 58: 45- 55.
[18] 刘守龙, 苏以荣, 黄道友, 肖和艾, 吴金水. 微生物商对亚热带地区土地利用及施肥制度的响应. 中国农业科学, 2006, 39(7): 1411- 1418.
[19] 毛艳玲, 杨玉盛, 崔纪超. 土地利用变化对土壤团聚体微生物量碳的影响. 水土保持学报, 2009, 23(4): 227- 231.
[20] Sparling G P. Ratio of microbial biomass carbon to soil organic matter carbon as a sensitive indicator of changes in soil organic matter. Australian Journal of Soil Research, 1992, 30(2): 195- 207.
[21] 吴庆标, 王效科, 任玉芬. CO2红外分析仪在土壤有机碳矿化中的测试与应用研究. 土壤, 2006, 38(3): 304- 308.
[22] 马效国, 樊丽琴, 陆妮, 沈禹颖. 不同土地利用方式对苜蓿茬地土壤微生物生物量碳、氮的影响. 草业科学, 2005, 22(10): 13- 17.
[23] 张成霞, 南志标. 土壤微生物生物量的研究进展. 草业科学, 2010, 27(6): 50- 57.
[24] 赵健, 梁敏. 紫色土水土流失特点及调控范式. 中国水利, 2010, (2): 41- 41.
[25] Brookes P C, Landman A, Pruden G, Jenkinson D S. Chloroform fumigation and the release of soil nitrogen: A rapid direct extraction method to measure microbial biomass nitrogen in soil. Soil Biology and Biochemistry, 1985, 17(6): 837- 842.
[26] Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C. Soil Biology and Biochemistry, 1987, 19(6): 703- 707.
[27] Frohne T, Rinklebe J. Biogeochemical fractions of Mercury in soil profiles of two different floodplain ecosystems in Germany. Water, Air, & Soil Pollution, 2013, 224(6): 1591.
[28] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000: 228- 233.
[29] Wu J, Joergensen R G, Pommerening B, Chaussod R, Brookes P C. Measurement of soil microbial biomass C by fumigation-extraction—an automated procedure. Soil Biology and Biochemistry, 1990, 22(8): 1167- 1169.
[30] Kandeler E, Tscherko D, Spiegel H. Long-term monitoring of microbial biomass, N mineralisation and enzyme activities of a Chernozem under different tillage management. Biology and Fertility of Soils, 1999, 28(4): 343- 351.
[31] 张海燕, 肖延华, 张旭东, 李军, 席联敏. 土壤微生物量作为土壤肥力指标的探讨. 土壤通报, 2006, 37(3): 422- 425.
[32] 何振立. 土壤微生物量及其在养分循环和环境质量评价中的意义. 土壤, 1997, (2): 61- 69.
[33] 赵先丽, 程海涛, 吕国红, 贾庆宇. 土壤微生物生物量研究进展. 气象与环境学报, 2006, 22(4): 68- 72.
[34] Acosta-Martínez V, Lascano R, Calderón F, Booker J D, Zobeck T M, Upchurch D R. Dryland cropping systems influence the microbial biomass and enzyme activities in a semiarid sandy soil. Biology and Fertility of Soils, 2011, 47(6): 655- 667.
[35] Pietri J C A, Brookes P C. Substrate inputs and pH as factors controlling microbial biomass, activity and community structure in an arable soil. Soil Biology & Biochemistry, 2009, 41(7): 1396- 1405.
[36] 刘丽, 段争虎, 汪思龙, 胡江春, 胡治刚, 张倩茹, 王书锦. 不同发育阶段杉木人工林对土壤微生物群落结构的影响. 生态学杂志, 2009, 28(12): 2417- 2423.
[37] 任庆水, 马朋, 李昌晓, 杨予静, 马骏. 三峡库区消落带落羽杉(Taxodiumdistichum)与柳树(Salixmatsudana)人工植被对土壤营养元素含量的影响. 生态学报, 2016, 36(20): 6431- 6444.
[38] 杨予静. 三峡库区消落带不同人工植被土壤化学性质动态变化[D]. 重庆: 西南大学, 2014: 106- 107.
[39] Liu B X, Shao M A. Modeling soil-water dynamics and soil-water carrying capacity for vegetation on the Loess Plateau, China. Agricultural Water Management, 2015, 159: 176- 184.
[40] 赵彤, 闫浩, 蒋跃利, 黄懿梅, 安韶山. 黄土丘陵区植被类型对土壤微生物量碳氮磷的影响. 生态学报, 2013, 33(18): 5615- 5622.
[41] 张洋, 倪九派, 周川, 樊芳玲, 谢德体. 三峡库区紫色土旱坡地桑树配置模式对土壤微生物生物量碳氮的影响. 中国生态农业学报, 2014, 22(7): 766- 773.
[42] Carter M R, White R P. Determination of variability in soil physical properties and microbial biomass under continuous direct-planted corn. Canadian Journal of Soil Science, 1986, 66(4): 747- 750.
[43] Filep T, Draskovits E, Szabó J, Koós S, László P, Szalai Z. The dissolved organic matter as a potential soil quality indicator in arable soils of Hungary. Environmental Monitoring and Assessment, 2015, 187(7): 479.
[44] 黄昌勇. 土壤学. 北京: 中国农业出版社, 2000: 50- 64.
[45] 王芳, 张金水, 高鹏程, 同延安. 不同有机物料培肥对渭北旱塬土壤微生物学特性及土壤肥力的影响. 植物营养与肥料学报, 2011, 17(3): 702- 709.
[46] Wardle D A. Controls of temporal variability of the soil microbial biomass: a global-scale synthesis. Soil Biology and Biochemistry, 1998, 30(13): 1627- 1637.
[47] Devi N B, Yadava P S. Seasonal dynamics in soil microbial biomass C, N and P in a mixed-oak forest ecosystem of Manipur, Northeast India. Applied Soil Ecology, 2006, 31(3): 220- 227.
[48] 姜培坤, 周国模. 侵蚀型红壤植被恢复后土壤微生物量碳、氮的演变. 水土保持学报, 2003, 17(1): 112- 114, 127- 127.
[49] 李新爱, 肖和艾, 吴金水, 苏以荣, 黄道友, 黄敏, 刘守龙, 彭洪翠. 喀斯特地区不同土地利用方式对土壤有机碳、全氮以及微生物生物量碳和氮的影响. 应用生态学报, 2006, 17(10): 1827- 1831.
[50] Jenkinson D S, Powlson D S. The effects of biocidal treatments on metabolism in soil-V: A method for measuring soil biomass. Soil Biology and Biochemistry, 1976, 8(3): 209- 213.
[51] Kemmitt S J, Wright D, Goulding K W T, Jones D L. pH regulation of carbon and nitrogen dynamics in two agricultural soils. Soil Biology and Biochemistry, 2006, 38(5): 898- 911.
CharacteristicsofsoilmicrobialbiomassCandNunderrevegetationinthehydro-fluctuationbeltoftheThreeGorgesReservoirRegion
YANG Wenhang, QING Hong, REN Qingshui, HE Yanyan, LI Xiaoxue, LI Changxiao*
KeyLaboratoryofEco-environmentintheThreeGorgesReservoirRegionoftheMinistryofEducation,ChongqingKeyLaboratoryofPlantEcologyandResourcesResearchintheThreeGorgesReservoirRegion,SchoolofLifeSciences,SouthwestUniversity,Chongqing400715,China
Operation of the Three Gorges Dam Reservoir on the Yangtze River, China, has formed a hydro-fluctuation belt with an annual water level change of near 30 m spanning and an area of 350 km2. Such a change in water level has led to a direct shift in plant community composition within the hydro-fluctuation belt. Different vegetation types alter the riparian soil environment to varying extents, via their influence on the biogeochemical cycles of materials such as soil microbial biomass carbon and nitrogen. Accordingly, by determining the relationship between soil physicochemical properties and soil microbial biomass under different vegetation types, we can provide useful information for vegetation restoration in the hydro-fluctuation belt of the Three Gorges Reservoir Region. To explore the changes in re-vegetated soil quality in the hydro-fluctuation belt of the Three Gorges Reservoir, we examined the contents of soil microbial biomass carbon (SMBC) and soil microbial biomass nitrogen (SMBN) in this region. Soils under four typical vegetation types (natural grassland, artificial timber forest, crop land, and unplanted soil) were investigated in the reservoir riparian region of Zhong County (107°32′—108°14′E, 30°03′—30°35′N), located in the center of Chongqing Municipality. The results showed that both SMBC and SMBN content was the highest in natural grassland and the lowest in unplanted soil. Under different types of vegetation, the ratio of SMBC/SMBN ranged from 8.02 to 10.25, the ratio of SMBC/soil organic carbon (SOC) was 2.40%—4.60%, and the ratio of SMBN/total nitrogen (TN) was 2.13%—3.58%. The SMBC/SOC and SMBN/TN ratios of forest soils were significantly higher than those of the unplanted soil (bothP< 0.05). Soil microbial biomass was significantly correlated with SOC, TN, and soil pH, and very significantly correlated with soil moisture. Our study showed that the physical and chemical properties of soil under revegetation had a significant impact on both SMBC and SMBN. Thus, revegetation facilitated an increase soil microbial biomass and enhanced soil quality in the hydro-fluctuation belt of the Three Gorges Reservoir Region.
vegetation restoration; soil microbial biomass carbon, nitrogen; Three Gorges Reservoir; hydro-fluctuation belt
重庆市林业重点科技攻关项目(渝林科研2016- 8;2015- 6);国家国际科技合作专项(2015DFA90900);中央财政林业科技推广示范项目(渝林科推[2014- 10]);重庆市研究生科研创新项目(CYS2015068);重庆市研究生科研创新项目(CYB16066)
2016- 10- 27; < class="emphasis_bold">网络出版日期
日期:2017- 08- 14
*通讯作者Corresponding author.E-mail: lichangx@swu.edu.cn
10.5846/stxb201610272191
杨文航,秦红,任庆水,贺燕燕,李晓雪,李昌晓.三峡库区消落带重建植被下土壤微生物生物量碳氮含量特征.生态学报,2017,37(23):7947- 7955.
Yang W H, Qing H, Ren Q S, He Y Y, Li X X, Li C X.Characteristics of soil microbial biomass C and N under revegetation in the hydro-fluctuation belt of the Three Gorges Reservoir Region.Acta Ecologica Sinica,2017,37(23):7947- 7955.
