铁皮石斛多糖提取工艺优化及对果蝇抗氧化能力的影响
2018-01-04邱现创王景雪
邱现创,赵 宁,李 晨,王景雪*
(山西大学生命科学学院,山西 太原 030006)
铁皮石斛多糖提取工艺优化及对果蝇抗氧化能力的影响
邱现创,赵 宁,李 晨,王景雪*
(山西大学生命科学学院,山西 太原 030006)
在低超声波功率250 W条件下,利用响应面法优化铁皮石斛多糖提取工艺。根据Box-Behnken设计原理对提取温度、液料比、超声波处理时间进行中心组合试验,结果表明最佳提取条件为提取温度41.74 ℃、液料比50.26∶1(mL/g)、超声波处理时间28.65 min,此条件下铁皮石斛多糖得率为25.39%。比文献报道传统热水浸提最佳条件下多糖得率提高了18%,提取时间为传统热水浸提的1/4,且超声波辅助法并没有造成多糖清除1,1-二苯基-2-三硝基苯肼自由基能力、清除羟自由基能力的降低。利用不同剂量铁皮石斛多糖喂食果蝇,结果表明中剂量组为最佳剂量组,雄果蝇超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活力提高了30%,丙二醛(malondialdehyde,MDA)含量降低了46%;雌果蝇CAT活力提高了60%,SOD活力提高了6%,MDA含量降低了20%,雌、雄果蝇的平均最高寿命提高了20%。
铁皮石斛;多糖;超声波;响应面优化;抗氧化;果蝇
铁皮石斛(Dendrobium officinale)是一种兰科植物,主要分布于我国的浙江、云南、广西、安徽等地,因其对生长环境要求苛刻,在自然条件下产量较小,但其具有较高的药用价值,因而具有“药中黄金”、“救命仙草”的美誉。《中华人民共和国药典》中记载铁皮石斛具有益胃生津、滋阴清热的功能[1]。
铁皮石斛多糖是铁皮石斛中的主要成分。多糖具有抗衰老[2]、保肝[3]、降血糖[4]、清肺[5]、抗疲劳[6]等作用。传统的热水浸提多糖存在得率低、周期长、耗能高等缺点[7]。虽然运用超声波、微波、酶辅助方法等提取多糖[8-10]使多糖得率得到了提高,但是有研究报道当超声波功率在300~500 W时多糖结构就会受到一定程度的破坏[11-14],不利于保持多糖的天然活性。本实验采用了低功率超声波辅助、低温提取铁皮石斛多糖,有效地保护多糖的天然活性,通过对提取工艺的优化,缩短提取周期,提高了多糖得率。
自由基是生命活动中生化反应中的中间代谢产物,正常情况下具有调节信号传递[15]、细胞生长、提高机体免疫[16]的作用,生物体的衰老、环境的污染、长期电离辐射[17]等会造成自由基动态异常,导致生物体内的大分子物质受到损伤,诱发各种疾病、加速机体衰老[18-19]。多糖具有抗氧化的功效,能够提高抗氧化酶的活力[20],有效清除生物体内的自由基[21],具有较好的保健作用。本实验对石斛多糖进行了体外和体内抗氧化性研究,旨在为铁皮石斛的进一步开发利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
葡萄糖、浓硫酸(分析纯) 天津市风船化学试剂科技有限公司;苯酚(分析纯) 天津市凯通化学试剂有限公司;氯化钠(分析纯) 天津市天力化学试剂有限公司;95%双脱醛乙醇(食品级) 苏州金醇化工有限公司;玉米粉、酵母粉 安琪酵母股份有限公司;解剖盘、总超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、微量蛋白试剂盒南京建成生物工程研究所;铁皮石斛(产地云南);黑腹果蝇由本实验室饲养。
1.2 仪器与设备
ML-800高速多功能粉碎机 永康市天祺盛世工贸有限公司;ESJ50-5B电子天平 上海奔普仪器科技有限公司;RE-52A型旋转蒸发器 上海亚荣生化仪器厂;HC-2066离心机 安徽中科中佳科学仪器有限公司;TU1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;KQ2200E型超声波清洗机 昆山市超声有限公司;SHB-III循环水式真空泵 郑州长城科工贸有限公司;SpectraMax M5多功能酶标仪、GZX-9076MBE型电热恒温鼓风干燥箱 上海博迅实业有限公司医疗设备厂;DK-8D电热恒温水槽 上海精宏实验设备有限公司;UV-2550紫外分光光度计 日本Shimadzu公司。
1.3 方法
1.3.1 铁皮石斛多糖的提取工艺流程
铁皮石斛鲜条→烘干粉碎→按照预设液料比加入去离子水→按照预设的温度和时间超声波处理2 次→离心取上清液(4 000 r/min离心15 min)→加入4 倍体积95%乙醇溶液4 ℃沉淀12 h→离心(4 000 r/min离心20 min)弃上清液→80%乙醇溶液洗涤沉淀2 次→溶解沉淀定容→多糖脱色素→多糖脱蛋白→测定多糖含量→测定多糖的抗氧化性
1.3.2 标准曲线的绘制
采用硫酸-苯酚法测定多糖的含量[1],将葡萄糖标准品烘至质量恒定,配制成0.9 mg/mL溶液,稀释10 倍获得90 μg/mL葡萄糖溶液。准确量取葡萄糖标准液0.2、0.4、0.6、0.8、1.0 mL,分别置于10 mL具塞试管中,各补水至1.0 mL,加入5%苯酚溶液(现配现用),摇匀,再加入5 mL浓硫酸,摇匀,90 ℃水浴加热20 min,取出,冰浴冷却5 min,在488 nm波长处测定溶液吸光度,以多糖浓度为纵坐标,溶液吸光度为横坐标,绘制葡萄糖溶液标准曲线。曲线方程为Y=96.915X-5.079 2,相关系数R2=0.999。空白对照组用蒸馏水进行上述操作处理。
1.3.3 铁皮石斛多糖含量的测定
准确称取铁皮石斛粉末0.3 g,按照不同液料比加入蒸馏水,250 W超声波辅助提取2次,将2 次提取液合并定容至100 mL容量瓶中,摇匀,准确量取2 mL提取液于10 mL离心管中,精密加入95%乙醇溶液8 mL,摇匀,4 ℃冷藏12 h,取出,4 000 r/min离心20 min,弃上清液留沉淀,沉淀用80%乙醇溶液洗涤2 次,加入20 mL去离子水溶解沉淀,然后将溶液定容至50 mL容量瓶中,摇匀。精密量取1 mL上述多糖溶液,置15 mL具塞试管中按照1.3.2节中方法测定吸光度,铁皮石斛多糖得率[22]的计算见公式(1)。

1.3.4 铁皮石斛多糖提取的单因素试验
准确称取0.3 g铁皮石斛粉末至20 mL试管中,以去离子水为提取剂,在低功率超声波250 W、液料比40∶1(mL/g)、超声波处理时间30 min 条件下,分别在30、40、50、60、70 ℃提取多糖,考察提取温度对多糖得率的影响;在提取温度40 ℃、超声波处理时间30 min的条件下,分别在液料比20∶1、30∶1、40∶1、50∶1、60∶1(mL/g)的条件下考察液料比对铁皮石斛多糖得率的影响;在提取温度40 ℃、液料比40∶1(mL/g)的条件下,分别用超声波处理10、20、30、40、50 min,考察超声波处理时间对铁皮石斛多糖得率的影响。
1.3.5 响应面优化铁皮石斛多糖提取工艺
在单因素试验的基础上,选择提取温度、液料比、超声波处理时间3 个因素[23],利用Design-Expert 8.0.6软件设计三因素三水平响应面试验,响应面因素与水平设计见表1。

表1 响应面试验设计因素与水平Table 1 Factors and levels used in response surface analysis
1.3.6 铁皮石斛多糖的纯化
1.3.6.1 铁皮石斛多糖溶液蛋白质的去除
利用Sevag法脱蛋白[24]。向铁皮石斛多糖溶液中加入Sevag试剂(氯仿和正丁醇的体积比为4∶1),多糖溶液和Sevag试剂的体积比为5∶1,磁力搅拌器搅拌40 min,4 000 r/min离心20 min除去蛋白层,重复上述操作,直到蛋白质除尽为止。
1.3.6.2 铁皮石斛多糖溶液脱色素
按照0.2 g/100 mL的量加入活性炭,60 ℃脱色1.5 h,除去铁皮石斛多糖溶液的色素得到纯化的多糖[25]。1.3.7 抗氧化活性的测定
1.3.7.1 羟自由基清除能力
用Fenton反应体系产生•OH,用水杨酸显色法测定多糖清除羟自由基能力[26]。精密量取1.0 mL不同浓度的铁皮石斛多糖待测夜,依次加入1.0 mL 2 mmol/L FeSO4溶液,1.0 mL 2 mmol/L H2O2溶液,混匀,室温反应10 min,然后加入1.0 mL 2 mmol/L水杨酸溶液,混匀,37 ℃恒温反应30 min。空白组用蒸馏水代替铁皮石斛多糖溶液,对照组用蒸馏水代替水杨酸溶液,510 nm波长处测定吸光度(A)。羟自由基清除率计算见公式(2)。
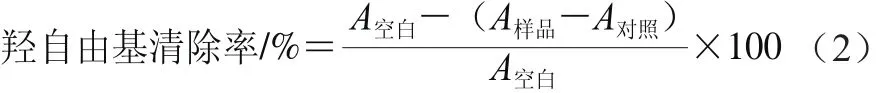
1.3.7.2 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力
精密量取0.8 mL不同浓度的铁皮石斛多糖待测液,加入0.8 mL 0.2 mmol/L DPPH溶液,混匀,避光反应30 min,在517 nm波长处测定吸光度。空白组用蒸馏水代替铁皮石斛多糖溶液,对照组用无水乙醇代替DPPH溶液[27]。DPPH自由基清除率计算见公式(3)。

1.3.8 果蝇培养基的配制
基础培养基的配制参照赵龙[28]优化的配方。称取玉米粉20 g、琼脂2 g、白砂糖15 g、酵母粉2 g,将玉米粉用120 mL蒸馏水加热溶解,用少量蒸馏水溶解琼脂和白砂糖并加热煮沸使琼脂充分溶解,将溶解的白砂糖和琼脂倒入溶解的玉米粉中并补水至200 mL加热煮沸,待温度降至50 ℃左右时加入酵母和2 mL丙酸。将配制好的培养基分装至果蝇管中,每管5 mL。分别按照每100 mL基础培养基中加入1、0.5、0.25 g铁皮石斛多糖的剂量设置高、中、低剂量组。
1.3.9 果蝇寿命实验
取48 h内羽化未交配的果蝇,用乙醚麻醉,收集个体大小相近的雌、雄果蝇各360 只,随机分为空白对照组、铁皮石斛多糖高剂量组、中剂量组、低剂量组4 组,每组雌、雄各90 只,每组雌、雄各3 支果蝇管,每支果蝇管30 只。在温度25 ℃、相对湿度30%~50%的环境中进行培养,每4 d换一次培养基,每天记录每只果蝇管的死亡个数(因换培养基以及其他因素造成非正常死亡的不计),直到每组果蝇全部死亡为止[29]。计算每组果蝇的最高寿命(每组最后一只死亡果蝇的寿命)、平均最高寿命(每组最后死亡3 只果蝇寿命的平均值)、半死亡时间。
1.3.10 果蝇SOD、CAT活性及MDA含量的测定
取48 h内羽化未交配的果蝇,根据雌、雄果蝇的外部特征将雌、雄果蝇分开,收集个体大小相近的雌、雄果蝇各360 只,随机分为空白对照组、铁皮石斛多糖高剂量组、中剂量组、低剂量组4 组,每组雌、雄各90 只,每组雌雄各3 支果蝇管,每支果蝇管30 只。在温度25 ℃、相对湿度30%~50%的环境中进行培养,每4 d换一次培养基,喂养30 d。将果蝇导入含有湿润滤纸条的果蝇管中,饥饿2 h后,用乙醚将果蝇麻醉,称质量并计数,按照料液比1∶49(mg/μL)加入0.9%无菌生理盐水,在冰浴条件下研磨,4 ℃、3 000 r/min离心15 min[25],取上清液按照试剂盒操作说明分别测定SOD、CAT活性及MDA含量。
1.3.11 果蝇逆重力爬行能力的测定
刚开始人类就在火堆上直接烧烤食物。后来,人类学会用石头或泥巴做成盆子状来盛放食物,并放到火上烧烤食物,发现火烧后的石头盆子或泥盆子变得坚硬耐用,又开始放水放食物在盆子里煮食物,发现煮过的食物比烧烤的食物吃起来更美味、更柔软,肚子也变得更舒服、更好消化,后来人类熟食方式就形成了烤和煮两种主要方式,人类身体比茹毛饮血时代更健康,寿命也更长了。这一时期被人类学家称之为“石器时代”。
将喂养30 d的果蝇用乙醚麻醉后,重新导入一个新的果蝇管中,待30 min全部苏醒后,轻拍果蝇管壁使果蝇全部落入底部,50 s后记录爬过标记线(距离底部6 cm)的个体数[30]。逆重力爬行能力的计算见公式(4)。

2 结果与分析
2.1 单因素试验结果
2.1.1 提取温度及液料比对铁皮石斛多糖得率的影响
由图1A可知,随着提取温度的升高铁皮石斛多糖得率先增高后降低,在70 ℃时最低,40 ℃时铁皮石斛多糖得率最大,铁皮石斛多糖得率最高为21.67%。随着温度继续升高时,多糖得率反而下降,表明石斛多糖中存在热敏性物质,在超声波辅助提取的条件下温度升高会使得这些成分易变性降解[10]。由图1B可知,随着液料比的增大,溶剂对超声波能量吸收增多导致铁皮石斛粉末对超声波能量吸收减小[31],导致细胞壁破碎不完全,多糖未能完全溶出,所以铁皮石斛多糖得率先增加后稳定,在液料比50∶1(mL/g)处多糖得率最大为23.42%。
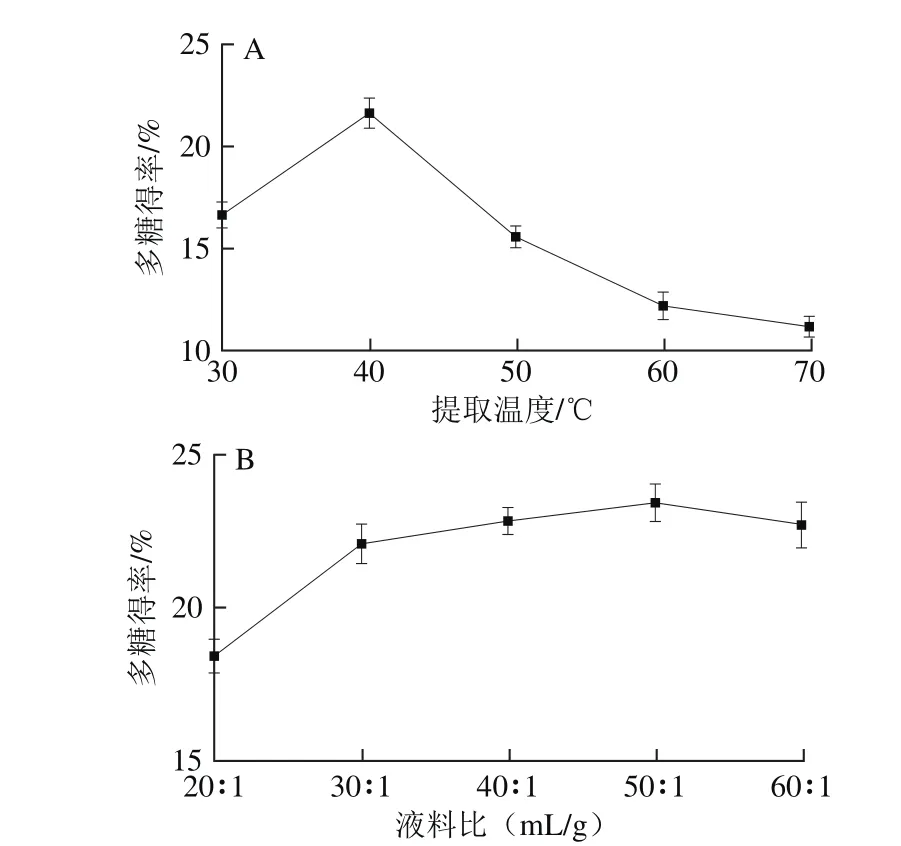
图1 提取温度(A)、液料比(B)对铁皮石斛多糖得率的影响Fig. 1 Effects of extraction temperature (A) and solvent-to-solid ratio (B)on the extraction yield of polysaccharide
2.1.2 超声波处理时间对铁皮石斛多糖得率及抗氧化功能的影响
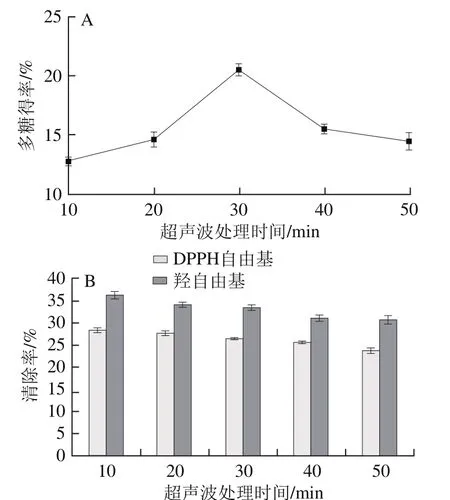
图2 超声波处理时间对铁皮石斛多糖得率(A)、抗氧化能力(B)的影响Fig. 2 Effects of ultrasonic treatment time on the extraction yield (A) and antioxidant activity of polysaccharide (B) from Dendrobium of fi cinale
由图2A可知,多糖得率随超声波处理时间延长先增大后逐渐减小。在30 min时最大,铁皮石斛多糖得率为20.48%。超声波处理前期随着细胞破碎程度的增大,细胞内的多糖溶出,多糖得率增加,但超声波对铁皮石斛多糖也具有剪切作用,时间过长会破坏多糖的结构,造成多糖得率降低[15],因此当超声波处理时间超过30 min后,多糖得率会降低。为验证超声波处理时间对多糖抗氧化能力的影响,确定选择超声波处理时间的合理性,实验研究了超声波处理时间对多糖抗氧化能力的影响,由图2B可知,铁皮石斛多糖清除羟自由基能力和清除DPPH自由基能力随着超声波处理时间的延长呈递减趋势,但衰减趋势缓慢,可能是超声波的空化作用和剪切作用破坏了多糖的结构,造成多糖的抗氧化性降低[31]。本实验选取超声波处理30 min,在保证铁皮石斛多糖得率最优的情况下,铁皮石斛多糖的抗氧化性能得到有效的保护,所以此处理时间符合实际生产的需要。
2.2 响应面试验结果
2.2.1 回归模型方差分析
在单因素试验结果的基础上,以提取温度、超声波处理时间、液料比3 个因素为自变量,以铁皮石斛多糖得率为响应值,运用Design-Expert 8.0.6软件进行三因素三水平的试验设计,共包括17 组试验方案,结果见表2。

表2 铁皮石斛多糖得率的响应面试验方案及结果Table 2 Experimental design and results for response surface analysis
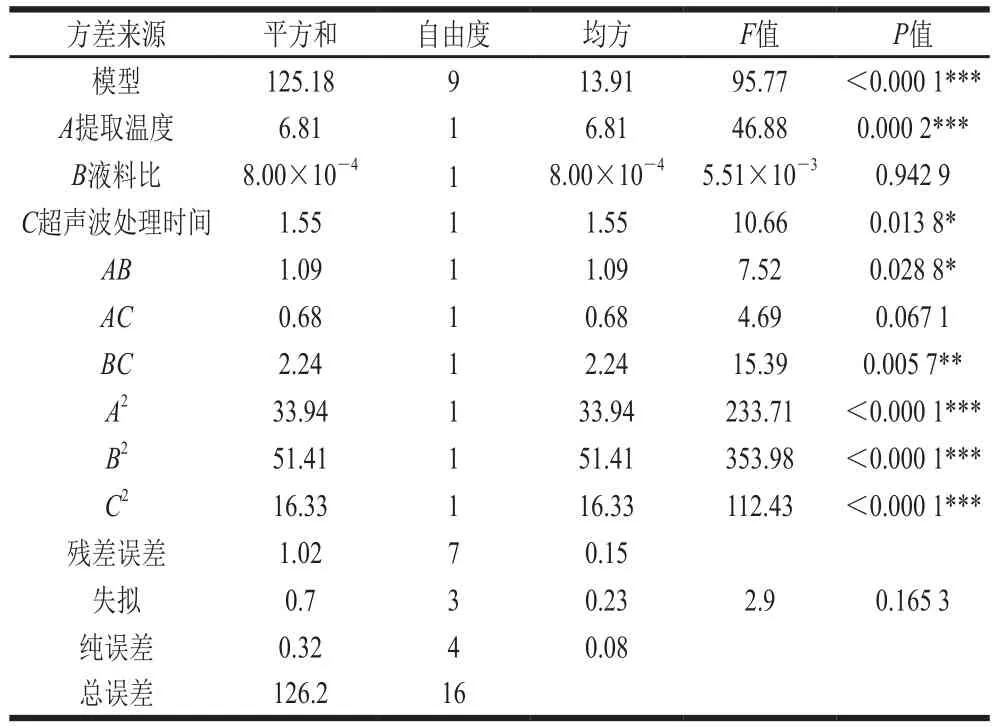
表3 回归模型的方差分析结果Table 3 Analysis of variance of regression model
由表3可知,本试验回归模型显著性极高(P<0.000 1),失拟项不显著(P=0.165 3),表明该模型可用于铁皮石斛多糖得率的分析。调整相关系数R2值为0.981 6,说明本试验模型与实际试验拟合度高,试验误差较小,能够准确地对铁皮石斛多糖得率进行分析和预测。从模型方程回归系数及其显著性可知,提取温度一次项、提取温度二次项、液料比二次项、超声波处理时间二次项对铁皮石斛多糖得率的影响极显著,超声波处理时间一次项对铁皮石斛多糖得率影响显著,超声波处理时间与液料比交互项对铁皮石斛多糖得率影响高度显著,提取温度与液料比交互项对铁皮石斛多糖得率影响显著[22]。通过方程回归系数及其显著性可知对铁皮石斛多糖影响因素主次顺序依次为提取温度>超声波处理时间>液料比。
2.2.2 因素交互作用分析
通过Design-Expert 8.0.6软件作出的响应面及等高线图可以很好地反映单个因素以及两个因素之间的相互协同作用对铁皮石斛多糖得率的影响,超声波处理时间与液料比相互作用对铁皮石斛多糖得率影响极显著,提取温度与液料比相互作用对铁皮石斛多糖得率影响显著。
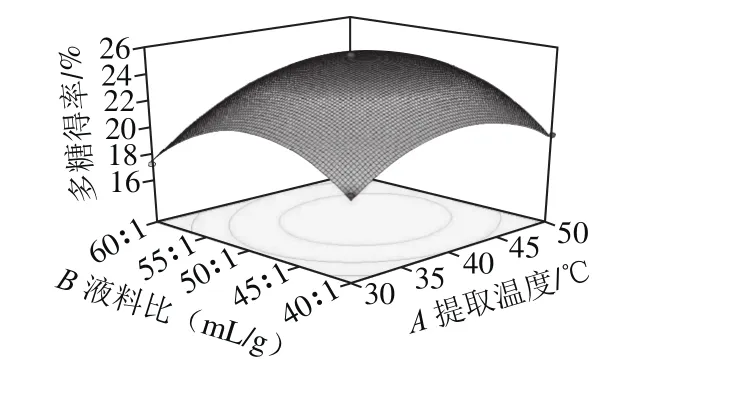

图3 各因素相互作用对铁皮石斛多糖得率的响应面与等高线图Fig. 3 Response surface and contour plots showing the interactive effects of factors on the extraction yield of polysaccharide
由图3可知,图3a的3D曲面图坡度大于图3b中3D曲面图坡度,图3a、b中3D曲面图坡度小于图3c中3D曲面图坡度,图3b中等高线图几乎为圆形,所以提取温度与液料比相互作用对铁皮石斛多糖提取率影响显著,提取温度和超声波处理时间两因素相互作用不明显,液料比与超声波处理时间相互作用对铁皮石斛多糖提取率影响极显著。
2.3 验证实验结果
对实验模型进行分析得出提取铁皮石斛多糖的最优工艺条件为提取温度41.74 ℃、液料比50.26∶1(mL/g)、超声波处理时间28.65 min,考虑到实际实验操作情况将最佳的实验条件调整为提取温度40 ℃、液料比50∶1(mL/g)、超声波处理时间30 min,实际测得多糖得率为(25.28±0.26)%,误差为1.02%,因此本实验得到的最优条件准确可靠,具有一定的参考价值。
2.4 传统热水浸提法和超声波辅助法提取铁皮石斛多糖得率与清除自由基的能力比较
按照梅威威等[33]优化传统热水浸提法最佳条件提取铁皮石斛多糖,并测定该条件下铁皮石斛多糖得率与清除自由基的能力,与本实验优化最佳提取条件下铁皮石斛多糖清除羟自由基的能力相比较,结果如图4所示。
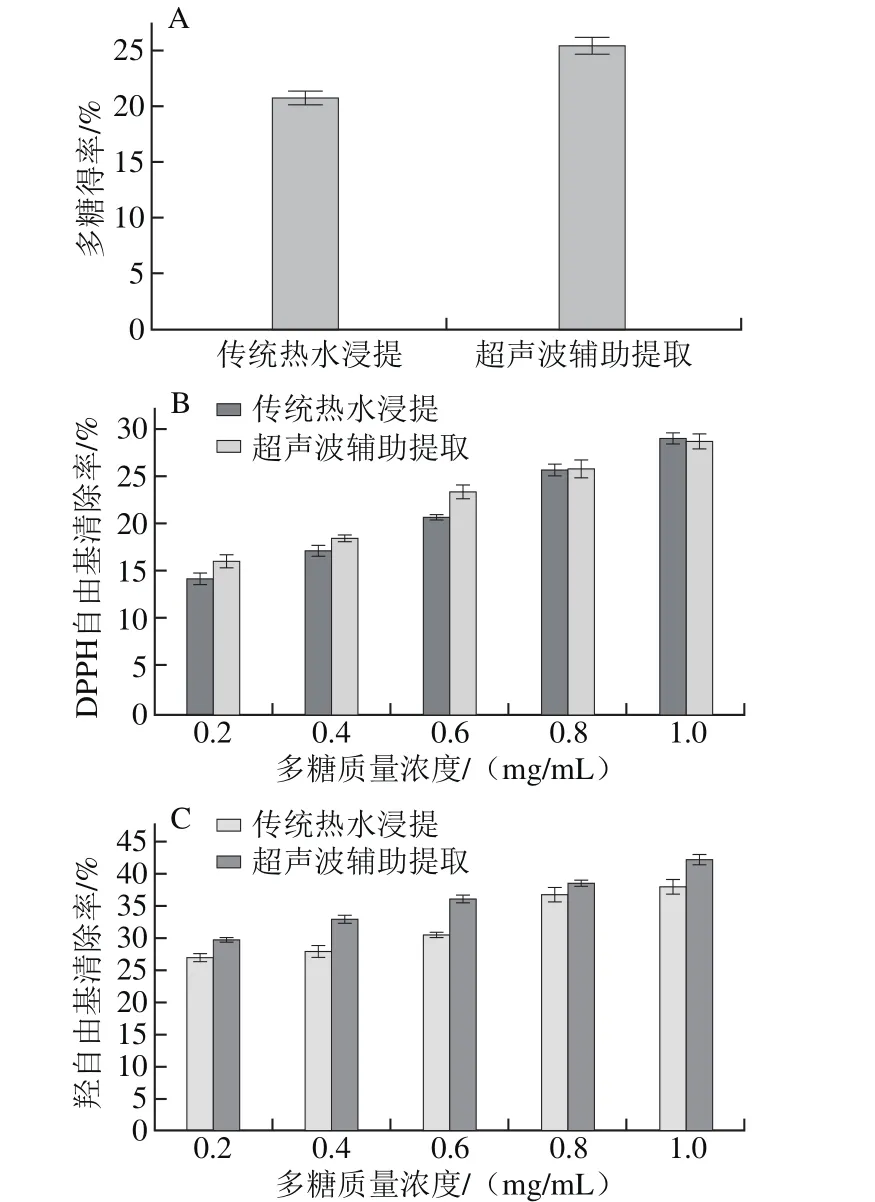
图4 不同提取方法提取的铁皮石斛多糖的得率(A)与清除DPPH自由基(B)、羟自由基(C)的能力Fig. 4 Yield (A) and hydroxyl (B), and DPPH radical(C) scavenging activities of polysaccharide from Dendrobium off i cinale by different extraction methods
由图4可知,本工艺条件下铁皮石斛多糖得率比传统的热水提取条件下铁皮石斛多糖得率提高了18%,清除羟自由基能力高于传统热水提法,清除DPPH自由基的能力略低于传统热水提法,说明低功率的超声波辅助提取铁皮石斛多糖基本没有影响铁皮石斛多糖抗氧化功能。
2.5 铁皮石斛多糖对果蝇抗氧化指标及寿命的影响
表4 铁皮石斛多糖对果蝇的抗氧化指标影响(x±s)Table 4 Effect of Dendrobium of fi cinale polysaccharide on endogenous oxidative stress indicators in Drosophila melanogaster (x s)
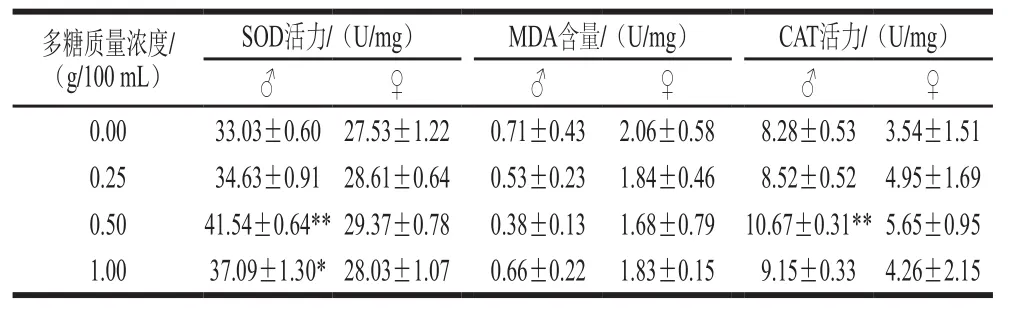
表4 铁皮石斛多糖对果蝇的抗氧化指标影响(x±s)Table 4 Effect of Dendrobium of fi cinale polysaccharide on endogenous oxidative stress indicators in Drosophila melanogaster (x s)
注:♂.雄性果蝇;♀.雌性果蝇。下同。
SOD活力/(U/mg) MDA含量/(U/mg) CAT活力/(U/mg)♂♀♂♀♂♀0.00 33.03±0.60 27.53±1.22 0.71±0.43 2.06±0.58 8.28±0.53 3.54±1.51 0.25 34.63±0.91 28.61±0.64 0.53±0.23 1.84±0.46 8.52±0.52 4.95±1.69 0.50 41.54±0.64**29.37±0.78 0.38±0.13 1.68±0.79 10.67±0.31**5.65±0.95 1.00 37.09±1.30*28.03±1.07 0.66±0.22 1.83±0.15 9.15±0.33 4.26±2.15多糖质量浓度/(g/100 mL)
表5 铁皮石斛多糖对果蝇寿命的影响(x±s)Table 5 Effects of Dendrobium of fi cinale polysaccharide on the lifespan of male Drosophila melanogaster (x s)
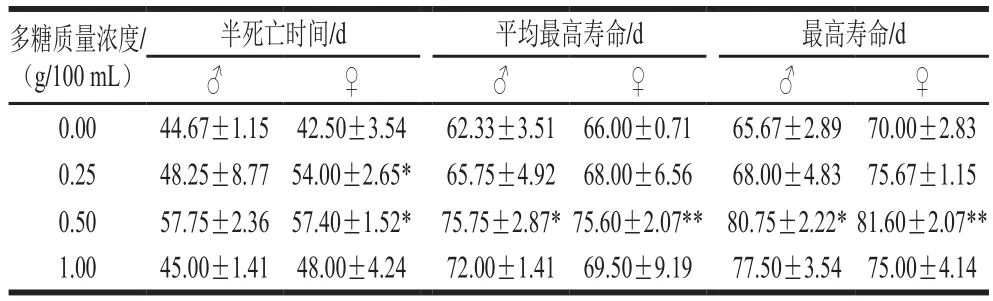
表5 铁皮石斛多糖对果蝇寿命的影响(x±s)Table 5 Effects of Dendrobium of fi cinale polysaccharide on the lifespan of male Drosophila melanogaster (x s)
多糖质量浓度/(g/100 mL)半死亡时间/d 平均最高寿命/d 最高寿命/d♂♀♂♀♂♀0.00 44.67±1.15 42.50±3.54 62.33±3.51 66.00±0.71 65.67±2.89 70.00±2.83 0.25 48.25±8.77 54.00±2.65* 65.75±4.92 68.00±6.56 68.00±4.83 75.67±1.15 0.50 57.75±2.36 57.40±1.52* 75.75±2.87*75.60±2.07** 80.75±2.22*81.60±2.07**1.00 45.00±1.41 48.00±4.24 72.00±1.41 69.50±9.19 77.50±3.54 75.00±4.14
由表4、5可知,喂食铁皮石斛多糖的果蝇的寿命、SOD、CAT活力及MDA含量要优于未喂食铁皮石斛多糖的对照组,其中中剂量组果蝇的寿命、SOD、CAT活力及MDA含量结果要优于低剂量组和高剂量组。
2.6 铁皮石斛多糖对果蝇体质量及逆重力爬行能力的影响
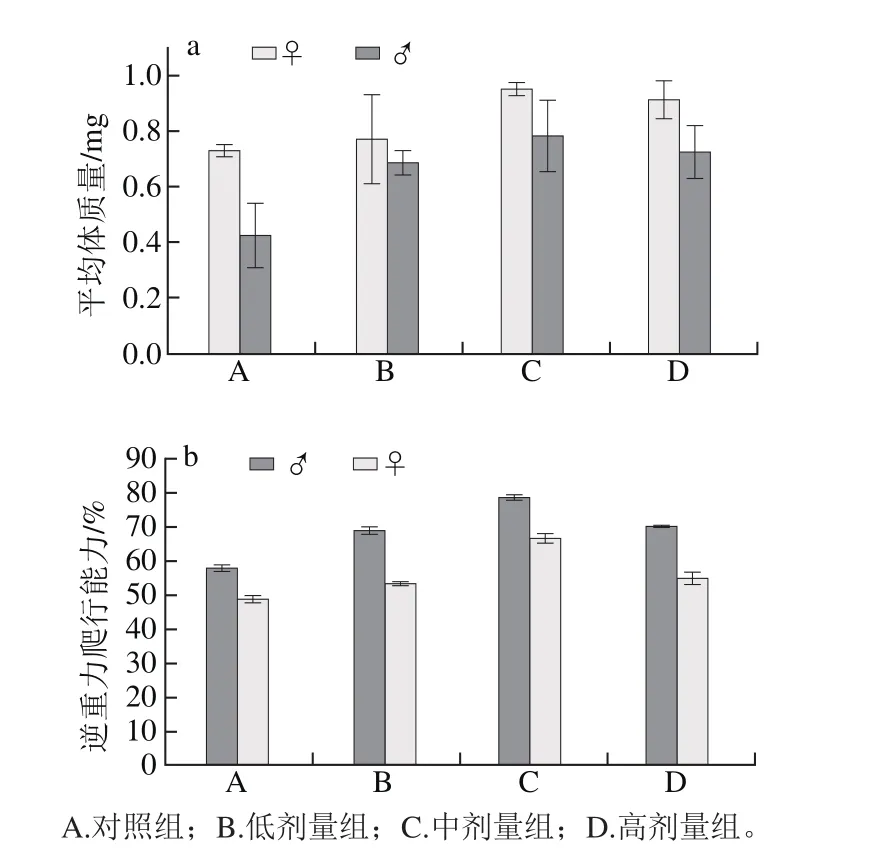
图5 铁皮石斛多糖对果蝇体质量(a)和逆重力爬行能力(b)的影响Fig. 5 Effects of Dendrobium off i cinale polysaccharide on body weight (a) and inverse gravity crawling ability (b) of Drosophila melanogaster
由图5可知,喂食铁皮石斛多糖的果蝇体质量、逆重力爬行能力大于未喂食铁皮石斛多糖果蝇的体质量、逆重力爬行能力,其中喂食中剂量铁皮石斛多糖组要优于低剂量组体质量和高剂量组体质量。
3 讨 论
与已报道的热水浸提法[33]和超声波辅助提取法[34]相比,本提取工艺具有超声波功率低、提取温度低、超声波处理时间短等优点,更好地保护了铁皮石斛多糖的抗氧化性,且本提取工艺对生产设备要求低、生产周期短,因此提取工艺对实际生产有一定的参考价值。
SOD、CAT广泛存在生物体细胞中,CAT能够降低生物体内过氧化氢的水平,从而减少自由基和过氧化脂质的形成,SOD能够把有害的超氧阴离子自由基转化为过氧化氢,进而在CAT的作用下转化为对生物体无危害作用的水。生物体内MDA含量反映出氧自由基对生物体脂质化的氧化程度[17],MDA含量与脂质化的氧化程度呈反比。
通过果蝇喂食铁皮石斛多糖实验,铁皮石斛多糖延长了果蝇平均最高寿命、最高寿命、半致死时间,且提高了果蝇的体内的SOD、CAT活力,降低了MDA含量,提高了果蝇的逆重力爬行能力。
铁皮石斛多糖通过调节相关基因提高SOD、CAT等酶的活力,清除果蝇体内的自由基进而延长寿命[35]及增强逆重力爬行能力[36]。实验结果表明中剂量组为最佳效果组,说明机体的抗氧化能力不是随着喂食铁皮石斛多糖剂量的增大而增强,这与生物体的耐受度有关。对于铁皮石斛多糖的其他功效及铁皮石斛其他有效成分的功效还有待进一步研究。
[1] 国家药典委员会. 中华人民共和国药典: 一部[M]. 北京: 中国医药科技出版社, 2015: 283.
[2] ZHA X, DENG Y, LI X, et al. The core structure of a Dendrobium huoshanense polysaccharide required for the inhibition of human lens epithelial cell apoptosis[J]. Carbohydrate Polymers, 2017, 155: 252-260. DOI:10.1016/j.carbpol.2016.08.087.
[3] WANG X Y, LUO J P, CHEN R, et al. Dendrobium huoshanense polysaccharide prevents ethanol-induced liver injury in mice by metabolomic analysis[J]. International Journal of Biological Macromolecules, 2015, 78: 354-362. DOI:10.1016/j.ijbiomac.2015.04.024.
[4] PAN L H, LIX F, WANG M N, et al. Comparison of hypoglycemic and antioxidative effects of polysaccharides from four different Dendrobium species[J]. International Journal of Biological Macromolecules, 2014, 64: 420-427. DOI:10.1016/j.ijbiomac.2013.12.024.
[5] SONG T, CHEN X, TANG S C W, et al. Dendrobium officinale polysaccharides ameliorated pulmonary function while inhibiting mucin-5AC and stimulating aquaporin-5 expression[J]. Journal of Functional Foods, 2016, 21: 359-371. DOI:10.1016/j.jff.2015.12.015.
[6] XIE S Z, HAO R, ZHA X Q, et al. Polysaccharide of Dendrobium huoshanense activates macrophages via toll-like receptor 4-mediated signaling pathways[J]. Carbohydrate Polymers, 2016, 146: 292-300.DOI:10.1016/j.carbpol.2016.03.059.
[7] LIU H M, WANG F Y, LIU Y L. Hot-compressed water extraction of polysaccharides from soy hulls[J]. Food Chemistry, 2016, 202: 104-109. DOI:10.1016/j.foodchem.2016.01.129.
[8] BHOTMANGE D, WALLENIUS J H, SINGHAL R S, et al.Enzymatic extraction and characterization of polysaccharide from Tuber aestivum[J]. Bioactive Carbohydrates and Dietary Fibre, 2017,10: 1-9. DOI:10.1016/j.foodchem.2016.01.129.
[9] XU Y, CAI F, YU Z, et al. Optimisation of pressurised water extraction of polysaccharides from blackcurrant and its antioxidant activity[J]. Food Chemistry, 2016, 194: 650-658. DOI:10.1016/j.foodchem.2015.08.061.
[10] AGUILÓ-AGUAYO I, WALTON J, VIŇAS I, et al. Ultrasound assisted extraction of polysaccharides from mushroom by-products[J].2017, 77: 92-99. DOI:10.1016/j.lwt.2016.11.043.
[11] YING Z, HAN X, LI J. Ultrasound-assisted extraction of polysaccharides from mulberry leaves[J]. Food Chemistry, 2011, 127:1273-1279. DOI:10.1016/j.foodchem.2011.01.083.
[12] ZHANG J, HOU X, DONG H, et al. Process optimization for the ultrasonic-assisted extraction of allium mongolicum regel seed polysaccharides using response surface methodology[J]. Food Science,2011, 32(2): 98-103. DOI:10.7506/spkx1002-6630-201102023.
[13] 李文谦, 矛燕勇. 响应面法超声波提取枸杞多糖工艺优化[J]. 中国酿造, 2011, 30(10): 122-125. DOI:10.3969/j.issn.0254-5071.2011.10.034.
[14] XIE L, WANG F, LI H, et al. Ultrasonic pretreatment followed by enzymatic hydrolysis for extraction of polysaccharides from fermented mycelia of phellinus linteus[J]. Food Science, 2010, 31(10): 81-85.DOI:10.7506/spkx1002-6630-201010016.
[15] KHAN M A, RAHMAN M, SARDAR N, et al. Comparative investigation of the free radical scavenging potential and anticancer property of Diospyros blancoi (Ebenaceae)[J]. Asian Pacif i c Journal of Tropical Biomedicine, 2016, 6(5): 410-417. DOI:10.1016/j.apjtb.2016.03.004.
[16] MASON R P. Imaging free radicals in organelles, cells, tissue, and in vivo with immuno-spin trapping[J]. Redox Biology, 2016, 8: 422-429.DOI:10.1016/j.redox.2016.04.003.
[17] 田金强, 朱克瑞, 李新明, 等. 阿魏菇多糖的抗氧化功能及其对果蝇寿命的影响[J]. 食品科学, 2006, 27(4): 223-226. DOI:10.3321/j.issn:1002-6630.2006.04.055.
[18] 余萍, 郑立群, 方一泓. 茶树菇多糖抗氧化性能的研究[J]. 食品研究与开发, 2009, 30(11): 36-40. DOI:10.3969/j.issn.1005-6521.2009.11.010.
[19] 阳志云, 刘峥. 天然药物中的抗氧化成分及评价方法的研究进展[J]. 华夏医学, 2005, 18(3): 492-494. DOI:10.3969/j.issn.1008-2409.2005.03.112.
[20] XIAO P C, YAN C, LI S B, et al. Free radical scavenging of Ganoderma lucidum polysaccharides and its effect on antioxidant enzymes and immunity activities in cervical carcinoma rats[J].Carbohydrate Polymers, 2009, 77(2): 389-393. DOI:10.1016/j.carbpol.2009.01.009.
[21] CHEN Y, XIONG W, ZENG L, et al. Bush sophora root polysaccharide and its sulfate can scavenge free radicals resulted from duck virus hepatitis[J]. International Journal of Biological Macromolec, 2014, 66: 186-193. DOI:10.1016/j.ijbiomac.2014.02.038.
[22] WANG J, ZHAO Y, LI W, et al. Optimization of polysaccharides extraction from Tricholoma mongolicum Imai and their antioxidant and antiproliferative activities[J]. Carbohydrate Polymer, 2015, 131:322-330. DOI:10.1016/j.carbpol.2015.06.009.
[23] 王燕华, 武福华, 郭昭涵, 等. 响应面试验优化丹参中多糖的超声波提取工艺及其抗氧化活性[J]. 食品科学, 2015, 36(18):7-12.DOI:10.7506/spkx1002-6630-201518002.
[24] 董英, 张艳芳, 孙艳辉. 水飞蓟粗多糖脱蛋白方法的比较[J]. 食品科学, 2007, 28(12): 82-84. DOI:10.3321/j.issn:1002-6630.2007.12.014.
[25] 董泽梁. 霍山铁皮石斛多糖的提取优化、分离纯化及结构特征的研究[D]. 合肥: 安徽农业大学, 2014: 11-12
[26] MAO G, ZOU Y, FENG W, et al. Extraction, preliminary characterization and antioxidant activity of se-enriched Maitake polysaccharide[J].Carbohydrate Polymers, 2014, 101: 213-219. DOI:10.1016/j.carbpol.2013.09.034.
[27] MA C, FENG M, ZHAI X, et al. Optimization for the extraction of polysaccharides from Ganoderma lucidum and their antioxidant and antiproliferative activities[J]. Journal of the Taiwan Institute of Chemical Engineers, 2013, 44(6): 886-894. DOI:10.1016/j.jtice.2013.01.032.
[28] 赵龙. 铁皮石斛原球茎功能活性研究[D]. 天津: 天津科技大学,2014: 15-18
[29] ZHAO T, ZHANG Q, QI H, et al. Extension of life span and improvement of vitality of Drosophila melanogaster by long-term supplementation with different molecular weight polysaccharides from Porphyra haitanensis[J]. Pharmacological Research, 2008, 57(1): 67-72. DOI:10.1016/j.phrs.2007.12.001
[30] SUN J, HOU J, YANG Y. Protective effect of selenium-enriched polysaccharides from cordyceps militaris against rotenone-induced oxidative damage in Drosophila melanogaster[J]. Food Science, 2013,34(7): 266-269. DOI:10.7506/spkx1002-6630-201307056.
[31] 赖颖, 赵锦慧, 陈茹. 响应面法优化超声波法提取红枣多糖工艺[J]. 生物加工过程, 2015, 13(5): 42-46. DOI:10.3969/j.issn.1672-3678.2015.05.008.
[32] CHEN T, WU Y, WU J, et al. Efficient extraction technology of antioxidant crude polysaccharides from Ganoderma lucidum(Lingzhi), ultrasonic-circulating extraction integrating with superf i nepulverization[J]. Journal of the Taiwan Institute of Chemical Engineers, 2014, 45(1): 57-62. DOI:10.1016/j.jtice.2013.05.010.
[33] 梅威威, 吴绍康. 铁皮石斛多糖提取工艺及脱蛋白方法研究[J].中华中医药学刊, 2014, 32(12): 2869-2871.
[34] 叶余原. 超声法提取铁皮石斛多糖工艺的研究[J]. 中药材, 2009,32(4): 617-620. DOI:10.3321/j.issn:1001-4454.2009.04.045.
[35] LABAT-ROBERT J, ROBERT L. Longevity and aging. role of free radicals and xanthine oxidase. a review[J]. Pathologie Biologie (Paris),2014, 62(2): 61-66. DOI:10.1016/j.patbio.2014.02.009.
[36] 赵江, 陈纯, 韩晓东, 等. 根皮苷对雌性果蝇寿命的影响及其作用机制[J]. 食品科学, 2015, 36(7): 167-171. DOI:10.7506/spkx1002-6630-201507031.
Optimization of Extraction of Polysaccharide from Dendrobium off i cinale and Its Antioxidant Effect on Drosophila melanogaster
QIU Xianchuang, ZHAO Ning, LI Chen, WANG Jingxue*
(School of Life Science, Shanxi University, Taiyuan 030006, China)
The ultrasonic-assisted extraction of polysaccharide from Dendrobium officinale at a 250 W low power was optimized by response surface methodology based on central combination design. Extraction temperature, solvent-to-solid ratio, and ultrasonic treatment time were considered as independent variables. The optimum extraction conditions were determined as follows: extraction temperature 41.74 ℃, solvent-to-solid ratio 50.26:1 (mL/g), and ultrasonic treatment time 28.65 min. Under these conditions, the maximum extraction yield of 25.39% was obtained, which was increased by 18%compared with the value obtained using conventional hot water extraction with a simultaneous reduction in extraction time of 75%. Moreover, the DPPH and hydroxyl radical scavenging activities of polysaccharide from D. off i cinale were not reduced during ultrasonic-assisted extraction. Drosophila melanogaster were fed with different doses of the extracted polysaccharide,and the results showed that the polysaccharide at moderate dose provided the best antioxidant activity as evidenced by a 30% increase in superoxide dismutase (SOD) and catalase (CAT) activity and a 46% decrease in malondialdehyde (MDA)content of male D. melanogaster, as well as an increase of 60% in CAT activity and 6% in SOD activ ity and a 20% decrease in MDA content of female D. melanogaster, extending the lifespan by an average of 20%.
Dendrobium off i cinale; polysaccharide; ultrasonic; response surface analysis; antioxidant activity; Drosophila melanogaster
10.7506/spkx1002-6630-201802043
TS201.1
A
1002-6630(2018)02-0273-08
邱现创, 赵宁, 李晨, 等. 铁皮石斛多糖提取工艺优化及对果蝇抗氧化能力的影响[J]. 食品科学, 2018, 39(2): 273-280.
DOI:10.7506/spkx1002-6630-201802043. http://www.spkx.net.cn
QIU Xianchuang, ZHAO Ning, LI Chen, et al. Optimization of extraction of polysaccharide from Dendrobium off i cinale and its antioxidant effect on Drosophila melanogaster[J]. Food Science, 2018, 39(2): 273-280. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201802043. http://www.spkx.net.cn
2017-03-24
邱现创(1990—),男,硕士研究生,研究方向为生物工程。E-mail:qiuxianchuang@163.com
*通信作者简介:王景雪(1961—),女,教授,博士,研究方向为生物工程。E-mail:jingxuew@sxu.edu.cn
