分蘖葱头蛋白提取工艺优化及其基础特性
2018-01-04刘婷婷宋云禹李桂杰张艳荣
刘婷婷,刘 阳,张 晶,宋云禹,李桂杰,张艳荣*
分蘖葱头蛋白提取工艺优化及其基础特性
刘婷婷,刘 阳,张 晶,宋云禹,李桂杰,张艳荣*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
采用碱溶酸沉正交法对分蘖葱头中蛋白质进行提取工艺优化,并对其基础特性进行测定,结果表明在料液比1∶15(g/mL)、pH 9.0、提取温度50 ℃、提取时间1.5 h条件下提取率最大为79.38%。电泳结果表明蛋白分子质量分别为61.94、27.10、17.62、13.34 kDa。高效液相色谱法测得分蘖葱头蛋白中必需氨基酸质量分数为38.96%,非必需氨基酸质量分数为61.04%。二级结构测定结果表明分蘖葱头蛋白中α-螺旋含量为52.60%,β-折叠含量为8.60%,β-转角含量为15.60%,无规则卷曲含量为22.40%。采用红外图谱法对分蘖葱头蛋白特征官能团进行测定,其特征官能团明显。
分蘖葱头;蛋白;正交试验;基础特性
分蘖葱头为百合科(Liliaceae)葱属(Allium)多年生草本植物[1]。1931年由日本引进吉林省,又名“鬼子葱”[2]。分蘖葱头是喜冷耐冻耐寒的高产作物[3],生育期短为58 d,亩产量在2 000~3 000 kg,其主产区集中在我国的东北、中北部[4],是吉林省和黑龙江省传统农作物,栽培面积日渐扩大[5-6]。新鲜的分蘖葱头中含有糖类、蛋白质及微量元素等基础成分[7],除此之外,分蘖葱头中还含有挥发性油成分[8],已有文献报道其具有抗菌、降血脂、抗癌、防治血栓病等多种生理功效[9-10]。
目前,分蘖葱头主要以鲜菜形式进行销售,工业化加工产品极少。国内外对分蘖葱头的研究主要集中在分蘖葱头栽培套作提高产量[11]、黄酮类抗氧化物质的提取优化及制备、分蘖葱头精油的制备等方面[12-13],目前在植物蛋白研究领域鲜见分蘖葱头蛋白的研究报道。由于植物蛋白食品因其资源丰富且不含胆固醇[14],已成为人们饮食中的主要蛋白质来源。寻找新的植物蛋白资源并进行开发利用,有利于满足人们对高品质蛋白质的需求,市场潜力巨大,前景广阔[15]。本实验采用碱溶酸沉法对分蘖葱头中蛋白质进行提取,正交试验法优化出最佳提取工艺条件,并对分蘖葱头蛋白基础特性进行深入的研究。为分蘖葱头蛋白的进一步开发应用研究提供了良好的理论基础。
1 材料与方法
1.1 材料与试剂
新鲜分蘖葱头 吉林省乌拉街镇农贸市场;溴化钾、丙烯酰胺、双丙烯酰胺、考马斯亮蓝、2-巯基乙醇、十二烷基磺酸钠、四甲基二乙胺(均为分析纯)北京化工厂;17 种氨基酸标准品、衍生剂、乙腈、甲醇、异丙醇、磷酸盐缓冲液(均为色谱纯) 美国Waters公司。
1.2 仪器与设备
DY-40型电动粉末压片机 天津科器高新技术公司;傅里叶交换红外检测器 日本岛津公司;HYP-1004型消化炉 上海纤检仪器有限公司;PHS-3D型pH计 上海精密科学仪器有限公司;CT15RT型台式高速冷冻离心机上海天美科学仪器有限公司;UV-2300型紫外-可见分光光度计 北京普析通用仪器有限公司;Alpha1-4LP Plus型冻干机 德国Christ公司;DYC2-24D型垂直电泳槽 北京君意东方电泳设备有限公司;超高效液相色谱系统 美国Waters公司。
1.3 方法
1.3.1 工艺流程及分蘖葱头蛋白提取率的计算
分蘖葱头→预处理→脱脂(用于生产分蘖葱头精油)→调节料液比→调 节pH值及温度→碱提→过滤(废渣)→滤液→酸沉→离心→冻干→分蘖葱头蛋白
分蘖葱头蛋白含量的测定参考GB5009.5—2010《食品中蛋白质的测定》中的分光光度法,提取率及蛋白纯度计算见公式(1)和(2)。

1.3.2 分蘖葱头蛋白提取单因素试验
本实验以分蘖葱头蛋白质的提取率为考察指标,分别对料液比、pH值、提取温度、提取时间4 个影响提取率的因素进行考察[16-17],设定料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25(g/mL),pH值分别为8.0、8.5、9.0、9.5、10.0,提取温度分别为20、30、40、50、60 ℃,提取时间分别为1.0、1.5、2.0、2.5、3.0 h,每组重复3 次平行实验,取其平均值[18-19]。固定的单因素条件为料液比1∶15(g/mL)、pH 9.0、提取温度30℃、提取时间2 h。
1.3.3 分蘖葱头蛋白提取的工艺优化
在单因素试验的基础上,设计正交试验的因素与水平如表1所示。

表1 正交试验因素与水平Table 1 Coded levels and corresponding actual levels of independent variables used for orthogonal array design
1.3.4 分蘖葱头蛋白基础特性的测定
1.3.4.1 等电点的测定
准确称取一定量的分蘖葱头蛋白冻干粉,用去离子水溶解调至pH 9.0,蛋白质充分溶解后,用0.1 mol/L的HCl溶液分别调节pH值为2.5、3.0、3.5、4.0、4.5、5.0静置30 min,使蛋白充分沉淀,3 800 r/min离心15 min,取上清液1 mL,加入4 mL双缩脲试剂,充分摇匀,静置30 min,于540 nm波长处测定吸光度,吸光度越低说明上清液中蛋白质含量越少,即为分蘖葱头蛋白质的等电点[20-21]。
1.3.4.2 紫外-可见分光光度计测定
称取一定质量的分蘖葱头蛋白样品,溶于去离子水中,稀释到适当的倍数配制成一定质量浓度的蛋白溶液,然后用紫外-可见分光光度计在270~700 nm波长范围内进行扫描测定[22-23]。
1.3.4.3 蛋白分子质量的测定
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)测定分蘖葱头蛋白的分子质量,选择10%分离胶、120 V电压、3%浓缩胶、80 V电压进行测定。样品上样量25 μL;以标准蛋白相对分子质量对数值为纵坐标,蛋白质相对迁移率为横坐标,绘制标准曲线,计算相对分子质量[24-25]。蛋白质相对迁移率的计算见公式(3)。

1.3.5 氨基酸组分分析
氨基酸含量测定:准确称取分蘖葱头蛋白冻干粉50 mg 110 ℃水解24 h,取1 mL水解液蒸干、洗涤、定容至10 mL备用。吸取定容后的液体样品10 μL,与70 μL硼酸盐缓冲溶液漩涡混合均匀,再加入20 μL衍生剂充分混合,放置1 min,封口,移入55 ℃烘箱中加热10 min。测定条件:BEHC18色谱柱,检测波长266 nm,柱温49 ℃,样品温度20 ℃,流速0.7 mL/min,梯度洗脱程序见表2[26-27]。
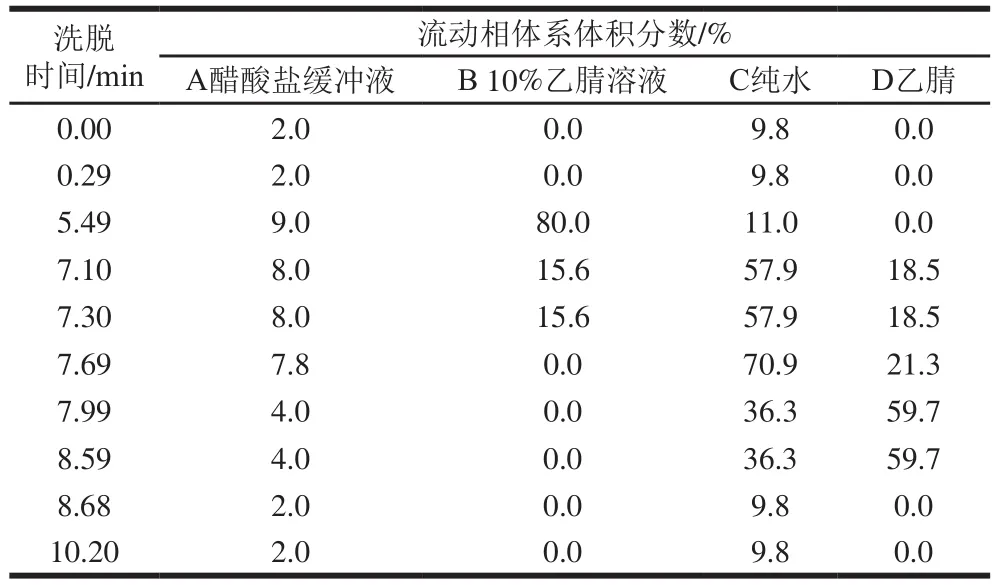
表2 梯度洗脱程序Table 2 Gradient elution program
1.3.6 二级结构的测定
配制8 mg/mL的分蘖葱头蛋白溶液,在远紫外光区190~250 nm波长范围内扫描,比色池为0.1 cm,光谱带宽为1 nm,分辨率为0.2 nm,响应时间为0.25 s,扫描速率为10 nm/min,圆二色光谱(circular dichroic spectroscopy,CD)分辨率为20 mdeg,室温条件下测定蛋白质二级结构并计算相对含量[28-29]。
1.3.7 特征性官能团的测定
采用傅里叶交换红外检测器,参照李晋等[30]方法并略有改动。将溴化钾烘干至质量恒定,准确称取分蘖葱头蛋白样品2 mg和200 mg溴化钾于研钵中研磨均匀,采用电动粉末压片机压片,于2 cm-1分辨率,4 000~400 nm-1范围条件下进行扫描测定。
2 结果与分析
2.1 分蘖葱头蛋白提取单因素试验结果
2.1.1 料液比对蛋白提取率的影响
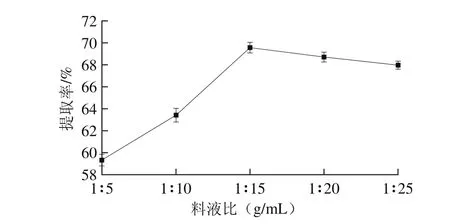
图1 料液比对蛋白提取率的影响Fig. 1 Effect of solid-to-solvent ratio on the extraction yield of protein
由图1可知,料液比对分蘖葱头蛋白质提取率影响较大,料液比在1∶5~1∶25(g/mL)范围内变化时,蛋白提取率随着提取液用量的增加,呈现先升高后降低的趋势,料液比在1∶15(g/mL)时,提取率最大。在蛋白质提取过程中,适当的增加提取液的用量有助于蛋白质的溶出,可提高分蘖葱头蛋白提取率。但继续增加提取液用量,蛋白质溶出达到饱和,提取率趋于稳定,过多的提取液会使酸沉过程中酸的用量大大增加,致使成本增加。因此选取料液比1∶15(g/mL)为最适宜条件。
2.1.2 pH值对蛋白提取率的影响
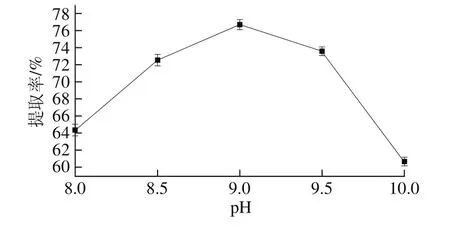
图2 pH值对蛋白提取率的影响Fig. 2 Effect of solvent pH on the extraction yield of protein
由图2可知,当提取液pH值在8.0~10.0范围内变化时,随着提取液pH值的不断增加,分蘖葱头蛋白提取率呈现先上升后下降的趋势,在pH 9.0时,蛋白提取率达到最大。pH值适当的增加有助于蛋白溶出,但pH值过大,会使蛋白质中的氢键断裂,也可以使蛋白质内部的可解离基团因受强烈的静电排斥作用造成分子伸展,蛋白质发生变性,从而导致蛋白提取率降低。另外,蛋白质暴露在强碱环境中会改变其营养特性并产生毒副产物[17]。因此选取pH 9.0为最适宜条件。
2.1.3 提取温度对蛋白提取率的影响

图3 提取温度对蛋白提取率的影响Fig. 3 Effect of temperature on the extraction yield of protein
由图3可知,当提取温度在20~40 ℃范围内变化时,随着温度的升高,蛋白提取率不断增加至最大,当提取温度在40~60 ℃范围内继续上升时,蛋白提取率呈现下降趋势。因为温度升高,分子的运动速度加快,提高了蛋白溶出率,继续升高温度,蛋白质的空间构象发生变化且在一定程度上发生变性沉淀,造成蛋白质溶出量减少,提取率下降[31]。因此选取提取温度40 ℃为最适宜条件。
2.1.4 提取时间对蛋白提取率的影响
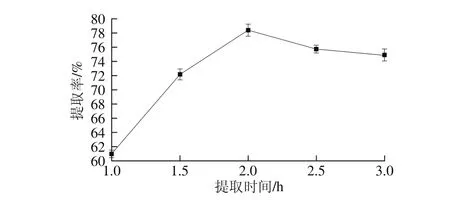
图4 提取时间对蛋白提取率的影响Fig. 4 Effect of extraction timeon the extraction yield of protein
由图4可知,提取时间在1~2 h范围内变化时,随着提取时间的延长,蛋白提取率呈现上升趋势,在提取时间为2 h时,蛋白提取率最大,但随着提取时间继续延长,提取率趋于平缓。提取时间过短,蛋白质从原料中溶解不完全。但随着提取时间的延长,蛋白质溶出量达到饱和,因此继续延长提取时间,蛋白提取率不再有明显的增加。因此选取提取时间2 h为最适宜条件。
2.1.5 分蘖葱头蛋白提取工艺优化
根据单因素试验结果,分别以料液比、pH值、提取温度、提取时间为考察因素,以蛋白提取率为评价指标,按L9(34)进行正交试验,优化最佳提取条件,结果见表3。
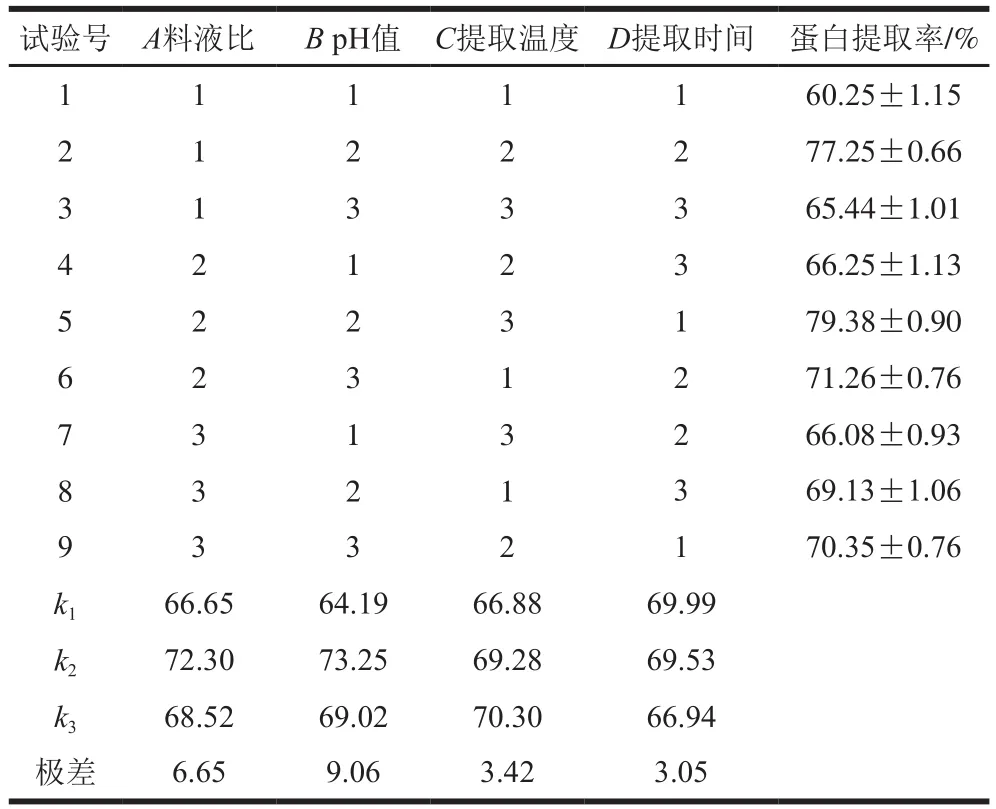
表3 正交试验设计及结果Table 3 Orthogonal array design matrix with experimental results
由表3可知,对分蘖葱头蛋白提取率影响因素大小分别为pH值>料液比>提取温度>提取时间。得到碱溶酸沉法提取的最佳工艺条件为A2B2C3D1,即料液比1∶15(g/mL)、pH 9.0、提取温度50 ℃、提取时间1.5 h,在此条件下蛋白提取率为79.38%,在此条件下,进行验证实验,蛋白提取率为80.12%,与正交试验优化得到的提取率相差不大。
2.1.6 正交试验方差分析

表4 正交试验的方差分析Table 4 Analysis of variance of the experimental results of orthogonal array design
由表4可知,校正模型具有显著性,A、B、C、D各因素对提取率的影响P值均小于0.01,表明料液比、pH值、提取温度、提取时间4 个因素对分蘖葱头蛋白质的提取影响均极显著,因此上述4 个影响因素可作为提取过程中影响蛋白提取率的首要考虑因素,且该提取方法可用于分蘖葱头蛋白提取。
2.2 分蘖葱头蛋白基础特性测定结果
2.2.1 等电点测定结果

图5 等电点测定结果Fig. 5 Isoelectric point of the protein
由图5可知,pH值在2.5~5.0范围内变化时,样品上清液吸光度呈现先下降后上升的趋势,在pH 3.0时吸光度最低,即上清液中蛋白含量最少,此时蛋白质沉淀完全,因此pH 3.0为分蘖葱头蛋白的等电点。
2.2.2 紫外-可见分光光度计测定结果
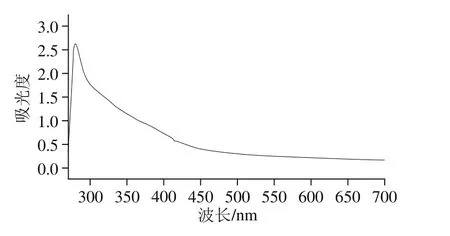
图6 蛋白溶液紫外-可见光谱扫描Fig. 6 UV-visible spectrum of the protein solution
由图6可知,在波长270~700 nm范围内对蛋白溶液进行紫外-可见光谱扫描时,279 nm波长处出现最大吸收峰,且其他波长处曲线较平缓,未见明显杂峰,而蛋白溶液的紫外-可见光光谱的最大吸收峰在280 nm波长附近。由此可知提取的分蘖葱头蛋白纯度较高,且结合分光光度法测得纯度数据结果可知,冻干粉中蛋白纯度为80.02%,说明该方法提取制备分蘖葱头蛋白的方法可靠。
2.2.3 蛋白分子质量测定结果

图7 SDS-PAGE法分析蛋白分子质量电泳图Fig. 7 SDS-PAGE analysis of the protein
根据SDS-PAGE条带计算标准蛋白的迁移率,以标准蛋白分子质量的对数为纵坐标,相对迁移率为横坐标,绘制标准曲线,得到回归方程:y=-0.595 3x+2.233 5,R2=0.978 4,由图7可知,分蘖葱头蛋白的分子质量在48~63、25~35、17~20 kDa以及11~17 kDa之间均有条带,在25~35 kDa条带颜色较深,根据标准曲线方程计算出分蘖葱头蛋白的分子质量可分为61.94、27.10、17.62、13.34 kDa 4 组。
2.2.4 氨基酸组分分析

表5 氨基酸组成成分及含量Table 5 Amino acid composition of the protein
由表5可知,分蘖葱头蛋白中必需氨基酸质量分数为38.96%,非必需氨基酸质量分数为61.04%,必需氨基酸和非必需氨基酸的比例为0.638,接近世界卫生组织规定值0.666,说明分蘖葱头蛋白氨基酸组成较为合理,并且赖氨酸含量较高,可弥补谷物蛋白中赖氨酸含量较低的缺陷。
2.2.5 蛋白二级结构的测定结果
CD是研究低浓度蛋白质分子构象的一种简单、便捷且准确度较高的方法。蛋白质在远紫外区的主要生色基团是肽键,肽键在蛋白质的二级结构中排列规则,且排列方向决定了肽键能级跃迁情况,不同蛋白质在二级结构测定过程中产生的谱带位置和吸收峰强弱都是不同的。α-螺旋构象在222 nm和208 nm波长处呈现负峰,109 nm波长处有一正峰,β-折叠为构象在217~218 nm波长处有一负峰,在195~198 nm波长处有一强的正峰,β-转角构象在206 nm波长附近有一正峰,无规则卷曲构象在198 nm波长处有一负峰,在220 nm波长处有一小而宽的正峰。
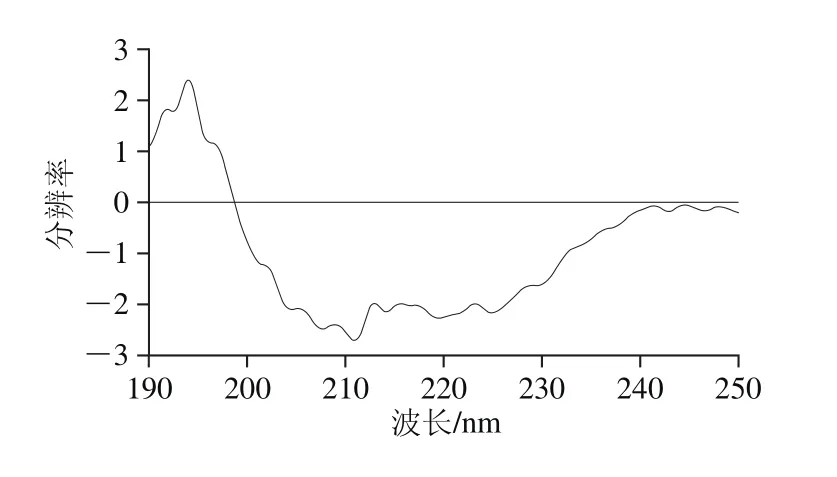
图8 蛋白的CD图谱Fig. 8 Far-UV CD spectrum of the protein
由图8可知,通过CD-Pro软件计算结果可知,分蘖葱头蛋白质中α-螺旋含量为52.60%,β-折叠含量为8.60%,β-转角含量为15.60%,无规则卷曲含量为22.40%。主要结构为α-螺旋,含量最低的为β-折叠。
2.2.6 特征性官能团测定结果
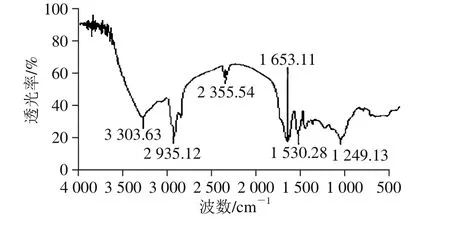
图9 蛋白的红外光谱图Fig. 9 Infrared spectrum of the protein
由图9可知,波数在3 303 cm-1处出现了典型的—OH吸收峰,2 935 cm-1出现的峰是由—CH2—反对称伸缩振动产生的,在2 356 cm-1处的吸收峰是由CO2反对称伸缩振动引起的,1 653 cm-1处的吸收峰是由蛋白质酰胺I带特征基团R—CO—NH2中—C=O—伸缩振动产生的,1 530 cm-1处吸收峰是由蛋白质仲酰胺基团中的—NH面内弯曲振动产生的,1 390 cm-1处较弱的吸收峰由蛋白质中游离的COO—对称伸缩振动产生的,1 249 cm-1处的吸收峰可能由—C(CH3)3中的C—C反对称伸缩振动产生的,后面出现的小杂峰可能是由于少量水分的存在而引起的[22]。
3 结 论
采用碱溶酸沉法提取分蘖葱头中的蛋白质,并通过正交试验法优化得到最佳提取工艺为料液比1∶15(g/mL)、pH 9.0、提取温度50 ℃、提取时间1.5 h,此条件下蛋白提取率最大为(79.38±0.90)%。
对所提取的分蘖葱头蛋白进行基础特性研究,实验结果表明蛋白的等电点为pH 3.0,由紫外-可见光谱图显示结果可知,碱溶酸沉法提取的蛋白纯度较高,提取方法可靠。电泳条带显示,分蘖葱头蛋白的分子质量可分为4 个组分,分别为61.94、27.10、17.62、13.34 kDa。高效液相色谱测得结果表明分蘖葱头中必需氨基酸质量分数为38.96%,非必需氨基酸质量分数为61.04%。在分蘖葱头蛋白二级结构中,α-螺旋含量为52.60%,β-折叠含量为8.60%,β-转角含量为15.60%,无规则卷曲含量为22.40%。红外图谱结果显示,分蘖葱头蛋白的特征性官能团明显,具有典型的吸收峰。
[1] 赵靖, 宋述尧, 赵春波, 等. 分蘖洋葱营养成分的保健作用与药用价值研究进展[J]. 食品工业科技, 2013, 34(23): 365-372.DOI:10.13386/j.issn1002-0306.2013.23.071.
[2] 贾帆. 毛葱油的提取、组分分析及微胶囊的制备研究[D]. 长春: 长春工业大学, 2014: 1-2.
[3] 李鹏. 从分蘖葱头中提取抗氧化活性成分的研究[D]. 长春: 长春工业大学, 2013: 1-8.
[4] 郭文场, 周淑荣, 刘佳贺. 毛葱的栽种和开发利用(1)[J]. 特种经济动植物, 2011, 14(5): 45-47. DOI:10.3969/j.issn.1001-4713.2011.04.022.
[5] 徐启江, 吴姝菊, 徐鑫成, 等. 脱毒分蘖洋葱高产优质栽培技术[J].北方园艺, 2003(1): 21-22. DOI:10.3969/j.issn.1001-0009.2003.01.013.
[6] 金玉忠, 李志民, 赵福顺, 等. 无公害农产品毛葱生产技术规程[J].蔬菜, 2015(4): 38-40. DOI:10.3969/j.issn.1001-8336.2015.04.020.
[7] 王强, 曹爱丽, 王苹, 等. 洋葱油的提取价值及其技术研究[J]. 食品科学, 2001, 22(8): 56-58.
[8] 孙昌平. 超声波辅助萃取毛葱油及其抑菌效果的研究[D]. 长春: 吉林农业大学, 2011: 2-5.
[9] 江漫涛, 陈滴. 分蘖葱头和长梗薤白的研究(一): 有效成份[J]. 白求恩医科大学学报, 1984(5): 477-480.
[10] FAN J, LI H T, ZHANG H Y, et al. Optimize conditions for extracting crude oil from Alliums cepa. L. var. agrogatum Don using response surface methodology[J]. IERI Procedia, 2013(5): 304-311.DOI:10.1016/j.ieri.2013.11.108.
[11] 王成武. 分蘖葱头栽培技术[J]. 农民致富之友, 2008(3): 162.DOI:10.3969/j.issn.1002-2767.2008.03.069.
[12] 邱俊, 王建刚, 柳杰, 等. 分蘖葱头挥发性成分的提取工艺研究[J]. 食品研究与开发, 2013, 34(10): 95-98. DOI:10.3969/j.issn.1005-6521.2013.010.025.
[13] 杨晓虹, 刘银燕, 刘丽娟, 等. 分蘖葱头中新黄酮苷的结构鉴定[J]. 药学学报, 2000(10): 752-755. DOI:10.3321/j.issn:0513-4870.2000.10.008.
[14] 曾光娟, 李春敏, 张新忠, 等. 适于双向电泳分析的苹果叶片蛋白质提取方法[J]. 色谱, 2009, 27(4): 484-488. DOI:10.3321/j.issn:1000-8713.2009.04.021.
[15] 张霞, 王峰. 植物蛋白质的特性及应用价值分析[J]. 现代农业科技,2014(1): 289-291. DOI:10.3969/j.issn.1007-5739.2014.01.187.
[16] XIONG G Y, GAO X Q, WANG P, et al. Comparative study of extraction efficiency and composition of protein recovered from chicken liver by acid-alkaline treatment[J]. Process Biochemistry,2016, 51(10): 1629-1635. DOI:10.1016/j.procbio.2016.07.007.
[17] 赵晨霞, 祝海娟, 张翌楠. 正交试验优化大麦虫蛋白质提取工艺[J].食品科学, 2013, 34(16): 42-45. DOI:10.7506/spkx1002-6630-201316009.
[18] WANG M, JIANG L Z. Optimization of extraction process of protein isolate from mungbean[J]. Procedia Engineering, 2011, 15: 5250-5258.DOI:10.1016/j.proeng.2011.08.973.
[19] AMAGLIANI L, O’REGAN J, KELLY A L. et al. The composition,extraction, functionality and applications of rice proteins: a review[J].Trends in Food Science & Technology, 2017, 64: 1-12. DOI:10.1016/j.tifs.2017.01.008.
[20] YU H, KANG B, WEI J, et al. 33 ku protein associated several polypeptides with nearly the same molecular weight but not the same isoelectric point[J]. Chinese Science Bulletin, 2000(1): 57-60.DOI:10.1007/BF02884904.
[21] 刘婷婷, 吴玉莹, 秦宇婷, 等. 绿豆淀粉工艺废水中蛋白质的功能性质[J]. 食品科学, 2017, 38(5): 104-110. DOI:10.7506/spkx1002-6630-201705017.
[22] 许彦腾. 黑水虻幼虫蛋白质提取与抗氧化活性及理化特性研究[D].杨凌: 西北农林科技大学, 2015: 1-12.
[23] BOGOMOLOV A, BELIKOVA V, GALYANIN V, et al. Referencefree spectroscopic determination of fat and protein in milk in the visible and near infrared region below 1 000 nm using spatially resolved diffuse reflectance fiber probe[J]. Talanta, 2017, 167: 563-572. DOI:10.1016/j.talanta.2017.02.047.
[24] ZHANG Y T, TIAN L, LI M F. Protein extraction methods suitable for two-dimensional gel electrophoresis analysis on protein expression in tomato pedicel[C]. Proceedings of the Third Conference on Horticulture Science and Technology, Beijing: science and technology review, 2012.
[25] 李莹莹, 吴彩娥, 杨剑婷, 等. 白果蛋白质提取及SDS-PAGE分析[J].食品科学, 2010, 31(22): 36-40.
[26] 许宪祝, 孙言春, 徐衍岭, 等. 柱前衍生-超高效液相色谱法测定鱼卵中的17 种氨基酸[J]. 色谱, 2013, 31(3): 275-280. DOI:10.3724/SP.J.1123.2012.11011.
[27] FIECHTER G, MAYRE H K. Characterization of amino acid profiles of culture media via pre-column 6-aminoquinolyl-N-hydroxysuccinimidyl carbamatederivatization and ultra performance liquid chromatography[J]. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, 2011, 879(17/18):1353-1360. DOI:10.1016/j.jchromb.2011.02.003.
[28] 胡熠凡, 赵亚周, 田文礼, 等. 蜂王浆中主蛋白成分(MRJP2)的分离纯化及圆二色谱分析[J]. 食品科学, 2013, 34(23): 57-61.DOI:10.7506/spkx1002-6630-201323013.
[29] 梁源, 陈敏. 蓝隐藻叶绿素蛋白复合物的圆二色谱特性[J]. 烟台大学学报(自然科学与工程版), 2014(3): 177-183. DOI:10.3969/j.issn.1004-8820.2014.03.005.
[30] 李晋, 徐怀德, 米林峰. 洋葱多糖的分离纯化及单糖组成研究[J]. 中国食品学报, 2012, 12(2): 202-206. DOI:10.3969/j.issn.1009-7848.2012.02.031.
[31] 洪晶, 陈涛涛, 唐梦茹, 等. 响应面法优化韭菜籽蛋白质提取工艺[J]. 中国食品学报, 2013, 13(12): 89-96. DOI:10.16429/j.1009-7848.2013.12.024.
Optimization of Extraction and Characterization of Protein from Allium cepa L. var. agrogatum Don
LIU Tingting, LIU Yang, ZHANG Jing, SONG Yunyu, LI Guijie, ZHANG Yanrong*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
The extraction of protein from Allium cepa L. var. agrogatum Don by alkali dissolution and acid precipitation was optimized using orthogonal array design method. Along with this, the extracted protein was also characterized. The results showed that the maximum extraction efficiency of protein of 79.38% was obtained after extraction at 50 ℃ and pH 9.0 with a solid-to-solvent ratio of 1:15 (g/mL) for 1.5 h. HPLC analysis demonstrated that the protein consisted of 38.96%essential amino acids and 61.04% non-essential amino acids. Electrophoresis showed that the protein was composed of four components with molecular weights of 61.94, 27.10, 17.62, and 13.34 kDa. The secondary structure consisted of 52.60% α-helix, 8.60% β-sheet, 15.60% β-turn and 22.40% random coil. The characteristic functional groups of the protein were confirmed by infrared spectroscopy.
Allium cepa L. var. agrogatum Don; protein; orthogonal array design; characteristics
10.7506/spkx1002-6630-201802042
TS255.1
A
1002-6630(2018)02-0267-06
刘婷婷, 刘阳, 张晶, 等. 分蘖葱头蛋白提取工艺优化及其基础特性[J]. 食品科学, 2018, 39(2): 267-272.
10.7506/spkx1002-6630-201802042. http://www.spkx.net.cn
LIU Tingting, LIU Yang, ZHANG Jing, et al. Optimization of extraction and characterization of protein from Allium cepa L. var. agrogatum Don[J]. Food Science, 2018, 39(2): 267-272. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201802042. http://www.spkx.net.cn
2017-06-21
吉林农业大学人才计划项目(20160509)
刘婷婷(1984—),女,副教授,博士,研究方向为谷物食品科学与副产物高值化利用。E-mail:xcpyfzx@163.com
*通信作者简介:张艳荣(1965—),女,教授,博士,研究方向为粮油植物蛋白工程与功能食品。E-mail:xcpyfzx@163.com
