脑梗死并阿司匹林抵抗患者血浆miRNA155和IL-6水平变化及相关性研究
2018-01-04刘娜周志奎刘爱华
刘娜 周志奎 刘爱华
脑梗死并阿司匹林抵抗患者血浆miRNA155和IL-6水平变化及相关性研究
刘娜 周志奎 刘爱华
目的探讨急性脑梗死并阿司匹林抵抗患者血浆miRNA155、白介素-6 (IL-6)水平变化及相关性。方法选择220例急性脑梗死患者,通过血小板聚集实验区分阿司匹林抵抗组(AR组)和非阿司匹林抵抗组(NAR组),对比分析2组基础资料、microRNA155、血浆IL-6水平变化以及2组血浆miRNA155与IL-6水平的相关性。结果2组患者基础资料比较无明显差别(P均>0.05);AR组患者miRNA155、IL-6水平显著高于NAR组(P均<0.05);血浆miRNA155 与IL-6水平呈显著正相关(r=0.82,P<0.05)。结论AR组患者血浆miRNA155、IL-6水平显著升高,这在一定程度上提示脑梗死患者阿司匹林抵抗的发生。
急性脑梗死 阿司匹林抵抗 miRNA155 IL-6
脑血管病是危害中老年人身体健康和生命的主要疾病之一,由于其较高患病率、致残率、病死率给社会、家庭带来沉重的负担。因此,脑卒中的预防成为近年来的热门话题。美国卒中学会和我国脑梗死治疗的专家共识中阿司匹林是重要的一线治疗及二线预防用药,但是人们发现部分应用阿司匹林的患者仍不能有效地抑制血小板聚集和活化,从而导致缺血事件的复发率升高,这种现象即阿司匹林抵抗(AR)。
阿司匹林抵抗的发生机制复杂,至今尚未完全明了,主要包括(1)用药剂量与阿司匹林抵抗的关系;(2)COX-2的可能作用;(3)基因多态性;(4)与药物间的相互作用有关等[1]。目前的热点为微小RNA (miRNA)的相关研究。miRNA可通过作用于靶mRNA进而调节靶蛋白的表达,从而在机体正常生理及病理过程中发挥着重要作用[2]。本实验通过观察血小板中miRNA155表达水平对AR的影响,旨在探讨其在阿司匹林抵抗中的作用。
1 对象与方法
1.1 研究对象
选择急性脑梗死患者220例,均为2015年06月~2016年6月神经内科住院的急性脑梗死患者,其中男115例,女105例,年龄50~80岁,平均年龄(66.9±5.3)岁。所选患者符合以下入选标准:(1)诊断符合全国第四届脑血管病学术会议第3次修订的缺血性脑血管病诊断标准;(2)均为首次急性发病;(3)无严重心肺疾病和肝肾功能不全、肿瘤、结缔组织病、自身免疫性疾病及其他脑部器质性病变;(4)签署知情同意书者。排除标准:(1)合并感染、高热及自身免疫疾病者; (2)精神疾病者; (3)合并哮喘、肿瘤、HIV 病毒感染者;(4)在入选前长期服用阿司匹林、氯吡格雷、非甾体抗炎药等影响血小板活性的药物。
1.2 方法
1.2.1 一般资料
记录并检测所有研究对象的基本资料,包括年龄、性别、体质量指数(BMI)、吸烟例数、舒张压(DBP)、收缩压(SBP)、甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDLC)、血肌酐(Cr)、尿素氮(BUN)、谷氨酸转氨酶(ALT)及血浆中IL-6水平。
1.2.2 血小板聚集率测定
把从静脉中取得的血液以1000 r/min离心8 min,离心半径15 cm,取上层PRP,计数血小板;剩余血液以3000 r/min离心10 min,取出血小板血浆(platelet poor plasma,PPP),用PPP调整PRP中的血小板数;将PRP及PPP各225 μL分别加入两支反应杯中,加搅拌棒,于37 ℃温浴5 min;将聚集剂AA和ADP加入样本中,使其终浓度分别为0.5 mg /mL和10 μmol/L;数据用聚集百分率和斜率表示。分别测量对照组体外PRP给予阿司匹林(终浓度为330 μmol/L,室温孵育30 min)前后的聚集率。根据 GUM标准,静脉血加入阿司匹林处理后ADP诱导的血小板聚集率≥70%或 AA 诱导的血小板聚集率≥20%的标本即为 AR,反之为NAR。
1.2.3 血浆中miRNA155表达水平的检测
取样本200 μL血浆,加入5 μL作为内参的50 pmol/L的线虫mi-39(Qiagen公司),再加入5 moL/L醋酸20 μL和750 μL TRI RegentBD(Molecular Research Center ),按TRI Regent BD说明书提取RNA;取2 μLRNA用TaqMan MicroRNA反转录试剂盒(Applied Biosystems公司)获取eDNA,反应条件:16 ℃ 30 min, 42 ℃ 30 min, 85 ℃ 5 min, 40 ℃维持;取2 μL cDNA作为模板,用TaqMan Universal Master Mix 11试剂盒进行RT-PCR, miR155和miR39 探针为Taq Man公司提供;PCR条件:95 ℃ 1 min, 95 ℃ 15 s, 60 ℃ 30 s,50个循环;每份标本设3个复孔;采用ABI 9700实时定量PCR仪进行检测,用SDS2.1软件计算标本Ct值,检测miRNA155表达水平。
1.2.4 统计学处理
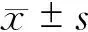
2 结 果
2.1 AR发生率
220例患者中共出现56例阿司匹林抵抗,AR发生率为25.5%;非阿司匹林抵抗的患者共164例,发生率为74.5%。
2.2 一般资料比较
阿司匹林抵抗组与非阿司匹林抵抗组比较,年龄、性别、BMI、吸烟例数、TG、TC、LDL-C、Cr、BUN、ALT等基础指标组间比较均不具有统计学差异(P均>0.05)(表1)。
2.3 各组血浆IL-6、miRNA155水平比较
AR组IL-6表达水平较NAR组升高(P<0.05);AR组与NAR组比较,miRNA155水平显著升高(P<0.01)(表2)。
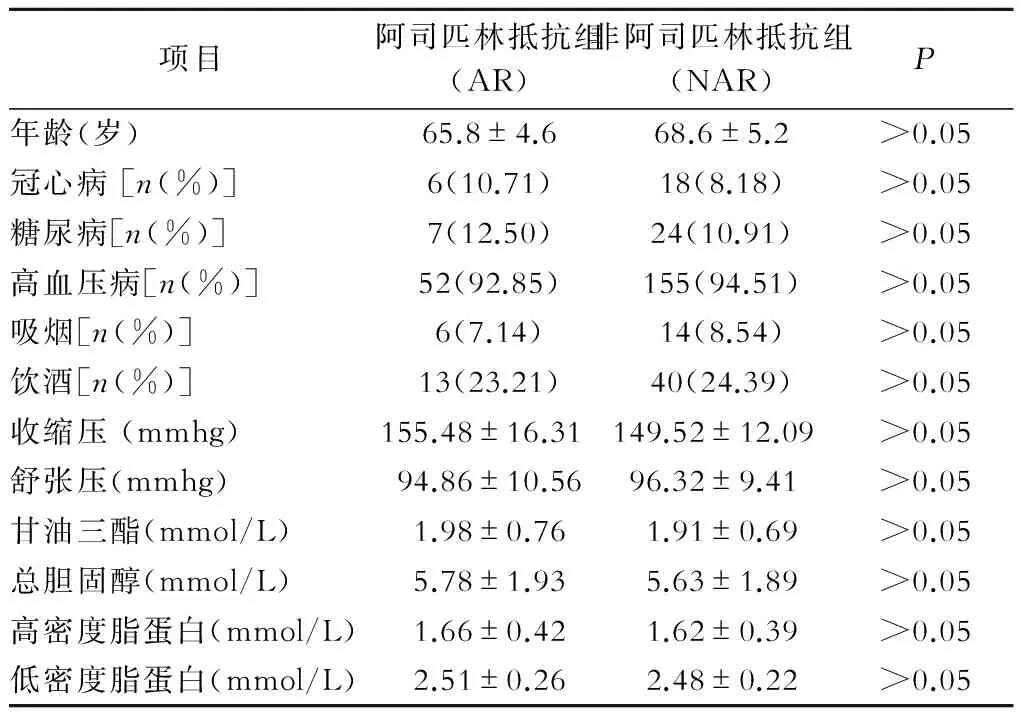
表1 各组一般资料比较

表2 各组血浆IL-6、miRNA155 水平比较)
3 讨 论
阿司匹林是缺血性脑血管疾病的首选预防用药,但Floyd等研究认为阿司匹林抵抗在固定人群中可以增加3倍以上的脑血管事件的发生概率[3]。目前关于阿司匹林抵抗的研究仍以COX1、COX2基因多态性为主,很少有关于miRNA的研究。本课题内容为脑梗死患者阿司匹林抵抗与miRNA关系的研究,实验入选者均为江苏镇江汉族老年人。在入选人群中共发现阿司匹林抵抗者共56例,占总样本的25.5%,非阿司匹林抵抗的患者共164例,占总样本的74.5%。与国外近年来的报道相比,阿司匹林抵抗发生率为8%~45%相符[4-5]。
一些研究提示年龄、性别、吸烟、血红蛋白水平、高脂血症等影响阿司匹林聚集情况,本实验AR组及NAR组的基础资料差别不大,提示患者基础资料对本实验结果无明显影响。因此,本研究认为不能下结论说这些众所周知的危险因素是影响阿司匹林抵抗的原因,而是提示应该更积极地治疗这些高危患者。
miRNA是约22个核苷酸的非编码单链RNA分子,多数miRNA以碱基配对的方式结合到靶mRNA的3’非翻译区后通过起始阶段的翻译抑制或其后mRNA的降解使基因表达沉默,从而达到调控基因表达的目的[6]。有些循环中的miRNA可作为糖尿病、冠心病的生物学指标。miRNA155在内皮细胞和血管平滑肌细胞中均有大量表达,其通过作用趋化因子和细胞因子等促炎介质上调,导致内皮细胞激活以及单核细胞进入血管壁且被激活[7-8]。有研究表明,降低miRNAl55的表达可以影响人涎腺腺样囊性癌细胞中的表皮生长因子受体的表达和NF-κB信号通路[9]。NF-κB信号途径是VEGF和COX2共有的一条信号传导通路,此通路与炎症和肿瘤的发生密切相关,miR155有可能通过对VEGF的调节进而影响着COX2的表达,从而表现出在AR和NAR之间的水平差异[10-11]。在炎症环境下,小鼠巨噬细胞miRNA155的表达也明显增高,改变miRNAl55的表达可以影响炎性细胞中的表达,炎性反应在动脉硬化及阿司匹林抵抗中的作用已得到共识,进一步提示miRNA155可能参与阿司匹林抵抗。
IL-6是一种主要由活化的单核巨噬细胞产生的糖蛋白,其在动脉粥样硬化壁中的水平为血清水平的200倍,且可作用于血管壁而引起血管壁的损伤[12]。本实验阿司匹林抵抗组较非阿司匹林抵抗组明显升高,提示IL-6与阿司匹林抵抗有一定的关系。本研究还发现miRNA155与IL-6水平呈显著正相关,提示两者在阿司匹林抵抗反应方面有较好的一致性。有研究发现,在巨噬细胞中炎症介质干扰素(IFNs)通过IL-6的自分泌/旁分泌激活可诱导miRNA155表达上调。本研究推测,一方面IL-6上调了miRNA155的表达;另一方面miRNA155的高表达促进趋化因子和细胞因子等促炎介质上调,两者相互影响,相互促进,最终导致阿司匹林抵抗的发生。
综上所述,本研究结果发现AR组血浆miRNA155水平显著高于NAR组,提示血浆miRNA155可能对阿司匹林抵抗有预测价值。个体化抗血小板聚集治疗是否有更好的成本效益比?相信随着更多基础研究和大规模随机对照试验的开展,这些问题最终都会得到答案,并进一步改善对阿司匹林抵抗的预防和治疗。
[1] 黄亚,闫福岭.阿司匹林抵抗研究进展[J].《东南大学学报(医学版),2015,3(1):459-462.
[2] Chen Q,Lan W,Wang J.Mining featured patterns of MiRNA interaction based on sequence and structure similarity[J].IEEE-ACM Transactions on Computational Biology and Bioinformatics,2013,10(2):415-422.
[3] Floyd CN,Ferro A.Mechanisms of aspirin resistance[J].Pharmacol Ther,2014,141(1):69-78.
[4] 马争飞,钟平,张雷,等.急性脑梗死患者阿司匹林抵抗及相关因素分析[J].《脑与神经疾病杂志,2015,23(4):25-29.
[5] Kim JT,Heo SH,Lee JS,et al.Aspirin resistance in the acute stages of acute ischemic stroke is associated with the development of new ischemic lesions[J].PLoS One,2015,10(4):e0120743.
[6] Lewis BP,Burge CB,Bartel DP.Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J].Cell,2005,120(1):15-20.
[7] Templin T,Young EF,Smilenov LB.Proton radiation-induced miRNA signatures in mouse blood:characterization and comparison with 56Fe-ion and gamma radiation[J].Int J Radiat Biol,2012,88(7):531-539.
[8] O'connell RM,Kahn D,Gibson WS,et al.MicroRNA-155 promotes autoimmune inflammation by enhancing inflammatory T cell development[J].Immunity,2010,33(4):607-619.
[9] 王建丽,张涌,朱媛媛,等.急性脑梗死患者阿司匹林抵抗与血小板miR126 的相关性研究发现[J].《山 东 大 学 学 报(医 学版),52(5):77-80.
[10] 黄珊,李天发,王军,等,冠心病患者血浆 microRNA155 和 TNF-α变化水平及相关性研究[Z].医学临床研究,2016,33(3):454-459.
[11] Liu L,Hu Y,Fu J,et al.MicroRNA155 in the growth and invasion of salivary adenoid cystic carcinoma[J].J Oral Pathol Med,2013,42(2):140-147.
[12] Khong WX,Foo DG,Trasti SL,et al.Sustained high levels of interleukin-6 contribute to the pathogenesis of enterovirus 71 in a neonate mouse model[J].J Virol,2011,85(7):3067-3076.
R743.32
A
1007-0478(2017)06-0534-03
10.3969/j.issn.1007-0478.2017.06.014
镇江市社会发展指导性项目(编号为FZ2015036);江苏大学医学临床科技发展基金项目(编号为JLY20160004)
212000 江苏省镇江市第一人民医院(刘娜 周志奎);江苏省丹阳市人民医院(刘爱华)
(2017-02-07收稿)
