重症监护病房患儿万古霉素血药浓度的监测
2018-01-03杨保旺李兴川杨志国
张 妮 杨保旺 李兴川 杨志国
兰州大学第二医院重症监护病房(甘肃兰州 730030)
重症监护病房患儿万古霉素血药浓度的监测
张 妮 杨保旺 李兴川 杨志国
兰州大学第二医院重症监护病房(甘肃兰州 730030)
目的 分析万古霉素不同给药次数与重症监护病房(PICU)患儿血药浓度的关系,不同谷浓度与疗效的关系,以及药物不良反应。方法 回顾2013年1月—2016年6月入住PICU并使用万古霉素的72例患儿的临床资料,其中58例万古霉素剂量为40 mg/(kg·d),14例60 mg/(kg·d);剂量40 mg/(kg·d)的患儿中q12h给药19例,q8h给药22例,q6h给药17例;万古霉素给药至少4个剂量后,在给药前30 min内采集血标本检测谷浓度;给药结束后30~60 min内采集血标本检测峰浓度;以高效液相色谱(HPLC)法快速测定血浆万古霉素浓度。结果 万古霉素以40 mg/(kg·d)进行治疗时,q12h、q8h和q6h三组之间万古霉素谷浓度与峰浓度的差异均无统计学意义(P>0.05)。万古霉素谷浓度≤5 μg/mL和>5 μg/mL组之间显效及有效率差异无统计学意义(81.8% 对84.0%,P>0.05)。与万古霉素40 mg/(kg·d)组(q8h)比较,60 mg/(kg·d)组谷浓度与峰浓度均明显升高,差异有统计学意义(P<0.05)。结论 使用常规剂量的万古霉素谷浓度难以达到10 μg/mL;为达到有效治疗浓度,降低不良反应,可增加万古霉素剂量,增加给药次数。
革兰阳性球菌; 万古霉素血药浓度; 疗效; 不良反应
脓毒症是PICU的首位死亡原因,而革兰阳性球菌是脓毒症的重要病原菌。万古霉素是三环糖肽类抗生素,能抑制细菌细胞壁的合成,有效地对抗革兰阳性菌,对耐甲氧西林金黄色葡萄球菌(methicillinresistant Staphylococcus aureus,MRSA)感染有效,对青霉素、头孢菌素类过敏或使用后无效的葡萄球菌、肺炎链球菌和肠球菌感染尤其有效,临床主要用于脓毒症、肺部感染、神经系统感染、皮肤软组织感染等。由于万古霉素的治疗指数窄,个体差异较大,浓度太低达不到有效血药浓度, 影响治疗效果且易产生耐药性;浓度太高则肾、耳毒性明显,因此临床上常需监测万古霉素的血药浓度,以便及时调整剂量, 实现个体化给药,避免不良反应的发生。本研究旨在探讨万古霉素不同给药次数的谷浓度及峰浓度差别,不同谷浓度的疗效以及不良反应,为临床医师调整万古霉素治疗剂量提供参考依据。
1 对象与方法
1.1 研究对象
以2013年1月—2016年6月入住兰州大学第二医院PICU且使用万古霉素的患儿为研究对象,入选标准:①年龄29天至14岁;②万古霉素使用剂量为40~60 mg/(kg·d);③排除用药时间不足3d的患儿。研究对象分组:万古霉素(礼来公司,500mg/瓶)使用剂量为40mg/(kg·d)时,根据使用频率分为q12h、q8h、q6h三组;60mg/(kg·d)组,q8h。每次持续1h以上静脉泵入。
1.2 方法
1.2.1 临床资料收集 患儿性别、年龄、体质量、诊断、用药时间、热退时间、不良反应,血常规、C反应蛋白(CRP)、降钙素原(PCT),脑脊液或穿刺液常规、生化、培养,血培养、血生化及影像学资料等。
1.2.2 血药浓度监测 患儿在接受至少4个固定剂量后,在给药前30nin内采血送检谷浓度,给药结束后30~60 min内采血送检,采用高效液相色谱(high performance liquid chromatography,HPLC)法快速测定人血浆中万古霉素浓度。
1.2.3 疗效评价指标 参照卫生部抗生素研究指导原则将疗效分为:①显效,使用万古霉素后临床症状、体征消失,血培养转阴;②有效,临床症状缓解;③无效,临床症状未缓解或加重,血培养结果未转阴。
1.3 统计学分析
采用SPSS19.0软件对数据进行统计分析。符合正态分布的计量资料以均数±标准差表示,多组间比较采用单因素方差分析,两组间比较采用两独立样本t检验;非正态分布计量资料以中位数(四分位数间距)表示,组间比较采用秩和检验。计数资料以百分比表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
共纳入72例患儿,男46、女26例,年龄1个月~13岁,中位数2.75岁;其中重症肺炎及肺炎合并脓胸29例(40.3%),化脓性脑膜炎27例(37.5%),蜂窝织炎5例(6.9%),脑脓肿3例(4.2%),骨髓炎3例(4.2%),化脓性髋关节炎3例(4.2%),纵隔脓肿2例(2.8%)。血培养阳性36例(50.0%),肺炎链球菌22例,其中11例为耐青霉素链球菌;金黄色葡萄球菌8例,其中MRSA 3例;A溶血性链球菌2例;草绿色链球菌1例;耐甲氧西林表皮葡萄球菌2例;腐生葡萄球菌1例。万古霉素平均使用时间(13.83±4.85)d。
2.2 万古霉素不同给药次数谷浓度与峰浓度比较
万古霉素剂量为40mg/(kg·d)进行治疗时,q12h组19例、q8h组22例、q6h组17例,三组患儿万古霉素最低谷浓度为1.1 μg/mL,≤2 μg/mL 4例(6.9%),≥10 μg/mL 2例(3.4%);最高峰浓度36.6 μ g/mL,≥30 μg/mL 8例(13.8%)。万古霉素谷浓度三组间差异无统计学意义(P>0.05),峰浓度三组间差异有统计学差异(P<0.01)。见表1。
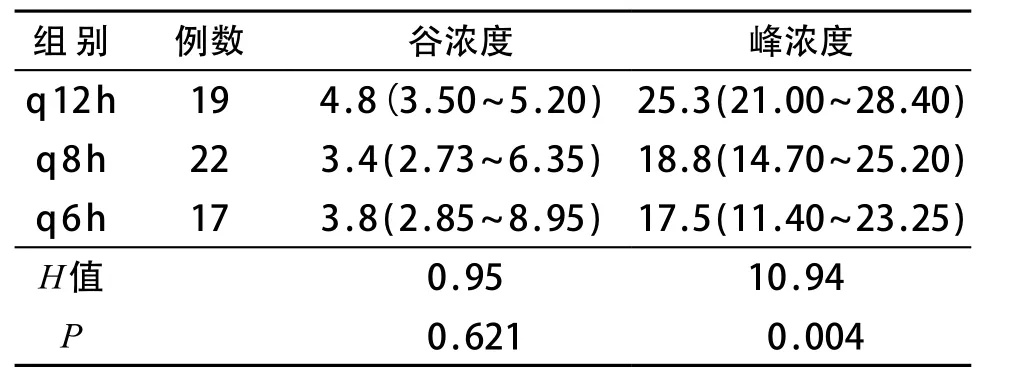
表1 万古霉素不同给药次数间谷浓度与峰浓度比较[M(P25~P75),μg/mL]
2.3 万古霉素不同谷浓度与疗效比较
按照万古霉素谷浓度分为≤5 μ g/mL和>5 μ g/mL组,≤5 μg/mL组33例患儿中,显效及有效27例(81.8%),>5 μ g/mL组25例患儿中,显效及有效21例(84.0%)。两组间显效及有效率的差异无统计学意义(χ2=0.00,P=1.000)。
2.4 万古霉素不同剂量谷浓度、峰浓度比较
万古霉素使用剂量为60 mg/(kg·d)的14例患儿中,谷浓度<10μg/mL 12例(85.7%),谷浓度超过10μg/mL 2例(14.3%);60mg/(kg·d)组最高峰浓度为58.4μ g/mL,≥30μg/mL 5例(35.7%)。万古霉素不同使用剂量40mg/(kg·d) q8h组与60mg/(kg·d)组之间比较,谷浓度差异有统计学意义(P<0.05),峰浓度差异无统计学意义(P>0.05)。见表2。

表2 万古霉素不同剂量组间谷浓度与峰浓度比较[M(P25~P75),μg/mL]
2.5 万古霉素不良反应
72例患儿中9例(12.5%)发生不良反应。红人综合征2例,分别为3月龄和5月龄,在输万古霉素的第1及第2天发生,临床表现为全身皮肤发红,心率呼吸增快,生命体征平稳,经稀释浓度后很快好转。发生肝酶升高6例,其中3例为药疹,同时伴高热、皮疹,在停药后及保肝治疗1周内均恢复正常。1例化脓性脑膜炎患儿,万古霉素60mg/(kg·d),谷浓度为7.6μg/mL,峰浓度为58.4μ g/mL,用药第5天发现双侧听力障碍,听力学检查结果提示双侧极重度感音神经性耳聋。全部患儿均未出现肾损伤。
3 讨论
万古霉素是三环糖肽类抗生素,杀菌作用是通过与细菌细胞壁结合,导致细菌的细胞壁合成受到干扰达到抗菌的作用,为快效杀菌剂,对革兰阳性菌杀灭作用强大,尤其对多重耐药的葡萄球菌抗菌活性强,是 MRSA 感染的首选药物。万古霉素治疗感染性疾病的耐药发生率低,是治疗重症感染如脓毒症、重症肺炎、脓胸、化脓性脑膜炎、骨髓炎、蜂窝织炎等的较好选择。2011年美国感染病学会(IDSA)指南指出,万古霉素谷浓度应提高到10μg/mL以上,必要时达到15~20μg/mL,以达到更为理想的临床治愈率[1]。目前国内外对于万古霉素在儿科患者中的给药剂量和谷浓度水平仍有争议[2]。由于儿童代谢旺盛 、排泄快,儿童谷浓度很难达到成人有效血药浓度。相关研究纳入的50例患儿中11例万古霉素剂量为40mg/(kg·d),39例为60mg/(kg·d),结果显示低剂量组及高剂量组分别有91%、73%与85%、69%未达到目标谷浓度水平10~14 μg/mL与15~20 μg/mL[3]。本研究与上述研究一致,万古霉素使用剂量为40mg/(kg·d)时,96.6%患儿的谷浓度<10μg/mL,仅3.4%谷浓度超过10μg/mL;使用剂量为60mg/(kg·d)时,85.7%患儿的谷浓度<10μg/mL,14.3%谷浓度超过10μg/mL,绝大多数患儿谷浓度均未达到IDSA推荐的血药浓度。提示目前推荐的万古霉素给药方案[40~60mg/(kg·d)]在儿科患者中为亚治疗血清浓度。有研究报告,予万古霉素每次15mg/kg,g6h的给药方案不可能在具有复杂感染的患儿中达到15~20μg/mL的谷浓度,对于这些患儿,每天80mg/(kg·d)的初始方案更可能达到万古霉素治疗的稳态浓度[4]。另一报道儿科万古霉素谷浓度能达到目标浓度10~20μg/mL数量较少,通常每天万古霉素剂量> 60mg/kg才能达到目标谷浓度,万古霉素的谷浓度随剂量增加而升高[5]。IDSA推荐对于复杂的脓毒血症、败血症、皮肤感染、软组织感染的患儿,万古霉素使用剂量推荐级别是A-Ⅱ,感染性内膜炎骨关节感染以及中枢神经系感染,万古霉素使用剂量推荐级别为B-Ⅱ/Ⅲ。本研究显示,在总量相同的情况下改变给药频次可以调整万古霉素血药浓度,三组万古霉素谷浓度和峰浓度虽无统计学差异,但随着使用频次增加,谷浓度呈增加趋势,而峰浓度呈下降趋势。本研究万古霉素40mg/(kg·d) q8h组最高峰浓度为36.6μg/ml,≥30μg/mL 5例(22.7%),60mg/(kg·d)组最高峰浓度为58.4μg/mL,≥30μg/mL 5例(35.7%)为提高血药浓度,增加剂量,峰浓度也升高,可能会增加不良反应的发生。研究中大部分患儿的万古霉素血药浓度低于有效血药浓度,但研究结果显示药物谷浓度≤5μg/mL组与>5μg/mL组治疗有效率无统计学差异,万古霉素在低浓度组治疗仍然取得了较好的疗效,但个体的差异很大,最高峰浓度为58.4μg/mL的患儿,谷浓度为7.6μg/mL,仍未达到10μg/mL。一项万古霉素治疗失败的相关因素分析表明,万古霉素谷浓度与治疗结果无关, 疾病的严重程度是治疗失败的独立预测因子[6]。另有研究显示,18岁以下使用万古霉素治疗的患儿谷浓度低于目标浓度, 但临床有效率却都在80%左右,对于那些血药浓度未达标但临床效果好的病例,建议不用调整给药方案[7]。上述研究与本组研究一致,万古霉素虽未达到有效血药浓度,治疗有效率却达到80%以上。万古霉素的疗效可能还与其他因素有关,包括疾病严重程度、疾病种类、疾病并发症是否需外科介入治疗等。
万古霉素的不良反应发生率高,主要包括过敏反应,严重者甚至发生心跳骤停、药物热、疼痛、白细胞异常、肾损伤、肝损伤、听力损伤等,有些病例存在多种不良反应。从临床表现来看,最常见的不良反应以过敏反应最多,万古霉素可促使机体释放组胺,从而引起过敏反应的发生。本研究中万古霉素不良反应相对较高,达到9例(12.5%),2例发生红人综合征,均为小于6月婴儿,经稀释浓度,减慢输注速度很快好转。低年龄的患儿用药应注意红人综合征的发生,对低年龄患儿万古霉素配液可比常规浓度更低,延长输注时间减少此种不良反应的发生。有6例患儿出现肝酶轻度增高,其中3例为药疹,同时有皮疹、高热,经停药及保肝治疗,一周内均恢复正常。万古霉素过敏反应与用药剂量以及输液滴注的速度均有关系,6例患儿用药时间均超过13天,此种不良反应还可能与用药时间相关。上述8例不良反应均较轻,经对症处理恢复正常。1例化脓性脑膜炎患儿,万古霉素治疗剂量为60mg/(kg·d),峰浓度为58.4μg/mL,用药第5天发现双侧听力障碍。过高的峰浓度与听力损伤有关,研究显示,当血药浓度>80 μg/mL会产生耳毒性[8]。本研究中这例患儿的万古霉素峰浓度很高,而谷浓度仍未达到10μg/mL,提示万古霉素的个体差异很大。万古霉素产生的耳毒性可致患儿终生残疾,增加剂量是提高血药浓度的直接办法,但也增加不良反应的风险。万古霉素经肾小球滤过,由肾小管排除,对肾功能的损伤也较多见。肾损伤与万古霉素的血药浓度有关,一项关于儿科患者肾毒性与万古霉素关系的研究显示,万古霉素谷浓度≥15μg/ mL时,与肾毒性相关的风险增加>2.5倍[9]。而本组未发现万古霉素致肾损害病例,可能与用药剂量偏小,谷浓度与峰浓度均较低有关。
IDSA指南指出金黄色葡萄球菌暴露于万古霉素谷浓度<10 μg/mL时,可产生具有万古霉素中介金黄色葡萄球菌样特点,推荐其血药浓度谷值应保持>10 μg/mL,以避免发生耐药。有报道MRSA菌血症患儿在使用万古霉素48小时后,初始万古霉素谷浓度<10μg/mL的患儿出现持久性菌血症频率更高,初始谷浓度≥10μg/mL与<10μg/mL两组之间30天病死率和复发性菌血症发生率的差异不显著[10]。儿童万古霉素谷浓度很难达到>10 μg/mL,如何避免耐药是儿科医师面临的难题。
综上所述,万古霉素常规剂量40~60mg/(kg·d)很难达到IDSA推荐的有效血药浓度,增加剂量、增加频次是提高万古霉素谷浓度直接而有效的方法。本研究多数患儿谷浓度低于10 μg/mL,却取得了较好的疗效。因此认为40~60 mg/(kg·d),q6h,作为起始剂量是相对安全的,可通过血药浓度监测及疗效评估来调整剂量。对于那些血药浓度未达标但临床效果尚好的病例,可以暂时不用调整给药方案,但低血药浓度可引起耐药,在儿童患者中如何提高万古霉素谷浓度,达到疗效最佳、不良反应最少、无耐药发生的目标,有待进一步大样本的研究。
[1] Liu C, Bayer A, Cosgrove SE, et al. Clinical practice guidelines by the infectious diseases society of america for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children∶ executive summary [J]. Clin Infect Dis, 2011, 52 (3)∶ 285-292.
[2] 万古霉素临床应用剂量专家组.万古霉素临床应用剂量中国专家共识[J].中华传染病杂志, 2012, 30(11)∶ 641-646.
[3] Arfa P, Karimi A, Rafiei Tabatabaei S, et al. A prospective study to assess vancomycin serum concentrations in pediatric patients with current dosing guidelines [J]. Iran J Pharm Res,2016, 15(1)∶ 341-346.
[4] Durham SH, Simmons ML, Mulherin DW, et al. An evaluation of vancomycin dosing for complicated infections in pediatric patients [J]. Hosp Pediatr, 2015, 5(5)∶ 276-281.
[5] Geerlof LM, Boucher J. Evaluation of vancomycin dosing and corresponding drμg concentrations in pediatric patients[J]. Hosp Pediatr, 2014, 4(6)∶ 342-347.
[6] Wei WX, Qin XL, Cheng DH, et al. Retrospective analysis of vancomycin treatment outcomes in Chinese paediatric patients with suspected Gram-positive infection [J]. J Clin Pharm Ther, 2016, 41(6)∶ 650-656.
[7] 闫立国, 赵志刚. 儿童患者中开展万古霉素血药浓度监测的研究[J] .中国临床药理学杂志, 2016, 32(10)∶ 933-935.
[8] Rybak M, Lomaestro B, Rotschafer JC, et al. Therapeutic monitoring of vancomycin in adult patients: a consensus review of the American Society of Health-System Pharmacists, the Infectious Diseases Society of America,and the Society of Infectious Diseases Pharmacists [J]. Am J Health Syst Pharm, 2009, 66(1)∶ 82-98.
[9] Le J, Ny P, Capparelli E, et al.Pharmacodynamic characteristics of nephrotoxicity associated with vancomycin use in children [J]. J Pediatric Infect Dis Soc, 2015, 4(4)∶ e109-116.
[10] Yoo RN, Kim SH, Lee J.Impact of initial vancomycin troμgh concentration on clinical and microbiological outcomes of methicillin-resistant Staphylococcus aureus bacteremia in children [J]. J Korean Med Sci, 2017, 32(1)∶ 22-28.
Monitoring of vancomycin concentration in children in pediatric intensive care unit
ZHANG Ni, YANG Baowang, LI Xingchuan, YANG Zhiguo (PICU, Lanzhou University Second Hospital, Lanzhou 730030, Gansu China)
Objectives To analyze the relationship between the different dosage of vancomycin and its blood concentration in children in pediatric intensive care unit (PICU), the relationship between different valley concentrations and therapeutic eff i cacy and the adverse reactions. Methods The clinical data of 72 children admitted to PICU and treated with vancomycin from January 2013 to June 2016 were retrospectively reviewed. The vancomycin doses in 58 cases was 40 mg/(kg·d) and were 60 mg/(kg·d) 14 patients. In the subjects treated at 40 mg/(kg·d), administration by q12h were in 19 cases, q8h in 22 cases and q6h in 17 cases. After vancomycin was administered at least 4 doses, blood samples were collected, and the valley concentration was determined within 30 min before administration of vancomycin and peak concentration was determined within 30-60 min after administration of vancomycin. The concentration of vancomycin in plasma was detected by high performance liquid chromatography (HPLC). Results When vancomycin was administrated at 40 mg/(kg·d), there were no difference in valley concentration and peak concentration among the three groups of q12h, q8h, and q6h (P>0.05). The effective rate was not different between valley concentration ≤5 μg/mL and >5 μg/mL of vancomycin (81.8% vs. 84.0%, P>0.05). Compared with vancomycin 40 mg/(kg·d) group (q8h), the valley concentration and peak concentration in 60 mg/(kg·d) group were signif i cantly increased (P<0.05). Conclusion It was diff i cult to reach a valley concentration of 10 μg/mL by using conventional doses of vancomycin. Thus, in order to achieve effective concentration and reduce adverse reactions, the dosage of vancomycin can be increased, and the times of administration can also be increased.
Ggram positive coccus; vancomycin concentration; eff i cacy; adverse reactions
doi∶10.3969/j.issn.1000-3606.2017.12.012
甘肃省自然基金项目(No.145RJZA233)
张妮 电子信箱:1005939382@qq.com
2017-03-15)
梁 华)
