皱皮木瓜多糖的分离纯化及结构表征
2018-01-03张体祥
刘 捷,王 文,张体祥
(河南工业大学 化学化工与环境学院,河南 郑州 450001)
皱皮木瓜多糖的分离纯化及结构表征
刘 捷,王 文,张体祥
(河南工业大学 化学化工与环境学院,河南 郑州 450001)
研究从皱皮木瓜中提取的水溶性多糖的分离、纯化、单糖组成及结构,为木瓜的开发利用提供依据.采用Sevag法除蛋白、透析法除小分子杂质后,经Sephadex G-100葡聚糖凝胶柱分离得到了皱皮木瓜多糖CSP1.通过高效凝胶渗透色谱、气相色谱、紫外光谱、红外光谱和核磁共振氢谱等分析手段初步确定了其组成和结构.皱皮木瓜多糖CSP1为均一组分,重均相对分子质量为27 622,由鼠李糖、木糖、葡萄糖、半乳糖4种单糖组成,摩尔比为0.042∶0.067∶0.860∶0.031,葡萄糖是主要成分,木瓜多糖CSP1结构中存在α-糖苷键.
皱皮木瓜;多糖;分离纯化;单糖组成;结构
木瓜的种类很多,主要分为三类:一类是蔷薇科木瓜,如光皮木瓜、皱皮木瓜;一类是番木瓜科木瓜,如番木瓜;还有一类是木通科木瓜,如野木瓜.作为一味常用的中药,木瓜具有平肝舒筋、和胃化湿的功效[2],文献[3]研究还发现木瓜有抗菌消炎、抗衰老、抗肿瘤的作用.皱皮木瓜(Chaenomeles Speciosa (Sweet.) Nakai)为木瓜中正品[1],是一种药食同源植物,果实中富含糖类、有机酸、蛋白质、多种维生素、矿物元素等,营养价值很高.
多糖是木瓜果实中重要的生物活性物质,国内外仅有为数不多的几篇文献对光皮木瓜、野木瓜多糖的提取及其抗氧化活性进行了研究[4-7],关于皱皮木瓜多糖的研究报道更不多见.为了进一步提高皱皮木瓜的经济价值,课题组在前期对皱皮木瓜多糖的提取、化学改性及其抗氧化活性工作的基础上[8],对提取的水溶性木瓜多糖进行分离纯化和结构分析,为深入研究皱皮木瓜多糖的理化性质、组成结构、生物活性及应用提供了实验依据.
1 材料与方法
1.1 材料与试剂
1.1.1原料
新鲜皱皮木瓜采摘于郑州市黄河游览区植物园,粉碎后,将粉末储存于冰箱备用.皱皮木瓜粗多糖由本实验室提取,多糖质量分数63%.
1.1.2试剂
葡萄糖(天津市科密欧化学试剂开发中心),D-半乳糖(上海市国药集团化学试剂有限公司),D-甘露糖(上海市国药集团化学试剂有限公司),D-木糖(上海伯奥生物科技有限公司),L-鼠李糖(美国Sigma公司),葡聚糖凝胶(Sephadex G-100,Sephadex G-200)(美国Sigma公司),透析袋(Sigma 公司),无水乙醇、氯仿、苯酚(A.R.,洛阳市化学仪器厂),三氟乙酸、吡啶、正丁醇(A.R.,天津市瑞金特化学品有限公司),盐酸羟胺(A.R.,洛阳化学试剂厂),醋酸酐、萘酚(A.R.,天津市科密欧化学试剂开发中心).
1.1.3仪器
微型高速万能试样粉碎机(北京市永光明医疗仪器厂),JJ-1型定时电动搅拌器(金坛市华峰仪器有限公司),RE-52c型旋转蒸发仪(上海亚荣生化仪器厂),SZ-93型自动双重纯水蒸馏器(上海亚荣生化仪器厂),BSZ-100型自动部分收集器(上海和勤分析仪器有限公司),SHA-B恒温水浴振荡器(金坛市华峰仪器有限公司),真空冷冻干燥机(上海比朗仪器制造有限公司),凝胶分离柱(上海亚荣生化仪器厂),BL-3205型电子天平(精度≥0.000 1 g,日本岛津公司),UV-2450型紫外-可见分光光度计(北京普析通用仪器有限责任公司),GC-9790型气相色谱仪(浙江温岭福立分析仪器有限公司),AVANCE 400型核磁共振谱仪(布鲁克北京科技有限公司),Prestige-21型傅里叶变换红外光谱仪(日本岛津公司),LC-10AVP型高效液相色谱仪(日本岛津公司).
1.2 实验方法
1.2.1多糖的分离纯化
采用 Sevag法去除蛋白质,将一定量的多糖溶液中加入氯仿和正丁醇(V(氯仿)∶V(正丁醇)= 5∶1)的混合溶剂,离心20 min,去除多糖溶液层与有机溶液层交界处的变性蛋白质,重复数次直至中间无混浊沉淀为止.然后,用透析法去除小分子杂质.
取5.0 mg 纯化后的多糖,1 mL 蒸馏水溶解后,离心20 min,上清液立即装入Sephadex G-100葡聚糖凝胶柱,用0.1 mol/L的NaCl溶液进行洗脱,控制流速为1 mL/min,洗脱液由分布收集器收集,每管5 mL,苯酚-硫酸法跟踪检测,合并流出液浓缩至一定体积,乙醇沉淀、过滤、干燥,得到精制的皱皮木瓜多糖.
1.2.2多糖纯度鉴定
将Sephadex G-100装柱,用0.05 mol/L的NaCl溶液平衡一天.将精制的木瓜多糖溶解后,用0.05 mol/L的NaCl溶液进行洗脱,按每管4 mL 分部收集,用苯酚-硫酸法检测.
1.2.3多糖的相对分子质量的测定
采用高效凝胶渗透色谱法测定木瓜多糖的相对分子质量,相对分子质量与多糖在凝胶柱上的洗脱体积Ve、分配系数Kav存在如下关系:
Ve=a-b×lgMw,
(1)
Kav=K1-K2×lgMw,
(2)

(3)
式中:a,b,K1,K2为常数;V0为标准物的洗脱体积;Vt为葡萄糖的洗脱体积.根据公式(3),用已知分子质量的标准物绘制标准曲线,然后根据木瓜多糖的洗脱体积计算木瓜多糖的相对分子质量[9].
色谱条件如下:GPC柱为Shim-pack GPC 803 300 mm×4.6 mm;柱温为40 ℃;流动相为0.7%的Na2SO4加0.05%的NaN3;流量为1.0 mL/min;检测器为示差折光检测器;样品质量浓度为10 mg/mL;进样量为100 μL.
1.2.4单糖组成的测定
(1)多糖糖腈乙酸酯衍生化
于10 mg 多糖中加入浓度为2 mol/L的三氟乙酸5 mL,在100 ℃下密闭水解6 h.将水解液减压浓缩至干,60 ℃烘箱中干燥后,加入10 mg 盐酸羟胺和0.5 mL 吡啶,将反应液水浴加热30 min.冷却至室温,加入0.5 mL 醋酸酐继续反应30 min,所得的反应液可直接进行气相色谱分析[10].
(2)标准单糖衍生物的制备
分别称取葡萄糖、木糖、半乳糖、甘露糖、鼠李糖各10 mg,按照上述多糖水解液制备多糖糖腈乙酸酯衍生物的方法进行乙酰化反应.
GC分析过程如下:150 ℃下保持4 min,然后以10 ℃/min升温至160 ℃,保持8 min,再以5 ℃/min升温至180 ℃,保持2 min,最后以20 ℃/min升温至250 ℃,保持5 min.进样口温度为250 ℃,检测器温度为240 ℃,载气压力为0.1 MPa.
将样品图谱与标准单糖图谱对照,确定皱皮木瓜多糖的单糖组成.
1.2.5理化性质
(1)碘-碘化钾反应
将木瓜多糖样品制成1 mg/mL的溶液,取1 mL加入碘-碘化钾溶液,观察颜色变化.
(2)茚三酮反应
取1 mL质量浓度1 mg/mL的木瓜多糖溶液,加入0.5 mL 0.1%的茚三酮乙醇溶液,混匀,煮沸1~2 min,冷却,观察颜色变化.
(3)Molish反应
分别取1 mL质量浓度为1 mg/mL的木瓜多糖溶液,各加入2滴Molish试剂(即10%的α-萘酚的乙醇溶液),混合均匀后将试管倾斜45°,沿试管壁慢慢加入1 mL浓硫酸(勿摇动),竖立试管,观察浓硫酸和糖交界面颜色的变化.
1.2.6红外光谱
取2.0 g纯化后的皱皮木瓜多糖粉末,KBr压片,在4 000~400 cm-1处扫描.
1.2.7紫外光谱
将纯化后的皱皮木瓜多糖溶于水,以蒸馏水为参比,在200~400 nm处扫描.
1.2.8核磁共振氢谱
将10 mg 纯化后的皱皮木瓜多糖溶于0.5 mL的D2O中,加入TMS,在核磁共振仪上测定1H NMR谱.
2 结果分析
2.1 皱皮木瓜多糖的纯化、分离
皱皮木瓜粗多糖经Sevag法脱蛋白、透析除小分子杂质后,由棕色粉末变为灰白色粉末,苯酚-硫酸法测定多糖质量分数为80.92%.木瓜多糖的Sephadex G-100柱层析的洗脱曲线见图1.
从图1可以看到,木瓜多糖样品经Sephadex G-100柱层析洗脱,分离得到3个峰,分别出现在第6管、第23管和第29管,其中第6管的含糖量最高且峰形尖锐对称,与另外两个小峰分离效果好.收集第6管的流出液,减压浓缩至一定体积,经醇沉、过滤、干燥,得精制木瓜多糖,命名为CSP1.这说明利用葡聚糖凝胶柱可以完全分离木瓜多糖.经苯酚-硫酸法测定,多糖质量分数为96.29%.
2.2 皱皮木瓜多糖CSP1的纯度鉴定
对Sephadex G-100柱层析分离得到的CSP1进行纯度鉴定,凝胶柱层析图谱中出现单一峰且峰形对称,说明CSP1为均一组分,如图2所示.

图1 木瓜多糖的Sephadex G-100柱层析的洗脱曲线Fig.1 Elution curve of CSP1 by Sephadex G-100

图2 木瓜多糖在Sephadex G-100柱层析的洗脱曲线Fig.2 Elution curve of CSP1 by Sephadex G-100

图3 葡聚糖的分子量标准曲线Fig.3 Standard curve of molecular weight
2.3 木瓜多糖CSP1的相对分子质量
图3是标准葡聚糖的标准曲线,回归方程为Y=7.218 7-1.441 5X,R2=0.992 9.根据洗脱体积回归方法计算,木瓜多糖CSP1的重均相对分子质量为27 622.
2.4 木瓜多糖CSP1的单糖组成分析
标准单糖混合物水解的衍生物和木瓜多糖CSP1水解衍生物的气相色谱图如图4所示,气相色谱保留时间数据见表1.
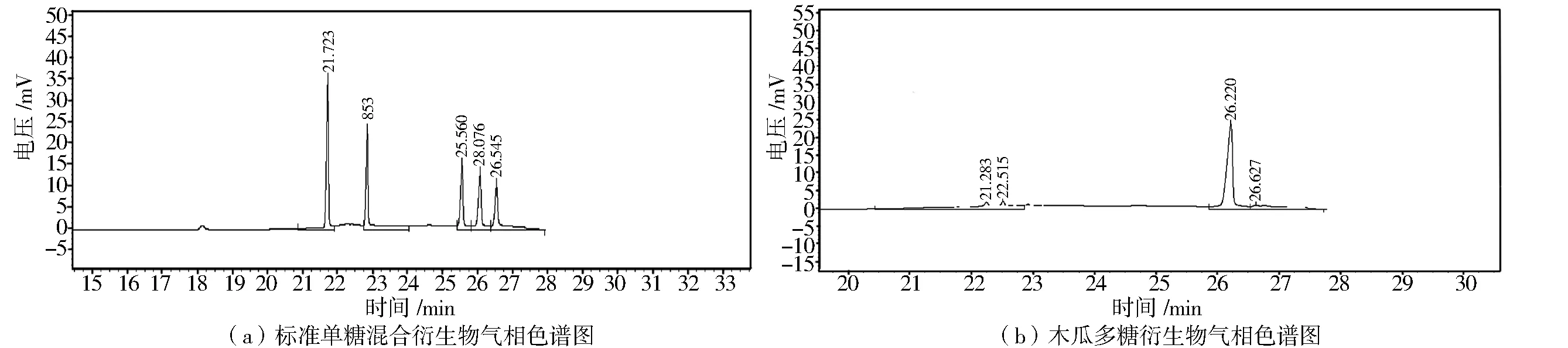
图4 标准单糖混合衍生物与木瓜多糖衍生物的气相色谱图Fig.4 GC spectra of standard monosaccharides derivatives and CSP1 derivate

表1 标准糖与木瓜多糖水解衍生物的保留时间数据Tab.1 The retention time of hydrolysis derivatives from standard monosaccharides and CSP1
气相色谱结果表明,皱皮木瓜多糖CSP1由鼠李糖、木糖、葡萄糖、半乳糖组成,摩尔比为0.042∶0.067∶0.860∶0.031,其中葡萄糖是主要的单糖成分.
2.5 皱皮木瓜多糖的理化性质
分离纯化后的皱皮木瓜多糖CSP1为白色粉末,溶于水,不溶于乙醇、丙酮、乙醚、氯仿等有机溶剂.理化性质测定显示:苯酚-硫酸反应呈阳性,碘-碘化钾反应和茚三酮反应均呈阴性,说明多糖中不含淀粉、氨基酸和蛋白质,属于非淀粉糖.
2.6 光谱鉴定
CSP1的紫外吸收光谱结果显示在260 nm处和280 nm处无吸收,表明CSP1不含核酸、多肽和蛋白质.CSP1的红外光谱具有典型的多糖特征吸收峰[11],如图5所示.各吸收峰的归属见表2.

图5 木瓜多糖CSP1的红外光谱Fig.5 IR spectrum of CSP1

表2 木瓜多糖CSP1的红外光谱数据Tab.2 Infrared spectrum data of CSP1
从图5和表2可知,红外光谱显示皱皮木瓜多糖在3 400 cm-1处、2 900 cm-1处、1 640 cm-1处和1 100~1 000 cm-1处有多糖的特征吸收峰.1 021 cm-1处出现的强吸收峰是葡萄糖的特征吸收峰,850 cm-1处的吸收峰表明多糖结构中存在α-糖苷键[12].890 cm-1处无吸收峰,可以确定不含有β-糖苷键.770 cm-1处附近的吸收峰为D-葡萄吡喃糖环的吸收.同时,在810 cm-1处和870 cm-1处无吸收峰表明无甘露糖的特征吸收,这也与GC结果相符.因此,通过IR光谱可以初步确定皱皮木瓜多糖属于α-吡喃糖.

图6 木瓜多糖的1H-NMR 图谱Fig.6 1H-NMR spectrum of CSP1
从1H-NMR(图6)结果分析,异头氢质子在4.5×10-6~5.5×10-6时出现一个明显的质子信号(δ4.721),说明木瓜多糖的主要单糖种类有一种,δ5.204 证实多糖中存在α-型糖苷键[13-14],这与木瓜多糖的红外光谱图、GC 结果是相符的,δ3.769、δ3.647和δ3.452为非异头氢质子.
3 结语
采用水煮醇沉工艺提取的水溶性皱皮木瓜粗多糖经过Sevag法脱蛋白、透析法除小分子化合物、Sephadex G-100色谱技术分离纯化得到精制的皱皮木瓜多糖CSP1,多糖质量分数达到96.29%,说明该工艺适用于纯化木瓜多糖.CSP1的重均相对分子质量为27 622,单糖组成主要有鼠李糖、木糖、葡萄糖、半乳糖,其中葡萄糖是主要的单糖成分.木瓜多糖CSP1具有多糖的典型特征吸收峰,属于α-吡喃糖,核磁共振氢谱进一步证实了皱皮木瓜多糖中存在α-糖苷键.多糖是结构复杂的生物大分子,糖的绝对构型、单糖的连接方式、羟基被取代情况等结构信息还有待进一步的深入研究.
[1] 中华人民共和国药典委员会.中华人民共和国药典一部[M].北京:化学工业出版社,2000:45.
[2] 郭学敏,洪永福,章玲,等.皱皮木瓜化学成分的研究[J].中草药,1997,28(10):584-585.
[3] 张冬松,高慧媛,吴立军.光皮木瓜的化学成分药理成分及临床研究进展[J].沈阳药科大学学报,2007,24(11):721-725.
[4] 王文平,郭祀远,李琳,等.野木瓜水溶性多糖的分离纯化及抗补体活性研究[J].食品科学,2008,29(5):120-124.
[5] 李才国,刘睿.木瓜多糖的提取、分离和鉴定[J].现代商贸工业,2007,19(2):172-174.
[6] 黄锁义,刘胜利,郭立强,等.正交设计优化木瓜多糖的超声提取工艺[J].安徽农业科学,2012,40(5):2618-2620.
[7] 王文平,郭祀远,李琳,等.野木瓜水溶性多糖的提取、分离及结构分析[J].华南理工大学学报(自然科学版),2008,36(7):128-133.
[8] 刘捷,王文,卢奎,等.皱皮木瓜多糖的提取及其抗氧化活性研究[J].河南工业大学学报(自然科学版),2011,30(1):48-52.
[9] 聂少平,谢明勇,申明月,等.应用高效液相色谱法测定茶叶多糖[J].食品科学,2006,27(4):178-181.
[10]PITKANEN E. Mannose, mannitol, fructose and 1, 5-anhydroglucitol concentrations measured by gas chromatography/mass spectrometry in blood plasma of diabetic patients[J]. Clinica Chimica Acta, 1996, (251):91-103.
[11]宁永成.有机化合物结构鉴定与有机波谱学[M].2版.北京:科学技术出版社,2000: 329-335.
[12]夏朝红,戴齐,房韦,等.几种多糖的红外光谱研究[J].武汉理工大学学报,2007,29(1):45-47.
[13]刘玉红,王凤山.核磁共振波谱法在多糖结构分析中的应用[J].食品与药品,2007,9(8): 39-43.
[14]王展,方积年.高场核磁共振波谱在多糖结构研究中的应用[J].分析化学,2000,28(2):240-247.
Isolation,purificationandstructuralcharacterizationofpolysaccharidesfromChaenomelesSpecious(Sweet.)Nakai
LIUJie,WANGWen,ZHANGTixiang
(CollegeofChemistry,ChemicalEngineeringandEnvironmentEngineering,HenanUniversityofTechnology,Zhengzhou450001,China)
The study on the isolation, purification, monosaccharides composition and structure of water-soluble polysaccharides from Chaenomeles Specious (Sweet.) Nakai will provide experimental foundation for the further development of chaenomeles. The refined polysaccharides CSP1 were obtained by Sevag method for de-protein, dialysis and Sephadex G-100 gel column chromatography. HPGPC, GC, UV, IR and1H-NMR were used to investigate the constituents and structrue of CSP1. Results CSP1 was homogeneous and the relative molecular weight was 27 622. The monosaccharides were Rha, Xyl, Glu and Gal, respectively, in molar ratio of 0.042∶0.067∶0.860∶0.031. There exists α-glucosidal bond in the polysaccharides, in which Glu is the main constituent.
Chaenomeles Specious (Sweet.) Nakai;polysaccharides;isolation and purification;monosaccharides composition; structure
O69
A
1674-330X(2017)04-0030-05
2017-07-19
河南工业大学博士科研基金(150049)
刘捷(1970-),女,河南郑州人,副教授,博士,研究方向为天然产物化学.
