两株水貂阿留申全基因重组核酸疫苗的免疫效果初步评估
2018-01-03孙利杰刘东旭李健明
孙利杰,刘东旭,李健明,冷 雪,时 坤,李 东,杜 锐
(1.吉林农业大学动物科学与技术学院,长春 130118; 2.吉林农业科技学院,吉林吉林 132000; 3.吉林农业大学研究生院,长春 130118)
两株水貂阿留申全基因重组核酸疫苗的免疫效果初步评估
孙利杰1,刘东旭2,李健明1,冷 雪1,时 坤1,李 东1,杜 锐3*
(1.吉林农业大学动物科学与技术学院,长春 130118; 2.吉林农业科技学院,吉林吉林 132000; 3.吉林农业大学研究生院,长春 130118)
为研究实验室构建的两株水貂阿留申重组核酸疫苗(pcDNA3.1-ADV-428和pcDNA3.1-ADV-428-487)对水貂的免疫原性,将其经肌肉注射接种到水貂体内进行免疫,免疫完成后对水貂进行攻毒,然后每隔两周对水貂进行指尖采血。应用流式细胞术检测全血中的CD8+淋巴细胞亚群,用间接ELISA法检测血清中的抗体水平,用血清蛋白电泳检测血清中γ球蛋白占总蛋白的百分比以及应用聚乙二醇沉淀比浊法检测水貂血清中抗原抗体复合物的含量,以对两株核酸疫苗的免疫效果进行初步评估。试验结果表明,pcDNA3.1-ADV-428和 pcDNA3.1-ADV-428-487的各项数据都优于对照组,且pcDNA3.1-ADV-428-487的保护效果优于pcDNA3.1-ADV-428,两种核酸疫苗都展现了良好的疫苗潜质。
水貂;阿留申病;核酸疫苗;免疫;抗原抗体复合物;γ球蛋白;淋巴细胞
核酸疫苗是将编码某种能引起保护性免疫反应的抗原基因直接导入机体内,经宿主细胞表达出抗原蛋白,诱导宿主产生全面的免疫应答,以期达到防治疾病的目的[1-3]。由于水貂阿留申病特殊的致病机理以及抗原抗体复合物的沉积作用[4]使得针对水貂阿留申病疫苗的研制一直是动物医学界难以解决的一大问题。核酸疫苗以其既能诱导宿主产生体液免疫同时也能引起宿主细胞免疫[5]的优势逐渐引起人们的重视,针对水貂阿留申病核酸疫苗的研究也越来越多。目前,水貂阿留申病疫苗的研究主要有关于ADV(Aleutian disease virus,ADV)全基因、NS1、VP2以及VP2截断序列的研究[6],这些研究虽然都表现出了一定的保护效果,但都无法完全预防水貂阿留申病。本研究以两株前期构建并已证明具有良好反应原性的核酸疫苗为实验对象,进行本体动物攻毒保护实验,研究其对水貂的免疫原性及免疫效果。
1 材料与试剂
1.1 重组真核质粒以及实验动物 重组质粒pcDNA3.1-ADV-428和pcDNA3.1-ADV-428-487为本实验室构建保存,ADV全基因切除428-446序列进行重组然后与真核表达载体pcDNA3.1(+)进行连接构建了pcDNA3.1-ADV-428。ADV全基因同时切除428-446和487-501序列后进行重组然后与真核表达载体pcDNA3.1(+)进行连接构建了pcDNA3.1-ADV-428-487。
实验动物来自黑龙江帽儿山水貂养殖场的六月龄阿留申病阴性雌貂。
1.2 主要试剂 10×红细胞裂解液购自美国BD公司;FITC标记的兔抗鼠IgG和纯化的小鼠IgG购自DAKO公司;小鼠抗牛IFN-γ干扰素购自AbD Serotec公司;固定剂、破膜剂购自北京四正柏公司;brefeldin A、inomycin、PNA、Saponin以及小鼠抗人CD8+IgG购自Sigma公司;RPMI 1640液体培养基、胎牛血清购自Hyclone公司;氨基黑10B购自上海源叶生物。
2 方 法
2.1 实验动物的分组、免疫与攻毒 将经检验无水貂阿留申病的六月龄雌性水貂随机分成5组,每组3只。分别为A:pcDNA3.1-ADV-428组;B:pcDNA3.1-ADV-428-487组;C:灭活苗组;D:空载体组;E:PBS组。两周后,对水貂进行免疫。A、B两实验组分别取相对应的质粒进行4~5位点的大腿内侧肌肉注射(533 μg/只)3~4位点的低脊背肌肉注射(267 μg/只),C组取灭活苗与等体积的铝胶佐剂混合后,大腿内侧肌肉注射(500 μL/只),所用灭活苗为实验室制备,D组取空载体pcDNA3.1(+)质粒进行4~5位点的大腿内侧肌肉注射(533 μg/只)3~4位点的低脊背肌肉注射(267 μg/只),E组取PBS大腿内侧肌肉注射(500 μL/只),共免疫3次,每次间隔3周。
在最后一次免疫1个月后对水貂进行攻毒,每只水貂腹腔注射105.0TCID50的水貂阿留申病强毒株ADV-DL125。攻毒后每2周对水貂进行指尖采血,收集各组水貂的全血和血清样本。
2.2 水貂血清中抗ADV抗体的检测 采用间接ELISA法检测各组水貂体内的抗体水平,以ADV病毒包被,HRP标记兔抗水貂IgG作为二抗。
2.3 水貂血清中抗原抗体复合物的检测 按照籍玉林等[7]建立的聚乙二醇沉淀比浊法检测水貂血清中抗原抗体复合物的含量。
将水貂血清稀释30倍,取酶标板每只水貂样本取两孔,1孔加203 μL硼酸盐缓冲液,2孔加203 μL PBS,两孔各加7 μL血清。4 ℃作用1 h,室温30 min。450 nm下读数。1孔的值减去2孔的值即为该水貂血清中抗原抗体复合物的含量。
2.4 水貂血清中γ球蛋白含量检测 将醋酸纤维素膜切成8×2 cm的长条浸于巴比妥缓冲液中完全浸透,用滤纸吸去多余液体,于无光面1.5 cm处呈线状点样,血清渗入膜内后,将薄膜搭于滤纸桥上。点样面朝下,点样端靠近负极。电压90~120 V,电流0.4~0.6 mA/Cm通电45~60 min,直至电泳带展开25~35 mm。将薄膜浸于染色液中,5~10 min后取出用漂洗液漂洗数次,至背景无色。将洗完的薄膜用滤纸吸干,剪下各蛋白带,分别浸于4 mL 0.4 mol/L NaOH溶液中,振摇数次,于580~620 nm波长处测各光密度值。蛋白带(由正极到负极)依次为A、α1、α2、β、γ。光密度综合为T=A+α1+α2+β+γ,γ球蛋白(%)=γ/T×100%。
2.5 外周血CD8+T淋巴细胞亚群检测 取500 μL新鲜抗凝血加入5 mL 10倍稀释的红细胞裂解液,37 ℃作用10 min,1000 r离心5 min,弃去上层红色液体,用含有10%血清的 RPMI1640营养液吹吸沉淀,洗涤1~2次,进行细胞计数。取经计数的淋巴细胞2×106个,用含0.2%血清及0.02%叠氮钠的PBS(FACS)洗涤两次,每次800 g离心5 min。用100 mL FACS重悬后每管加入5 μL 10倍稀释的鼠抗人CD8+抗体,4 ℃孵育1 h,以小鼠纯化IgG为同型对照。800 g离心5 min,用FACS洗涤两次。用100 μL FACS重悬后每管加入10 μL 10倍稀释的FITC标记兔抗鼠抗体,4 ℃孵育1 h。用FACS洗涤2次后,加入300 μL FACS吹打混匀过膜,经流式细胞仪读数。
3 结 果
3.1 水貂血清中抗ADV抗体检测 图1为不同时间段各组水貂血清中的抗体水平,攻毒当天各组血清中抗体水平都比较低,而且pcDNA3.1-ADV-428组、pcDNA3.1-ADV-428-487组和灭活苗组抗体水平都比两个对照组高。随着时间增加各组水貂血清中的抗体水平都显著增长,且灭活苗组的抗体水平一直高于其他组。在第24周之前pcDNA3.1-ADV-428组、pcDNA3.1-ADV-428-487组的抗体水平一直高于空载体组和PBS组,从24周开始两对照组的抗体水平超过两实验组。
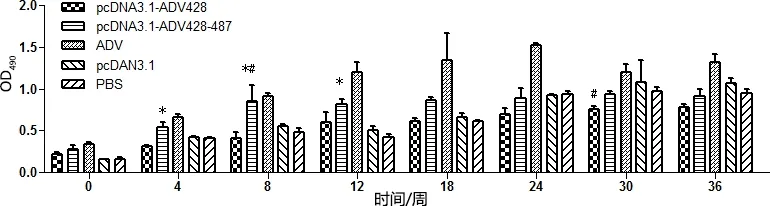
*表示与PBS组相比差异显著(P<0.05),**表示与PBS组差异极显著(P<0.01)。#表示与pcDNA3.1空载体组相比差异显著(P<0.05),##表示与pcDNA3.1空载体组相比差异极显著(P<0.01)*Express the difference was significant compared with the PBS group(P<0.05),** Express the difference was extremely significant compared with the PBS group(P<0.01). # Express the difference was significant compared with the pcDNA3.1 null carrier group(P<0.05), ## Express the difference was extremely significant compared with the pcDNA3.1 null carrier group(P<0.01)图1 水貂抗体水平变化Fig 1 The level of antibody in the serum from the mink change test
3.2 水貂血清中抗原抗体复合物的检测 图2为各组水貂血清中抗原抗体复合物的含量变化,攻毒当天各组水貂血清中的抗原抗体复合物的含量都比较低且灭活苗组明显高于其他组。从第8周开始灭活苗组、空载体组、PBS组的抗原抗体复合物含量开始显著升高,而pcDNA3.1-ADV-428组、pcDNA3.1-ADV-428-487组一直处于缓慢增长的趋势且30周之前含量一直未超过0.3。
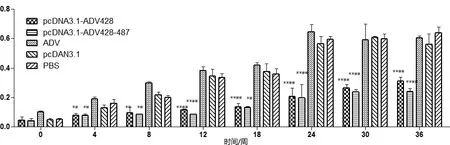
*表示与PBS组相比差异显著(P<0.05),**表示与PBS组差异极显著(P<0.01)。#表示与pcDNA3.1空载体组相比差异显著(P<0.05),##表示与pcDNA3.1空载体组相比差异极显著(P<0.01)*Express the difference was significant compared with the PBS group(P<0.05),** Express the difference was extremely significant compared with the PBS group(P<0.01).# Express the difference was significant compared with the pcDNA3.1 null carrier group(P<0.05),## Express the difference was extremely significant compared with the pcDNA3.1 null carrier group(P<0.01)图2 水貂血清中抗原抗体复合物含量变化Fig 2 The result of CIC in the serum from the mink change test
3.3 水貂血清中γ球蛋白含量检测 图3为各组水貂血清中γ球蛋白的含量变化,免疫后各组水貂血清中的γ球蛋白初始含量均在10%左右,随着攻毒时间增长各组γ球蛋白含量也随之增长。灭活苗组、空载体组和PBS组水貂血清中的γ球蛋白含量在第8周开始显著增长且在第18周三组的γ球蛋白的含量均超过了40%。而pcDNA3.1-ADV-428组和pcDNA3.1-ADV-428-487组水貂血清中的γ球蛋白含量一直未超过40%。

*表示与PBS组相比差异显著(P<0.05),**表示与PBS组差异极显著(P<0.01)。#表示与pcDNA3.1空载体组相比差异显著(P<0.05),##表示与pcDNA3.1空载体组相比差异极显著(P<0.01)*Express the difference was significant compared with the PBS group(P<0.05),** Express the difference was extremely significant compared with the PBS group(P<0.01). # Express the difference was significant compared with the pcDNA3.1 null carrier group(P<0.05),## Express the difference was extremely significant compared with the pcDNA3.1 null carrier group(P<0.01)图3 水貂血清中γ球蛋白含量变化Fig 3 The level of γ globulin in the serum from the mink change test
3.4 外周血CD8+T淋巴细胞亚群检测 结果如图4所示,攻毒当天各组水貂血清中的CD8+T淋巴细胞均在20%左右,从第4周开始各组CD8+细胞含量显著升高,到第12周为止各组一直处于增长趋势。第18周往后各组CD8+细胞含量呈缓慢下降趋势。在24周之前pcDNA3.1-ADV-428组和pcDNA3.1-ADV-428-487组中的CD8+细胞含量一直低于其他三组。

*表示与PBS组相比差异显著(P<0.05),**表示与PBS组差异极显著(P<0.01)。#表示与pcDNA3.1空载体组相比差异显著(P<0.05),##表示与pcDNA3.1空载体组相比差异极显著(P<0.01)*Express the difference was significant compared with the PBS group(P<0.05),** Express the difference was extremely significant compared with the PBS group(P<0.01).# Express the difference was significant compared with the pcDNA3.1 null carrier group(P<0.05),## Express the difference was extremely significant compared with the pcDNA3.1 null carrier group(P<0.01)图4 水貂外周血CD8+ T淋巴细胞亚群含量变化Fig 4 The quantification of CD8+ cells in PBMC from the mink change test
4 讨论与总结
水貂阿留申病是由水貂阿留申病毒引起的一种慢性的淋巴增殖性疾病[8],病毒破坏水貂机体免疫系统,降低水貂抵抗力[9]。水貂机体在感染ADV后产生的大量非中和抗体并不能中和病毒,反而与病毒结合形成抗原抗体复合物[10],抗原抗体复合物随血液在机体内循环到达肾小球壁和动脉壁进行沉积引起水貂的动脉炎和肾小球肾炎[11]。目前,尚无可以有效防治水貂阿留申病的疫苗,该病的防治只能采用定期检疫及时处死病貂的手段[12]。
水貂在感染水貂阿留申病毒后,体内的CD8+T淋巴细胞的含量显著升高[13];同时血清中γ球蛋白的含量也会急剧增加[14],感染后γ球蛋白占总蛋白的百分比往往会超过40%。所以检测CD8+淋巴细胞和γ球蛋白的含量是判定水貂是否感染阿留申病的重要指标。除此以外考虑到抗原抗体复合物在水貂机体内所引起的特殊反应,本实验所使用的核酸疫苗在构建时切除了疑似介导抗原抗体复合物产生的位点(428~446位点)[15],所以对攻毒后水貂血清中的抗原抗体复合物含量也进行了检测,期望更全面的的评估所构建疫苗的防治效果。
从结果中我们可以看出,在水貂攻毒第0周pcDNA3.1-ADV-428组和pcDNA3.1-ADV-428-487组的水貂均已产生了抗体且含量都比空载体组和PBS组高,说明两种核酸疫苗均能引起水貂的免疫反应,且随着攻毒时间的增长抗体水平一直在稳步提高;在抗原抗体复合物的检测中,pcDNA3.1-ADV-428组和pcDNA3.1-ADV-428-487组的水貂血清中的抗原抗体复合物的含量一直低于其他三组,且增长的趋势比较缓慢,而且pcDNA3.1-ADV-428-487组的含量一直略低于pcDNA3.1-ADV-428组,说明核酸疫苗pcDNA3.1-ADV-428和pcDNA3.1-ADV-428-487对抗原抗体复合物的形成有一定抑制作用;血清中γ球蛋白的检测结果显示,在攻毒当天五组水貂的γ球蛋白含量均在正常水平10%左右,随着时间增长灭活苗组、空载体组和PBS组最终γ球蛋白所占比例均超过了40%,而两核酸疫苗组一直维持在40%以下且pcDNA3.1-ADV-428-487组的含量一直略低于pcDNA3.1-ADV-428组,说明两种核酸疫苗对水貂起到了一定的保护作用;CD8+淋巴细胞的检测中,各组CD8+淋巴细胞的含量都随着攻毒时间的增加而增加,在第24周之前pcDNA3.1-ADV-428组和pcDNA3.1-ADV-428-487组的CD8+淋巴细胞的含量一直低于其他三组,但是在24周之后pcDNA3.1-ADV-428和pcDNA3.1-ADV-428-487两组的CD8+淋巴细胞含量开始略高于空载体组和PBS组。
总而言之,pcDNA3.1-ADV-428和pcDNA3.1-ADV-428-487两种核酸疫苗,都对水貂有一定的保护力,展现了良好的疫苗潜质,且pcDNA3.1-ADV-428-487还要优于pcDNA3.1-ADV-428,但是通过以上实验分析还不能全面的评价两种核酸疫苗的保护效果,还需要进一步的实验进行分析。
[1] 王 凯. 动物核酸疫苗的研究现状及发展前景[J]. 中国畜牧兽医, 2010, 37(8):186-188.
Wang K. Animal nucleic acid vaccine research status and prospects for development[J]. Chinese Animal Husbandry and Veterinary Medicine,2010,37(8):186-188.
[2] 邱春红,陈开廷,王永堂,等. 核酸疫苗的安全性及其优化策略研究[J].生命科学,2013,9:858-864.
Qiu C H, Chen K T, Wang Y T,etal. The research on safety of DNA vaccine and its optimization[J]. Chinese Bulletin of Life Sciences, 2013,9:858-864.
[3] 李月涛,霍金龙,信吉阁,等. 核酸疫苗的研究及应用进展[J]. 生物技术通报, 2006(4):1-5.
Li Y T, Huo J L, Xin J G,etal. Progress on application and research of nucleic Acid vaccine[J], Biotechnology Bulletin, 2006(4):1-5.
[4] Dyer N W, Ching B, Bloom M E. Nonsuppurative meningoen-cephalitis associated with Aleutian mink disease parvovirus in-fection in ranch mink[J].Journal of Veterinary Diagnostic In-vestigation,2000,12(2):159-162.
[5] 温建新,王金宝. 核酸疫苗的应用研究进展[J]. 动物医学进展,2005,7:40-44.
Wen J X, Wang J B, Progress on the application of nucleic acid vaccine[J]. Progress in Veterinary Medicine, 2005,7:40-44.
[6] Castelruiz Y, Blixenkrone-Møller M, Aasted B. DNA vaccination with the Aleutian mink disease virus NS1 gene confers partial protection against disease[J]. Vaccine, 2005, 23(10):1225-1231.
[7] 籍玉林,曲维江,赵元楷,等. 应用聚乙二醇沉淀比浊法检测水貂血清中循环免疫复合物的研究[J]. 特产研究, 1994, 2: 1-4.
Ji Y L, Qu W J, Zhao Y K,etal. Research of detecting circu ̄lating immune complexes in mink serum with polyethylene glycol[J].Special Wild Economic Animal and Plant Research,1994, 2: 1-4.
[8] 郑 全,王树志,王全凯. 水貂阿留申病研究进展[J]. 经济动物学报, 2006, 6(4):49-52.
Zheng Q, Wang S Z, Wang Q K. Advance of mink aleutian disease[J]. Journal of Economic Animal, 2006, 6(4):49-52.
[9] Aivi Leimann, Anna Knuuttila, Tiit Maran,etal. Molecular epidemiology of Aleutian mink disease virus (AMDV) in Estonia, and a global phylogeny of AMDV[J]. Virus Research, 2015,11:56-61.
[10] Porter D D, Larsen A E, PorterH G.Aleutian disease of mink[J].Advances in Immunology,1980,29(5):261-262.
[11] Alex S, BloomM E, Wolfinbarger J. Evidence of restricted viral replication in adult mink infected with Aleutian disease of mink parvovirus[J].J Virol,1988,62(5):1495-1507.
[12] 曾祥伟,华育平,梁冬莹. 水貂阿留申病毒VP2蛋白主要抗原表位基因原核表达及其检测应用[J]. 微生物学报, 2007, 47(6): 1088-1090.
Zeng X W, Hua Y P, Liang D Y. Prokaryotic expression and detective application of the main antigenic region of VP2 protein of Aleutian mink disease parvovirus[J]. Acta Microbiologica Sinica, 2007, 47(6): 1088-1090.
[13] Aasted B. Mink infected with Aleutian disease virus have an elevated level of CD8-positive T-lymphocytes[J]. Veterinary Immunology & Immunopathology, 1989, 20(4):375-385.
[14] Castelruiz Y, Blixenkronemøller M, Aasted B. DNA vaccination with the Aleutian mink disease virus NS1 gene confers partial protection against disease[J]. Vaccine, 2005, 23(10):1225.
[15] Bloom M E, Best S M, Hayes S F,etal. Identification of Aleutian mink disease parvovirus capsid sequences mediating antibody-dependent enhancement of infection, virus neutralization, and immune complex formation[J]. Journal of Virology, 2001, 75(22):23-29.
PreliminaryImmuneEffectEvaluationofTwoADVRecombinantDNAVaccines
SUN Li-jie1, LIU Dong-xu2, LI Jian-ming1, LENG Xue1, SHI Kun1, LI Dong1, DU Rui3*
(1.CollegeofAnimalScienceandTechnology,JilinAgriculturalUniversity,Changchun130118,China;2.JilinAgricultureScienceandTechnologyCollege,Jilin132000,China;3.GraduateSchoolofJilinAgriculturalUniversity,Changchun130118,China
DURui,E-mail:durui197107@sina.com
In this study, recombinant DNA two nucleic acid vaccines constructed by intramuscular inoculation to mink body immune(pcDNA3.1-ADV-428 and pcDNA3.1-ADV-428-487). Mink were challenged experiment when after the completion of immunization, then every two weeks for blood collection of mink fingertips. The whole blood CD8+lymphocyte subsets detection by flow cytometry; detection of antibody levels in serum by indirect ELISA; serum protein electrophoresis was used to detect the γ globulin percentage of total protein in serum and the application of polyethylene glycol precipitation determination of antigen antibody complexes in serum of mink, the immunogenicity of two nucleic acid vaccines was evaluated preliminarily. The experimental results showed that the data of pcDNA3.1-ADV-428 and pcDNA3.1-ADV-428-487 were better than those of the control group, the protective effect of pcDNA3.1-ADV-428-487 was better than that of pcDNA3.1-ADV-428, two nucleic acid vaccines had shown good vaccine potential.
mink Aleutian disease;nucleic acid vaccine;immunization;antigen antibody complex;γ globulin;lymphocyte
10.11751/ISSN.1002-1280.2017.12.01
2017-03-07
A
1002-1280 (2017) 12-0001-06
S859.797
国家自然基金(31372436);吉林省科技厅科技支撑计划(20160209006YY)
孙利杰,硕士研究生,从事经济动物疫病的研究。
杜 锐。E-mail:durui197107@sina.com
(编辑:李文平)
