越冬白蜡虫微生物多样性分析
2018-01-02王雪庆赵遵岭于淑慧
孙 涛,王雪庆,赵遵岭,于淑慧,杨 璞
(中国林业科学研究院资源昆虫研究所,国家林业局资源昆虫培育与利用重点实验室,云南 昆明 650224)
越冬白蜡虫微生物多样性分析
孙 涛,王雪庆,赵遵岭,于淑慧,杨 璞*
(中国林业科学研究院资源昆虫研究所,国家林业局资源昆虫培育与利用重点实验室,云南 昆明 650224)
目的了解白蜡虫越冬时体内微生物的多样性,比较昆明与长春越冬虫体内微生物种类和数量的差异,为了解白蜡虫低温适应机制提供有用信息。方法采用Miseq高通量测序方法对昆明越冬雌成虫(KM)和长春越冬雌成虫(CC)体内细菌16s rRNA及真菌ITS基因进行测序,利用Usearch 软件进行细菌和真菌OTU(Operational Taxonomic Unit)划分,并利用Mothur软件对OTU进行分类学分析和多样性指数分析。结果细菌KM和CC样品中共得到344个OTU,真菌KM和CC样品中共得到230个OTU。细菌共鉴定到15门、137属,在KM中乳球菌属占主要比例(29.78%),而在CC中立克次氏体占主要比例(55.77%),真菌中共鉴定到6门、83属,在KM中仅鉴定到41个属,而CC中鉴定到75个属,其中线虫草科无法归类的属在2个样品中均为优势菌群,但CC中含量远低于KM。结论昆明与长春越冬虫体内细菌及真菌种类和数量均不相同,与昆明越冬虫不同,需要应对极端低温的长春越冬虫体内立克次氏体为优势菌群。
白蜡虫;群落组成;越冬虫;Miseq测序;立克次氏体
白蜡虫(EriceruspelaChavannes)是我国传统的资源昆虫,其2龄雄幼虫分泌的白蜡具有重要的经济价值,被广泛应用于医药、食品、航天等领域[1-2]。白蜡虫分布广泛,在我国其自然种群主要分布在18°N到42°N地区[3]。李健等在最冷月日均最低气温-18.0℃的吉林省四平市发现白蜡虫依然能够生长发育繁衍后代[4],说明白蜡虫对极端低温环境具有很强的适应能力。白蜡虫以雌成虫虫态越冬,对白蜡虫越冬过程中生理状态等方面的研究将有助于了解其低温适应机制,并对扩大白蜡产区具有参考意义。
共生微生物在昆虫生长发育、繁衍进化以及环境适应等方面具有重要作用。例如,在对美洲大蠊(PeriplanetaAmericanaL.)内共生菌的研究中发现其共生菌中含有可抑制病原细菌生长的共生菌,并且存在着能够降解多糖的真菌[5]。研究发现豌豆蚜(AcyrthosiphonpisumHarris)的共生菌布赫纳氏菌属(Buchnera)能够帮助其抵御极端温度[6]。研究表明共生真菌也具有抵御极端温度侵害的作用,如在对德州切叶蚁(AttatexanaBuckley)进行研究时发现,其所携带的Attamyces共生菌株能够帮助切叶蚁抵御低温侵害提高适应性[7]。在对白蜡虫低温适应机制的研究中,发现长春和昆明越冬虫在代谢等方面存在很多差异[8-9],我们推测白蜡虫内共生微生物也可能在越冬以及抵御极端低温过程中具有重要作用。
本研究将对白蜡虫越冬虫态体内共生微生物进行16s rRNA和ITS基因高通量测序,研究白蜡虫越冬过程体内微生物多样性,并将昆明与长春越冬雌成虫体内微生物进行比较分析,以了解在极端低温条件下越冬雌成虫体内微生物种类及数量的变化,分析微生物和白蜡虫越冬及抗冻可能的相关性。
1 材料和方法
1.1 试验材料
所用白蜡虫分别为昆明和长春越冬雌成虫。昆明越冬雌成虫(KM)采自云南昆明(102.73°E;25.04°N);长春越冬雌成虫(CC)采自于吉林省长春市(125.32°E;43.90°N)。采集时将白蜡虫从女贞树上迅速剥离放入液氮中储存。
1.2 越冬雌成虫内微生物总DNA提取
按照DNeasy Blood & Tissue Kit试剂盒(QIAGEN, Germany)方法提取越冬雌成虫内微生物总DNA,将提取出的微生物总DNA进行1%的琼脂糖凝胶电泳检测,并用超微量紫外分光光度计(Thermo, 美国)测定DNA浓度。将抽提后的总DNA置于-20℃保存。
1.3 PCR扩增白蜡虫越冬雌成虫微生物的16S和ITS基因
以提取的越冬雌成虫内微生物总DNA为模板,使用通用引物338F和806R扩增细菌16s rRNA基因片段[10],使用通用引物1737 F和2043 R扩增真菌ITS基因片段[11]。PCR扩增体系如下:总DNA 0.4 μL、上下游引物各0.4 μL、5×FastPfu Buffer 4 μL、2.5 mmol·L-1dNTPs 2 μL、FastPfu Polymerase(TaKaRa, 日本) 0.4 μL以及双蒸无菌水10.3 μL。扩增程序为:94℃预变性4 min;94℃变性30 s,55℃退火30 s,72℃延伸45 s,28个循环;72℃延伸10 min。
将PCR产物进行1%的琼脂糖凝胶电泳检测,使用Axygen DNA胶回收试剂盒(Axygen, 美国)进行回收。回收产物使用QuantiFluorTM-ST定量系统(Promega, 美国)定量,按照上机测序要求跟据测序量计算样本上机量。
1.4 Miseq测序
首先将“Y”字形接头连接到片段上,通过磁珠筛选将接头自连片段剔除,然后利用PCR技术扩增已加入“Y”字形接头的目的片段,经氢氧化钠变性后得到单链DNA片段上机测序文库。使用Illumina MiSeq(Illumina, 美国)测序仪对获得的上机测序文库进行测序分析。
1.5 Miseq测序结果数据分析
根据reads的重叠关系,使用FLASH软件(Version 3+;http://gnu.org/licenses/gpl.html)将Miseq双端测序得到的序列拼接得到一条序列,同时对reads质量以及拼接效果进行质控和有效数据的过滤,将接头和无重复单序列剔除获得有效序列。利用Usearch 软件 (Vsesion 7.1;http://drive5.com/uparse/)在97%相似度水平下对有效序列进行OTU(Operational Taxonomic Unit)划分,并将聚类过程中产生的嵌合体剔除。
根据OTU划分结果,利用RDP Classifier软件(Version2.2;http://sourceforge.net/projects/rdp-classifier/)进行分类学分析,在域、界、门、纲、目、科、属、种等不同分类阶元统计其群落组成。利用Mothur软件(Version v.1.30.1;http://www.mothur.org/wiki/Schloss_SOP#Alpha_diversity)进行Chao(Chao指数)、Ace(Ace指数)、Shannon(香农指数)以及Simpson(辛普森指数)等多样性指数分析,其中,Ace指数和Chao指数代表了群落的丰富程度,香农指数和辛普森指数表明了群落多样性,同时辛普森指数也可以呈现优势种的集中程度。
利用Mothur软件 (Version v.1.30.1;http://www.mothur.org/wiki) 和R 软件进行稀释曲线(rarefaction curve)和Shannon-Wiener曲线(Shannon-Wienercurve)分析,其中,稀释曲线用于比较测序数量不同的样本中物种的丰富程度,而Shannon-Wiener曲线则用于反映各样本在不同测序量时的微生物多样性。除此之外两种曲线均被用于说明样本测序数量的合理性。
2 结果
2.1 OTU数目统计
细菌16S rRNA:KM内共检测到12 538条reads,CC内共检测到27 575条reads;真菌ITS:KM内共检测到14 483条reads, CC内共检测到21 650条reads。KM和CC两个样品细菌一共检测到344个OTU:包含KM 177个和CC 167个;真菌共有230个OTU:包含KM 168个和CC 62个。
KM和CC的细菌、真菌稀释曲线均趋于平坦(图1:A,B),继续增加测序量将不会产生更多的OTU,说明数据量合理可以用于其他分析。同时,Shannon-Wiener曲线也均趋于平坦(图1:C,D),进一步说明数据量足够大,可以反映样本中绝大部分微生物信息。
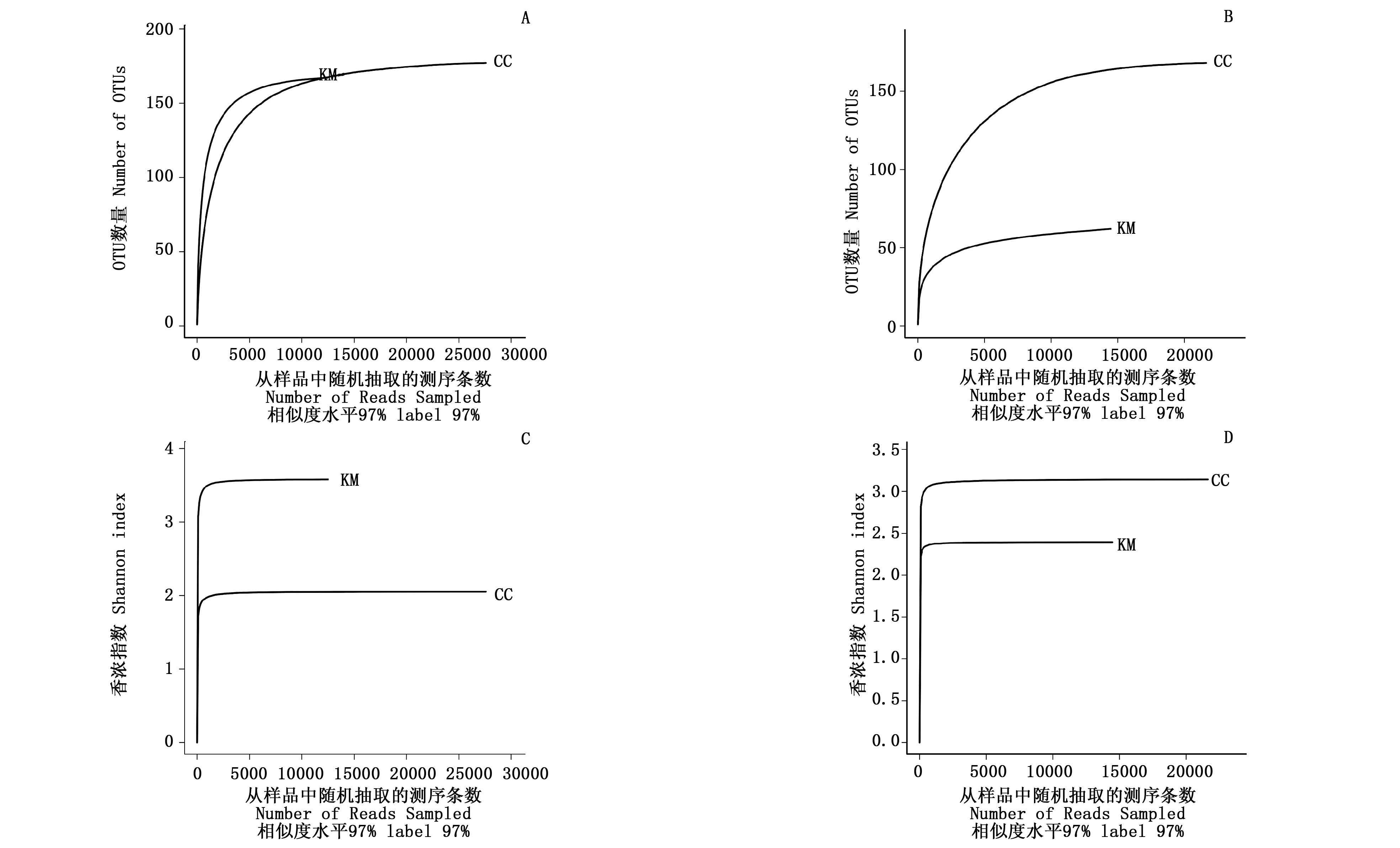
图1 KM和CC稀释曲线及Shannon-Wiener曲线Fig. 1 Rarefaction curve and Shannon-Wiener curve of KM and CCA:细菌稀释曲线Rarefaction curve of bacteria;B:真菌稀释曲线Rarefaction curve of bacteria fungi;C:细菌Shannon-Wiener曲线Shannon-Wiener curve of bacteria;D:真菌Shannon-Wiener曲线Shannon-Wiener curve of fungi
2.2 昆明长春越冬雌成虫内细菌种类及变化
基于Miseq测序结果,在细菌中共鉴定到15门28纲54目84科137属。
鉴定到的门水平中主要有:变形菌门、厚壁菌门、拟杆菌门、放线菌门,这4个门的总和在KM和CC中分别占98.29%和98.86%,是越冬雌成虫内细菌的主要成分,其中变形菌门在越冬雌成虫内细菌中占主要比例。将KM和CC中这4个门所占比例进行对比后发现,除了变形菌门从41.57%(KM)升高至72.25%(CC),其它3个门在CC中所占比例均下降(图2:A)。
在KM中共鉴定到115个属细菌,其中乳球菌属(Lactococcus)占主要比例(29.78%),其次为假单胞菌属(Pseudomonas)占15.05%、鞘氨醇单胞菌属(Sphingomonas)占5.38%、薄层菌属(Hymenobacter)占5.31%。而在CC中共鉴定到125个属细菌,其中立克次氏体(Rickettsia)占主要比例(55.77%),其次为乳球菌属(Lactococcus)占17.96%、假单胞菌属(Pseudomonas)占8.09%。对比KM与CC发现,占主要比例的菌属发生了改变,KM中的大多数较高丰度的菌属在CC中所占比例较低(图2:B),立克次氏体在KM中仅占0.03%。
2.3 昆明长春越冬雌成虫内真菌种类及变化
基于Miseq测序结果,在真菌中共鉴定到6门20纲35目46科83属。
鉴定到的门水平中主要有:子囊菌门、担子菌门,这2个门的总和在KM和CC中分别占90.42%和99.37%,其中子囊菌门在越冬雌成虫内真菌中占比最高,为78.45% (图2:C)。
在KM中仅鉴定到41个属真菌,其中线虫草科无法归类的属(unclassified Ophiocordycipitaceae)占主要比例(31.06%),其次为微座孢属(Microstroma)占13.96%、红酵母属(Rhodotorula)占13.14%、茎点霉属(Phoma)占10.38%、横断孢属(Strelitziana)占8.45%、枝孢霉属(Cladosporium)占5.26%。而在CC中共鉴定到75个属真菌,其中线虫草科无法归类的属(unclassified Ophiocordycipitaceae)占主要比例(14.75%),其次为枝氯霉属(Ramichloridium)占15.76%、枝孢霉属(Cladosporium)占9.11%、茎点霉属(Phoma)占9.03%。对比KM与CC发现,线虫草科无法归类的属、微座孢属、红酵母属等菌属在CC所占比例低于KM,但CC中枝孢霉属所占比例高于KM,而且新鉴定到了诸如枝氯霉属等34个菌属(图2:D)。

图2 KM和CC微生物群落组成 此图为文章证据材料,根据占比多少不同已在文中有说明Fig. 2 Composition of microorganism communities in the KM and CCA:KM和CC细菌门水平群落组成Composition of bacterial communities at the phylum;B:KM和CC细菌属水平群落组成Composition of bacterial communities at the genus;C:KM和CC真菌门水平群落组成Composition of fungal communities at the phylum;D:KM和CC真菌属水平群落组成Composition of fungal communities at the genus
2.4 昆明长春越冬雌成虫内细菌和真菌多样性分析
在两细菌样本中,CC的Ace指数和Chao指数均稍高于KM,表明在CC细菌群落中其群落丰富度相对高于KM;CC的香农指数低于KM,而辛普森指数高于KM,表明其群落多样性相对低于KM,辛普森指数高于KM同时也反映了CC优势种的集中程度要高于KM(表1)。
在两真菌样品中,CC的Ace指数、Chao指数和香农指数均高于KM,表明在CC真菌群落中其群落丰富度以及多样性相对高于KM,而辛普森指数低于KM,说明CC优势种的集中程度要低于KM(表1)。

表1 KM和CC内细菌和真菌多样性指数分析
3 讨论
昆虫在生理上主要是通过调节含水量、控制冰核物质、改变代谢途径以及积累抗冻蛋白等耐寒物质来提高自身适应能力降低低温伤害[12]。许多研究发现,微生物在昆虫适应低温等不良环境胁迫时起到了重要作用[6-7,12-13]。前期在对白蜡虫耐寒性的研究中,已经鉴定到了抗冻蛋白候选基因并对其中部分基因进行了功能验证[8]。本研究基于Miseq高通量测序技术对白蜡虫越冬雌成虫体内微生物进行研究。
对比昆明长春白蜡虫越冬雌成虫体内微生物种类和数量发现,无论是细菌还是真菌都发生了很大的变化,群落丰富度相对提高,尤其是真菌样品,研究发现有34个属在CC中被鉴定到而KM中没有。
在昆明长春白蜡虫越冬雌成虫体内均鉴定到了立克次氏体,并且其在长春样品CC中所占比例高达55.77%。立克次氏体能够广泛侵染植物、脊椎动物以及无脊椎动物等。立克次氏体在昆虫营养、对环境适应性等方面起到了一定的积极作用[14]。在Chen等2000年的研究中发现立克次氏体能够在不适宜温度条件下提高豌豆蚜繁殖能力[15],在对烟粉虱(BemisiatabaciGennadius)中立克次氏体的研究中发现立克次氏体能够提高寄主对于极端温度的耐受能力[16]。在对白蜡虫立克次氏体的研究中发现 ,自然环境下并不是所有白蜡虫都被立克次氏体寄生[17],但是本研究的样品KM和CC中均检测到立克次氏体的存在,而且长春样品CC中所占比例很高,因此推测可能是和立克次氏体能够提高寄主对环境适应性的特点有关。
假单胞菌属是目前国内外研究发现的具有生物冰核活性的细菌属,其可以通过诱导结冰降低寄主体温[18]。研究发现,一些昆虫能够在其受到低温胁迫时将具有生物冰核活性的物质排出体外,降低自身过冷却点,抵御极端低温的侵害[19]。从昆明长春白蜡虫越冬雌成虫体内微生物高通量测序结果中,我们发现相比昆明越冬雌成虫样品KM,假单胞菌属在CC中所占比例降低,可能是白蜡虫为了适应更低的温度环境,很可能将这些具有生物冰核活性的假单胞菌从自身排出,以降低过冷却点。
除了寄主体内细菌具有提高寄主对于不良环境的耐受能力,有的真菌也具有这种特征[7]。在对松树蜂(SirexnoctilioFabricius)与其共生真菌关系的研究中发现,其共生真菌能够协助松树蜂卵抵御不良环境保障其成功孵化[20]。基于本研究高通量测序结果,有34个真菌属只在CC中出现,可能是受KM和CC所处地理位置以及环境条件不同影响越冬雌成虫生理和代谢状态改变所致。对于KM和CC内真菌的差异是否与极端低温环境有关,还需要进一步研究。
4 结论
基于Miseq高通量测序结果,我们发现长春和昆明越冬雌成虫体内微生物存在显著差异,在对长春越冬雌成虫微生物检测中发现,有很多能够协助昆虫适应不利环境因素的微生物种群相比昆明样品变化很大,诸如立克次氏体、假单胞菌属等。
[1] Yang P, Chen X M, Liu W W,etal.Transcriptome analysis of sexually dimorphic Chinese white wax scale insects reveals key differences in developmental programs and transcription factor expression[J].Scientific Reports,2015 (5):8141.
[2] 孙 涛,王雪庆,赵遵岭,等.白蜡虫热激蛋白序列分析[J].林业科学研究, 2016,29(5):778-783.
[3] 张长海.白蜡虫在我国的地理分布[J].林业科学研究, 1991, 4(2):192-196.
[4] 李 健,张喜俭,程玉林,等.白蜡虫生物学特性及防治对策[J].吉林农业:学术版,2010(8):170-170.
[5] 阮传清,刘 波,吴珍泉,等.美洲大蠊内生菌的分离鉴定及酶活性、抑菌作用测定[J].微生物学杂志,2015,35(5):36-42.
[6] Dunbar H E,Wilson A C,Ferguson N R,etal.Aphid thermal tolerance is governed by a point mutation in bacterial symbionts[J] .Plos Biology,2007,5(5):e96
[7] Mueller U G,Mikheyev A S,Hong E,etal.Evolution of cold-tolerant fungal symbionts permits winter fungiculture by leafcutter ants at the northern frontier of a tropical ant-fungus symbiosis[J].Proceedings of the National Academy of Sciences,2011,108(10):4053-4056.
[8] 杨 璞,陈晓鸣,谢正华,等.白蜡虫不同虫态及不同地理种群越冬雌成虫过冷却点的研究[J].林业科学研究,2011,24(5):585-590.
[9] Yu S H,Yang Pu,Sun T,etal.Transcriptomic and proteomic analyses on the supercooling ability and mining of antifreeze proteins of the Chinese white wax scale insect[J].Insect Science,2016,23(3):430-437.
[10] Xu N,Tan G,Wang H,etal.Effect of biochar additions to soil on nitrogen leaching,microbial biomass and bacterial community structure[J].European Journal of Soil Biology,2016,74:1-8.
[11] Bokulich N A,Mills D A.Improved internal transcribed spacer (ITS) primer selection enables quantitative, ultra-high-throughput fungal community profiling[J].Applied & Environmental Microbiology,2013,79(8):2519-2526.
[12] 冯宇倩,王锦林,宗世祥.昆虫越冬虫态及耐寒策略概述[J].中国农学通报,2014,30(9):22-25.
[13] 马巨法,程家安.冰核活性微生物对昆虫耐寒性的影响[J].植物保护,1996,22(2):35-38.
[14] 梁士可,王方海.稻飞虱共生菌的研究进展[C]. 第十七次全国环境微生物学学术研讨会.2014.
[15] Chen D Q,Montllor C B,Purcell A H.Fitness effects of two facultative endosymbiotic bacteria on the pea aphid,Acyrthosiphon pisum,and the blue alfalfa aphid,A. kondoi[J].Entomologia Experimentalis Et Applicata,2000,95(3):315-323.
[16] Brumin M,Kontsedalov S,Ghanim M. Rickettsia,influences thermotolerance in the whitefly Bemisia tabaci, B biotype[J].Insect Science,2011,18(1):57-66.
[17] 刘魏魏,杨 璞,阮永明,等.白蜡虫体内杀雄菌属(Arsenophonus)共生菌的分子检测[J].微生物学报,2012,52(8):1002-1010.
[18] 杜鹏瑞,杜 睿,路则栋,等.西藏那曲地区夏季降水中生物冰核的分布特征[J].中国环境科学,2015,35(7):1998-2006.
[19] Zachariassen&Amp K E,Husby J A.Antifreeze effect of thermal hysteresis agents protects highly supercooled insects[J]. Nature,1982,298(5877):865-867.
[20]李大鹏,石 娟,骆有庆.松树蜂与其共生真菌的互利共生关系[J].昆虫学报,2015,58(9):1019-1029.
MicroorganismDiversityAnalysisofOverwinteringChineseWhiteWaxScaleInsect
SUNTao,WANGXue-qing,ZHAOZun-ling,YUShu-hui,YANGPu
(Research Institute of Resources Insects, Chinese Academy of Forestry, Key Laboratory of Cultivating and Utilization of Resources Insects of State Forestry Administration, Kunming 650224, Yunnan, China)
ObjectiveThe study aimed to investigate the microorganism diversity and compare the difference of microorganism between overwintering individuals in Kunming and Changchun.MethodThe bacteria 16S rRNA and the fungi internal transcribed space (ITS) of overwintering individuals in Kunming (KM) and Changchun (CC) were sequencing by MiSeq high-throughput sequenced method. The bacterial and fungal Operational Taxonomic Units (OTUs) were obtained by the Usearch software, and the Mothur software was used to calculate and analyze the taxonomy and alpha diversity.ResultAccording to 344 OTUs obtained from KM and CC bacteria samples, 15 phyla and 137 genera were identified. Meanwhile, 6 phyla and 83 genera were identified from 230 OTUs obtained from KM and CC fungi samples. In KM the dominant bacteria,Lactococcusaccounted for 29.78%. And in CCRickettsiawas dominant (55.77%). UnclassifiedOphiocordycipitaceaewas dominant both in KM and CC, but its proportion in CC was much lower than in KM.ConclusionIn this study, lots of differences were found between Kunming and Changchun overwintering individuals on the bacteria and fungi category and quantity. In comparison of KM bacteria sample,Rickettsiabecame the dominant genus in CC.
Ericeruspela; community composition; overwintering individuals; Miseq sequencing;rickettsia
10.13275/j.cnki.lykxyj.2017.06.018
2016-10-07
国家863计划2014AA021801,云南省应用基础研究重点项目2013FA052,林业公益性行业科研专项201504302、201304808,国家自然科学基金31572337.
孙 涛(1991—),男,硕士研究生,主要从事昆虫分子生物学研究.
* 通讯作者:杨 璞.
S899.1
A
1001-1498(2017)06-1009-06
张 玲)
