人体器官芯片*
2018-01-02秦建华李中玉
秦建华 张 敏 于 浩 李中玉
1 中国科学院大连化学物理研究所 大连 160023
2 中国科学院大学 未来技术学院 北京 100049
人体器官芯片*
秦建华1,2张 敏1于 浩1李中玉1
1 中国科学院大连化学物理研究所 大连 160023
2 中国科学院大学 未来技术学院 北京 100049

人体器官芯片是一门新兴的前沿科学技术,也是一门典型的多学科交叉汇聚技术,对人类健康和生物产业发展具有重要战略意义,吸引了来自政府、科学界和产业界的关注,被 2016 年达沃斯世界经济论坛列为“十大新兴技术”之一。人体器官芯片指的是一种在载玻片大小芯片上构建的器官生理微系统,包含有活体细胞、组织界面、生物流体和机械力等器官微环境关键要素。它可在体外模拟人体不同组织器官的主要结构功能特征和复杂的器官间联系,用以预测人体对药物或外界不同刺激产生的反应,在生命科学和医学研究、新药研发、个性化医疗、毒性预测和生物防御等领域具有广泛应用前景。文章概述性介绍了人体器官芯片的起源、国际发展态势和研究进展,并对其面临的挑战和未来发展趋势予以展望。
器官芯片,微流控,生物传感,疾病模型,药物评价
DOI 10.16418/j.issn.1000-3045.2017.12.002
人体器官芯片(Human organs-on-chips)是近几年快速发展起来的一门前沿科学技术,也是生物技术中极具特色而富有活力的新兴领域,对人类健康和生物产业发展具有重要战略意义。它融合了物理、化学、生物学、医学、材料学、工程学和微机电等多个学科,被 2016 年达沃斯世界经济论坛列为“十大新兴技术”之一。
人体器官芯片指的是一种在芯片上构建的器官生理微系统,它以微流控芯片为核心,通过与细胞生物学、生物材料和工程学等多种方法相结合,可以在体外模拟构建包含有多种活体细胞、功能组织界面、生物流体和机械力刺激等复杂因素的组织器官微环境,反映人体组织器官的主要结构和功能特征。这种微缩的组织器官模型不仅可在体外接近真实地重现人体器官的生理、病理活动,还可能使研究人员以前所未有的方式来见证和研究机体的各种生物学行为,预测人体对药物或外界不同刺激产生的反应,在生命科学研究、疾病模拟和新药研发等领域具有广泛应用价值。2015 年 Nature 杂志发表评论,称器官芯片是未来可能替代动物试验的革命性技术[1]。
1 人体器官芯片的崛起
人体器官芯片崛起的动力是生命科学领域快速发展所产生的强烈需求,而以半导体加工方法为核心的微流控技术与细胞生物学交叉研究的成就积累是其得以快速发展的重要保障。长久以来,生命科学和医学研究的主要目的是为了解析人类生命现象,探究人体生理活动以及疾病过程,并寻求有效治疗方案。尽管生命科学领域的快速发展已为改善人类健康发挥了极其重要的作用,但是 1 个世纪以来,大量的生物学实验仍依赖于非常简单的单层细胞培养方式。研究人员将不同来源细胞接种在具有刚性的基板上进行培养,研究观察多种细胞行为。由于人体的复杂性,这种过于简化的研究方式不仅难以反映体内复杂的组织器官功能特点,更难以反映人体组织器官对外界刺激产生的真实响应。虽然动物实验可以提供一定的体内信息,但仍存在种属差异和对实际人体反应预测能力较差等显著不足。仅以药物研发为例,美国食品药品监督管理局(FDA)调查显示,每种新药的研发周期平均长达 10 年,费用约为 5 亿—10 亿美元;而约92%的药物经动物实验证实安全有效之后,在临床人体试验中失败,从而形成了新药研发领域高投入、高风险和低产出的尴尬局面。正是这些迫切需求催生了人体器官芯片这一新兴技术的出现,同时也为解决上述瓶颈问题提供了一种基于组织和器官水平的创新研究体系和系统解决方案。
2 人体器官芯片的国际发展态势
人体器官芯片研究的早期报道见诸于 2004 年[2],但是,其真正从学术界的广泛重视转为政府及产业界的介入则是近几年的事,其标志性工作是由哈佛大学开展的肺芯片研究[3-5]。Ingber 等开发了一种载玻片大小的两层肺芯片,用以模拟人体肺泡的气液界面和肺牵张作用,形成一个类似“呼吸的肺”,这显示了器官芯片的初级功能化。几乎在同一时期,笔者研究团队也从不同角度介入这一领域研究,设计开发肿瘤芯片并用于肿瘤转移研究[6-9]。鉴于器官芯片的独特功能特点和广泛应用前景,该技术一经出现,很快引起了政府部门、科技界和产业界的高度关注,多国政府陆续设立一系列项目加速开展人体器官芯片研究。
2011 年,美国政府率先宣布启动人体芯片计划(Human-on-Chip)。该计划由美国国立卫生研究院(NIH)组建跨部门协作机构国家高级转化科学中心(NCATS)负责,并联合美国 FDA 和国防部高级研究计划局(DARPA)共同推进。人体芯片计划的主要目的是开发人体芯片用于新药开发和毒性预测领域,计划投入总计约 7 500 万美元。近期,美国又在干细胞领域继续加大布局,支持器官芯片技术用于疾病研究。此外,2017 年初,美国空间科学发展中心(CASIS)联合 NCATS 和 NIH,设立多项基金支持美国国家实验室开展人体器官芯片空间站试验,以推进新技术,改善人类健康。2017 年 4 月,FDA 作为美国政府官方机构正式宣布对一种肝脏芯片开展系列测试,以确认其能否获取新药审批认可的实验数据,进而来代替动物实验。
欧盟是世界最大的经济体,近几年对人体器官芯片相关研究也有大量投入。特别是,欧洲禁止动物用于化妆品测试等政策的出台,也极大地促进了对器官芯片这一可能的动物替代性技术的关注。比如,德国柏林工业大学 2010 年获得 Go-Bio 基金支持,欧盟第七框架计划也包含“人体芯片”项目,以及 2016 年开始的 EU-Tox 风险项目等也包含支持器官芯片的部分。这些资金支持极大地推进了世界范围内器官芯片领域的研究,同时也吸引了更多其他项目和机构进入这一全新领域。令人欣慰的是,近期,我国科技部和中科院等相继在人体器官芯片领域开展布局,设立不同专项支持,体现了政府部门和科学界对这一新兴前沿技术的关注和支持。同时,国际器官芯片领域的主流刊物 Lab on a Chip 自 2011 年始,连续出版系列专辑介绍器官芯片的最新研究成果。2015 年,第一届世界器官芯片大会在美国波士顿召开。2017 年 6 月,在瑞典召开微流控诺贝尔论坛,笔者受邀参加并做器官芯片主题报告。
与此同时,由于人体器官芯片具有广泛应用空间和产业化前景,一些企业也纷纷涉足这一高新技术领域,一个新兴的器官芯片产业正在初步形成之中。Emulate、CN Bio、CN Bio Innovations 等一批致力于器官芯片研发的新型初创生物公司陆续涌现;大型制药企业和化妆品公司(如默克、欧莱雅、强生、罗氏和赛诺菲等企业)也开始介入这一领域,例如辉瑞公司宣布将 Draper 公司的器官芯片技术用于药物研发。
无疑,人体器官芯片的出现已形成了由政府、学术界和产业界三方联动的助推模式,显示出世界范围内对这一变革性技术的关注和期待,也使这项技术形成了一种迅猛发展以及加速转化应用的态势,有可能成为竞争新一轮科技革命的战略制高点之一。
3 人体器官芯片的研究进展
人体器官芯片是生物芯片领域发展最快、应用前景最为明确的方向之一,近年来已经取得了显著进展——在微芯片上构建的组织器官类型逐渐增多,“心脏芯片”“肺芯片”“肝脏芯片”“血管芯片”和“肠芯片”等多种器官芯片相继出现,同时包含多个组织器官的“多器官芯片”也陆续见于报道,这显示出器官芯片技术在疾病研究、个性化医疗和药物开发中的巨大应用潜力。
3.1 肺芯片
肺是人体的呼吸器官,肺泡是肺部气体交换的主要部位。传统生物学研究方法难以在体外模拟肺泡复杂的细胞组成及周期性的呼吸运动。肺芯片研究主要集中于气血屏障构建、机械压力[10]、流体剪切力作用研究[4]及病理生理过程模拟。例如,Ingber 课题组开展了一系列肺芯片构建及肺相关疾病研究,构建了一种双层夹膜芯片以模拟人肺的呼吸过程。研究发现,在气体通道中加入 TNF-α、二氧化硅纳米颗粒和细菌均能诱导血管内皮细胞黏附分子(ICAM)表达增加,并促进下层通道循环流体中中性粒细胞的黏附[3]。在肺芯片基础上,通过在微通道中加入白细胞介素 2(IL-2),建立了肺水肿病理学模型(图 1)[5];利用慢性阻塞性肺病病人样本,体外模拟了病毒性或细菌性感染诱导的肺部炎症恶化,这与在慢性阻塞性肺疾病(COPD)病人病理标本中的观察结果类似[11]。该系列研究证实了肺芯片不仅可以模拟肺部疾病的病理过程,也发现了周期性呼吸运动在肺部疾病发生发展中的重要作用,为呼吸系统疾病研究提供了一种新的思路。
3.2 肝芯片
肝脏是人体内最重要的毒素、药物代谢器官,由具有复杂多细胞成分和管道结构的肝小叶构成[12]。如何在体外实验中长时间地维持肝细胞的生物学特性与功能是肝组织工程学研究的难点。目前,肝芯片研究主要集中于在芯片上建立多种细胞组成的功能化肝组织生理学模型[13],如胆小管、肝小叶和肝血窦等[14],并将其应用于药物 ADMET 动力学分析及药物毒理评价[15]。例如,Lee 等[16]成功构建了人工肝窦芯片,采用具有高度渗透性的内皮间隙结构将原代肝细胞与外部血窦样区域分离,所构建的肝模型更加接近人体内的真实形态,并能更好地保持肝脏特异性功能。也有研究显示,成纤维细胞、肝星形细胞[17]以及人诱导性多能干细胞来源的血管内皮细胞[18]等其他细胞及流体因素参与肝芯片模型建立,对于促进肝细胞发育、白蛋白分泌、糖原合成以及药物代谢等肝脏功能也具有重要意义。如何利用器官芯片技术的微环境多维可控特点,更好地实现肝组织功能化并集成高通量分析是肝芯片研究的重点。
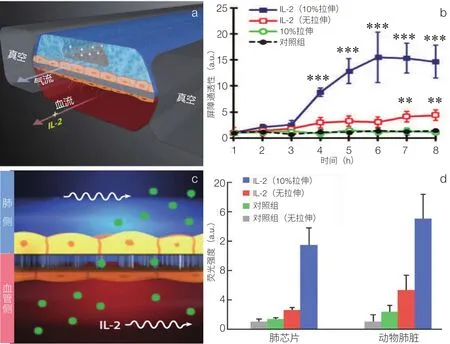
图1 肺芯片构建及体外模拟肺水肿病变[5](a)肺水肿芯片结构示意图;(b)IL-2和机械力介导的肺泡-毛细血管屏障渗透性改变;(c)通过检测FITC-菊粉的渗透率表征IL-2介导的屏障功能改变;(d)芯片模拟与小鼠模型IL-2介导的屏障通透性量化关系的比较
3.3 肾芯片
肾脏是人体重要的排泄器官,对维持体内渗透压与自稳态具有重要的作用,也是药物排泄的主要器官。肾单位是肾脏的结构单位,由肾小球、肾小囊和肾小管共同构成,也是肾脏发挥滤过与重吸收功能的基础。肾芯片研究主要集中在肾单位结构和功能的模拟,以及在此基础上的肾脏疾病病理微环境模拟和疾病机制研究。例如,有研究者在芯片上模拟了肾单位结构中的肾小球、近曲小管和远曲小管,并初步实现了血样样本滤过、原尿形成和尿素的重吸收[19]。也有研究关注于流体剪切力对肾单位细胞骨架、离子、糖及药物等物质转运的影响[20],验证了流体因素对于肾功能研究的重要性[21]。笔者团队利用肾小管细胞构建肾纤维化病理模型,研究证实了补体 C3a 在肾间质纤维化过程中的关键作用[22]。
3.4 血脑屏障芯片
血脑屏障(Blood-Brain Barrier,BBB)是人脑中介于血液和脑组织之间的一道生理性屏障,对维持中枢神经系统的生理活动和脑内微环境稳态至关重要,而建立近生理的 BBB 体外模型有利于推动神经系统药物研发进程。Shao 等[23]通过在芯片微通道的膜上培养微血管内皮细胞,施加流体刺激构建了动态 BBB 模型,模拟了药物诱导脑细胞毒性反应的过程。Wang 等[24]使用脑微血管内皮细胞与大鼠原代星形胶质细胞在多孔膜两侧共培养,构建了 BBB 模型。为反映 BBB 模型更接近生理环境的功能特征,笔者团队利用器官芯片技术特色性构建了包含多种脑细胞、细胞外基质和机械流体条件等关键要素的高通量动态三维 BBB 模型,验证了其近生理环境的结构功能特性,并利用该模型开展了对临床抗肿瘤药物的筛选评价,为脑肿瘤研究和药物研发提供了一种新的思路(图 2)[25]。
3.5 多器官芯片
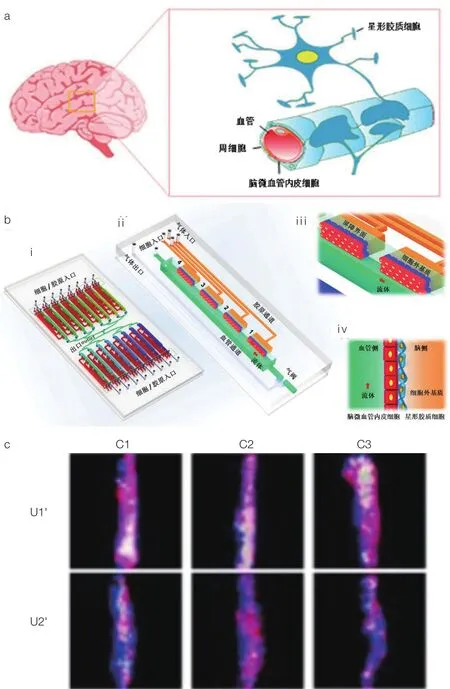
图2 高通量三维血脑屏障(BBB)芯片结构功能示意图[25](a)体内BBB主要细胞组成;(b)BBB芯片结构示意图:(i)高通量BBB芯片包含16个功能单元,(ii)每个功能单元包含4个屏障区域、胶原通道、血管通道和气体通道,(iii)芯片局部放大示意图和(iv)侧视图,流体刺激、三维基质界面、脑微血管内皮细胞和星形胶质细胞;(c)包含多细胞的屏障形成荧光图
随着器官芯片技术的发展,在芯片上同时构建多个器官的“多器官芯片”成为当前研究的热点[26]。而人体芯片的最终形式将拥有10种以上的器官类型,包括肝、肠、心、肾、脑、肺,以及生殖系统、免疫系统、血管系统和皮肤等。人体芯片将能够监控药物对芯片上“人体”的反应,并最终勘察出药物对不同器官或整个系统的药理和毒性作用。“多器官芯片”可在不同功能区域同时构建多个组织器官,并通过芯片管道(模拟人体血管)相连接[27],模拟人体对特定物质的吸收、代谢、转化和排泄过程[28](图 3)。目前已有研究者尝试在一个芯片上实现对肠、肝、皮肤和肾等类器官的长时间共培养,细胞均保持高活性并能够自发形成功能结构,实现系统自稳态[29]。此外,为实现多器官芯片的信息采集处理,将多模式传感技术与芯片进行集成是未来的发展趋势。已有研究者开发了一种可集成电化学及免疫传感模块的多器官芯片,可同时监测组织培养微环境参数(pH值、O2浓度、温度等)及与组织功能相关的可溶性生物标志物[30]。
4 人体器官芯片的应用领域
人体器官芯片技术研究的创新思想建立在充分了解人体的复杂组织器官结构和生理功能特点的基础上,它为药物研发、疾病研究、化学品、毒素以及化妆品测试等领域提供了一种近生理的体外模型,在多个领域具有广泛应用价值。
4.1 药物评价
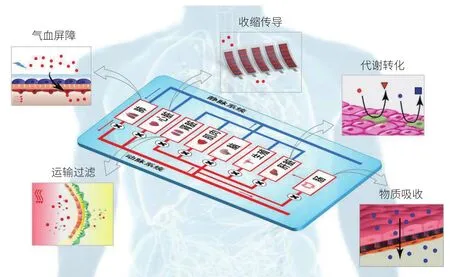
图3 多器官人体芯片作用示意图
药物评价主要是研究药物与人体之间的作用及规律,根据药物吸收、分布、代谢、排泄(ADME)的体内过程,确定其有效性及安全性。器官芯片可反映这种药物在体内的动态变化规律和人体器官对药物刺激的真实响应,弥补了现有模型与人体偏差较大的不足,构成一种药代、药效、毒性三位一体的成药性评价技术体系。目前已有诸多研究用器官芯片开展药物评价的工作,如:Shuler 课题组通过可控的流体操控在肝-肿瘤多器官芯片,建立基于生理学的药代动力学模型(PKPD),预测人体对药物的反应[31-33]。笔者课题组也构建了一种研究药代、药效、毒理三位一体成药性过程的多器官芯片。该芯片采用卡培他滨为模型药物,研究其经肝细胞代谢后生成的代谢物对不同组织的作用[34]。此外,还构建了肝-肾、肠-肾复合器官芯片模型,开展药物肝代谢、肠吸收及肾毒性研究[35,36]。采用器官芯片进行药代、药效、毒理研究,对获得更为可靠的测试数据、减少动物实验数量具有重要意义。
4.2 疾病研究
在疾病研究领域,器官芯片对于重现人类疾病特征、研究多因素参与的疾病病理机制提供了新的机遇。尽管器官芯片技术对人体生物学组织器官构成进行了一定程度的简化,但该技术在重建复杂器官功能和人体病理生理学特征方面仍具有不可替代的作用。比如,利用肠芯片可以实现对多种组织细胞的共培养,包括上皮组织细胞、免疫细胞及共生细菌、致病菌等,从而可用来研究炎性肠病发病过程中细菌和淋巴细胞的相互作用特性[37]。笔者团队也成功构建了含有原代肾小球组织、基质成分和血管样机械流体的肾芯片模型,反映糖尿病肾病发生过程中早期肾小球损害的主要病理变化特点,结果显示出与体内典型病理生理过程的相关性[38]。
随着干细胞领域研究的快速发展,人体器官芯片在利用人多能干细胞建立疾病模型等方面也已取得进展。有研究报道,利用患者来源干细胞,可在芯片上构建功能性心脏组织,模拟遗传性心脏病模型(Barth 综合征)[39]。采用患者体细胞来源干细胞构建的特定病人“个性化人体芯片”,将使个体化的疾病风险预测、药物药效评价、毒理评估和预后分析成为可能。笔者团队将器官芯片技术与干细胞发育学原理相结合,实现了对人诱导多能干细胞来源类脑器官模型的工程化构建,并用于研究环境因素暴露对脑早期发育的影响[40,41]。
4.3 毒理学评价
随着经济的高速发展和人们对人体和环境安全重视度提高,亟需出现更为科学、高效、经济的毒性测试方法来满足人们对化学品、药品、农药、食品添加剂和化妆品等各种化学物质进行安全风险评估的需求。由于人体的复杂性,现有的体外评价模型和动物实验并不能准确地反映人体对危害因素的反应。将器官芯片应用于环境污染物、化学品、纳米颗粒、生物毒素、物理辐射等毒理学测试领域[42],具有巨大的应用空间。可以更好地模拟人体对化合物、细菌、毒素真实反应[43],显著减少毒性评估的成本和时间,是毒性测试动物替代技术研究的前沿领域和研究热点。
5 结语与展望
人体器官芯片是人类健康领域的未来技术,在疾病研究、个性化医疗、毒性预测和新药研发等领域的作用和优势日益呈现,其发展前景吸引了世界范围的关注,孕育着重要的科学进步。随着该技术的长远发展,在未来利用人体器官芯片有可能构建一种“类人”的生命模拟系统,并将有可能彻底改变人们了解自身的方式,为生命科学和医学研究提供一种整体性和系统性的解决方案,在生命科学和医学等多个领域发挥重要作用。
尽管人体器官芯片研究已取得显著进展,但其未来发展仍面临着诸多挑战,比如:如何建立更符合人体生理的器官芯片体系,如何实现多种器官的功能关联性和兼容性,以及如何实现芯片标准化和集成传感检测等。伴随着巨大应用需求和市场驱动,人体器官芯片与干细胞、组学技术、基因编辑、合成生物学、高分辨成像、大数据和人工智能等领域的深度融合发展将是未来的发展趋势。目前,中科院在干细胞和生物传感等多个领域都已达到国际先进水平,面临时不我待的新形势,如果能及时抓住机遇,集成多个优势领域进行前瞻布局,加大投入,将有利于促进我国人体器官芯片的快速发展,并带动相关产业,也势必有利于我国在新一轮国际竞争中占据有利地位。
1 Reardon S. ‘Organs-on-chips’ go mainstream. Nature, 2015,523(7560): 266-266.
2 Sin A, Chin K C, Jamil M F, et al. The design and fabrication of three-chamber microscale cell culture analog devices with integrated dissolved oxygen sensors. Biotechnology Progress,2004, 20(1): 338-345.
3 Huh D, Matthews B D, Mammoto A, et al. Reconstituting organlevel lung functions on a chip. Science, 2010, 328(5986): 1662-1668.
4 Huh D, Fujioka H, Tung Y C, et al. Acoustically detectable cellular-level lung injury induced by fluid mechanical stresses in microfluidic airway systems. PNAS, 2007, 104(48): 18886-18891.
5 Huh D, Leslie D C, Matthews B, et al. A human disease model of drug toxicity-induced pulmonary edema in a lung-on-a-chip microdevice. Science Translational Medicine, 2012, 4(159): 147-159.
6 Ma H P, Zhang M, Qin J H, et al. Probing the role of mesenchymal stem cells in salivary gland cancer on biomimetic microdevices.Integrative Biology, 2012, 4(5): 522-530.
7 Liu T J, Lin B C, Qin J H. Carcinoma-associated fibroblasts promoted tumor spheroid invasion on a microfluidic 3D co-culture device. Lab on a Chip, 2010, 10(13): 1671-1677.
8 Zhang Q, Liu T J, Qin J H. A microfluidic-based device for study of transendothelial invasion of tumor aggregates in realtime. Lab on a Chip, 2012, 12(16): 2837-2842.
9 Xu H, Shervin R, Cody L N, et al. Activation of hypoxia signaling induces phenotypic transformation of glioma cells: implications for bevacizumab antiangiogenic therapy. Oncotarget, 2015, 6(14):11882-11893.
10 Douville N J, Zamankhan P, Tung Y C, et al. Combination of fluid and solid mechanical stresses contribute to cell death and detachment in a microfluidic alveolar model. Lab on a Chip, 2011,11(4): 609-619.
11 Benam K H, Villenave R, Lucchesi C, et al. Small airway-ona-chip enables analysis of human lung inflammation and drug responses in vitro. Nature Methods, 2016, 13(2): 151-157.
12 McCuskey R S. The hepatic microvascular system in health and its response to toxicants. Anatomical Record, 2008, 291(6): 661-671.13 Cho C H, Park J, Tilles A W, et al. Layered patterning of hepatocytes in co-culture systems using microfabricated stencils.Biotechniques, 2010, 48(1): 47-52.
14 Bartholomew J K, Michael J Z, Martin L Y, et al. Liver-specific functional studies in a microfluidic array of primary mammalian hepatocytes. Analytical Chemistry, 2006, 78(13): 4291-4298.
15 Khetani S R, Bhatia S N. Microscale culture of human liver cells for drug development. Nature Biotechnology, 2008, 26(1): 120-126.
16 Lee P J, Hung P J, Lee L P. An artificial liver sinusoid with a microfluidic endothelial-like barrier for primary hepatocyte culture. Biotechnology and Bioengineering, 2007, 97(5): 1340-1346.
17 Lee S A, No D Y, Kang E, et al. Spheroid-based three-dimensional liver-on-a-chip to investigate hepatocyte–hepatic stellate cell interactions and flow effects. Lab on a Chip, 2013, 13(18): 3529-3537.
18 Du C, Narayanan K, Leong M F, et al. Induced pluripotent stem cell-derived hepatocytes and endothelial cells in multi-component hydrogel fibers for liver tissue engineering. Biomaterials, 2014,35(23): 6006-6014.
19 Weinberg E, Kaazempur M M, Borenstein J. Concept and computational design for a bioartificial nephron-on-a-chip. The International Journal of Artificial Organs, 2008, 31(6): 508-514.
20 Jang K J, Mehr A P, Hamilton G, et al. A Human kidney proximal tubule-on-a-chip for drug transport and nephrotoxicity assessment.Integrative Biology, 2013, 5(9): 1119-1129.
21 Duan Y, Gotoh N, Yan Q, et al. Shear-induced reorganization of renal proximal tubule cell actin cytoskeleton and apical junctional complexes. PNAS, 2008, 105(32): 11418-11423.
22 Zhou M Y, Ma H P, Lin H L, et al. Induction of epithelial-tomesenchymal transition in proximal tubular epithelial cells on microfluidic devices. Biomaterials, 2014, 35(5): 1390-1401.
23 Shao X J, Gao D, Chen Y L, et al. Development of a blood-brain barrier model in a membrane-based microchip for characterization of drug permeability and cytotoxicity for drug screening. Analytica Chimica Acta, 2016, 934: 186-193.
24 Wang J D, Khafagy E S, Khanafer K, et al. Organization of endothelial cells, pericytes, and astrocytes into a 3D microfluidic in vitro model of the blood-brain barrier. Molecular Pharmaceutics,2016, 13(3): 895-906.
25 Xu H, Li Z Y, Yu Y, et al. A dynamic in vivo-like organotypic blood-brain barrier model to probe metastatic brain tumor.Scientific Reports, 2016, 6: 36670.
26 Oleaga C, Bernabini C, Smith A S, et al. Multi-Organ toxicity demonstration in a functional human in vitro system composed of four organs. Scientific Reports, 2016, 6: 20030.
27 Zhang W J, Zhang Y S, Bakht S M, et al. Elastomeric free-form blood vessels for interconnecting organs on chip systems. Lab on a Chip, 2016, 16(9): 1579-1586.
28 Esch M B, Smith A S, Prot J M, et al. How multi-organ microdevices can help foster drug development. Advanced Drug Delivery Reviews, 2014, 69: 158-169.
29 Maschmeyer I, Lorenz A K, Schimek K, et al. A four-organ-chip for interconnected long-term co-culture of human intestine, liver,skin and kidney equivalents. Lab on a Chip, 2015, 15(12): 2688-2699.
30 Zhang Y S, Aleman J, Shin S R, et al. Multisensor-integrated organs-on-chips platform for automated and continual in situ monitoring of organoid behaviors. PNAS, 2017, 114(12): e2293-2302.
31 Esch M B, Mahler G J, Stokor T, et al. Body-on-a-chip simulation with gastrointestinal tract and liver tissues suggests that ingested nanoparticles have the potential to cause liver injury. Lab on a Chip, 2014, 14(16): 3081-3092.
32 Sung J H, Kam C, Shuler M L. A microfluidic device for a pharmacokinetic-pharmacodynamic (PK-PD) model on a chip.Lab on a Chip, 2010, 10(4): 446-455.
33 Sung J H, Dhiman A, Shuler M L. A Combined pharmacokineticpharmacodynamic (PK-PD) model for tumor growth in the rat with UFT administration. Journal of Pharmaceutical Sciences, 2009,98(5): 1885-1904.
34 Li Z Y, Guo Y Q, Yu Y, et al. Assessment of metabolism-dependent drug efficacy and toxicity on a multilayer organs-on-a-chip.Integrative Biology, 2016, 8(10): 1022-1029.
35 Li Z Y, Jiang L, Zhu Y J, et al. Assessment of hepatic metabolismdependent nephrotoxicity on an organs-on-a-chip microdevice.Toxicology in Vitro, 2018, 46:1-8.
36 Li Z Y, Su W T, Zhu Y J, et al. Drug absorption related nephrotoxicity assessment on an intestine-kidney chip.Biomicrofluidics, 2017, 11(3): 034114.
37 Kim H J, Li H, Collins J J, et al. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. PNAS, 2016, 113 (1):7-15.
38 Wang L, Tao T T, Su W T, et al. A disease model of diabetic nephropathy in aglomerulus-on-a-chip microdevice. Lab on a Chip, 2017, 17: 1749-1760.
39 Wang G, McCain M L, Yang L, et al. Modeling the mitochondrial cardiomyopathy of Barth syndrome with induced pluripotent stem cell and heart-on-chip technologies. Nature Medicine, 2014, 20(6):616-623.
40 Zhu Y J, Wang L, Yin F C, et al. Hollow fiber system for simple generation of human brain organoids. Integrative Biology, 2017, 9:774-781.
41 Zhu Y J, Wang L, Yu H, et al. In situ generation of human brain organoids on a micropillar array. Lab on a Chip, 2017, 17: 2941-2950.
42 Rebelo S A, Dehne E M, Brito C, et al. Validation of bioreactor and human-on-a-chip devices for chemical safety assessment.Validation of Alternative Methods for Toxicity Testing, 2016, 856:299-316.
43 Alberti M, Dancik Y, Sriram G, et al. Multi-chamber microfluidic platform for high-precision skin permeation testing. Lab on a Chip,2017, 17(9): 1625-1634.
Human Organs-on-a-chip
Qin Jianhua1,2Zhang Min1Yu Hao1Li Zhongyu1
(1 Division of Biotechnology, Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 160023, China;2 School of Future Technology, University of Chinese Academy of Sciences, Beijing 100049, China)
Human organs-on-a-chip is a newly emerging and frontier technology involving with different disciplines in recent years. It refers to a biomimetic microphysiological system created on a bioengineered microfluidic device, representing the organ-level functional units. It can recapitulate the physiologically relevant structures and functions of the organs, as well as the interaction between multiple organs as in vivo, thereby offering alternative models for predicting human responses to various drugs and environmental stimulus. Organs-on-a-chip technology has wide application potentials in many fields such as life science, drug discovery, personalized medicine, food/environment monitoring and biological defense et al. The emergence of this technology has attracted much attention from the government, scientific community and industry due to its unique features and promising applications. It has been selected as the “Top Ten Emerging Technologies” by the World Economic Forum in 2016. Considering the huge market in industrialization, several companies have started to get involved in this area and the pace of industrialization has been accelerated rapidly.Human organs-on-a-chip scan not only reproduce the physiopathology of human organ, but it can also enable researchers to witness and study various biological behaviors of the organism in an unprecedented way. It could be used to analyze the occurrence and development of the complicated human diseases in a new perspective, and is expected to bring about a revolution in the traditional fields including biomedical research, drug testing,personalized medicine, toxicity prediction, biodefensive fields. Here, we summarize the origins, development, and application fields of human organson-a-chip technology. We also discuss the existing challenges and give perspectives for the development of this technology in future.
organs-on-a-chip, microfluidic, biosensing and devices, disease model, drug evaluation
秦建华 中科院大连化学物理所研究员、微流控芯片中心主任,辽宁省微流控芯片重点实验室主任,大连市微流控芯片工程中心主任。先后任本领域国际刊物 Biomicrofluidics 副主编和 Lab on a Chip 副主编,2014年入选英国皇家化学会会士。主要研究领域:微流控系统与生物医学交叉学科研究,人体器官芯片构筑基础及其应用。E-mail: jhqin@dicp.ac.cn
M.D. from China Medical University, and Ph.D. from Chinese Academy of Sciences (CAS), respectively. She did postdoctoral research at Universityof Toronto in Canada and worked as visiting professor at the University of Hong Kong, China. She is the director of Microfluidics Research Center in Dalian Institute of Chemical Physics, CAS. She was elected as the Fellow of Royal Society of Chemistry (FRSC) in 2014. She served as the associate editor of Lab on a Chip and Biomicrofluidics. She has published more than 100 peer reviewed papers and 2 books. She held 70 patents till now. Her current research interests lie in the development of organs-on-chips technology for applications in disease modeling and drug testing. E-mail: jhqin@dicp.ac.cn
*资助项目:国家自然科学基金项目(91543121、3167 1038),中科院战略性先导科技专项(XDA16020900、XDPB030503)
修改稿收到日期:2017年12月16日
