米非司酮对Wistar大鼠窗口期子宫内膜整合素和血管内皮生长因子基因表达的影响
2017-12-29黎福荣付新录江国建
唐 彬, 黎福荣, 付新录, 江国建, 赵 勇, 张 薇
(中山大学实验动物中心, 广州510080)
米非司酮对Wistar大鼠窗口期子宫内膜整合素和血管内皮生长因子基因表达的影响
唐 彬, 黎福荣, 付新录, 江国建, 赵 勇, 张 薇
(中山大学实验动物中心, 广州510080)
目的 研究米非司酮对大鼠窗口期子宫内膜整合素(αvβ3)、血管内皮生长因子(VEGF)基因表达, 探讨其对子宫内膜超微结构的影响。方法 将36只Wistar大鼠分4组,1、2组妊娠1 d后分别服用5 mg/kg、10 mg/kg的米非司酮,3、4组为空白未妊娠组和空白妊娠组,4个组于4.5 d后麻醉取大鼠子宫内膜组织,进行透射电镜观察、ELISA检测血清中雌激素、孕激素含量,同时运用实时荧光定量PCR技术,定量分析整合素αvβ3以及VEGF 基因在其子宫内膜中的表达。结果 米非司酮能明显抑制Wistar大鼠窗口期子宫内膜αvβ3、VEGF基因的表达,同时能显著降低窗口期孕激素的含量(P<0.05),其三者的下调及子宫内膜的超微结构的改变与米非司酮具有明显的剂量依赖关系,对雌激素的含量没有显著影响(P>0.05)。结论 米非司酮能在不同程度上降低大鼠整合素αvβ3、VEGF基因的表达及孕激素的含量,破坏子宫内膜的超微结构.
米非司酮; 整合素(αvβ3); 血管内皮生长因子(VEGF); 雌激素; 孕激素
整合素 (integrins) 为细胞粘附分子家族的重要成员之一, 是一组广泛分布于细胞表面由α及β两个亚单位(αvβ3)组成的跨膜糖蛋白受体, 主要介导细胞与细胞、细胞与细胞外基质(extracellular matrix,ECM)之间的相互黏附 , 并介导细胞与 ECM 之间的双向信号转导, 对细胞的黏附、增殖、分化、转移、凋亡起着重要的调控作用[1-3]。同时,整合素αvβ3的表达在血管生成与重建过程中具有独特的作用[4]。血管内皮生长因子 (vascular endothelial growth factor,VEGF) 是目前认为作用最强、特异性最高的促血管生成因子,是新生血管形成定量分析的较可靠指标。研究表明[5],VEGF 的表达与血管生成明显呈正相关,故 VEGF 能较好地反映新生血管生长的活跃程度,其在胚胎发育、骨骼生长和生殖等众多生物学过程中起重要作用,且卵泡的生长和黄体的发育依赖于新生的毛细血管,而VEGF 对小鼠胚胎及新生鼠血管内皮细胞增殖和存活至关重要。VEGF 促进血管生成,是促进肿瘤血管生成的重要因子, 在肿瘤生长和转移中起着不可或缺的作用[6,7]。αvβ3、VEGF是血管新生具有协同作用的重要因子,而新生血管的正常增生是促进窗口期子宫内膜超微结构的构建并保持一种允许胚胎种植状态的重要环节。
米非司酮临床应用在不断被挖掘,但作用机理尚不够深入,本研究在大鼠妊娠1 d后给予不同剂量的米非司酮,观察妊娠4.5 d的大鼠胚胎种植窗口期αvβ3,VEGF基因在子宫内膜中的表达,大鼠血清雌激素、孕激素的含量,以及对窗口期子宫内膜超微结构的影响。
1 材料与方法
1.1 主要试剂与仪器
米非司酮由深圳市资福药业有限公司生产,批准文号: 国药准字H20055518,批号: 141004。手提式高速分散器(中国, 宁波新芝, S10)、紫外可见分光光度计(中国, 上海奥谱勒仪器, UV-752P)、紫外透射分析仪(中国,Hema, UV-3A)、数显恒温水浴锅(中国,江苏环宇科学仪器,HH-4)、冷冻高速离心机(中国,Hema, TGL-16R)、基因扩增仪(中国,Hema,Hema9600)、Real-time Quantitative PCR(美国,Bio-Rad,MiniOpticon)、Trizol(美国,MRC,TR118-500)、M-MLV Reverse Transcriptase(美国,Promega, M1705)、GoTaq®qPCR Master Mix(美国,Promega,A6002)。
1.2 实验动物与环境
SPF级Wistar近交系雌雄性大鼠各36只, 体质量180~220 g,购自中山大学实验动物中心[SCXK(粤)2011-0029],饲养于中山大学实验动物中心(北校)屏障环境动物实验设施[SYXK(粤)2012-0081]。
1.3 实验方法
1.3.1 妊娠判断 将25只雄鼠与25只雌鼠合笼,于第2日上午检查阴栓,以在雌鼠阴道见到阴道栓或阴道分泌物涂片在光学显微镜下观察到精子确定妊娠。
1.3.2 实验分组 将妊娠Wistar大鼠分为3组, 1组服用5 mg/kg剂量的米非司酮(8只), 2组服用10 mg/kg的米非司酮(8只),3组为空白妊娠组(9只),另设空白未妊娠组(11只),1、2组模型大鼠妊娠1d后分别服用米非司酮,在妊娠4.5 d麻醉取材观察。
1.3.3 检测方法 用质量分数20%乌来糖溶液按0.6 mL/100 mg腹腔注射麻醉大鼠后,取子宫组织于质量分数2.5%戊二醛中固定,在JEM-1400的透射电镜下观察,其血清用ELISA 方法进行雌、孕激素的测定, 同时运用实时荧光定量PCR技术检测αvβ3、VEGF基因在在位内膜组织中的表达,目标基因的相对表达量计算公式为: 2-△△Ct= 2-[(△Ct)处理组 - (△ Ct)对照组], 其中, △△ Ct =(△ Ct)处理组- (△Ct)对照组, 表示处理组相对对照组进行归一化, 2-△△Ct表示处理组相对对照组的相对表达量。
引物分别为
VEGF正向: TTCATGGACGTCTACCAGCG;
VEGF 反向: CTTCATCATTGCAGCAGCCC;
αvβ3正向: CTGGACTGGCTACTACTGCA;
αvβ3反向: ATGTAGCTTTCCCCGGTTGA
1.4 统计方法
2 结果
2.1 子宫内膜透射电镜观察
空白未妊娠组子宫在位内膜黏膜上皮细胞形态规则均一致呈低柱状 (图1B),排列整齐, 层次清晰,细胞核位于基底位,核质分布均匀,高尔基体及线粒体散在分布于分泌细胞中; 上皮细胞间隙紧密, 黏膜上皮主要由少量纤毛细胞和大量分泌细胞组成,质顶部可见电子致密颗粒,分泌细胞游离面可见短小微绒毛, 呈板层状,排列整齐(图1A)。空白妊娠组在位内膜黏膜上皮细胞也呈低柱状,且胞质内有丰富的线粒体,多为卵圆形; 基质细胞长梭形,细胞核大,呈不规则长管状,胞质较少,核浆比例大; 细胞内线粒体数量较多,体积较小,内质网、高尔基体均较空白未妊娠组发达(图1B)。
米非司酮5 mg/kg剂量组在位内膜黏膜上皮细胞呈柱状, 形态较规则, 基底膜完整, 较弯曲; 上皮细胞紧密连接,分泌细胞游离面微绒毛短小, 腺腔可见少量脱落的微绒毛; 胞质内电子致密颗粒散在分布、脂滴少; 胞质内线粒体、内质网较丰富并具有一定的空泡化但无内含物(图1C); 细胞核较不规则,核膜可见大小不等的切迹,核染色质均匀。
米非司酮10 mg/kg剂量组子宫在位内膜黏膜上皮细胞呈高低不齐的柱状,细胞排列不规则,基底膜弯曲; 上皮细胞缝隙连接,分泌细胞游离面微绒毛短小,腺腔可见大量脱落的微绒毛(图1D); 胞质内电子致密颗粒少见,可见丰富脂滴(图1E); 细胞核不规则,核膜内陷核膜有缺裂,核质周围边集化,呈锯齿状; 胞质内线粒体部分空泡化并有内含物,且大部分脊已断裂、内质网扩张明显(图1F)。
2.2 血清激素含量
雌激素含量四个组别比较差异无统计学意义(P>0.05)(表1)。而米非司酮能够下调妊娠大鼠孕激素含量, 且剂量效应明显(P<0.05 或P<0.01)(表1)。
2.3 子宫内膜基因表达
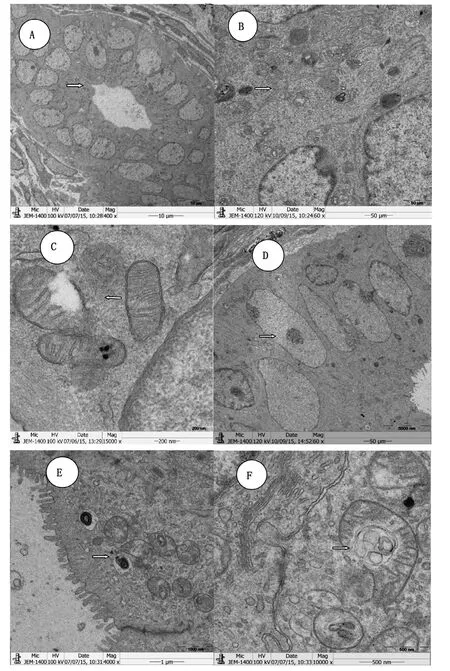
图1 大鼠子宫组织超微结构观察

表1 各组大鼠血清雌、孕激素含量
与空白妊娠组比较, 5 mg/kg米非司酮组αvβ3基因表达差异无统计学意义(P<0.05), 10 mg/kg米非司酮能够明显下调妊娠大鼠αvβ3基因表达(P<0.05)。5 mg/kg、10mg/kg米非司酮组均可下调妊娠大鼠VEGF基因表达,剂量效应明显(P<0.05或P<0.01)(表 2)。

表2 各组大鼠子宫内膜αvβ3、VEGF基因相对表达
3 讨论
本研究中10 mg/kg剂量的米非司酮能同时下调Wistar大鼠窗口期孕激素含量、αvβ3以及VEGF表达, 严重损害子宫内膜的超微结构。5 mg/kg剂量的米非司酮对孕激素、VEGF有下调作用, 但对αvβ3的作用不明显, 对子宫内膜超微结构有轻微损害, 其三者的下调及子宫内膜的超微结构的改变与米非司酮具有明显的剂量依赖关系。米非司酮对VEGF、αvβ3的影响, 前者较后者敏感, 而本研究中 Wistar大鼠窗口期的雌激素水平没有出现下调现象。
子宫内膜在接受胚胎种植的窗口期, 要发生充血、增厚、上皮增生、子宫腺体分泌逐渐增强等变化,促使窗口期子宫内膜变化的因素主要有子宫母体激素、子宫内膜容受性、胚泡激素、胚激肽等。孕激素具有促使子宫内膜分泌,以利受精卵植入; 米非司酮与子宫内膜中的孕激素受体高亲和力结合,其影响子宫内膜的孕激素受体表达[8], 竞争性阻断了孕激素的作用,其作用机制为米非司酮与孕激素受体结合后, 并不阻断受体与热休克蛋白的解离,也允许受体二聚化并与DNA结合, 但米非司酮不能激活孕激素受体的激素结合区( HBD) 上的转录活化因子,因而不发挥黄体酮的活性效应[9-11],从而竞争性抑制孕激素的作用,这样使孕激素减少。本研究中5 mg/kg、10 mg/kg剂量的米非司酮均导致大鼠孕激素含量下降,且随着剂量的增加下降越明显,大鼠胚胎种植期的子宫内膜增生失去孕激素的支持。
最近研究表明[12], VEGF和整合素αvβ3是参与子宫内膜血管生成的重要生长因子,其中,VEGF可以通过受体VEGFR2 /KDR 刺激内皮细胞活化,降解基底膜使内皮细胞增殖形成新的血管。而整合素αvβ3位于细胞膜,作为一种信号受体能够诱导蛋白酪氨酸磷酸化以传递细胞信号,参与VEGF 诱导的血管生成进一步支持血管生成[8]。二者在血管生成的过程中起着协同作用。在子宫内膜中,血管中的血液起着输送营养以及各种生物信号肽的作用,一旦整合素αvβ3以及VEGF 基因的表达量下降,会导致子宫内膜血管生成受阻,影响窗口期子宫内膜组织正常形态变化。本研究中米非司酮有下调子宫内膜 VEGF、αvβ3的表达作用, 与赵轩等[13]临床报道的米非司酮有抑制VEGF产生,抑制内膜螺旋动脉的血管生长等作用相吻合。
本研究通过透射电镜对米非司酮组窗口期子宫内膜的观察,显示米非司酮明显破坏子宫内膜的超微结构功能,子宫位内膜组织有着不同程度的损伤改变, 5 mg/kg剂量组损害较轻,仅表现为少量绒毛脱落,线粒体少量空泡化,胞质有少量脂滴;10 mg/kg剂量组胞质内线粒体空泡化、内质网扩张明显,核膜内陷有缺裂、核质着周围边集化,胞质有脂滴增多等等,子宫内膜的改变除VEGF 基因的表达量下降,导致新生血管生成困难外,另一原因可能源于米非司酮对内膜的抗增殖作用, 以减少内膜的血管生成及子宫血流下降, 使内膜动脉萎缩,内膜变薄妊娠困难。有学者报道[14],米非司酮可增加内源性前列腺素(PG)的合成,而PG具有强大的收缩子宫平滑肌和血管平滑肌的作用,使子宫肌及血管收缩。同时,米非司酮还可通过阻断孕激素受体,降低血液中-氧化氮(NO)、肾上腺髓质素(ADM)、降钙素基因相关肤(CGRp)这三种具有强大扩管作用的血管活性物质的合成[14],从而减弱孕激素扩血管作用,使子宫血管收缩,最终导致在位子宫内膜的超微结构的改变[15]。本研究表明,αvβ3、VEGF以及孕激素是大鼠子宫内膜超微结构的构建和维持的重要影响因子,三者的下调,在雌激素没有显著变化情况下,仍能引起大鼠子宫内膜超微结构的改变。推测在雌激素不变的前提下,孕激素的降低,导致雌孕激素比列的失调也可能是影响子宫内膜超微结构改变的重要原因。
VEGF 是许多肿瘤血管生成的核心,主要由多种组织细胞分泌,分布广泛,在肿瘤细胞增殖、凋亡、淋巴道转移等过程中起着至关重要的作用。肿瘤的生长及转移的关键步骤是新生血管的形成。整合素可以加快肿瘤新生血管内皮细胞的运动,促进肿瘤新生血管的形成[16,17],Hosotani 等[18]研究显示αvβ3整合素的高表达有促进胰腺癌侵袭生长及远处迁徙转移等生物学行为,二者对促进肿瘤组织新生血管形成起到协同作用。
目前, 米非司酮作为孕激素的受体拮抗药物, 妇产科临床治疗应用广泛, 如: 终止早期妊娠[19]、紧急避孕和功能性子宫出血[20]、子宫内膜异位症[21]、子宫肌癌[22]、脑膜瘤[23,24]等疾病的治疗,但其治疗子宫肌癌、脑膜瘤等疾病作用机理的实验验证尚不深入。米非司酮对子宫肌瘤的治疗,主要观点认为米非司酮是雌性激素的竞争性抑制剂,可以与孕酮受体结合[25], 然而本研究表明, 米非司酮不仅仅是降低孕激素, 5 mg/kg剂量的米非司酮能降低子宫内膜组织VEGF的表达,10 mg/kg剂量的米非司酮能同时降低VEGF、αvβ3整合素的表达,阻止了子宫内膜新生血管的生成,可能是其治疗子宫内膜异位症、子宫肌瘤、脑膜瘤的重要作用机理之一。而米非司酮对VEGF、αvβ3的下调作用,是否可成为阻断肿瘤转移的药物,还有待进一步研究。
[1] Kim M, Carman CV, Springer TA. Biodirectional transmemnbrane signaling by cytoplasmic domain separation in integrins[J]. Science, 2003, 301(5640):1720-1725.
[2] Bauer SM, Bauer RJ, Velazquez OC, et al. Angiogenesis,vasculogenesis, and induction of healing in chronic wounds[J]. Vasc Endovascu-lar Surg, 2005, 4:293-306.
[3] Carano RA, Filvaroff EH. Angiogenesis and bone repair[J].Drug Discov Today, 2003, 21:980-989.
[4] Oxboel J, Binderup T, Knigge U, et al. Quantitative geneexpression of the tumor angiogenesis markers vascular endo thelial growth factor, integrin alphaV and integrin beta3 in human neuroendocrine tumors[J]. Oncol Rep, 2009, 3:769-775.
[5] 王成伟, 庞琦, 张珑, 等. 人脑胶质瘤中微血管密度和血管内皮生长因子表达的意义[J]. 癌症, 2004, 3:326-327.
[6] Senger DR, Gallis J, Dvorak AM, et al. Tumor cells secrete a vascular permeability factor that promote accumulation of ascites fluid[J]. Science, 1983, 219(4587):983-985.
[7] 刘桂君, 陈国江, 黎燕, 等. 血管内皮生长因子在肿瘤生长转移中的作用机制研究进展[J]. 国际药学研究杂志, 2012,39(5):391-395.
[8] Hayashi A, Tanabe A, Kawabe S, et al. Dienogest increases the progesterone receptor isoform B/A ratio in patients with ovarian endometriosis[J]. J Ovarian res, 2012, 5(1):31-38
[9] 陆叶, 于丽, 陈春玲. 雌、孕激素和米非司酮对子宫内膜癌细胞的作用[J]. 北京大学学报, 2005, 37(5):284-286.
[10] Barrier BF. Immunology of endometriosis [J]. Clin Obstet Gynecol, 2010, 53(2):397- 402.
[11] Lessey BA, Lebovic DI, Taylor RN. Eutopic endometrium in women with endometriosis: ground zero for the study of implantation defects[J]. Semin Reprod Med, 2013, 31(2):109-124.
[12] Zachary I. VEGF signalling: integration and multi-tasking in endothelial cell biology[J]. Biochem Soc Trans, 2013, 31(1):1171-1177.
[13] 赵轩, 吴华真, 王宝金, 等. 米非司酮对子宫内膜异位症患者在位及异位子宫内膜中血管内皮生长因子表达及微血管密度的影响[J]. 中华妇产科杂志, 2005, 40(4):277-278.
[14] Gangula PR, SuPowit SC, Wimalawansa SJ, et al. Caleitonin gene-relatedEPtide in a depressor in N(G)-vitro-L-arginine methylester induced hypertension during preaney[J].Hypertension, 2012, 29(lptZ):248-253.
[15] Reinseh RC, Murphy A, Morales AJ, et al. The effect of RU-486 and leuprolide acetate on uterine blood flow in fibroid uterus: a prospective Randomized study[J]. Am J Obstet Gynecol, 2014, 170(1):1623-1627.
[16] Serini G, Valdembri D, Bussolino F. Integrins and angiogenesis:asticky business[J]. Exp Cell Res, 2006, 312(5):651-658.
[17] Matou S, Colliec-Jouault S, Galy-Fauroux I, et al. Effect of anoversulfated exopolysaccharide on angiogenesis induced by fibroblastgrowth factor-2 or vascular endothelial growth factor in vitro [J].Biochem Phamacol, 2005, 9(5):751-759.
[18] Hosotani R, Kawaguchi M, Masui T, et al. Expression of integrinαvβ3 in pancreatic carcinoma: relation to MMP-2 activation andlymph node metastasis[J]. Pancreas, 2002, 25(2):e30-35.
[19] 谢杏美, 王玉霞. 米非司酮配伍米索前列醇治疗稽留流产和终止10~16周妊娠的效果比较[J]. 实用妇产科杂志,2012, 28(8):693-695.
[20] 王婷. 米非司酮对子宫内膜作用的研究进展[J]. 现代妇产科进展, 2013, 12(4):295 -297.
[21] 马成斌, 刘平, 曹美良. 盆腔子宫内膜异位症术后应用不同剂量米非司酮治疗的疗效观察[J]. 实用妇产科杂志,2012, 23(1):61-63.
[22] 韩兆忠, 刘茜, 郑伟然. 桂枝茯苓胶囊联合米非司酮治疗子宫肌瘤临床疗效和安全性的系统性评价[J]. 中医药现代化, 2016, 18(3):543-551.
[23] 张恒柱, 武永康, 李耀华, 等. 米非司酮对人脑膜瘤治疗作用的实验研究[J]. 中华神经外科杂志, 2005, 21(1):51-54.
[24] 刘桂君, 陈国江, 黎燕. 血管内皮生长因子在肿瘤生长转移中的作用机制研究进展[J]. 国际药学研究杂志, 2012,39(5):391-395.
[25] 赵公平, 刘兴, 王梦溪. 米非司酮治疗多囊卯巢综合征的疗效观察(附临床病例96例) [J]. 中华妇科杂志, 2008, 10(3):22-23.
Effects of Mifepristone on Expression of Integrin αvβ3and Vascular Endothelial Growth Factor in Wistar Rats at Implantation Window Phase
TANG Bin, LI Fu-rong, FU Xing-Lu, JIANG Guo-Jian, ZHAO Yong, ZHANG Wei
(Laboratory Animal Center of Sun Yat-sen University, Guangzhou 510080, China)
ObjectiveTo investigate the effect of mifepristone on the expression of integrin αvβ3and vascular endothelial growth factor (VEGF) gene, and the effect on ultrastructure of endometrium at implantation window phase in Wistar rats.MethodsThirty-six Wistar rats were divided to four groups,the rats of two experimental groups were orally administered with 5 mg/kg, 10 mg/kg of mifepristone respectively one day after conception. The endometrium was collected 4.5 days after mate both in two experimental groups and two control groups. Ultrastructure of the endometrium were observed by transmission electron microscope, and the expression of integrinαvβ3andVEGFgene in endometrial were tested by RT-PCR method, meantime, the contents of estrogen and progesterone in serum were detected by ELISA technique.ResultsMifepristone can inhibits the expression of integrin αvβ3, VEGF and progesterone, and increase the content of estrogen (P>0.05). The down-regulation of the three factors and the changes of the ultrastructure of endometrium has obvious dose-response relationship with mifepristone.ConclusionThe expression of integrinαvβ3andVEGFgene were decreased differently by mifepristone as well as the content of progesterone, eventually it will affect the ultrastructure of endometrium.
Mifepristone; Integrin αvβ3; Vascular endothelial growth factor (VEGF); Estrogen;Progesterone
Q95-33
A
1674-5817(2017)05-0399-06
10.3969/j.issn.1674-5817.2017.05.011
2017-04-20
广东省科技基础条件建设项目(No. 2012B060300015)
唐 彬(1989-), 男, 硕士, 主要从事实验动物研究。E-mail: 761284837@qq.com
张 薇(1964-), 女, 硕士, 高级实验师, 从事中西医结合基础和实验动物研究工作。E-mail: zwygqj@163.com
