不同剂量褪黑素对多浪羊受胎及产羔效果的影响
2017-12-28新疆农业大学动物科学学院乌鲁木齐830052中国农业大学动物科技学院北京100193
(1.新疆农业大学动物科学学院,乌鲁木齐 830052;2.中国农业大学动物科技学院,北京 100193)
doi:10.6048/j.issn.1001-4330.2017.11.019
不同剂量褪黑素对多浪羊受胎及产羔效果的影响
阿尔曼·海热1,艾合买提江·吐尔逊1,宋玉坤1,2,王旭光1,努日比娅姆·麦麦提托合提1,刘国世1,2,阿布力孜·吾斯曼1
(1.新疆农业大学动物科学学院,乌鲁木齐 830052;2.中国农业大学动物科技学院,北京 100193)
目的研究褪黑素对多浪羊受胎及产羔效果的影响,提高多浪羊繁殖率。方法研究注射褪黑素提高受胎率和产羔率的方法,选择年龄、胎次、体况相似的57只多浪羊母羊,试验羊随机分为三组同时进行同期发情处理,并在撤栓36 h后皮下注射褪黑素注射剂。试验1组1 mL (5 mg)、试验2组2 mL (10 mg) 、对照组0 mL。并在埋栓前(中午12:00)、撤栓时(中午12:00)、撤栓后36 h(晚上24:00)、配种时(撤栓后48 h,中午12:00)、配种后20 d五个时间段采集血清,采用放射免疫法对其褪黑素含量进行测定与分析;配种后第45 d采用B超监测法检测三组的受胎率;在产羔后比较这三组的产羔率。结果试验1组受胎率显著高于试验2组和对照组(P<0.05),试验2组与对照组之间差异不显著(P>0.05);对产羔率而言,三组之间相互比较后无统计学差异(P>0.05)。结论对多浪羊进行同期发情处理时,撤栓后36 h皮下注射1、2 mL褪黑素会提高受胎率,其中1 mL的受胎率高于2 mL ,但是对产羔率无显著影响。
褪黑素;多浪羊;受胎效果;产羔
0 引 言
【前人研究进展】褪黑素(Melatonin , MT)发现于上世纪20年代,是McCord和Allen在牛松果腺提取物中分离出的一种使小蜡蚌皮肤黑色素发生凝聚反应从而变白的物质,因而得名[1]。褪黑素可结合 OH、次氯酸(HOCl)、H2O2等活性氧,还能与氧化氮基(NO)及过氧亚硝酸根(ONOO-)等结合,是一种广谱抗氧化剂[2]。此外,褪黑素还可以有效地减少氧化应激引起的染色体和线粒体DNA的损伤,起到抑制细胞凋亡的作用[3]。褪黑素作为强抗氧化剂已经应用在牛、羊、猪、老鼠、家禽等多种动物的卵泡发育、卵母细胞成熟以及胚胎发育等各方面[4]。褪黑素作为一种强抗氧化剂,经常运用在体外细胞、胚胎培养中。对动物体直接注射或埋植褪黑素的研究,正在起步阶段。现今已在鸡、鹅等家禽,以及牛、鹿等动物身上直接注射或埋植过,最终得出对其繁殖性能方面有积极作用的结果[5]。目前褪黑素在动物生殖生产当中的研究不断发展,在抗氧化、抗衰老、提高雄性动物的精液品质、雌性动物卵母细胞的发育等方面取得了一些成绩[6]。在绵羊上通过埋植褪黑素来诱导母羊提前发情的研究也取得了较好的成果[7]。研究注射褪黑素提高受胎率和产羔率的方法,以达到提高多浪羊的繁殖率为目的。【本研究切入点】对绵羊进行注射褪黑素的研究尚未有报道。试验通过注射褪黑素,研究对多浪羊受胎及产羔效果的影响。【拟解决的关键问题】
1 材料与方法
1.1 材 料
1.1.1 试验动物
选择繁殖周期正常,健康无病,体况大致相同(体重、手术次数、年龄、经产次数等差异不大)2~4岁的多浪羊空怀母羊57只进行试验。
1.1.2 所用材料与药品
于2016年11月~2017年4月在和田地区洛浦县真心养殖农民专业合作社进行。埋栓枪,脱脂棉,纱布,口罩,手套,注射器(1、5、10和50 mL),温度计,玻璃棒,石蜡油,假阴道,集精杯,精液稀释液,显微镜,盖玻片,载玻片,生理盐水,酒精,碘液,头灯,开腔器,输精器,腹腔镜,腹腔镜输精器,采血管。
羊用孕酮硅胶阴道栓(CIDR),孕马血清促性腺激素(PMSG)为宁波三生药业生产,促性腺激素释放激素(A3)由上海市计划生育科学研究所提供,褪黑素注射剂(MT)自制。
1.2 方 法
1.2.1 试验分组
将57只试验母羊随机分为三组,试验1组(20只)、实验2组(20只)、对照组(17只)。试验1、2组撤栓后36 h注射褪黑素,试验1组注射1 mL(5 mg)、试验2组注射2 mL(10 mg),对照组不做处理。保证使用相同的饲料饲喂,自由饮水。
1.2.2 试验羊处理
对试验羊埋植孕酮海绵阴道栓(CIDR)进行同期发情处理。每组随机挑选6只试验羊做出标记,在实验过程中分别于埋栓前(中午12:00)、撤栓时(中午12:00)、撤栓后36 h(晚上24:00)、配种时(撤栓后48 h,中午12:00)、配种后20 d五个时间段采集血清。
在埋植后的第13 d撤栓,注射孕马血清(PMSG),进行采血分离血清,标记为第一次采样。在撤栓后第36 h进行第二次采血,同时注射褪黑素针剂。撤栓后第48 h进行人工授精,并注射促排3号(A3),同时采血。配种后第20 d采血。输精后第45 d进行B超检测,产羔后统计产羔数量。
1.2.3 输精
试验采用腹腔镜人工输精方法,在撤栓后第48 h统一对所有试验羊进行输精。输精前12~24 h输精母羊禁食空腹;手术器械等提前用0.1%新洁尔灭液浸泡30 min。将待输精羊保定在手术移植车上,手术部位经剪毛、剃毛、常规消毒,术时呈仰卧斜倒立保定,角度为45~60°。在输精时,腹腔镜的套管穿刺针在输精母羊腹部乳房下10~14 cm处的位置刺入最佳,并且1.0和0.5 cm直径穿刺针应分别在腹中线两侧刺入,其中0.5 cm直径穿刺针刺入的方向应以操作者最适宜的操作手臂侧为主,这样可便于使用骨科长钳进行母羊卵巢状况观察及进行子宫内输精针的操作。当确定所观察母羊可以进行输精时,用套管长钳将要输精侧的子宫角调整到子宫角中线正对视野方向,以便于进行输精操作。然后撤出套管长钳,在子宫内输精枪吸入精液后,插入刚刚撤出长钳的套管内,借助于冷光源探头的观察,沿着子宫角正中线,靠近子宫体侧的子宫角上1/3处[8],调整好子宫内输精枪的方向后,以点式快速刺入的手法,将输精枪的前端细针完全刺入子宫角内,刺入的感觉类似于用针刺破有弹性的乳胶手套或气球,然后慢慢将精液输到子宫角内。
1.2.4 血液样品采集
颈静脉采集5 mL血液,置于含有促凝剂的采血管中,3 000 转/分离心10 min,取上层血清置于1.5 mL灭菌离心管中,-80℃保存备测。
血样测定是由北京北方生物技术研究所有限公司,采用放射免疫法在XH6080放免仪上进行检测。收集所有样品后,进行一次检测,批内变异系数为2.4% 。图1

图1 褪黑素测定标准曲线
Fig.1 Standard curve of melatonin
1.3 数据处理
数据先用Excel作初步统计,采用SPSS软件进行重复数不等的方差分析,处理间的差异采用LSD、Duncan检验。所有数据均以平均值±标准差表示,以P<0.05 作为差异显著性评判标准。
2 结果与分析
2.1 血液中褪黑素的变化
研究表明,在埋栓之前这三组血液中褪黑素含量都较低,在撤栓时都有了明显的提高,其中试验1组与试验2组直到配种时,血液中褪黑素的变化都呈现稳定的上升趋势,在配种后第20 d则表现出显著的下降(P<0.05);但是对照组从埋栓时到撤栓后36 h,血液中褪黑素的变化呈现出下降,在配种时则表现出显著的上升,在配种后第20 d也表现出一定的上升趋势,而且明显高出试验1、2组(P<0.05);试验1组与试验2组之间褪黑素含量的变化没有显著差异(P>0.05),只是在配种时试验1组血液中褪黑素的含量略高于试验2组。表1,图2
表1 血液中褪黑素变化
Table 1 Changes of melatonin in blood

组别第一次采血(埋栓之前)褪黑素浓度(pg/m)第二次采血(撤栓时)褪黑素浓度(pg/mL)第三次采血(撤栓后36h)褪黑素浓度(pg/mL)第四次采血(配种时)褪黑素浓度(pg/mL)第五次采血(配种后第20d)褪黑素浓度(pg/mL)试验1组83.640206.5597a360.894A542.658a248.3505a试验2组102.352301.2783b467.717A512.9386a308.5272b对照组75.825343.123b204.55BB427.7203b538.2356AB
注:同列数据,肩标不同小写字母表示差异显著(P<0.05);肩标相同或不标表示差异不显著(P>0.05);肩标不同大写字母表示差异极显著(P<0.01),下同
Note:in the same row, values with different lower case letter superscripts mean significant difference(P<0.05); with the same superscripts or non-letter mean no significant difference(P>0.05); While with different capital letters mean significant difference (P<0.01), the same as below

图2 血液中褪黑素变化
Fig.2 changes of melatonin in the blood
2.2 注射不同褪黑素剂量对受胎及产羔效果的影响
研究表明,试验1组受胎率为75.0%,试验2组为55.0%,对照组为58.82%。由此可以看出,试验1组的受胎率明显高于其他两组(P<0.05);而试验2组与对照组之间差异并不显著(P>0.05)。
对产羔率而言,对照组为80.00%,试验1组产羔率为86.67%,试验2组为90.91%。试验结果显示,三组之间相互比较后无统计学差异(P>0.05),说明对多浪羊进行同期发情处理,在撤栓后36 h皮下注射1 mL、2 mL褪黑素对于多浪羊产羔率无影响。表2
表2 注射不同剂量褪黑素下受胎及产羔效果
Table 2 The effect of injection of different doses of melatonin on pregnancy and lambing effect
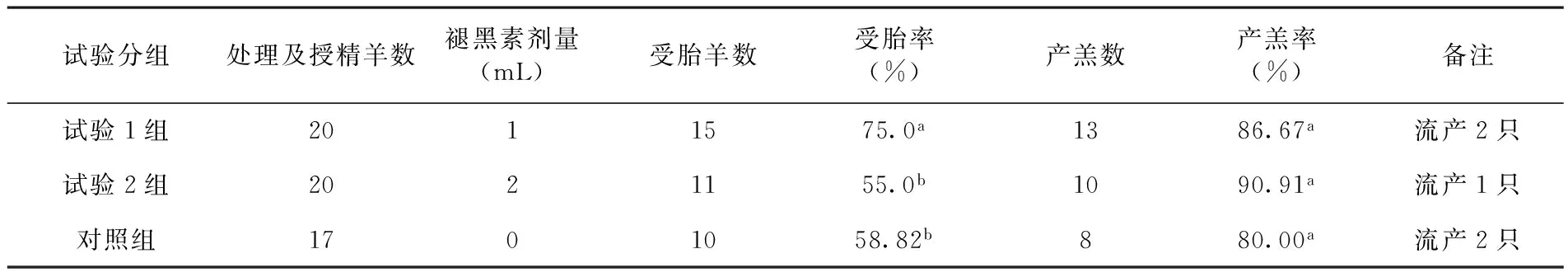
试验分组处理及授精羊数褪黑素剂量(mL)受胎羊数受胎率(%)产羔数产羔率(%)备注试验1组2011575.0a1386.67a流产2只试验2组2021155.0b1090.91a流产1只对照组1701058.82b880.00a流产2只
3 讨 论
3.1 血液中褪黑素的变化
新疆绵羊品种大多数属于季节性发情,一般在秋季配种,春季产羔。在自然光周期条件下,春夏季的光周期延长和夏季至后的光周期缩短共同协调母羊在秋季进入繁殖季节,春夏两季的长光照起着协调内源节律的作用,从而使绵羊在秋季自发启动生殖活性,传统上将绵羊划成“短光照型生殖动物”[9]。有研究表明,褪黑素对羊的生殖活动影响较大,如能使公母羊初情期提前、促进卵母细胞的发育、提高精子质量等[6]。褪黑素能直接调控卵巢的生理功能,参与调节卵泡发育、卵母细胞成熟等功能。在哺乳动物卵巢中存在褪黑素的两种膜受体和核受体。褪黑素在卵巢中的一些功能可以通过膜受体介导,这些受体广泛的存在于成熟卵泡中的卵泡膜细胞、颗粒细胞和黄体细胞上[2]。
杨启堂等[10]褪黑素分为2组:150 mg/只,300 mg/只的剂量。45 d后,抽取血样并进行检测。试验结果发现,当用150 mg/只和300 mg/只的剂量处理雌性马鹿后,血液中褪黑素的水平为41.398和45.422 pg/mL,而未处理组中褪黑素的水平为44.011 pg/mL,说明只有褪黑素达到一定剂量后,才会增加马鹿血液中褪黑素的浓度。在试验中对试验1、2组注射褪黑素后,血液中的褪黑素含量呈现出上升趋势,但是与对照组的差异不显著(P>0.05)。这与杨启堂等[10]的试验结果一致,证明褪黑素剂量需达到一定数值,才会增加血液中褪黑素的浓度。
王梁等[11]在试验中得出,对照组母鹿的褪黑激素浓度在撤栓前呈下降趋势,撤栓后褪黑素迅速下降。在试验中对照组在撤栓后36 h呈现下降趋势,这与王梁等[11]的试验结果一致。而试验1、2组呈现上升趋势,这说明注射褪黑素可以使血液内褪黑素水平升高。
试验1、2组从撤栓时直到配种时,血液中褪黑素的变化都呈现稳定的上升趋势,在配种后第20 d则表现出显著的下降(P>0.05);但是对照组从埋栓时到撤栓后36 h,血液中褪黑素的变化呈现出下降趋势,在配种时则是显著的上升(P<0.05),在配种后第20 d也表现出一定的上升,而且明显高出注射了试验1、2组(P>0.05);试验1、2组间,只有在配种时试验1组血液中褪黑素的含量高出了试验2组,而其他时间段试验1组均小于试验2组,但是并没有呈现出显著差异(P>0.05)。
3.2 注射不同褪黑素剂量对受胎及产羔效果的影响
褪黑素对生殖系统的作用对动物种类、生理状态不同的个体表现出抑制、促进或无作用等多重性。有学者通过改变光照时间长短、测定动物体内MT水平、给予外源性MT等方式初步得出结论,MT对牛、鼠类、禽等动物和人的生殖系统的发育表现出抑制作用;但对绵羊、鹿等动物表现出促进作用;而对光不敏感的动物无作用[12-13]。褪黑素能直接调控卵巢的生理功能,参与调节卵泡发育、卵母细胞成熟等功能。在哺乳动物卵巢中存在褪黑素的两种膜受体和核受体。褪黑素在卵巢中的一些功能可以通过膜受体介导,这些受体广泛存在于成熟卵泡中的卵泡膜细胞、颗粒细胞和黄体细胞上[2]。
史建民等[14]研究发现了一个与奶牛受胎率关系密切的指标——配种时血液中褪黑素的浓度。研究发现,配种时血液中褪黑素浓度高的奶牛配种后更容易妊娠。通过皮下注射的方式增加血液中褪黑素的浓度可以提高奶牛的产后首次配种受胎率,夏季可达到(26.15±2.00)%,春季可达到(44.00±2.28)%,还可以降低死胎率,而对犊牛性别、体重和成活率没有影响。试验中试验1组在配种时血液中褪黑素浓度高于试验2组和对照组,受胎率也显著高于这两组(P<0.05),这一结果与史建民等[14]的研究结果一致。以此证明,配种时血液中褪黑素浓度高的绵羊容易妊娠,且褪黑素有提高受胎率的作用。但是输精前注射褪黑素对产羔率没有影响,这可能是由于褪黑素针剂的作用效果持续时间短有关,因此,褪黑素对提高绵羊产羔效果的作用有待进一步研究。
4 结 论
4.1 对多浪羊进行同期发情处理时,撤栓后36 h皮下注射1和2 mL褪黑素会使得母羊血液内的褪黑素水平升高,并且试验1组与试验2组之间褪黑素水平的变化没有显著差异。
4.2 对多浪羊进行同期发情处理时,撤栓后36 h皮下注射1和2 mL褪黑素会提高受胎率,其中1 mL的受胎率高于2 mL。
4.3 对多浪羊进行同期发情处理时,撤栓后36 h皮下注射1和2 mL褪黑素对多其产羔率无显著影响。
参考文献(References)
[1] 张振南,陈丹朔,任立坤,等.褪黑素提高热应激猪卵母细胞的质量[J]. 黑龙江畜牧兽医, 2015,(23):7-9, 13, 309.
ZHANG Zhen - nan, CHEN Dan - shuo, REN Li - kun, et al. (2015). Study on melatonin to improve the quality of heat - stressed procine oocytes [J].JournalofHeilongjianganimalhusbandryandveterinary, (23): 7-9, 13, 309. (in Chinese)
[2] Reiter, R., Rosalescorral, S., Manchester, L., & Tan, D. X. (2013). Peripheral reproductive organ health and melatonin:, ready for prime time.InternationalJournalofMolecularSciences, 14(4): 7,231-7,272.
[3] Tamura, H., Takasaki, A., Taketani, T., Tanabe, M., Kizuka, F., & Lee, L., et al. (2012). The role of melatonin as an antioxidant in the follicle.JournalofOvarianResearch, 5(1): 5.
[4] 汪锋. 白藜芦醇和褪黑素对卵母细胞成熟及胚胎发育的作用机制[D].北京:中国农业大学博士学位论文,2014.
WANG Feng. (2014).MechanismsofResveratrolandMelatoninonOocyteMaturationandEmbryoDevelopment[D]. PHD Thesis. China Agricultural University, Beijing. (in Chinese)
[5] 李连瑞,何良军,吴静.褪黑激素对生殖的调控机理及其在动物繁殖中的作用和应用前景[J].动物科学与动物医学,2002,19(3):4-11.
LI Lian - rui, HE Liang - jun, WU Jing. (2002). Regulation mechanism of melatonin on reproduction and its application in animal reproduction[J].JournalofAnimalScience&VeterinaryMedicine, 19(3):4-11. (in Chinese)
[6] 刘森,李海涛.褪黑素在牛、羊生产中的应用[J].中国畜牧兽医文摘, 2016,32(12): 53, 78.
LIU Sen, LI Hai - tao. (2016). Application of melatonin in the production of cattle and sheep[J].JournalofChineseAbstractsofAnimalHusbandryandVeterinaryMedicine, 32(12):53, 78. (in Chinese)
[7] 张海容.褪黑素调控绵羊季节性发情的研究进展[J].河北农业科学,2008,12(12):44-46, 155.
ZHANG Hai - rong. (2008). Research progress of melatonin regulating seasonal oestrus in sheep[J].JournalofHebeiAgriculturalSciences,12(12):44-46, 155. (in Chinese)
[8] 刘玉峰.子宫内输精技术在绵羊生产中的应用研究[J].黑龙江农业科学,2007,(5):77-79.
LIU Yu - feng. (2007). Applied Research of Intrauterine Insemination Technology on Sheep Production [J].JournalofHeilongjiangAgriculturalSciences, (5):77-79. (in Chinese)
[9] 孙儒泳.动物生态学原理[M]. 第二版. 北京: 北京师范大学出版社,1992:81-88.
KONG Ru-yong. (1992).Theprincipleofzooecology[M]. second Ed. Beijing: Beijing Normal University Publishing House: 81-88. (in Chinese)
[10] 杨启堂,王勇,师培生,等.外源褪黑素对马鹿生殖生理影响的探讨[J]. 新疆畜牧业, 2015,(5):21-23.
YANG Qi-tang, WANG Yong, SHI Pei-sheng, et al. (2015). To investigate the effects of exogenous melatonin on reproductive physiology of red deer[J].Xinjiangxumuye, (5):21-23. (in Chinese)
[11]王梁,刘国世,史文清,等.外源褪黑激素对梅花鹿超数排卵及体内促性腺激素的影响[C]//. 2011年中国鹿业进展,2011:190-199.
WANG Liang, LIU Guo-shi, SHI Wen-qing, et al. (2011).EffectsofExogenousMelatoninonSuperovulationandGonadotrophinHormonesinSiksDeer[C]//. Proceeding of Progress of deer industry in China in 2011: 190-199. (in Chinese)
[12] 徐金会.褪黑激素的生物学作用[J].曲阜师范大学学报(自然科学版),2002,28(3):91-93.
XU Jin-hui. (2002). Biological effects of melatonin [J].JournalofQufuNormalUniversity(NaturalScienceEd.) , 28(3):91-93. (in Chinese)
[13] 陈国华, 王建新. 外源性褪黑激素对雄性小鼠外周免疫与生殖相关性影响的初步研究[J]. 解剖科学进展,2004,10(8):7-11.
CHEN Guo-hua, WANG Jian-xin. (2004).Effects of exogenous melatonin on peripheral immunity and reproduction in male mice[J].JournalofProgressofAnatomicalSciences, 10(8):7-11. (in Chinese)
[14] 史建民.褪黑素降低牛奶体细胞数和提高奶牛繁殖性能的研究与应用[D].北京:中国农业大学博士学位论文,2015.
SHI Jian-min. (2015).StudyofMelatoninonReducingSomaticCellsandImprovingReproductivePerformanceinDairyCows[D].PhD Thesis. China Agricultural University, Beijing. (in Chinese)
EffectsofDifferentDosesofMelatoninonDuolangSheepPregnancyandLambingEffect
Aerman Haire1, Aihemaitijiang Tuerxun1, SONG Yu-kun1,2, WANG Xu-guang1,Nuribiyamu Maimaitituoheti1, LIU Guo-shi1,2, Abulizi Wusiman1
(1.CollegeofAnimalScience,XinjiangAgriculturalUniversity,Urumqi830052,China;2.CollegeofAnimalScienceandTechnology,ChinaAgriculturalUniversity,Beijing100193,China)
ObjectiveTo study the influence of melatonin on Duolang sheep pregnancy and lambing effect, to select the optimal amount to improve the pregnancy rate and lambing rate and improve the reproduction rate.MethodThis study selected 57 Duolang sheep ewes with similar age, parity and body condition from November 2016 to April 2017 to conduct experiments in the professional farmers' cooperatives in Luopu County of Hotan area. Sheep were randomly divided into three groups at the same time for the same period of estrus, and after the withdrawal of 36 hours, the test group I was injected melatonin 1 mL (5 mg), the test group II 2 mL (10 mg), the control group 0ml. And before the burying bolt (12 o'clock midday), bolt withdrawal (12 o'clock midday), 36 hours after the bolt withdrawal (12 o'clock midnight), the breeding (48 hours after embolization, serum withdrawal) of the five time periods for 20 days after the acquisition of its breeding, melatonin contents were determined and analyzed by radioimmunoassay; forty-fifth days after mating, they went through B-monitoring assay in three groups' pregnancy for the lambing rate; After the birth, the lambing rate of the three groups was compared.ResultThe test results showed that the pregnancy rate of test group I was significantly higher than that of the test group II and the control group (P< 0.05), there was no significant difference between test group II and control group (P> 0.05); As for the the lambing rate, comparison between the three groups demonstrated no significant difference (P> 0.05).ConclusionWhen treating Duolang sheep estrus, subcutaneous injection of 1 mL, 2 mL melatonin 36 hours after the withdrawal of thrombus can improve the pregnancy rate. The pregnancy rate of 1 mL injection amount is higher than that of 2 mL injection, but no significant effect is found on the lambing rate.
melatonin; Duolang sheep; pregnancy effect; lambing
Supported by: Science and Technology Supporting Xinjiang Program (2016E02037), National Spark Program (2015GA890002) and The China Agricultural University - Xinjiang Agricultural University Joint Fund Project(2015TC050)
Abulizi Wusiman(1968-), male, from Xinjiang, doctor’s degree, professor, research area is animal reproduce and Embryo biotechnology, (E-mail) abulizi68@126.com
S826.3+1
A
1001-4330(2017)11-2111-07
2017-05-17
新疆维吾尔自治区科技支疆项目“”(2016E02037);国家星火计划项目“”(2015GA890002);中国农业大学-新疆农业大学联合基金项目“”(2015TC050)
阿尔曼·海热(1991-),男,新疆人,硕士研究生,研究方向为动物生殖生理与繁殖技术,(E-mail)arman.hairy@foxmail.com
阿布力孜·吾斯曼(1968-),男,新疆和田人,教授,博士,研究方向为动物繁殖与胚胎生物技术,(E-mail)abulizi68@126.com
