栽培种花生RIL群体荚果及籽仁性状遗传变异分析
2017-12-26刘佳琪李英杰杨会刘风珍万勇善张昆吕玉英张秀荣
刘佳琪+李英杰+杨会+刘风珍+万勇善+张昆+吕玉英+张秀荣

摘要:以花生栽培品种山花15号与中花12号杂交,经多代自交获得的包含441个家系的F5-7重组自交系群体为材料,分别在2014—2016年3个环境条件下(E1、E2和E3)种植,对荚果及籽仁的6个产量相关性状进行遗传变异分析。结果表明,花生果宽、单果重、单仁重和果壳厚度主要受3对主基因控制,表现为完全等加性效应或加性上位性效应,主基因遗传率分别为88.11%、87.58%、78.12%和87.31%;果长主要受2对或3对主基因控制,基因间存在加性上位性或隐性上位性效应,主基因遗传率为90.29%。以上5个性状除单仁重外,在不同环境中遗传率均表现稳定,适合在早期世代进行选择。单株生产力在3个环境中受主基因和多基因共同控制,主基因遗传率平均为22.49%,多基因遗传率平均为 71.24%。
关键词:花生;RIL群体;荚果和籽仁性状;遗传分析
中图分类号:S565.201文献标识号:A文章编号:1001-4942(2017)11-0013-07
Genetic Variation Analysis of Pod and Kernel Traits
in Cultivated Peanut RIL Population
Liu Jiaqi, Li Yingjie, Yang Hui, Liu Fengzhen, Wan Yongshan,Zhang Kun, Lü Yuying, Zhang Xiurong
(College of Agronomy, Shandong Agricultural University/State Key Laboratory of Crop Biology/
Key Laboratory of Crop Biology of Shandong Province, Taian 271018, China)
AbstractThe F5-7 RIL population consisting of 441 stable families was obtained after successive inbreeding from F2 generation of the cross of peanut cultivar Shanhua 15 and Zhonghua 12. The genetic variation analysis was performed in 6 yield-related traits of pods and seed kernels. The RIL population was planted under 3 environmental conditions (E1, E2 and E3) in 2014-2016. The results showed that the pod width (PW), single pod weight (SPW), single-seed weight (SSW)and pod shell thickness (PST) were controlled by 3 pairs of major genes, which showed complete additive or additive-epistatic effects. The major gene heritability of PW, SPW, SSW and PST were 88.11%, 87.58%, 78.12% and 87.31% respectively. The pod length (PL) was controlled by 2 or 3 pairs of major genes, which showed additive-epistatic or recessive-epistatic effects, and its major gene heritability was 90.29%. Except SSW, the above 5 traits all showed stable heritability in different environments, so they were suitable for selection in the early generations. The total pod weight per plant was controlled by major genes plus polygenes in the 3 environments, and its major gene heritability was averagely 22.49%, while its polygene heritability was 71.24%.
KeywordsPeanut; Recombinant inbred line (RIL) population; Pod and kernel traits; Genetic analysis
花生是热带和亚热带地区广泛种植的经济和油料作物,2016年产量约为4 600万吨[1]。我国是世界上重要的花生生产、消费和出口大国。2015年我国花生播种面积为461.57万公顷,总产1 643.97万吨(中国种植业信息网,2015)。因逐年增加的消费需求,目前花生育种工作的主攻方向仍是高产育种。前人利用主基因+多基因混合遗传模型分析方法对数量性状的表型特征进行过描述,可在一定程度上认识花生复杂数量性状的遗传规律[2,3],并主要集中于花生的品质性状[4-6]和農艺性状[7,8]。本研究以包含441个家系的重组自交系群体为研究材料,利用章元明教授提供的G3DH.exe模型软件对花生果长、果宽、果壳厚度、单果重、单仁重和单株生产力6个与产量相关的性状进行遗传分析,以确定该6个性状的最适遗传模型及基因间的作用方式,并通过估计基因的遗传率大小,判断荚果及籽仁性状的基因型效应和环境效应。endprint
1材料与方法
1.1试验材料
本研究以山东农业大学培育的大花生新品种山花15号(P1)为母本,以中国农业科学院油料作物研究所选育的小花生品种中花12号(P2)为父本配制杂交组合,自F2 经单粒传法,多代自交后获得由441个分离家系组成的F5-7代重组自交系群体。
1.2试验方法
田间试验采用完全随机区组设计,分别在2014、2015、2016年3个环境条件下将供试材料种植于山东农业大学农学试验站(泰安),每份材料种植一行,单粒播种,行长为280 cm,行距40 cm。每行14穴,每穴播种3粒种子、定单株苗。田间管理同大田栽培。
收获时每个家系随机选取5株,单独收获(避免边缘效应)。种子风干后进行室内考种,依据《花生种质资源描述规范和数据标准》[9]调查果长、果宽、果壳厚度、单果重、单仁重、单株生产力6个花生产量性状。考种设5个重复,取其平均值。
1.3数据分析
利用软件SPSS 20.0对数据进行方差及遗传变异分析。采用盖钧镒、章元明等[10-12]提出的数量性状主基因+多基因混合遗传模型分离分析方法对2014—2016三年亲本及RIL群体的6个产量相关性状进行遗传分析。
运用G3DH.exe软件,通过迭代ECM算法进行遗传分析。根据AIC最小原则,AIC值最小的模型为相对最佳模型,同时进行一组适合性检验,包括均匀性检验(U21、U22、U23)、Smirnov检验、Kolmogorov检验,根据模型适合性的概率,从备选模型中选择统计量达到显著水平个数最少的模型作为最适模型。由最适模型的各成分分布参数估算主基因及多基因的相关遗传参数,采用最小二乘法估计各基因效应值、遗传方差等。
2结果与分析
2.1花生亲本及RIL群体产量相关性状的遗传变异
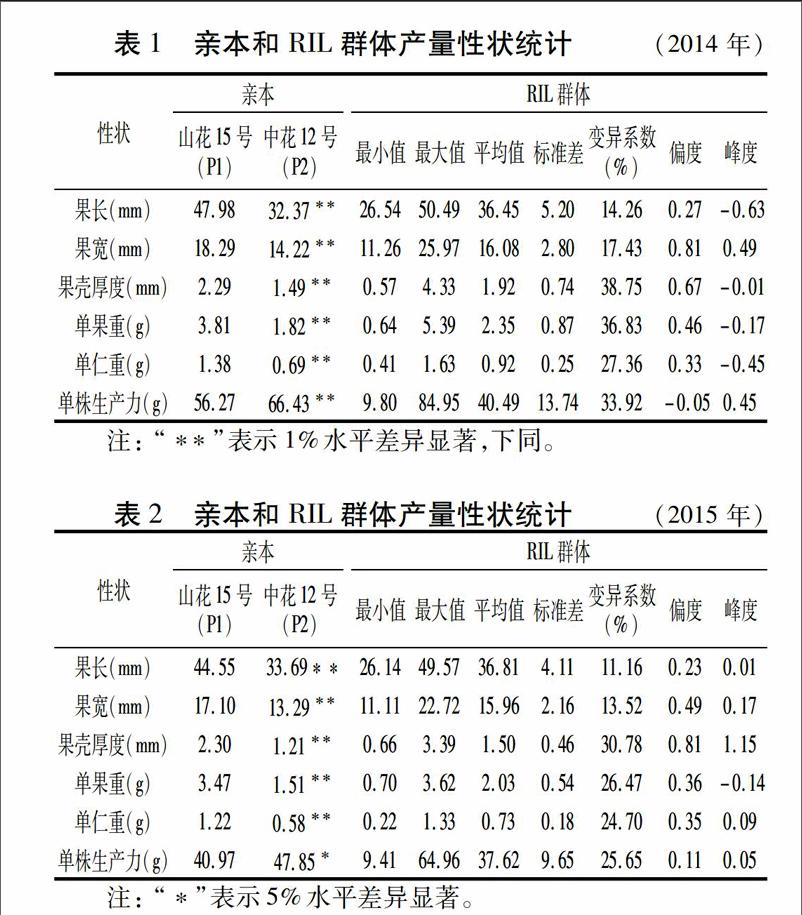
3个年度种植环境的调查结果显示,双亲间6个花生产量性状差异均达到显著或极显著水平(表1~表3);RIL群体6个性状的最大值和最小值均存在超亲类型;由综合标准差和变异系数可看出,群体变异类型丰富,变异系数均大于10%;偏度绝对值均小于1,表现为连续性变异,呈正态分布,具有典型的数量性状特征。因此,该RIL群体适合进行下一步产量性状相关的遗传模型分析。
2.2最适遗传模型研究
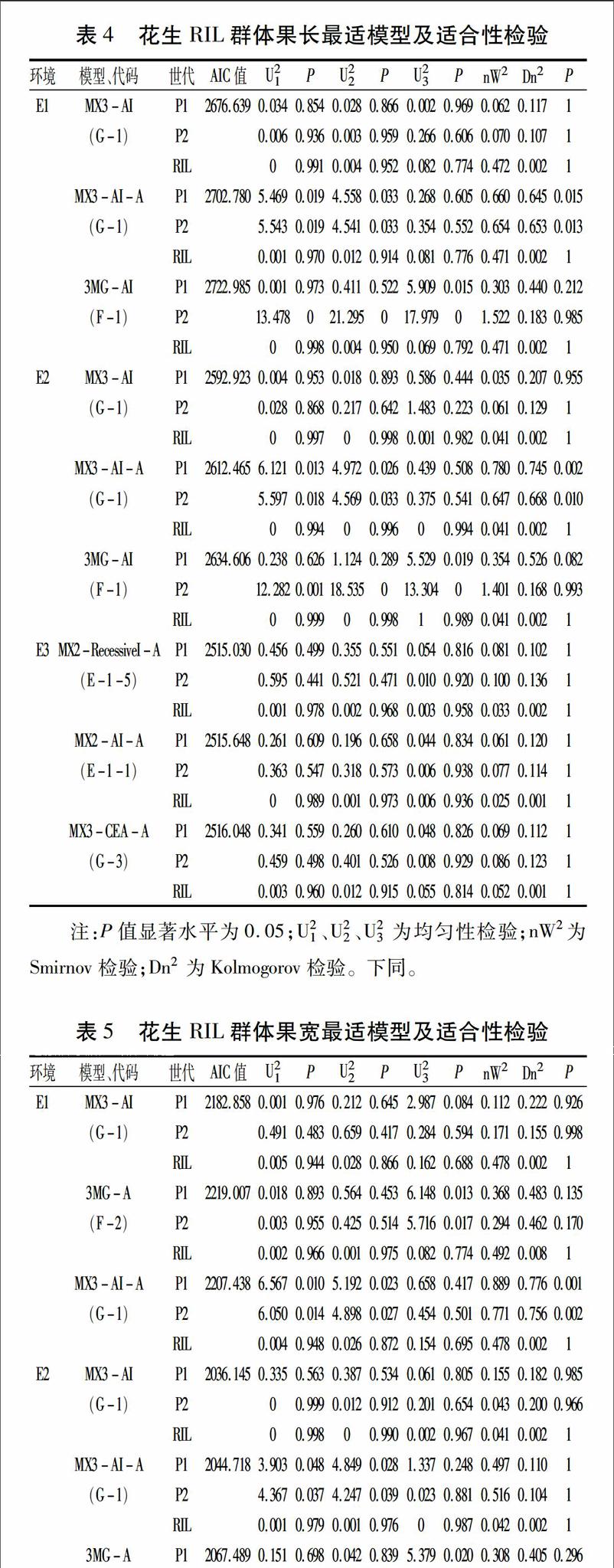
运用模型分析软件G3DH.exe对6个产量相关性状表型数据进行运算,选取AIC值最小及与之较接近的模型为备选模型。果长在环境E1和E2中最适模型均为G-1,即3对具有加性上位性效应的主基因+多基因混合遗传模型,环境E3中的最适模型为E-1-5,即2对具有隐性上位性的主基因+多基因混合遗传模型(表4)。果宽在环境E1和E2中最适模型均为G-1,即3对具有加性上位性效应的主基因+多基因混合遗传模型,环境E3中的最适模型为G-3,即3对具有完全等加性效应的主基因+多基因混合遗传模型(表5)。果壳厚度在E1环境中的最适模型为F-1,即3对具有加性上位性效应的主基因遗传模型;E2和E3环境的最适模型分别为G-1、G-3,即3对具有加性上位性效应的主基因+多基因混合遗传模型和3对具有完全等加性效应的主基因+多基因混合遗传模型(表6)。单果重在环境E1、E2和E3中最适遗传模型分别为G-1、G-1和G-3,即在E1、E2环境为3对具有加性上位性效应的主基因+多基因混合遗传模型,E3环境为3对具有完全等加性效应的主基因+多基因混合遗传模型(表7)。单仁重在3个环境中的最适模型分别为G-1、F-1、G-3,即3对具有加性上位性效应的主基因+多基因混合遗传模型、3对具有加性上位性效应的主基因遗传模型和3对具有完全等加性效應的主基因+多基因混合遗传模型(表8)。单株生产力在3个环境中均检测到多基因效应存在,最适模型分别为E-1-1、E-1-3、E-1-1,即2对具有加性上位性的主基因+多基因混合遗传模型、完全等加性的主基因+多基因混合遗传模型和2对具有加性上位性的主基因+多基因混合遗传模型(表9)。
2.3遗传参数估计
确定各性状的最适遗传模型后,根据最适模型各个成分分布的均值和权重,估算出各性状相应的遗传参数(表10)。果长在E1和E2环境中的最适模型均为G-1,即3对具有加性上位性效应的主基因+多基因混合遗传模型。在E1环境中,3个主基因的加性效应值为-8.893、-5.622、-7.126,两主基因间互作值为-2.985,主基因遗传率为99.69%;在E2环境中3个主基因加性效应值为1.163、0.413、0.857,两主基因间互作值为0.123,主基因遗传率为99.24%;在E3环境中的最适模型为E-1-5,即2对具有隐性上位性的主基因+多基因混合遗传模型,3个主基因加性效应值分别为0.728、0.356、0.570,两主基因间互作值为-0.093,主基因遗传率为71.93%。可见,花生果长的遗传主要受主基因控制,主基因遗传率平均为90.29%,说明果长遗传变异主要由遗传效应决定,受环境影响较小。
果宽在E1和E2环境中的最适模型均为G-1,即3对具有加性上位性效应的主基因+多基因混合遗传模型。在E1环境中,3个主基因的加性效应为4.495、2.900、3.609,两基因间互作值为-1.012,主基因遗传率为99.30%;在E2环境中3个主基因加性效应值分别为-4.130、-2.367、-3.328,两主基因间互作值为-1.203,主基因遗传率为98.80%。E3环境中3个主基因加性效应值均为1.234,多基因效应值为-0.975,主基因遗传率为66.22%。在3个环境中均无多基因效应存在,主要受3对主基因控制,主基因遗传率平均为88.11%,说明果宽遗传变异主要由遗传效应决定,环境因素影响较小。
果壳厚度在3个环境中的最适模型分别为F-1、G-1、G-3。E1环境中表现为3对具有加性上位性效应的主基因遗传模型,3对主基因效应值为1.021、0.445、0.605,两基因间互作值为0.041,主基因遗传率为97.36%,无多基因效应。在E2环境中,3个主基因效应值为0.618、0.323、0.484,两基因间互作值为-0.024,主基因遗传率为96.84%。E3环境中的3个主基因效应值均为0.199,主基因遗传率为67.72%。花生果壳厚度在3个环境中的主基因遗传率平均为87.31%,说明果壳厚度的遗传变异主要由遗传效应决定,受环境影响较小。endprint
单果重在环境E1中表现为3对具有加性上位性效应的主基因+多基因混合遗传模型(G-1),主基因的效应值分别为1.163、0.413、0.857,两主基因间互作值为0.123,主基因遗传率为97.73%。在环境E2中,最适模型为G-1,表现为3对具有加性上位性效应的主基因+多基因混合遗传模型,3个主基因的加性效应值分别为0.728、0.356、0.570,两主基因间的互作值为-0.093,主基因遗传率为97.78%。E3环境中最适遗传模型为MX3-CEA-A(G-3),即3对具有完全等加性效应的主基因+多基因混合遗传模型,主基因的效应值均为0.313,主基因遗传率为67.22%。单果重在3个环境中主基因遗传率平均为87.58%,说明单果重遗传变异主要由遗传效应决定,受环境因素影响较小。
单仁重在环境E1和E3中最适遗传模型分别为G-1、G-3,即3对主基因+多基因混合遗传模型;在环境E2中最适模型表现为3对主基因遗传模型(F-1)。在环境E1中3个主基因的加性效应值分别为0.341、0.009、0.195,两主基因间的互作值为-0.119,主基因遗传率为98.47%。E2环境中3个主基因加性效应值为0.283、0.117、0.214,两主基因间的互作值为-0.011,主基因遗传率为97.31%。E3环境中3个主基因的加性效应值均为0.082,主基因遗传率为38.59%。花生单仁重的主基因遗传率平均为78.12%,且在3个环境中差异较大,表明单仁重的遗传规律较复杂,主基因效应可能随环境的变化而变化。
单株生产力在3个环境中的最适模型为E-1-1和E-1-3,即2对具有加性上位性或完全等加性的主基因+多基因混合遗传模型。在E1环境中,2个主基因的效应值为-10.429、0.091,多基因效应值为17.119,主基因遗传率为59.78%,多基因遗传率为38.98%。E2环境中,2个主基因效应值均为-9.351,主基因遗传率为0.26%,多基因遗传率为88.94%。E3环境下2个主基因效应值分别为6.150和6.145,两主基因间互作值为6.144,主基因遗传率为7.43%,多基因遗传率为85.79%。单株生产力主基因遗传率平均为22.49%,且在不同环境中差异较大,主基因效应可能随着环境变化而改变;多基因遗传率平均为71.24%,且在不同环境中的差异也较为明显。可见,花生单株生产力除受主基因和多基因共同控制外,环境对其影响也较为明显。
3讨论
针对重组自交系群体(RIL)进行数量性状遗传分析具有以下优点:(1)RIL群体为永久性群体,不易受到环境影响;(2)家系间纯合稳定并能准确地估计出主效基因的加性效应值及加性×加性互作值[13]。本研究以山花15号×中花12号为杂交组合,经多代自交获得F5-7重组自交系群体,作为永久性群体进行有重复的比较试验,适合在多个环境条件下对荚果及籽仁相关性状进行遗传研究。
张新友[7]研究表明,花生单株饱果数、单株秕果数、出仁率、百果重、百仁重5个性状的遗传符合等加性遗传模型和加性-显性上位性遗传模型;江建华等[13]研究发现,花生结果枝数、单株总果数、百果重3个产量相关性状的遗传符合加性-显性遗传模型,其中,结果枝数和单株总果数受主基因控制,百果重由主基因和多基因共同控制。赖明芳等[15]研究同样认为,花生产量相关性状的遗传效应以加性效应为主。刘华[16]综合两个环境的调查结果表明,结果枝数、百果重、百仁重、出仁率、单株果重5个性状受主基因和多基因共同控制。
李兰周等[14]利用特大果变异品系04D893与其受体79266杂交构建的RIL群体,在两个环境对荚果及籽仁相关性状的遗传模型分析研究结果表明,花生单果重、单仁重、果壳厚度、果宽、果长和单株生产力6个性状的遗传效应以加性效应为主,均属于2个或3个主基因遗传模型,且主基因遗传率高于多基因遗传率。
本研究同样对花生荚果和籽仁相关的6个产量相关性状进行遗传模型分析,结果表明:花生果宽、单果重、单仁重和果壳厚度主要受3对主基因控制,表现为完全等加性效应或加性上位性效应;其中,果宽、单果重和果壳厚度3个性状的主基因遗传率达到80%以上,且在不同环境中遗传规律较稳定,适合在早期世代进行选择。单仁重的主基因遗传率平均为78.12%,但在不同环境表现不同的遗传规律。花生果长主要受2对或3对主基因控制,基因间存在加性上位性或隐性上位性,主基因遗传率为90.29%,在不同环境中遗传規律稳定,同样适合在早期世代进行选择。单株生产力受主基因和多基因共同控制,表现为加性上位性或完全等加性效应,多基因遗传率高于主基因遗传率,多基因遗传率平均为71.24%,随环境的改变主基因和多基因效应值存在明显差异。对相同的性状进行遗传分析得出与前人研究结果不一致的原因可能为:(1)杂交组合亲本间遗传背景不同;(2)不同的种植环境中,估算的基因遗传率也存在较大差异。
4结论
RIL群体的6个产量相关性状均表现为连续变异,且变异类型丰富,近似正态分布,适合进行遗传模型分析。
本研究初步确定了影响花生产量相关的6个性状的遗传模型:果长环境E1、E2中符合主基因+多基因混合遗传模型,在环境E3中符合2对主基因+多基因混合遗传模型;果宽符合3对主基因+多基因遗传模型;果壳厚度在E1环境中符合3对主基因遗传模型,在E2和E3中符合3对主基因+多基因混合遗传模型;单果重在3个环境中符合3对主基因+多基因混合遗传模型;单仁重在环境E1、E3中遗传符合3对主基因+多基因遗传模型,环境E2中表现为3对主基因模型;单株生产力符合2对主基因+多基因遗传模型。
果长、果宽、单果重和果壳厚度的遗传主要由遗传效应占主导,主基因遗传率分别为90.29%、88.11%、87.58%和87.31%。单仁重和单株生产力则受环境影响较大,单仁重主基因遗传率平均为78.12%;单株生产力主基因遗传率平均为22.49%,多基因遗传率为71.24%。以上结果可为花生高产优质育种的产量相关性状选择提供参考。endprint
参考文献:
[1]Bertioli D J, Cannon S B, Froenicke L, et al. The genome sequences of Arachis duranensis and Arachi sipaensis, the diploid ancestors of cultivated peanut[J]. Nature Genetics, 2016, 48(4):438.
[2]陈四龙,李玉荣,程增书,等.花生含油量杂种优势表现及主基因+多基因遗传效应分析[J].中国农业科学,2009,42(9):3048-3057.
[3]刘恩生.花生蛋白质、脂肪含量及其他农艺性状的配合力和遗传参数分析[J].华北农学报,1987,2(3):18-26.
[4]张新友,韩锁义,徐静,等.花生蛋白质含量的主基因+多基因遗传分析[J].中国油料作物学报,2011,33(2):118-122.
[5]刘华,张新友,崔党群,等.花生蛋白质和脂肪含量的主基因+多基因遗传分析[J].江苏农业科学,2011,39(2):127-130.
[6]黄冰艳,张新友,苗丽娟,等.花生油酸和亚油酸含量的遗传模式分析[J].中国农业科学,2012,45(4):617-624.
[7]张新友.栽培花生产量、品质和抗病性的遗传分析与QTL定位研究[D].杭州:浙江大学,2010.
[8]江建华,王嵩,王晓帅,等.2个环境条件下花生产量性状的遗传分析[J].北方农业学报,2016,44(3):45-51.
[9]姜慧芳. 花生种质资源描述规范和数据标准[M]. 北京:中国农业出版社,2006.
[10]章元明,盖钧镒. 数量性状分离分析中分布参数估计的IECM算法[J].作物学报,2000, 26(6):699-706.
[11]Gai J Y, Wang J K. Identification and estimation of a QTL model and its effects[J]. Theoretical & Applied Genetics, 1998, 97(7):1162-1168.
[12]章元明,盖钧镒.利用DH或RIL群体检测QTL体系并估计其遗传效应[J].遗传学报,2000,27(7):634-640.
[13]江建华,王嵩,汪清,等.花生4个主要农艺性状的遗传分析[J].花生学报,2015,44(3):7-13.
[14]李兰周,刘风珍,万勇善,等.花生荚果和籽仁相关性状的主基因+多基因混合遗传模型分析[J].华北农学报,2013,28(5):116-123.
[15]赖明芳,曾彦,漆燕,等.花生主要经济性状遗传特点分析[J].中国油料作物学报,2007,29(2):148-151.
[16]刘华.栽培花生产量和品质相关性状遗传分析与QTL定位研究[D].鄭州:河南农业大学,2011.山 东 农 业 科 学2017,49(11):20~23,44Shandong Agricultural Sciences山 东 农 业 科 学第49卷第11期任海霞,等:26个香菇菌株的遗传多样性分析DOI:10.14083/j.issn.1001-4942.2017.11.003
收稿日期:2017-09-08
基金项目:山东省现代农业产业技术体系食用菌创新团队建设项目(SDAIT-07-01);新疆自治区科技支疆项目(201591120);山东省重点研发计划项目“食用菌精准化生产模式集成示范与产业化应用”(2016ZDJS08A03)
作者简介:任海霞(1977—),女,副研究员,主要从事农业微生物研究工作。E-mail: sdrenhaixia@163.com
通讯作者:万鲁长(1965—),男,研究员,主要从事食用菌育种及高效栽培技术研究。E-mail: wanluzhang657@163.comendprint
