马铃薯内生真菌的多样性及抑菌活性研究
2017-12-26艾洪莲杨曼思海梅荣郭华春王文祥
艾洪莲,杨曼思,何 隽,海梅荣,郭华春,王文祥,*
(1 中南民族大学 药学院,武汉 430074;2 云南农业大学 农学与生物技术学院,昆明 650201)
马铃薯内生真菌的多样性及抑菌活性研究
艾洪莲1,2,杨曼思1,2,何 隽1,海梅荣2,郭华春2,王文祥1,2,*
(1 中南民族大学 药学院,武汉 430074;2 云南农业大学 农学与生物技术学院,昆明 650201)
从采自德宏、大理、临沧3地健康马铃薯植株的根、茎、叶、块茎中分离、纯化内生真菌,测定了其抑菌活性,并进行形态学和18S rDNA序列分析,确定了内生真菌种属. 共分离得到了493株内生真菌,其中44株对3种马铃薯病害(马铃薯枯萎病、马铃薯黑痣病和马铃薯早疫病)有不同程度的抑制作用. 形态学特性和分子生物学研究结果显示:44株活性内生真菌分属于21个属,具有丰富的多样性;其中篮状菌属、毛壳菌属和附球菌属为马铃薯拮抗活性内生真菌的优势菌属.
马铃薯;内生真菌;生物多样性;抑菌活性
马铃薯(SolanumtuberosumL.)又名洋芋、土豆、薯仔等,是茄科(Solanaceae)茄属(Solanum)多年生草本块茎植物,原产于南美洲安第斯山区,在我国已有数百年的栽培历史,是继水稻、小麦、玉米之后的第四大主粮作物[1],随着主粮化战略的推出,马铃薯种植过程中所面临的制约马铃薯产量的病害日益引起人们的重视. 目前马铃薯病害的防治主要以化学农药为主,在使用过程中易产生“3R1P”,即残留、抗性、害虫再猖獗和环境污染问题.
近来,微生物农药因其源于自然,无污染、低残留等优点,颇受人们的青睐. 植物内生真菌中的拮抗内生真菌可以产生多种多样具农药生物活性的次生代谢产物,为微生物农药的研究和开发提供了宝贵的资源库. 因此对马铃薯共生及协同进化的内生拮抗真菌的研究,已经成为马铃薯病害防治研究的重点方向.
以健康马铃薯植株为材料,分离、筛选具有抑菌活性的内生真菌,对具有拮抗作用的内生真菌进行形态学和分子生物学鉴定,为开发无污染、低残留并且可以使农业生产种植进入可持续良性发展的微生物源农药奠定理论基础.
1 材料与方法
1.1 供试材料
马铃薯植株采自于云南省德宏、大理、临沧三地,新鲜健康,无明显病虫害,取材部位为根、茎、叶、块茎.供试靶标病原菌株:马铃薯枯萎病(Fusariumoxysporum),标记为S01;马铃薯黑痣病(Rhizoctoniasolani),标记为S02;马铃薯早疫病(Alternariasolani),标记为S04. 马铃薯病原真菌菌株由河北农业大学提供.
1.2 内生真菌的分离、纯化
将健康马铃薯植株的根、茎、叶、块茎在自来水下冲洗干净,擦干,根、茎、块茎剪成3 cm的小段,叶剪成3 cm×3 cm的小片,按下列程序进行表面灭菌:无菌条件下,75%乙醇漂洗1 min,无菌水冲洗3次;2%次氯酸钠消毒(消毒时间:根3 min;茎2.5 min;叶2 min)或者0.1%升汞消毒(消毒时间:根40 s;茎30 s;叶20 s)、无菌水漂洗3次;然后放置于无菌滤纸上将水分吸干. 将表面消毒后的根、茎、块茎剪去两端切口,剩余段从中间剖开,剪成(0.3~0.5) cm3的小块,叶剪去四周后将剩余部分剪成0.3 cm×0.3 cm小块.
消毒有效性评价采取3种方法[2]:1) 在内生真菌分离操作的同时将未使用过的培养基平板盖子打开,暴露在无菌操作工作台上;2) 取少量的第3次无菌水漂洗液涂布于新的培养基平板上;3) 用组织印迹法,将表面消毒好待处理的完整根、茎枝段和叶片在未使用过的培养基平板上轻轻滚动或紧贴培养基放置5 min后移走. 将上述3种处理的培养皿置于22~25 ℃培养箱中与分离培养基共同培养,三者均未有杂菌生长,表明此分离方法所得到的真菌即为马铃薯内生真菌而非附生菌.
采用顶端菌丝纯化法,每日定期观察内生真菌长出情况,将切口处新长出的菌丝挑取尖端部分转接至PDA培养基上,纯化培养至获得纯菌株. 将纯化后的纯菌株于4 ℃冰箱保存.
1.3 内生拮抗真菌的筛选
初筛:采用平板对峙拮抗实验法. 在9 cm的PDA平板上,分别接种待测内生真菌菌株和靶标病原真菌,间距为5 cm,同时设置只接靶标病原真菌的平板作为对照,置于22~25 ℃培养箱中培养3~5 d,观察菌株生长情况和菌株间的拮抗现象.
复筛:在PDA培养基上接种已经纯化好待检测活性的内生真菌,22~25 ℃活化72 h后,挑取内生真菌接种至大米固体培养基上(三角瓶中装入等量的大米和水),22~25 ℃培养20~30 d,捣碎,加入2倍体积95%的甲醇提取3次,每次浸泡24 h,过滤得到甲醇提取液,合并、减压浓缩成浸膏,加入等体积的乙酸乙酯和水萃取4~5次,将萃取的乙酸乙酯部分合并浓缩得到各个不同内生真菌的浸膏,分装转移至小瓶标记.
在PDA培养基上活化病原真菌,制成菌悬液,菌体终浓度调至1×106CFU/mL,取200 μL菌悬液均匀涂布于PDA平板培养基上,用直径8 mm的打孔器打孔, 取50 μL待测内生真菌溶液(以DMSO稀释内生真菌浸膏至5 mg/mL)滴入孔中,同时设置只加等量的DMSO溶液作为对照. 22~25 ℃培养,在第4 d和第8 d时观察病原真菌的生长情况,出现抑菌圈后采用十字交叉法测定菌落直径,记录抑菌结果,按照下式计算抑菌圈直径.
菌落直径 (cm) =3次直径平均值-打孔器直径(0.8 cm),
抑菌圈直径=处理菌落直径-对照菌落直径.
1.4 内生真菌的形态学、分子生物学鉴定
形态学鉴定:采用真菌学插片培养法[3]来观察内生真菌的菌丝和孢子形态.采用Ainsworth等[4]分类系统进行初步分类鉴定.
分子生物学鉴定:参照Saghai和Guo等[5-8]方法,提取内生真菌DNA. 采用真菌18S通用引物(ITS1:5′-TCCGTAGGTGAACCTGCGG-3′; ITS4: 5′-TCCTCCGCTTATTGATATGC-3′),进行PCR扩增. 18S rDNA序列由上海生工生物工程股份有限公司测定. 登录NCBI,将测序获得的18S rDNA ITS序列进行BLAST同源性序列比对分析(http:// blast. ncbi. nlm. nih. gov/).
2 结果与分析
2.1 马铃薯内生真菌分离结果
从德宏、大理、临沧3地马铃薯植株中共分离得到内生真菌493株(表1). 德宏马铃薯中分离到的内生真菌总数略高于大理、临沧两地,分离自德宏、大理、临沧的内生真菌数各占总数的38.95%、29.41%和31.64%. 德宏马铃薯茎、叶中分离到的内生真菌数量相对于根部多一些,分别占德宏分离总数的32.81%和31.77%,而从块茎中分离所得内生真菌数明显低于其他3个部位分离所得,仅占10.42%. 临沧马铃薯分离情况与德宏马铃薯大致相同,而大理马铃薯根、茎、叶、块茎中分离到的内生真菌数量差别不大.
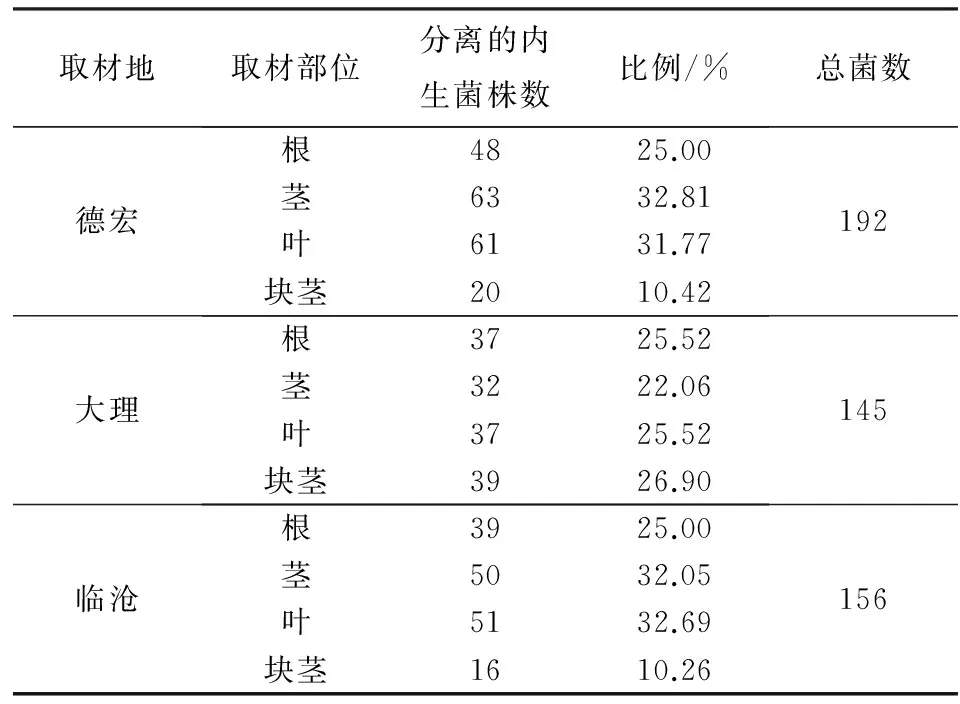
表1 马铃薯内生真菌分离结果Tab.1 The isolation results of endophytic fungi from Solanum tuberosum L.
2.2 内生真菌抑菌活性筛选结果
通过平板对峙法对马铃薯内生真菌进行初步筛选,获得有活性的菌株共44株,占分离菌株总数的8.92%. 其中德宏20株,大理4株,临沧20株,对马铃薯枯萎病、黑痣病、早疫病均显示出不同程度的抑菌活性效果.测量生长4 d后和8 d后马铃薯内生真菌次生代谢产物对3种病原真菌产生抑菌活性的抑菌圈直径大小(表2), 绝大部分内生真菌次生代谢产物均具有抑菌活性,抑菌圈直径最小为0.13 cm,最大可达4.67 cm. 抑菌圈大小随着病原真菌生长时间的延长而逐渐减小,有的内生真菌4 d的时候还能表现出抑菌活性,待8 d后抑菌活性消失;而有的内生真菌则一直表现出很强的抑菌活性,如E19、D22.
从病原真菌角度分析来看:有8株内生真菌菌株对马铃薯枯萎病有很强的抑菌活性,其中临沧1株(E19),德宏2株(D10、D22)对枯萎病的抑制效果尤其明显;有18株内生真菌菌株对马铃薯黑痣病有很强的抑菌活性,其中大理2株(L01、L05),临沧5株(LC36、E10、E14、E15、E19),德宏3株(D01、D05、D22)对黑痣病的抑菌效果尤其显著;有34株内生真菌菌株对马铃薯早疫病有很强的抑菌活性,其中大理2株(L01、L05),临沧9株(LC01、LC13、LC16、LC36、E08、E10、E14、E15、E19),德宏3株(D01、D02、D22)对早疫病的抑制效果尤甚. 数据结果显示,对马铃薯枯萎病有特别明显抑制效果的菌株很少,只有3株,而对马铃薯早疫病有非常明显抑制效果的菌株较多,有14株. 综合来看,对马铃薯枯萎病、黑痣病、早疫病均有明显抑菌活性的内生真菌菌株有12株,占活性菌株总数的27.27%,它们分别是L05、LC13、LC36、E08、E10、E14、E15、E19、D01、D03、D10、D22,其中大理1株,临沧7株,德宏4株.
表2 马铃薯内生真菌次生代谢产物对病原真菌的抑菌活性数据
Tab.2 Antimicrobial activity data of the secondary metabolites from endophytic fungi ofSolanumtuberosumL. to pathogenic fungi
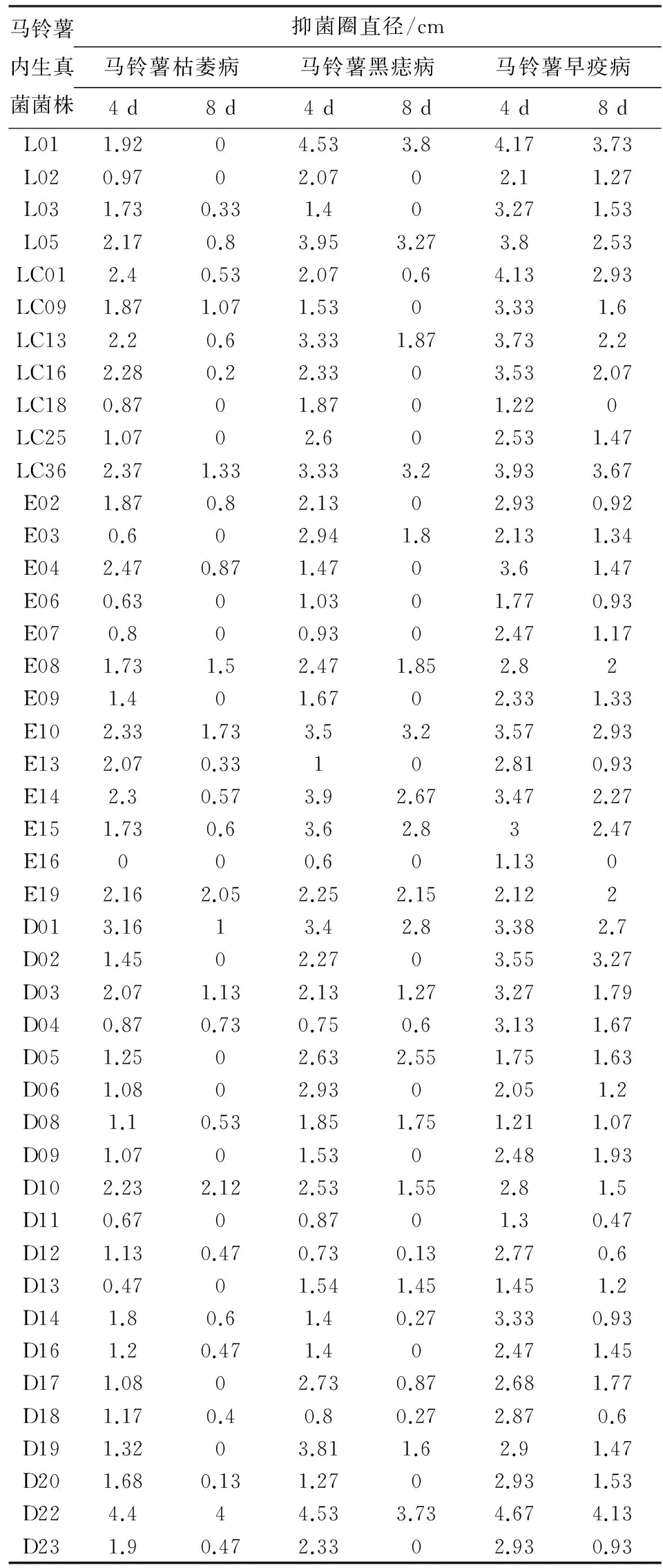
马铃薯内生真菌菌株抑菌圈直径/cm马铃薯枯萎病马铃薯黑痣病马铃薯早疫病4d8d4d8d4d8dL011.9204.533.84.173.73L020.9702.0702.11.27L031.730.331.403.271.53L052.170.83.953.273.82.53LC012.40.532.070.64.132.93LC091.871.071.5303.331.6LC132.20.63.331.873.732.2LC162.280.22.3303.532.07LC180.8701.8701.220LC251.0702.602.531.47LC362.371.333.333.23.933.67E021.870.82.1302.930.92E030.602.941.82.131.34E042.470.871.4703.61.47E060.6301.0301.770.93E070.800.9302.471.17E081.731.52.471.852.82E091.401.6702.331.33E102.331.733.53.23.572.93E132.070.33102.810.93E142.30.573.92.673.472.27E151.730.63.62.832.47E16000.601.130E192.162.052.252.152.122D013.1613.42.83.382.7D021.4502.2703.553.27D032.071.132.131.273.271.79D040.870.730.750.63.131.67D051.2502.632.551.751.63D061.0802.9302.051.2D081.10.531.851.751.211.07D091.0701.5302.481.93D102.232.122.531.552.81.5D110.6700.8701.30.47D121.130.470.730.132.770.6D130.4701.541.451.451.2D141.80.61.40.273.330.93D161.20.471.402.471.45D171.0802.730.872.681.77D181.170.40.80.272.870.6D191.3203.811.62.91.47D201.680.131.2702.931.53D224.444.533.734.674.13D231.90.472.3302.930.93
说明:L代表大理,LC和E代表临沧,D代表德宏;抑菌圈直径单位cm
2.3 内生真菌形态学、分子生物学鉴定结果
马铃薯中所含内生真菌的形态丰富多样,有絮状、毡状、绒毛状、颗粒状;菌丝生长的密集程度也各不相同,有的稀疏,有的致密;菌落的形状有圆弧形、花环状、齿轮状、锯齿状,也有的呈不规则状;菌落的颜色有白色、淡黄色、砖红色等;有的菌体产色素,有褐色、橘色、棕色等.
将马铃薯内生真菌的ITS序列在核酸序列数据库中进行BLAST检索,结果表明,各内生真菌ITS序列与目标序列相似度很高,均达到99%或100%(表3).
表3 马铃薯内生真菌分子鉴定结果
Tab.3The molecular identification results of endophytic fungi inSolanumtuberosumL.
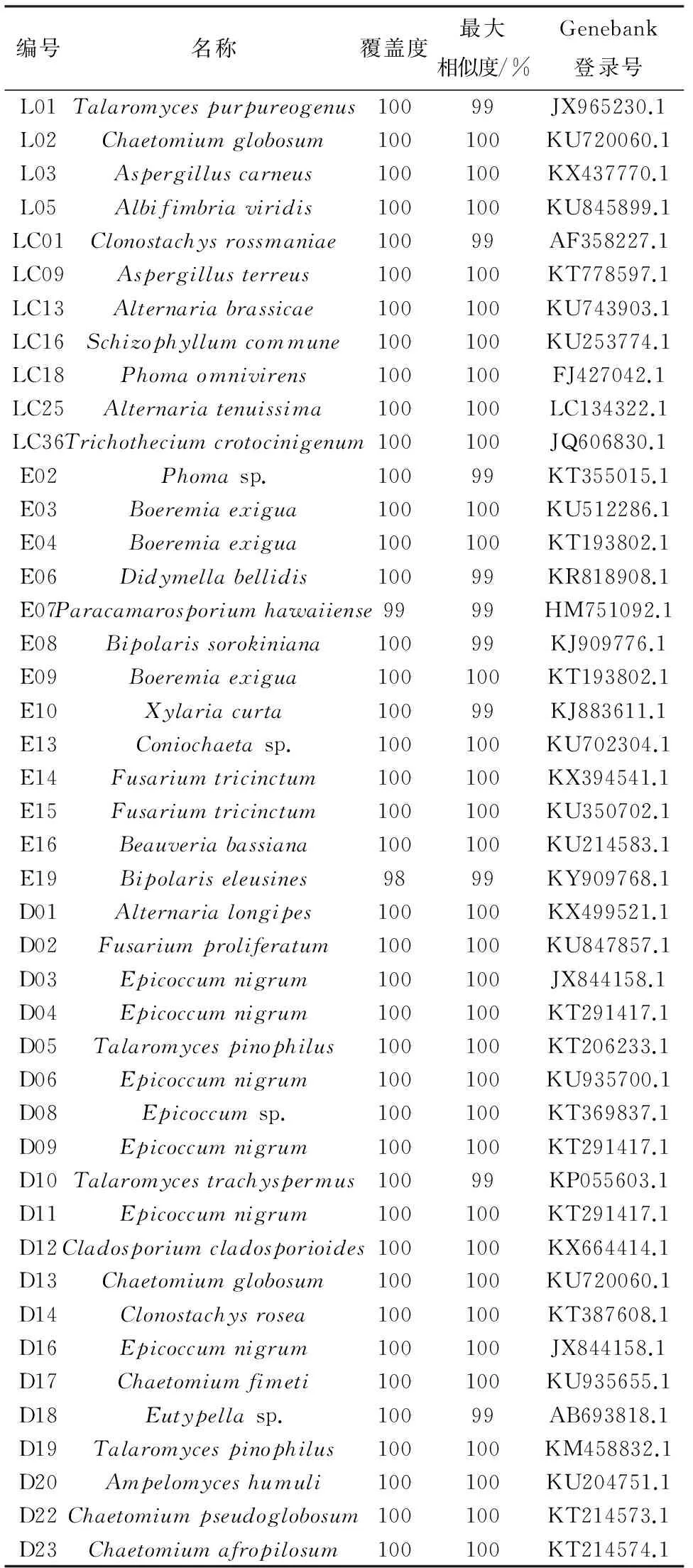
编号名称覆盖度最大相似度/%Genebank登录号L01Talaromycespurpureogenus10099JX965230.1L02Chaetomiumglobosum100100KU720060.1L03Aspergilluscarneus100100KX437770.1L05Albifimbriaviridis100100KU845899.1LC01Clonostachysrossmaniae10099AF358227.1LC09Aspergillusterreus100100KT778597.1LC13Alternariabrassicae100100KU743903.1LC16Schizophyllumcommune100100KU253774.1LC18Phomaomnivirens100100FJ427042.1LC25Alternariatenuissima100100LC134322.1LC36Trichotheciumcrotocinigenum100100JQ606830.1E02Phomasp.10099KT355015.1E03Boeremiaexigua100100KU512286.1E04Boeremiaexigua100100KT193802.1E06Didymellabellidis10099KR818908.1E07Paracamarosporiumhawaiiense9999HM751092.1E08Bipolarissorokiniana10099KJ909776.1E09Boeremiaexigua100100KT193802.1E10Xylariacurta10099KJ883611.1E13Coniochaetasp.100100KU702304.1E14Fusariumtricinctum100100KX394541.1E15Fusariumtricinctum100100KU350702.1E16Beauveriabassiana100100KU214583.1E19Bipolariseleusines9899KY909768.1D01Alternarialongipes100100KX499521.1D02Fusariumproliferatum100100KU847857.1D03Epicoccumnigrum100100JX844158.1D04Epicoccumnigrum100100KT291417.1D05Talaromycespinophilus100100KT206233.1D06Epicoccumnigrum100100KU935700.1D08Epicoccumsp.100100KT369837.1D09Epicoccumnigrum100100KT291417.1D10Talaromycestrachyspermus10099KP055603.1D11Epicoccumnigrum100100KT291417.1D12Cladosporiumcladosporioides100100KX664414.1D13Chaetomiumglobosum100100KU720060.1D14Clonostachysrosea100100KT387608.1D16Epicoccumnigrum100100JX844158.1D17Chaetomiumfimeti100100KU935655.1D18Eutypellasp.10099AB693818.1D19Talaromycespinophilus100100KM458832.1D20Ampelomyceshumuli100100KU204751.1D22Chaetomiumpseudoglobosum100100KT214573.1D23Chaetomiumafropilosum100100KT214574.1
由表3可见,这44株内生真菌分属于21个属,分别是篮状菌属(Talaromyces)、毛壳菌属(Chaetomium)、曲霉属(Aspergillus)、Albifimbria、螺旋聚孢霉属(Clonostachys)、链格孢属(Alternaria)、裂褶菌属(Schizophyllum)、茎点霉属(Phoma)、单端孢属(Trichothecium)、Boeremia、壳二孢属(Didymella)、Paracamarosporium、离蠕孢属(Bipolaris)、炭角菌属(Xylaria)、Coniochaeta、镰孢菌属(Fusarium)、白僵菌属(Beauveria)、附球菌属(Epicoccum)、枝孢属(Cladosporium)、弯孢聚壳属(Eutypella)、白粉寄生孢(Ampelomyces);有40株内生真菌鉴定到种,其余4株仅鉴定到属. 其中,篮状菌属(Talaromyces)、毛壳菌属(Chaetomium)和附球菌属(Epicoccum)为马铃薯具拮抗活性内生真菌中的优势菌属.
3 讨论
采自德宏、大理、临沧3地的健康马铃薯植株不同部位分离得到493株内生真菌. 从分离部位来看,德宏和临沧两地马铃薯茎、叶中分离到的内生真菌数量明显多于根和块茎,这与药用植物车前、侧柏等的研究结果一致[9,10]. 而大理产马铃薯根、茎、叶、块茎中分离的内生真菌数量差别不大,其原因初步估计与3地气候特点密切相关. 大理属于低纬高原季风气候,而临沧和德宏均属于热带季风气候. 热带作为物种最为丰富、结构最为复杂的陆地生态系统,其植物内生真菌物种数量和多样性亦非常丰富. 结果表明,分离自大理的内生真菌主要分布在4个属(Talaromyces、Chaetomium、Aspergillus、Albifimbria);分离自德宏的活性内生真菌主要分布在9个属(Talaromyces、Chaetomium、Clonostachys、Alternaria、Fusarium、Epicoccum、Cladosporium、Eutypella、Ampelomyces),分离自临沧的活性内生真菌主要分布在14个属(Aspergillus、Clonostachys、Alternaria、Schizophyllum、Phoma、Trichothecium、Boeremia、Didymella、Paracamarosporium、Bipolaris、Xylaria、Coniochaeta、Fusarium、Beauveria)从分离的内生真菌类群多样性来看,临沧最多,德宏次之,大理最少. 44株对马铃薯枯萎病、马铃薯黑痣病和马铃薯早疫病有不同程度抑制作用的内生真菌中,来自德宏的20株,临沧的20株,大理的4株,结合形态学、分子生物学鉴定结果,离蠕孢属(Bipolaris)和Chaetomium的内生真菌抑菌活性较好,离蠕孢属和镰孢菌属内生真菌的次生代谢产物值得进一步深入研究,为开发无污染、低残留并且可以使农业生产种植进入可持续良性发展的微生物源农药奠定了基础.
[1] 艾洪莲,杨会祥,王文祥,等.马铃薯内生拮抗真菌E-02发酵液的化学成份研究[J].中南民族大学学报(自然科学版),2017,36(3):34-42.
[2] 窦学娥,牟志美,韩景瑞,等.桑树内生真菌的分离、鉴定及其多样性分析[J].蚕业科学,2008,34(1):6-10.
[3] 方中达.植病研究方法[M].北京:中国农业出版社,1998:112-121;146-149.
[4] Ainsworth G C, Sparrow F K, Sussman A S. The fungi. Vol. IV A and B [M]. New York and London: Academic Press, 1973.
[5] Saghai M A, Solman K M, Jorgensen R A, et al. Ribosomal DNA spacer-length polymorphisms in barley: Mendelian inheritance, chromosomal location and population dynamics [J]. Proc Natl Acad Sci USA, 1984, 81(24): 8014-8018.
[6] Guo L D, Hyde K D and Liew E C Y. Identification of endophytic fungi fromLivistonachinensisbased on morphology and rDNA sequences [J]. New Phytologist, 2010, 147(3):617-630.
[7] White T J, Bruns T D, Lee S B, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//Innis M A,Galfand D H,Sninsky J J,et al.PCR Protocols.New York:Academic Press,1990:315-322.
[8] Ko T W K, Stephenson S L, Bahkali A H, et al. From morphology to molecular biology: can we use sequence data to identify fungal endophytes [J]. Fungal Diversity, 2011, 50(1): 113-120.
[9] 毕江涛,何 萍,王小霞,等.药用植物车前内生真菌分离及其抑菌活性初步分析[J].世界科学技术-中医药现代化,2013,15(3):520-526.
[10] 王现坤,张晓华,郝双红.侧柏内生真菌的分离鉴定及抗菌活性筛选[J].农药,2010,49(7):519-521.
DiversityandAntibacterialActivityofEndophyticFungiIsolatedfromSolanumtuberosumL.
AiHonglian1,2,YangMansi1,2,HeJuan1,HaiMeirong2,GuoHuachun2,WangWenxiang1,2
(1 College of Pharmacy, South-Central University for Nationalities, Wuhan 430074, China;2 College of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming 650201,China)
A series of endophytic fungi were isolated and purified from the rhizomes, stems leaves and tubers of healthySolanumtuberosumL. growing in Dehong, Dali and Lincang Yunnan Province, and the antibacterial activity of these strains was identified. The species were determined based on the fungi′s morphology and 18S rDNA analysis. In the total of 493 isolated endophytic fungi strains, 44 strains have different inhibitory effects on three kinds of diseases (Fusariumoxysporum,RhizoctoniasolaniandAlternariasolani) ofSolanumtuberosumL. The results of morphological classification and molecular biological research showed that those 44 strains belong to 21 genera, in whichTalaromyces,ChaetomiumandEpicoccumwere the predominant fungi. The above results revealed the high diversity and antibacterial of endophytic fungi derived fromSolanumtuberosumL..
endophytic fungi;SolanumtuberosumL.;bio-diversity;bacteriostatic activity
2017-07-26 *
王文祥,研究方向:天然药物化学,E-mail:903544288@qq.com
艾洪莲(1981-),女,讲师,博士,研究方向:民族药用植物学,E-mail:2015050@mail.scuec.edu.cn
国家自然科学基金资助项目(31560010); 中央高校基本科研业务费专项资金资助项目(CZW17094,CSP17067, CZY16010,CSP17061)
O692.3;Q946.88
A
1672-4321(2017)04-0051-05
