pcDNA3.1/ SjDLC 和pcDNA3.1/mIFN-γ重组质粒构建及表达
2017-12-25,,,2,,3,,3,,,*
,, ,2, ,3, ,3,,,*
(1.南华大学医学院病原生物学研究所 湖南 衡阳 421001;2.南华大学护理学院内护教研室;3.南华大学医学院寄生虫学教研室)
·基础医学·
pcDNA3.1/ SjDLC和pcDNA3.1/mIFN-γ重组质粒构建及表达
高勇强1,阳青兰1,胡丽1,2,梁瑜1,3,刘彦1,3,张愉快1,王可耕1,肖建华1*
(1.南华大学医学院病原生物学研究所 湖南 衡阳 421001;2.南华大学护理学院内护教研室;3.南华大学医学院寄生虫学教研室)
目的构建日本血吸虫动力蛋白轻链DNA疫苗和小鼠干扰素真核表达质粒,研究其在HeLa细胞及动物体内的表达。方法设计特异性引物,PCR扩增获取动力蛋白轻链(SjDLC)与干扰素-γ(IFN-γ)基因,克隆于pcDNA3.1真核质粒,经双酶切及测序鉴定。将两种重组质粒分别转染至HeLa细胞,Western blot鉴定其表达。真核质粒经左腿股四头肌免疫小鼠,在末次免疫2周后,PCR法检测小鼠肌组织内SjDLC和IFN-γ基因,免疫组织化学法检测基因的表达,MTT法检测T细胞增殖水平。结果PCR和双酶切能检测到280 bp的SjDLC基因及480 bp的IFN-γ基因;Western blot显示在12 kDa和19 kDa处有阳性反应条带,与SjDLC和IFN-γ分子量大小一致,两种基因能在HeLa细胞中表达。PCR及免疫组化显示两种基因能在小鼠肌肉组织中存在和表达。MTT法显示两种质粒均能刺激T细胞增殖。结论成功构建pcDNA3.1/SjDLC和pcDNA 3.1/ mIFN-γ真核质粒,两种质粒能在HeLa细胞和动物体内表达。
DNA疫苗; 动力蛋白轻链; 干扰素-γ
在血吸虫病防治方面,寻找疫苗候选抗原分子和加强疫苗的保护效果是血吸虫病研究工作的热点。本课题组前期通过构建日本血吸虫cDNA文库,发现了日本血吸虫新基因即动力蛋白轻链(dynein light chain of Schistosoma japonicum,SjDLC)基因,并对其进行了初步的生物学特性研究[1]。细胞因子具有增强免疫应答及调节免疫应答类型的作用,目前已作为佐剂广泛应用,如IFN-γ具有刺激Th1细胞增殖及抑制Th2细胞作用,应用IFN-γ能调节细胞免疫向Th1型极化,从而减轻Th2型细胞免疫所致疾病[2]。为进一步研究日本血吸虫pcDNA3.1/SjDLC DNA疫苗及IFN-γ在日本血吸虫感染中的保护性作用,本研究通过构建pcDNA3.1/ SjDLC及pcDNA 3.1/ mIFN-γ真核质粒并鉴定其在小鼠体内的表达情况,为疫苗研究奠定基础。
1 材料与方法
1.1材料与试剂6~8周雌性BALB/C小鼠购自长沙斯莱克景达实验动物有限公司,pcDNA3.1,DH5α由本研究所保存。Trizol购于Invitrogen公司,逆转录试剂盒购于大连宝生物工程有限公司,T4DNA连接酶、BamH I、Hind III、EcoR I限制性内切酶购于NEB公司,PCR产物纯化试剂盒、质粒去内毒素大量提取试剂盒购于OMEGA生物技术公司,MTT购于Sigma公司。
1.2 pcDNA3.1/SjDLC和pcDNA3.1/mIFN-γ真核质粒的构建及鉴定根据DLC基因和mIFN-γ基因序列使用PRIMER5.0软件设计特异性引物,在上游引物中引入BamH I 酶切位点(GGATCC),在下游引物中分别引入Hind III酶切位点(AAGCTT)和EcoRI酶切位点(GGATCC),其中DLC基因上游引物:5′-CGCGGATCCAGAATGAATGAACGTAAAGCCG-3′,下游引物:5′-CCC AAGCTTTTATCCTGATTTAAATAGTAGAA ATGC-3′,mIFN-γ基因上游引物:5′-CGCGGATCCACAATGAACGCTACACACTGCA-3′,下游引物:5′-CCGGA ATTCTCAGCAGCGACTCCTTTTCC-3′,上述引物由上海生工生物工程股份有限公司合成。
DLC基因扩增方法如下,新西兰兔腹部敷贴法感染尾蚴,42天后取成虫,使用Trizol提取成虫RNA,逆转录为cDNA。mIFN-γ基因扩增方法如下,健康8周龄BALB/c小鼠,无菌取脾脏后,剪碎放入70 μm细胞筛孔中,加PBS研磨洗涤;加2mL红细胞裂解液裂解10 min,1 700 rpm,离心5 min,弃上清;加入 2 mL 含 10 μL/mL ConA 的完全 RPM I1640培养基于 5% CO237 ℃ 培养箱中诱导3天;然后收集细胞提取RNA,逆转录为cDNA,以两者cDNA为模板,PCR条件:94 ℃ 预变性5 min,94 ℃变性60 s、58 ℃ 退火60 s、72 ℃延伸60 s,共35个循环后72 ℃保温10 min,4 ℃终止反应。1%琼脂糖凝胶鉴定后,纯化PCR产物。纯化后的产物与pcDNA3.1常规连接方法连接后,转化至DH5α,筛选阳性克隆菌,同时进行BamH I和Hind III双酶切,鉴定后测序。
1.3真核质粒在HeLa细胞中的表达HeLa细胞分别接种到细胞培养板中(每孔2 mL,5.0×105个细胞/孔),生长达90%时,按照Lip2000说明书将质粒转染细胞,培养48 h,收集细胞,加入5倍细胞体积的 RIPA 裂解液,悬浮细胞,冰上裂解半小时,13 000 rpm 4 ℃离心5 min,收集蛋白,SDS-PAG电泳,用半干式电转移法将蛋白电泳条带转移至PVDF膜,进行Western blot分析。一抗为日本血吸虫感染兔血清(1∶1 000稀释),4 ℃反应过夜;TBST液洗膜5 min,重复 3次,加HRP标记的羊抗兔IgG二抗(1∶1000稀释)4 ℃反应2 h。洗膜同上,ECL化学发光显影。
1.4真核质粒在小鼠体内的接种及表达15只雌性BALB/c小鼠随机分为3组:pcDNA3.1组、pcDNA3.1 / SjDLC组及pcDNA3.1 / mIFN-γ组,分别经左腿股四头肌注射重组质粒,每2周免疫1次,共免疫3次。末次免疫后2周,麻醉后断颈处死小鼠,取腿部肌肉提取总DNA,PCR法检测小鼠肌组织内SjDLC和mIFN-γ基因。另取每组小鼠的股四头肌用4%多聚甲醛固定4 h后,常规制作石蜡切片,免疫组化法检测SjDLC和IFN-γ基因在小鼠体内的表达。
1.5 MTT法检测SjDLC和mIFN-γ刺激T细胞增殖情况末次免疫后2周, 麻醉后断颈处死小鼠,分离小鼠脾淋巴细胞,调整细胞浓度为6×106/mL,接种于96孔板,每组分别用RPMI1640培养液、SWA(10 μg/mL)和Con A(10 μg/mL)作为刺激物进行刺激,于5% CO237 ℃培养箱培养72 h后,每孔加入MTT溶液(5 mg/mL) 20 μL培养4 h,800 rpm离心15 min弃上清,每孔加入150 μL DMSO,振荡10 min,检测每孔OD570nm值。
1.6统计分析计量数据用均数+标准差表示,统计学分析采用SPSS 18.0软件进行t检验分析,以P<0.05表示差异具有统计学意义。
2 结 果
2.1 pcDNA3.1/ SjDLC及pcDNA3.1/mIFN-γ真核质粒的构建及鉴定
2.1.1 SjDLC和mIFN-γ基因PCR扩增结果 1%琼脂糖胶电泳后在280 bp处可见目的条带,与SjDLC基因大小相符(图1 A);在480 bp处可见目的条带,与mIFN-γ 基因大小一致(图1 B)。

图1.SjDLC基因(A)和mIFN-γ 基因(B)PCR的扩增M:Marker;1:SjDLC基因扩增产物;2:mIFN-γ 基因扩增产物
2.1.2 重组质粒pcDNA3.1/SjDLC及pcDNA3.1/mIFN-γ双酶切鉴定 利用BamH I和Hind III双酶切方法检测到重组质粒的两条目的条带,条带大小与PCR 检测结果一致 (图2)。
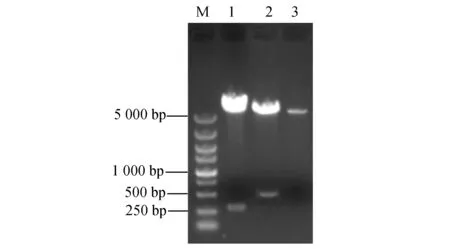
图2 重组质粒的双酶切鉴定M:Marker;1:双酶切验证pcDNA3.1/ SjDLC质粒;2:双酶切验证pcDNA3.1/mIFN-γ质粒;3:双酶切验证pcDNA3.1质粒
2.2 pcDNA3.1/SjDLC及pcDNA3.1/mIFN-γ在HeLa细胞中的表达HeLa细胞分别接种到细胞培养板中,按照Lip2000说明书将质粒转染细胞,培养48 h,收集细胞,进行Western blot分析。Western blot显示在12 kDa(图3A)和19 kDa(图3B)处有阳性反应条带,与SjDLC和IFN-γ分子量大小一致。
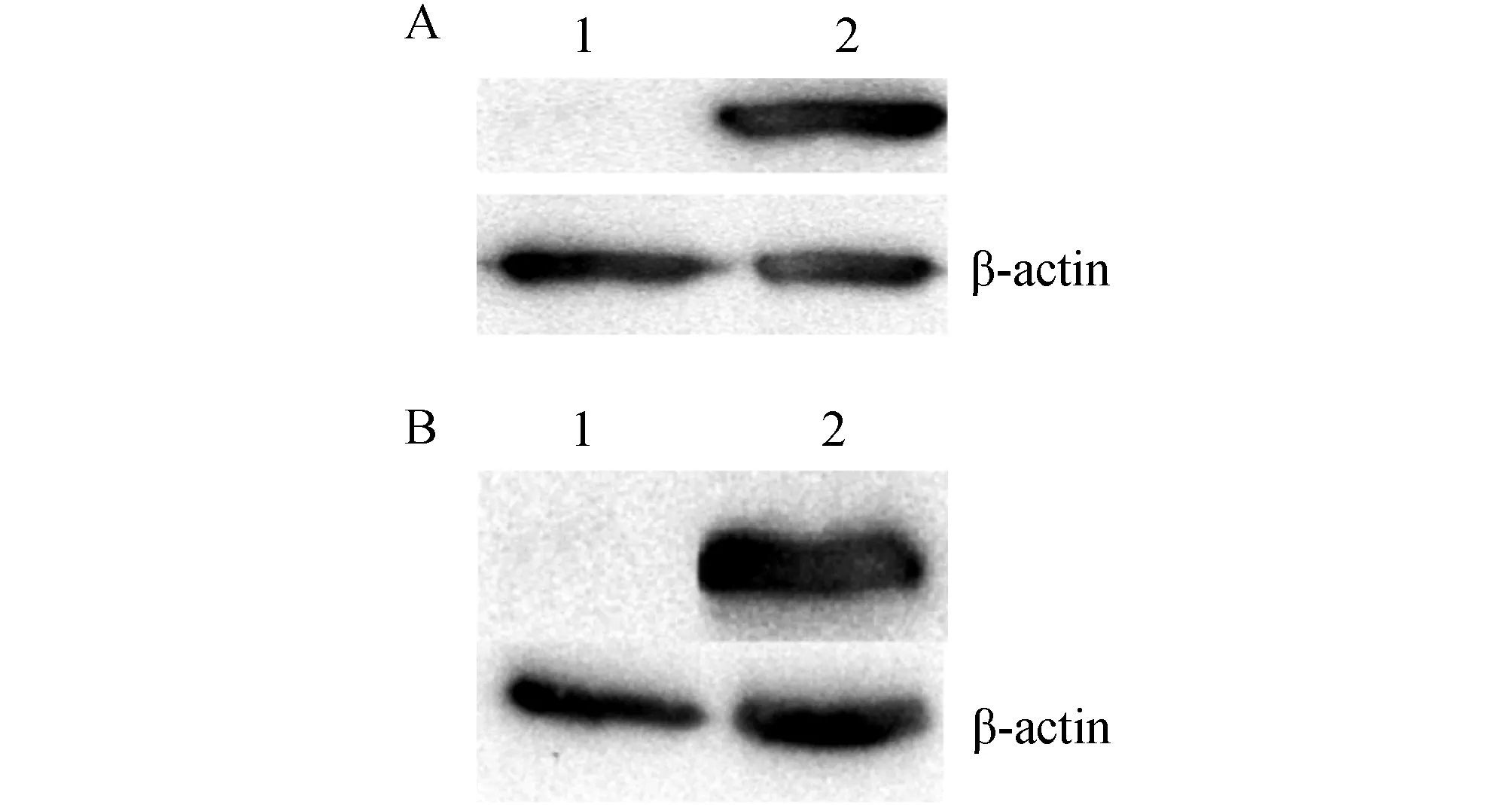
图3 pcDNA3.1/SjDLC和pcDNA3.1 / IFN-γ在HeLa细胞中的表达A:1:pcDNA3.1; 2:pcDNA3.1/ SjDLC;B:1:pcDNA3.1;2:pcDNA3.1/IFN-γ
2.3 pcDNA3.1/ SjDLC及pcDNA3.1 / mIFN-γ真核质粒在动物体内的表达
2.3.1 PCR法检测小鼠肌肉组织中SjDLC和mIFN-γ基因 取腿部肌肉组织提取总DNA,使用SjDLC及mIFN-γ特异性引物,扩增各基因,结果可见能从小鼠肌肉组织中扩增出280 bp的SjDLC基因及480 bp的mIFN-γ基因(图4)。
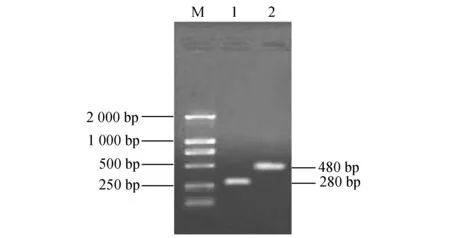
图4 PCR法检测小鼠肌肉组织中SjDLC及mIFN-γ基因M:DNA Maker;1:pcDNA3.1/ SjDLC;2:pcDNA3.1/ mIFN-γ
2.3.2 免疫组化法检测pcDNA3.1/SjDLC和pcDNA3.1/mIFN-γ在小鼠肌肉组织中的表达 免疫组化结果显示各组肌细胞区域可见pcDNA3.1/SjDLC和pcDNA3.1/mIFN-γ在肌肉组织中表达的棕黄色阳性反应颗粒(图5)。

图5 免疫组化法检测小鼠肌肉组织内重组质粒的表达(200×)A:pcDNA3.1; B:pcDNA3.1/ SjDLC; C:pcDNA3.1/ mIFN-γ
2.4 MTT法检测淋巴细胞体外增殖试验MTT法结果显示:用SWA刺激后SjDLC组和IFN-γ组T细胞增殖水平均显著性高于pcDNA3.1对照组,P<0.05,IFN-γ组高于SjDLC组,P<0.05。Con A刺激组与SWA刺激组比较,P>0.05。RPMI1640刺激后各组T细胞均不增值,与SWA刺激组比较,P<0.05。见图6。

图6 MTT检测免疫后小鼠脾淋巴细胞增值率与pcDNA3.1比较,*:P<0.05,与SWA组比较,#:P<0.05
3 讨 论
核酸疫苗是近年来快速发展的新型疫苗,将编码抗原基因或基因片段插入质粒载体中构成重组质粒,直接免疫后,机体内的细胞表达这一抗原,刺激机体免疫系统,产生细胞免疫和体液免疫,达到抗感染的目的[3]。核酸疫苗能诱导有效的适应性免疫应答,也没有死疫苗、减毒疫苗的致病作用,并且生产简单,成本低廉,因此受到广泛青睐。
目前血吸虫病的疫苗研究仍未得到令人满意的结果[4],因此,寻找有效的候选疫苗抗原分子仍然是日本血吸虫疫苗研究工作的重要基础。血吸虫抗原作为疫苗常常免疫效果有限,为了加强疫苗的免疫效果联合佐剂十分重要,运用细胞因子作为佐剂也是目前血吸虫病疫苗研究的方向。
本研究通过构建日本血吸虫SjDLC DNA疫苗及mIFN-γ真核质粒,初步研究其在真核细胞及小鼠体内表达状况,为寻找有效的候选疫苗抗原分子及应用IFN-γ作为佐剂加强血吸虫疫苗免疫接种效果奠定基础。
日本血吸虫动力蛋白轻链基因(SjDLC)是由本课题组前期发现的新基因,已获得GenBank 登录号(AY225851),该基因序列与曼氏血吸虫DLC基因序列同源性较高,相似性为86%[1]。该蛋白位于血吸虫体被,介导其与“外界分子”的相互识别,可结合血吸虫体被需要转运的物质通过微管进行运输,是血吸虫生存和发挥免疫逃逸的重要基因之一[5-6]。
IFN-γ主要是由Th1细胞分泌,具有抗感染、抗肿瘤及免疫调节作用的细胞因子,能抑制Th2型细胞免疫,有利于减轻由血吸虫虫卵抗原诱导的Th2型细胞免疫介导的免疫病理损伤[7-8]。
本研究构建了pcDNA3.1/SjDLC及pcDNA3.1/mIFN-γ真核质粒,通过PCR和双酶切方法检测到280 bp的SjDLC基因及480 bp的mIFN-γ基因,测序结果显示这两个基因的核苷酸序列与GenBank中的序列完全一致。 Western blot显示在12 kDa和19 kDa处有阳性反应条带,与SjDLC和IFN-γ分子量大小一致,说明两种基因能在HeLa细胞中表达。PCR能从小鼠肌肉组织中扩增出280 bp的SjDLC基因及480 bp的mIFN-γ基因,免疫组化结果显示小鼠肌组织中出现两种蛋白的阳性反应颗粒。说明pcDNA3.1/SjDLC及pcDNA3.1/ mIFN-γ能在小鼠肌肉组织中存在和表达,这是疫苗发挥作用的免疫学基础。MTT法检测到SjDLC和IFN-γ能显著性诱导T细胞增殖和活化。
综上所述,本研究成功构建的pcDNA3.1/SjDLC和pcDNA 3.1/mIFN-γ真核表达质粒,能在小鼠体内良好表达,为进一步研究其在日本血吸虫感染中的保护性作用奠定了实验基础。
[1] 刘彦,肖建华,廖力,等.日本血吸虫肌动蛋白轻链基因的获得和分析[J].中国人兽共患病杂志,2004,20 (11):960-962.
[2] de Carvalho PG,de Oliveira Rodrigues R,Ribeiro da Silva SF,et al.CD38+CD8+ and CD38+CD4+ T cells and IFN Gamma (+874) polymorphism are associated with a poor virological outcome[J].Immunol Invest,2016,45(4):312-327.
[3] Kumar A,Samant M.DNA vaccine against visceral leishmaniasis:a promising approach for prevention and control[J].Parasite Immunol,2016,38(5):273-281.
[4] Attallah AM,El-Far M,Omran MM3,et al.Levels of schistosoma mansoni c irculating Antigen in chronic hepatitis C patients with different stages of liver fibrosis[J].J Immunoassay Immunochem,2016,37(3):316-330.
[5] Argiro L,Henri S,Dessein H,et al.Induction of a protection against S.mansoni with a MAP containing epitopes ofSm37-GAPDH and Sm10-DLC.Effect of coadsorption with GM-CSF on alum [J].Vaccine,2000,18 (19):2033-2038.
[6] Diniz PP,Nakajima E,Miyasato PA,et al.Two SmDLC antigens as potential vaccines against schistosomiasis[J].Acta Trop,2014,140:193-201.
[7] Yao H,Pan J,Qian Y,et al.Enhanced effect of soluble transforming growth factor-beta receptor II and IFN-gamma fusion protein in reversing hepatic fibrosis[J].Eur J Med Res,2010,15(4):152-161.
[8] Ramalingam TR,Gieseck RL,Acciani TH,et al.Enhanced protection from fibrosis and inflammation in the combined absence of IL-13 and IFN-γ[J].J Pathol,2016,239(3):344-354.
ConstructionandexpressionofthepcDNA3.1/SjDLCandpcDNA3.1/mIFN-γ
GAO Yongqiang,YANG Qinglan,HU Li,et al
(InstituteofPathogenicBiology,MedicalCollege,UniversityofSouthChina;Hengyang421001,Hunan,China)
ObjectiveTo construct the dynein light chain of Schistosoma japonicum DNA vaccine and IFN-γ recombinant plasmid of mice,so as to investigate their expression in HeLa cells and mouse.MethodsA pair of primers designed by PRIMER5.0 software was synthesized;the gene fragments of SjDLC and mIFN-γ were amplified by PCR,and inserted into eukaryotic expression plasmid pcDNA3.1,where the recombinant plasmids were identified with restrictive enzymes and sequenced.The recombinant vectors pcDNA3.1/SjDLC and pcDNA3.1 /mIFN-γ were transfected into HeLa cells;the expressed proteins were identified by Western blot.These plasmids were injected into BALB /c mice too,the gene of SjDLC and IFN-γ in quadriceps femoris were identified by PCR.The expression of SjDLC,IFN-γ were observed with immunohistochemistry.The proliferation of splenic lymphocytes in mice was detected by MTT.ResultsThe 280 bp of SjDLC gene and 480 bp of IFN-γ gene were observed through PCR and double enzyme digestion;Western blot displayed that positive response bands in 12 kDa and 19 kDa which is consistent with the molecular weight of SjDLC and IFN-γ were successfully expressed in HeLa cells.PCR and immunohistochemistry showed that two genes expressed in mouse muscle tissue.MTT showed that two plasmids could stimulate the proliferation of T cells.ConclusionThe pcDNA /SjDLC DNA vaccine and recombinant plasmid pcDNA /mIFN-γ were successfully constructed and then expressed in HeLa cells and mouse.
DNA vaccine; SjDLC; IFN-γ
10.15972/j.cnki.43-1509/r.2017.06.006
2016-07-20;
2017-08-28
湖南省教育厅科学研究项目(编号:13C824);湖南省研究生科研创新项目(CX2015B415);湖南省分子靶标新药研究协同创新中心资助项目(NO.2015-351);特殊病原体防控湖南省重点实验室资助项目(NO.2014-5).
*通讯作者,E-mail:jhxiao223@163.com.
R383.24
A
蒋湘莲)
