阿帕替尼联合化疗用于二线治疗失败晚期卵巢癌的临床观察
2017-12-23赵峻峰史晓宇赵丽霞
李 琪,赵峻峰,史晓宇,赵丽霞,刘 丹
(1.河北北方学院研究生部,河北 张家口 075000;2.河北北方学院附属第一医院肿瘤内科,河北 张家口 075000)
·论著·
阿帕替尼联合化疗用于二线治疗失败晚期卵巢癌的临床观察
李 琪1,赵峻峰2*,史晓宇2,赵丽霞2,刘 丹1
(1.河北北方学院研究生部,河北 张家口 075000;2.河北北方学院附属第一医院肿瘤内科,河北 张家口 075000)
目的观察新型靶向药物阿帕替尼联合化疗治疗复发后耐药卵巢癌的近期疗效和安全性。方法选择二线化疗失败的进展期卵巢癌患者30例,按治疗方法分为试验组10例和对照组20例,试验组采用阿帕替尼加紫杉类、蒽环类药物为基础的化疗方案,对照组采用以紫杉类或蒽环类为基础化疗方案化疗,比较2组治疗效果及不良反应发生情况。结果6个周期后试验组临床疗效优于对照组,客观缓解率和疾病控制率高于对照组,差异均有统计学意义(P<0.05)。不良反应主要为手足综合征、高血压、胃肠胀气及腹泻等,主要为1~2级。结论阿帕替尼联合化疗治疗复发后耐药卵巢癌有较好的疗效,且不良反应可耐受。
卵巢肿瘤;抗药性,肿瘤;阿帕替尼;药物疗法,联合
10.3969/j.issn.1007-3205.2017.12.006
卵巢癌是预后最差的女性恶性肿瘤,病死率在妇科恶性肿瘤中居首位,近20年其发病率以每年0.1%的速度增长,5 年总生存率为30%左右[1-2]。卵巢癌通常采用手术结合化疗的方式治疗。由于癌细胞扩散快,手术通常无法彻底切除病灶,而且卵巢癌细胞对化疗药物易产生耐药性,并有约25%确诊患者对作为一线药物的铂类制剂不敏感,这类患者生存期可能仅18个月[3]。研究显示卵巢癌三线化疗缓解率为25.7%[4]。本研究选择二线化疗失败及复发耐药的卵巢癌患者,分析靶向药物阿帕替尼联合化疗的治疗效果及安全性。现报告如下。
1 资 料 与 方 法
1.1一般资料 收集2016年2—11月河北北方学院附属第一医院收治的二线化疗失败及复发耐药的卵巢癌患者30例,均经病理组织学证实。按治疗方法分为试验组10例和对照组20例。试验组年龄26~70岁,平均(55±14)岁;对照组年龄30~74岁,平均(52±13)岁。2组年龄差异无统计学意义(P>0.05),具有可比性。
1.2入选标准和排除标准 入选标准:①年龄≥18岁;②体力状况为美国东部肿瘤协作组评分<3分;③细胞学或组织病理学确诊的卵巢癌患者,治疗过程中疾病进展或治疗结束后复发,既往接受系统化疗≥2个周期;④前一次抗肿瘤治疗结束距开始本研究用药时间<4个月;⑤器官功能水平良好,白细胞>3×109/L,血小板>80×109/L,血红蛋白>90 g/L,白蛋白浓度>29 g/L,丙氨酸转氨酶和天冬氨酸转氨酶<2.5倍正常值,胆红素<1.5倍正常值,尿常规尿蛋白<2+。排除标准: ①6个月内使用过血管内皮生长因子受体抑制剂类小分子药物;②给药前4周内接受过抗肿瘤治疗,包括化疗、放疗、手术或分子靶向治疗;③高血压疾病患者,经降压药物治疗不能降至正常范围(收缩压>150 mmHg或舒张压>90 mmHg);④严重心血管疾病患者,包括充血性心力衰竭、症状性冠状动脉疾病、心律不齐、心肌梗死等;⑤患有以不可控制的恶心、呕吐、腹泻为症状的胃肠道疾病;⑥有静脉血栓或肺栓塞病史;⑦存在中枢神经系统肿瘤转移;⑧妊娠期、哺乳期女性患者;⑨有严重的、不可控的危害患者安全的伴随疾病,如严重的糖尿病、感染、上腔静脉综合征、精神障碍史等。
1.3治疗方法 对照组以紫杉类或蒽环类为基础化疗方案化疗;试验组在上述化疗方案基础上加用阿帕替尼治疗,口服剂量为500 mg/d,持续给药直至病情进展或不能耐受药物引起的不良事件。每2个化疗周期复查CT及肿瘤标记物,每个化疗周期复查血、尿常规及肝、肾功能,同时密切监测客观病灶、不良反应、生活质量。6个化疗周期后进行疗效对比。
1.4疗效及不良反应 疗效评价标准[5]:完全缓解(complete response,CR),部分缓解(partial response,PR),稳定(stable disease,SD)以及进展(progressive disease,PD);客观缓解率=(CR+PR)/总例数×100%,疾病控制率=(CR+PR+SD)/总例数×100%。不良反应分级标准参照美国NCI-CTC标准[6]。
1.5统计学方法 应用SPSS 19.0统计学软件分析数据。计数资料比较采用χ2检验;等级资料比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1临床疗效 治疗6个周期后试验组临床疗效优于对照组,客观缓解率和疾病控制率高于对照组,差异均有统计学意义(P<0.05),见表1。
2.2安全性 试验组常见不良反应为手足综合征、白细胞减少、腹泻等,对照组常见不良反应有白细胞减少、腹泻、胃肠胀气等,2组不良反应发生率差异无统计学意义,且均未出现不良反应引起的恶性事件,见表2。
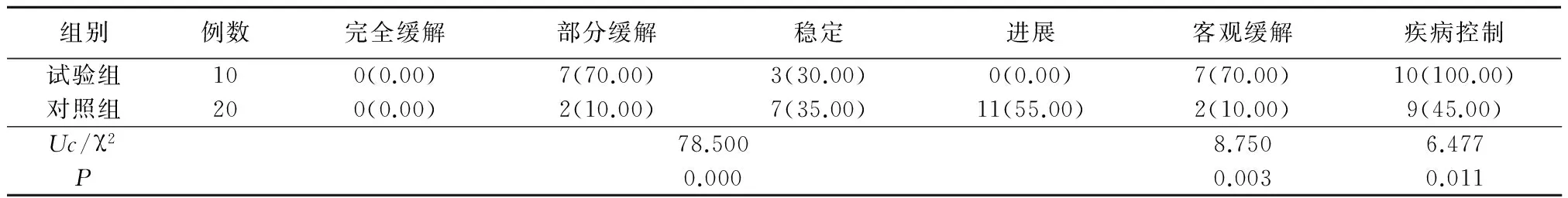
表1 试验组与对照组疗效比较Table 1 Comparison of curative effect in treatment group and control group (例数,%)
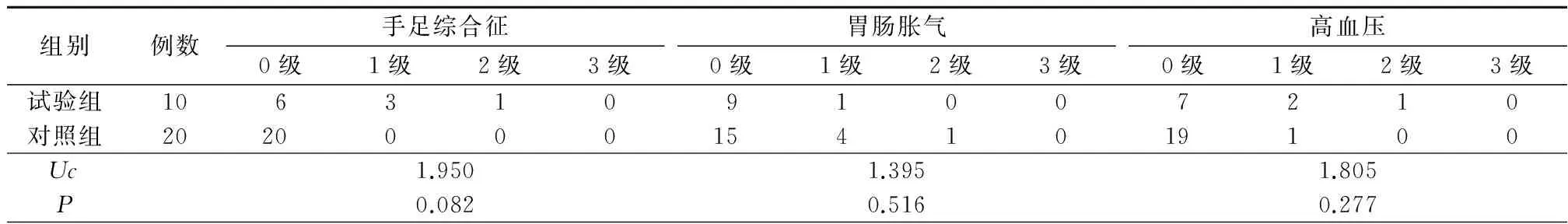
表2 试验组与对照组不良反应比较Table 2 Comparison of adverse reaction in treatment group and control group (例数,%)

表2 (续)
3 讨 论
在我国,卵巢癌预后极差,生存率低,故卵巢癌治疗进展备受关注,尽管医学技术在不断发展,治疗手段与以前相比已有明显进步,但大部分患者的治疗效果欠佳。卵巢癌早期缺乏明显的临床症状,筛查效果并不理想[7]。卵巢癌的治疗方法包括手术切除、化疗、放疗、靶向治疗等,由于卵巢癌诊断多数处于中晚期,大部分患者失去手术机会,化疗则作为主要的治疗手段,而传统药物疗效已达到平台期,不良反应较多[8]。化疗耐药是影响预后的主要因素,肿瘤耐药涉及多系统、多层次[9],大多与基因的差异表达有关[10]。近年来靶向药物成为治疗恶性肿瘤的热点,研究者们希望通过新型靶向制剂解决各种恶性肿瘤患者的耐药问题,从而延缓癌细胞的转移,延长患者生存期。靶向治疗不良反应轻,患者耐受性较好,目前有关卵巢癌靶向治疗的应用越来越多,主要包括PARP抑制剂、PI3K/AKT/mTOR信号通路抑制剂和血管生成抑制剂。肿瘤在异常增值过程中需要更多的营养成分与氧气,这就需要通过新生血管从宿主向肿瘤组织输送,所以血管生成抑制剂成为研究热点之一。由于VEGF/VEGFR-2信号通路在肿瘤血管新生中起重要作用,因此阻断该信号通路进而抑制肿瘤血管新生已成为肿瘤靶向治疗的新热点[11]。阿帕替尼是我国自主研制成的作用于VEGFR-2新型靶向药物,可以高选择性地阻断VEGFR-2及其下游信号通路,从而抑制血管内皮细胞的增殖及迁移,以达到抑制肿瘤的目的[12]。研究显示,阿帕替尼治疗恶性肿瘤可有效缓解症状,改善总生存期,在安全性方面,Ⅱ期与Ⅲ期临床研究比较,不良事件的类型和发生率基本一致,与已上市的其他同类药物相类似[13]。本研究通过观察化疗联合阿帕替尼用于二线化疗失败卵巢癌的治疗,评估此联合方案在晚期卵巢癌中的效果。
本研究结果显示,对照组客观缓解率为10.00%、疾病控制率为45.00%,试验组客观缓解率为70.00%、疾病控制率为100.00%,试验组客观缓解率和疾病控制率均高于对照组。值得一提的是,试验组服用阿帕替尼之后各有1例恶性腹腔积液和恶性胸腔积液消失。恶性腹腔积液是卵巢癌最常见并发症之一,患者通常表现为腹胀、腹痛、纳差、少尿等,严重时甚至可能出现呼吸困难,对患者的生活质量产生严重影响。有研究显示,抑制血管内皮生长因子及其受体的表达,可抑制恶性腹腔积液的形成[14]。本研究结果显示,阿帕替尼联合化疗在恶性胸腹腔积液方面有一定的疗效,但还需大样本进一步证实。
本研究中阿帕替尼联合化疗出现的不良反应主要为手足综合征、高血压、白细胞减少、胃肠胀气、腹泻、恶心呕吐,尚未发现消化道出血患者,但对于具有高出血风险患者,应慎用阿帕替尼,一旦出现消化道大出血,必须立即停用阿帕替尼,并且按照临床常规积极治疗出血。不良反应中手足综合征发生率较高,主要表现为手足麻木、红斑肿胀、起疱、皲裂以及脱屑,也可以出现手指及脚趾弯曲部位皮肤角化,主要发生在手掌及足底。本研究中暂无患者出现脸部红斑症状。使用氢化可的松软膏或尿素软膏可有效缓解手足综合征症状,口服阿帕替尼时需嘱患者注意加强皮肤护理,保持皮肤清洁湿润。患者在服用ACEI类及ARB类降压药物后,高血压症状即可缓解。至于口服阿帕替尼引起的白细胞减少、恶心、呕吐等反应,对症治疗后均可缓解。近期一项小样本研究也显示,阿帕替尼在治疗中具有耐受性和安全性[15]。
综上所述,卵巢癌已成为影响我国女性生命健康的主要疾病,形势严峻,寻找有效的治疗手段迫在眉睫。阿帕替尼联合化疗对进展期复发耐药卵巢癌治疗具有较好疗效,有一定的临床意义,有望成为一种安全有效的治疗手段,从而改善进展期卵巢癌的治疗效果。今后尚需开展大规模临床研究以进一步证实阿帕替尼联合化疗应用于晚期卵巢癌患者的安全性,观察长期疗效及总体生存率,并需要大量临床数据进一步探讨最佳剂量及最佳联合用药模式。
[1] Mezzanzanica D. Ovarian cancer:a molecularly insidious disease[J]. Chin J Cancer,2015,34(1):1-3.
[2] Alkema NG,Tomar T,van der Zee AG,et al. Checkpoint kinase 2(Chk2) supports sensitivity to platinum-based treatment in high grade serous ovarian cancer[J]. Gynecol Oncol,2014,133(3):591-598.
[3] 陈珊,李荣清.卵巢癌靶向治疗新进展[J].医学综述,2016,22(23):4617-4621.
[4] 方勇.Gem和CarBo和5-Fu三线治疗PVB及VAC晚期卵巢癌的观察[J].医药论坛杂志,2016,37(9):148-150.
[5] 朱国栋,吴大鹏,樊桂玲,等.单中心56例舒尼替尼治疗转移性肾细胞癌患者的疗效及安全性分析[J].现代泌尿外科杂志,2017,22(4):286-290.
[6] 皋文君,刘砚燕,袁长蓉.国际肿瘤化疗药物不良反应评价系统——通用不良反应术语标准4.0版[J].肿瘤,2012,32(2):142-144.
[7] 李磊,赵永民,高新萍.超声、CT、MRI及血清CA125对卵巢癌诊断的对比分析[J].河北医科大学学报,2017,38(3):349-352.
[8] 温灏,吴小华.复发性卵巢癌研究现状及治疗决策[J].中国实用妇科与产科杂志,2012,28(3):192-196.
[9] Dasari S,Tchounwou PB. Cisplatin in cancer therapy:molecular mechanisms of action [J]. Eur J Pharmacol,2014,740:364-378.
[10] LIU X,GAO Y,LU Y,et al. Oncogenes associated with drugresistance in ovarian cancer[J]. J Cancer Res Clin Oncol,2015,141(3):381-395.
[11] Hamerlik P,Lathia JD,Rasmussen R,et al.Autocrine VEGF-VEGFR2-Neuropilin-1 signaling promotes glioma stemlike cell viability and tumor growth[J]. J Exp Med,2012,209(3):507-520.
[12] Zhang H. Apatinib for molecular targeted therapy in tumor[J]. Drug Des Devel Ther,2015,9:6075-6081.
[13] 繆建华,束永前.肿瘤内科相关事件临床处理策略[M].南京:东南大学出版社,2015:368-398.
[14] Zhan N,Dong WG,Wang J. The clinical significance of vascular endothelial growth factor in malignant ascites [J].Tumour Biol,2016,37(3):3719-3725.
[15] 林岩松.甲磺酸阿帕替尼治疗进展性碘难治性甲状腺癌的短期疗效及安全性初步报告[J].中国癌症杂志,2016,26(9):721-726.
Clinicalobservationofapatinibcombinedwithchemotherapyforsecond-linetreatmentfailureinadvancedovariancancer
LI Qi1, ZHAO Jun-feng2*, SHI Xiao-yu2, ZHAO Li-xia2, LIU Dan1
(1.HebeiNorthCollegeGraduateDepartment,Zhangjiakou075000,China; 2.DepartmentofMedicalOncology,theFirstAffiliatedHospitalofHebeiNorthCollege,Zhangjiakou075000,China)
ObjectiveTo observe the short-term efficacy and safety of the new targeted drug apatinib combined with chemotherapy in the treatment of patients with ovarian cancer recurrence.MethodsA total of 30 cases of patients with second-line treatment failure in advanced ovarian cancer were randomly divided into 2 groups: the observation group(n=10) and the control group(n=20).The patients with advanced ovarian cancer adopted a apatinib and taxel, anthracyclines-based combination chemotherapy regimen as observation group. Concurrent other patients who did not receive apatinib were chosen as control group. The therapeutic efficacy and side-effect of the two groups were compare.ResultsAfter 6 cycles, clinical curative effect of observation group is better than the control group. There were significant differences in the objective response rate and the disease control rate(P<0.05).The most common adverse reactions were hand-foot syndrome, hypertension, flatulence and diarrhea, mainly in grade 1-2.ConclusionApatinib combined with chemotherapy is an effective and well-tolerated treatment for advanced ovarian cancer, and the adverse reaction were tolerable.
ovarian neoplasms; drug resistance, neoplasm; apatinib; drug therapy, combination
2017-07-03;
2017-07-19
李琪(1992-),女,河北定州人,河北北方学院医学硕士研究生,从事肿瘤诊治研究。
*通讯作者。E-mail:zhaojunfengmin@163.com
R737.31
A
1007-3205(2017)12-1384-04
赵丽洁)
