功能化离子液体催化氧化偏三甲苯合成2,3,5-三甲基苯醌
2017-12-23林富荣伍家卫陈淑芬杨兴锴夏德强
颉 林 林富荣 李 薇 伍家卫 陈淑芬 杨兴锴 夏德强
(1兰州石化职业技术学院,甘肃 兰州730060;2常州大学江苏精细石油化工重点实验室,江苏 常州213164)
功能化离子液体催化氧化偏三甲苯合成2,3,5-三甲基苯醌
颉 林1林富荣2李 薇1伍家卫1陈淑芬1杨兴锴1夏德强1
(1兰州石化职业技术学院,甘肃 兰州730060;2常州大学江苏精细石油化工重点实验室,江苏 常州213164)
以磺酸基功能化离子液体与CuCl2的配合物为催化剂,H2O2为氧化剂,直接催化氧化偏三甲苯合成2,3,5-三甲基苯醌。考察了催化剂用量与配比、反应温度、反应时间等因素对反应的影响。探讨了功能离子液体与CuCl2的配合物催化氧化反应机理。该催化剂体系具有较好的活性和选择性,2,3,5-三甲基苯醌产率达78.7%,纯度为99.5%。该方法具有原子经济性好,生产成本低,环境污染小,催化剂可循环利用,为工业生产2,3,5-三甲基苯醌提供了一种较好的方法。
磺酸基功能化离子液体;CuCl2;偏三甲苯;催化氧化
2,3,5 -三甲基苯醌(TMBQ)是工业生产维生素E的关键中间体[1]。维生素E是一种脂溶性维生素,其水解产物为生育酚,是最主要的抗氧化剂之一,可提高生育能力和预防近视眼发生与发展。作为全球市场容量最大的维生素类产品之一,维生素E广泛应用于饲料、医药、食品、化妆品等行业。2016年维生素E全球需求量约为8万吨,我国维生素E需求增长率约为7%-8%,对TMBQ的需求也日益增加。
目前,国内外合成TMBQ的方法主要以2,3,6-三甲基苯酚(TMP)为起始原料经氧化而得,其氧化工艺主要有化学氧化和催化氧化两种。钱东[2]等用浓硫酸将TMP磺化,然后以MnO2-H2SO4混合物作氧化剂氧化得到TMBQ,产率为60.8%。该方法一般采用无机氧化物(如KMnO4、MnO2、PbO等)为氧化剂,但收率较低,生产过程腐蚀性强,且产生大量的工业废水废渣,环境污染严重。化学氧化法作为合成TMBQ的传统方法,由于其生产工艺的环保问题,逐渐被淘汰。
催化氧化法通常采用分子氧或过氧化氢等洁净氧化剂,在催化剂作用下进行氧化。专利US6262311[3]采用CuCl2作催化剂,以其他过渡金属氯化物为助催化剂,一步催化氧化得到TMBQ,产率达97%,但该法需要消耗大量的CuCl2。Shimizu[4]等盐酸羟胺-丙酮肟-盐酸混合物为辅助催化剂,适当降低了CuCl2的用量,以氧气作为氧化剂得到产率为80%的TMBQ。以CuCl2为主的一步催化氧化法,虽然产品收率较高,但存在催化剂不易回收、产品分离难及纯度低等问题。王宪沛[5]等采用普通的咪唑类离子液体为助催化剂,以CuCl2-MnCl2为主催化剂催化氧化得到产率较高的TMBQ,解决了后处理过程催化剂回收难的问题。以上方法都是以TMP为原料进行催化氧化,考虑到TMP价格高的问题,张天永[6]等用铜酞菁与γ-Al2O3的复合催化剂催化氧化偏三甲苯(TMB)得到TMBQ,大大降低了生产成本。
一步催化氧化法流程短,工艺操作简单,产生工业三废少,生产过程节能环保,该法成为制备TMBQ工艺路线研究的主流,且开发新型绿色催化剂是关键。本文采用磺酸基功能化离子液体与CuCl2的配合物为催化剂,研究TMB催化氧化制备TMBQ的反应,考察催化活性、工艺条件等对反应的影响,并研究催化剂回收套用情况。
1 实验部分
1.1 主要仪器与试剂
RE3000B旋转蒸发仪(上海亚荣生化仪器厂),WRS-3熔点仪(上海精科仪器有限公司),GC9800气相色谱仪(上海科创色谱仪器有限公司),DUG-91446真空干燥箱(上海精宏实验设备有限公司)。
实验所用偏三甲苯、二水合氯化铜、30% H2O2、36%盐酸、1,3-丙烷磺内脂、N-甲基咪唑、甲苯、乙酸乙酯均市售分析纯。
1.2 催化剂的制备
按照等摩尔比称取一定量的N-甲基咪唑与1,3-丙烷磺内脂,在室温下搅拌20h后抽滤得到白色固体盐,用乙酸乙酯洗涤3次,60℃进行真空干燥,得到1-甲基-3-(丙基-3-磺酸基)咪唑内鎓盐(简称MIMPS)。称取一定质量的MIM-PS于三口烧瓶中,在搅拌下于常温滴加浓度为36%盐酸溶液,MIM-PS与HCl的总量等摩尔,滴完后缓慢升温至80 ℃反应4h,真空脱水,得到淡黄色[PSMIm]Cl离子液体。
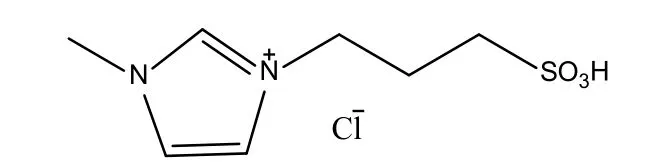
图1 磺酸基功能化离子液体
1.3 催化氧化反应
先将一定量的[PSMIm]Cl离子液体催化剂和CuCl2·2H2O加入到带有机械搅拌的500mL三口烧瓶中,室温下搅拌1h后,再加入一定量的TMB和甲苯,然后逐渐升温至110℃时,开始滴加浓度为30%的双氧水,控制滴加时间和反应时间。
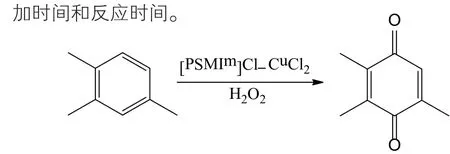
图2 催化氧化反应
反应结束后,反应液水洗三次,收集的水相用旋转蒸发仪脱除大部分水,残余物为含水的离子液体可回收套用。有机相用旋转蒸发仪脱除部分甲苯后,低温下结晶,抽滤干燥后,得到黄色的TMBQ晶体,气相色谱分析产品纯度99.5%,熔点为29-32℃。
2 结果与讨论

图3 功能离子液体催化氧化反应机理
2.1 反应机理探讨
在磺酸基功能化离子液体与CuCl2形成的配合物催化作用下,TMB催化氧化合成TMBQ的可能机理如图2所示。
在强酸功能离子液体与CuCl2共同作用下,活化的过氧化氢与TMB碰撞反应,使苯环上形成苯过氧自由基,同时被还原的一价铜离子活化过氧化氢时自身被氧化为二价铜离子。活性CuCl2与此自由基结合,然后发生自由基上电子转移,在苯环6号和3号碳上形成羰基,从而得到TMBQ。
2.2 催化剂用量及配比对反应的影响
在0.2molTMB、200mL甲苯,90.7g30%双氧水滴加时间30min,催化剂用量为TMB物质的量百分比,反应温度110 ℃,反应时间5 h,且加料顺序和方式相同的条件下,考察催化剂磺酸基功能化离子液体与CuCl2配比及用量对反应的影响,结果如表1所示。
由表1结果可知,无催化剂磺酸基功能化离子液体参与反应时,转化率和产率都比较低,当催化剂磺酸基功能化离子液体与CuCl2共同参与催化氧化反应时,转化率和产率有明显提高,这可能是由于功能离子液体与CuCl2形成的配合物催化剂起了显著的作用。当催化剂用量超过10%时产品收率增加不明显,且催化剂较佳配比为1:1,故较佳的催化剂用量选择10%。
2.3 温度对反应的影响
在0.2mol TMB、200mL甲苯,90.7g30%双氧水滴加时间30min,催化剂用量分别为TMB物质的量10%的[PSMIm]Cl离子液体和10%的CuCl2,反应时间5h,且加料顺序和方式相同的条件下,考察温度对反应的影响,结果如表2所示。
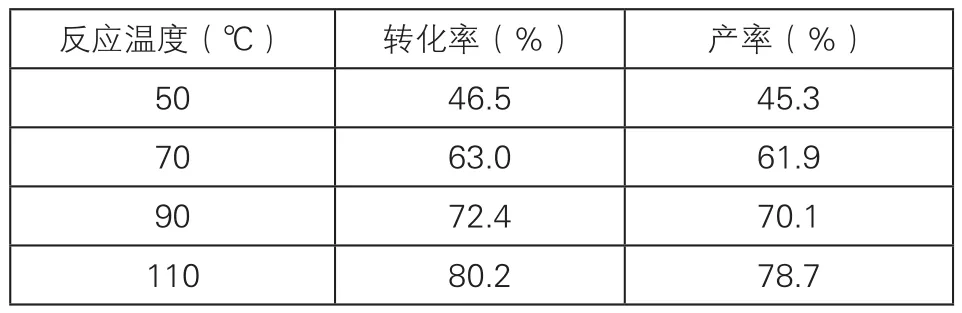
表2 温度对反应的影响
由表2结果可知,生成TMB的转化率和产品的收率都随着温度的升高而增加,直至溶剂的沸点温度。这说明强Brønsted酸功能离子液体环境下H2O2不易分解,这与用一般催化剂进行催化氧化不同,随温度升高H2O2易分解,这样大大降低了双氧水的用量,且在回流温度下易于控制,有利于提高反应速率。故选择反应温度为110℃。
2.4 反应时间的确定
在0.2molTMB、200mL甲苯,90.7g30%双氧水滴加时间30min,催化剂用量分别为TMB物质的量10%的[PSMIm]Cl离子液体和10%的CuCl2,反应温度110℃,且加料顺序和方式相同的条件下,考察反应时间对催化氧化TMB转化率和产品收率的影响,结果如表3所示。

表3 反应时间对催化氧化TMB转化率和产品收率的影响
由表3结果可知,随着反应时间的推移,TMB转化率和目的产品产率呈不断增加趋势,但是在5h之后转化率增加速度大于产率的增加速度,即产品产率趋于平稳,这说明5h之后副产物的量逐渐增加。在反应前3h转化率与产率之差较大,且从气相色谱分析可知,反应开始时,生成中间产物的量较多,随着时间的延长,中间产物逐渐转化为目的产品。故选择反应时间为5h。
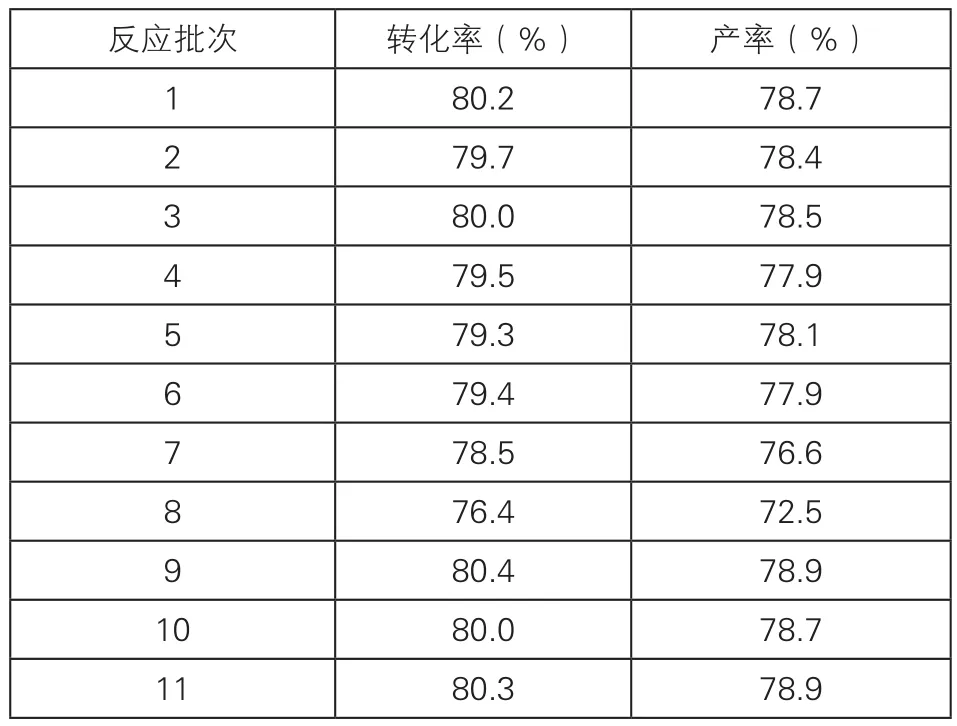
表4 催化剂回收套用对反应的影响
2.5 催化剂回收套用对反应的影响
在0.2molTMB、200mL甲苯,90.7g30%双氧水滴加时间30min,催化剂用量分别为TMB物质的量10%的[PSMIm]Cl离子液体和10%的CuCl2,反应温度110℃,反应时间5h,且加料顺序和方式相同的条件下,考察催化剂回收套用对反应的影响,结果如表4所示。
由表4结果可知,回收的催化剂配合物套用6次时,原料转化率和产品产率基本比较平稳,但在第7次开始转化率和产率下降较快,且副产物的量最大,即催化剂选择性变差,这可能因为随着催化剂套用次数增多,催化剂中离子浓度降低且有部分损失造成催化剂活性和选择性下降。为了能使催化剂很好的回收套用,降低工业成本,减少环境污染,在催化剂套用第9次时,补加[PSMIm]Cl离子液体和CuCl2各5%的量,结果发现催化剂活性和选择性提高到原来水平,通过这种方法可以使催化剂长期循环使用。
3 结 语
实验采用磺酸基功能化离子液体与CuCl2的配合物为催化剂,可以将廉价易得的石油裂解产物TMB直接催化氧化制备TMBQ。该方法原子经济性好,环境污染小,催化剂可循环利用。
该工艺方法较适宜的反应条件为:TMB:[PSMIm]Cl:CuCl2=10:1:1,溶剂为甲苯,氧化剂双氧水逐滴加入,反应温度110℃,反应时间5h,产率达78.7%,纯度为99.5%。
[1]BONRATH W,EGGERSDORFER M,NETSCHER T. Catalysis in the industrial preparation of vitamins and nutraceuticals[J].Catalysis Today,2007,121:45-57.
[2]钱东,何厚群,王开毅.直接氧化法合成.2,3,5-三甲基苯醌[J].化学试剂,2002,24(4),231-232.
[3]DEGUSSA.Process for the preparation of 2,3,5-trimethyl-p-benzoquionne[P].US6262311,2001.
[4]BODNAR Z,MALLAT T et al. Oxidation of 2,3,6-trimethylphenol to trimethyl-1,4-benzo quinone with catalytic amount of CuCl2[J].Journal of Molecular Catalysis A:Chemical,1996,110:55-63.
[5]王宪沛,杨瑞云,李文等.离子液体催化氧化2,3,6-三甲基苯酚合成2,3,5-三甲基苯醌[J].工业催化,2013,21(8):73-75.
[6]张天永,段永洁,李彬等.偏三甲苯催化氧化制备2,3,5-三甲基苯醌的研究[J].化学试剂,2013,35(1):3-6.
Functionalized ionic liquid catalytic oxidation of pseudocumene to 2,3,5-trimethyl-benzoquinone
Pseudocumene was oxidized catalytically to 2,3,5-trimethyl-benzoquinone using complex of SO3H functionalized ionic liquid and copper(II) chloride as catalyst,H2O2 as the oxidant.The effects of reaction conditions such as dosage and ratio of the catalysts,reaction temperature,reaction time on reaction were optimized.The reaction mechanism of catalytic oxidation by complex of SO3H functionalized ionic liquid and copper(II) chloride.The results indicated that the catalyst system showed better catalytic activity and selectivity.The yield of product can be 78.7% with content of 99.5%.The method is characterized by excellent atom economy,low production cost and low environmental pollution and the catalyst can be recycled.It provided a good way for the commercial synthesis of 2,3,5-trimethyl-benzoquinone.
SO3H functionalized ionic liquid;copper(II) chloride;pseudocumene;catalytic oxidation
甘肃省教育厅高等学校科研项目(2014B-125)
O643.32
B
1003-8965(2017)05-0033-03
