皮诺敛酸/左旋肉碱降低HepG2细胞脂质的最佳浓度配比研究
2017-12-22杨明非张孙东杨雨春付玉杰
杨明非 张 晶 苏 雯 王 鹏 张孙东 寇 萍 焦 骄 杨雨春 付玉杰*
(1.北日本制药株式会社产品研发室,日本富山县中新川郡上市町若杉55号 930-0314; 2.广东省珠海市斗门区公立医疗卫生机构管理中心,珠海 519125; 3.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040; 4.吉林省林业科学院,长春 130033)
皮诺敛酸/左旋肉碱降低HepG2细胞脂质的最佳浓度配比研究
杨明非1张 晶3苏 雯2王 鹏3张孙东3寇 萍3焦 骄3杨雨春4付玉杰3*
(1.北日本制药株式会社产品研发室,日本富山县中新川郡上市町若杉55号 930-0314;2.广东省珠海市斗门区公立医疗卫生机构管理中心,珠海 519125;3.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040;4.吉林省林业科学院,长春 130033)
针对单一活性成分的减肥降脂效果较差,且容易出现耐药性等问题,本文筛选并优化了皮诺敛酸/左旋肉碱降低HepG2细胞脂质的最佳浓度配比,为皮诺敛酸降脂产品的开发提供基础数据。通过油酸诱导HepG2细胞成脂建立体外非酒精性脂肪肝模型。采用油红O染色法确定了皮诺敛酸/左旋肉碱降低HepG2细胞中脂滴的最佳浓度配比。实验结果表明0.5 mmol·L-1油酸诱导HepG2细胞脂肪变性效果最佳,皮诺敛酸(PLA)最佳降脂浓度为6.25 μmol·L-1,左旋肉碱(LC)最佳降脂浓度为250 μmol·L-1,皮诺敛酸/左旋肉碱 (PLA /LC) 最佳降脂浓度配比为1∶40 (μmol·L-1/μmol·L-1)。皮诺敛酸/左旋肉碱复配物可以显著降低HepG2细胞脂质,具有用量少,协同作用效果突出的优点,因此皮诺敛酸/左旋肉碱复配物在开发降脂减肥产品中具有良好的应用前景。
皮诺敛酸;左旋肉碱;复配;降脂;非酒精性脂肪肝
皮诺敛酸(Pinolenic acid)又称洗血因子,是一种仅存在于红松籽油中[1~2]的新型多不饱和脂肪酸,属于△5型多不饱和脂肪酸,具有减肥、降血脂以及抑制癌细胞转移等功能[3~4]。研究显示,皮诺敛酸能够刺激两大饥饿抑制剂—缩胆囊素(CCK)和胰高血糖素样肤-1(GLP-1),其中CCK要主要作用是刺激胰酶的分泌与合成,也可作为饱感因素来调节食欲,GLP-1是回肠内分泌的一种脑肠肽,一般作为2型糖尿病药物作用的靶点[5]。此外,皮诺敛酸不仅可以抑制小鼠营养性肥胖[6],还可以降低低密度脂蛋白(Low-density lipoprotein)[7],在美国也有以其为主要功能成分的减肥食品出售。因此皮诺敛酸可以作为一种健康的降脂减肥营养食品。
左旋肉碱(L-Carnitiue),又称L-肉碱,维生素BT[8]。化学名为β-羟基γ-三甲铵丁酸,是一种自然界中广泛存在的类维生素,首次由俄国科学家在肌肉浸汁中发现[9]。目前可从饮食中获得,也可通过内源性生物合成。长期以来,L-肉碱被公认为脂质代谢中重要的组成部分,并且具有很好的抗氧化活性[10~12]。研究发现,左旋肉碱通过加速脂肪代谢速率,发挥了其对人体脂肪酸氧化的重要作用。除此之外,左旋肉碱还具有抗疲劳及减肥的作用。
非酒精性脂肪肝病(Non-alcoholic fatty liver disease,NAFLD)是一种无过度饮酒,以肝细胞脂质贮积和脂肪变性为特征的临床病理综合征,包括脂肪性肝炎(NASH)、肝硬化、肝癌以及肥胖症等[13~14]。目前NAFLD在我国的患病率约为15%~20%,在40岁以上男性中患病率高达30%,且近几年有年轻化的趋势[15]。研究者对于NAFLD发病机制的研究主要围绕在脂代谢异常、胰岛素抵抗、脂质过氧化等方面[16~18]。
功能活性成分的复配应用广泛,具有用量少,延缓抗性,增加功效,作用方式互补等优点。虽然有研究表明皮诺敛酸和左旋肉碱能够降低体重,但是对两者具体的降脂效果报道较少。本实验首次对皮诺敛酸和左旋肉碱二者进行复配,并考察其对HepG2非酒精性脂肪肝模型的降脂效果,以期获得功效更好的降低脂质的皮诺敛酸/左旋肉碱复配物,为红松籽油的开发利用提供科学数据。
1 材料与方法
1.1 实验试剂
油酸,MTT,DMSO,EDTA(美国Sigma公司),DMEM高糖培养基(美国Hyclone公司),胎牛血清(杭州四季青生物工程材料有限公司),胰蛋白酶(美国Gibco公司),青霉素,链霉素双抗(Beyotime生物技术研究所),饱和油红O染色液(北京索莱宝科技有限公司),异丙醇(天津市瑞金特化学品有限公司),人肝癌HepG2细胞株(中国科学院细胞库),皮诺敛酸(纯度50%)由东北林业大学森林植物生态学国家重点实验室付玉杰团队提取,左旋肉碱(纯度≥98%)购自四川维克奇生物科技有限公司。
1.2 实验方法
1.2.1HepG2细胞培养
将HepG2细胞培养于含有10%胎牛血清、1%青霉素,链霉素的DMEM高糖培养液中,37℃,5% CO2孵育。当细胞密度达到80%以上时,用0.25%(含EDTA)胰酶消化,按1∶2比例传代,取对数生长期的细胞用于后续实验。
1.2.2非酒精性脂肪肝模型的建立
接种HepG2于24孔板中,过夜,待细胞贴壁生长至70%后,分别加入含不同浓度含油酸的培养液(0,0.25,0.5,1.0mmol·L-1),继续培养24h。结合细胞形态观察并选择对细胞毒性较小的浓度作为诱导细胞形成脂肪变性的最适浓度。
1.2.3细胞毒性检测
当细胞密度达到80%时,将HepG2细胞接种于96孔板中,置于培养箱培养24h后。分别用0(对照组)、0.5、0.7812、1.5625、3.125、6.25、12.5、25、50、100μmol·L-1的皮诺敛酸或0(对照组)、20、40、62.5、125、250、500、1000、2000、4000μmol·L-1的左旋肉碱或0(对照组)、0.5∶20、1∶40、1.5∶80、2∶100、2.5∶200、5∶300、10∶400、12.5∶500(μmol·L-1/μmol·L-1)的皮诺敛酸/左旋肉碱复配物处理细胞。处理24h后每孔加入20μL MTT(5mg·mL-1),避光,37℃孵育4h后,弃去培养液,然后加入100μL DMSO,震荡混匀后选择490nm波长,在酶标仪上测定各孔光吸收值,记录结果,分析皮诺敛酸,左旋肉碱以及皮诺敛酸/左旋肉碱复配物对HepG2细胞的毒性。
1.2.4HepG2细胞油红O染色
将HepG2细胞接种于24孔板中,贴壁培养过夜。分别将1.5625、3.125、6.25、12.5μmol·L-1的皮诺敛酸或62.5、125、250、500μmol·L-1的左旋肉碱或12.5∶500、6.25∶500、12.5∶250、6.25∶250(μmol·L-1/μmol·L-1)皮诺敛酸/左旋肉碱的高浓度复配组,或0.5∶20、1∶40、1.5∶80、2∶100(μmol·L-1/μmol·L-1)皮诺敛酸/左旋肉碱的低浓度复配组混于含2%胎牛血清的DMEM培养液培养细胞12h后,小心移去培养液,加入含0.5mmol·L-1油酸的2%胎牛血清培养液进行培养。24h后,用生理盐水清洗3次,油红O染色30min,再用60%的异丙醇固定2min,立即用生理盐水清洗3次,显微镜下观察细胞形态及脂滴分布情况,并拍照记录实验结果。
1.2.5油红O染色细胞内脂滴含量测定
油红O染色步骤同1.2.4,待终止染色后,加入100%异丙醇进行破膜,待细胞内油红O完全溶出后,震荡10min,490nm下进行OD值检测。
1.2.6数据处理与分析
本实验中所有测试重复3次,数据以平均值±标准偏差(SD)表示。显着性差异通过单因素方差分析计算,显着性水平(P<0.05)。借助Excel软件进行数据分析,制图。
2 结果与分析
2.1 油酸诱导HepG2细胞成脂的最佳浓度
通过油红O染色肉眼观察0.25,0.5,1mmol·L-1油酸处理细胞后胞内脂滴分布情况。由于1mmol·L-1油酸处理细胞后,脂滴量过多,不利于后期药物降脂浓度的筛选,而0.25mmol·L-1油酸处理细胞后脂滴积累量少,选用0.5mmol·L-1油酸诱导HepG2细胞建立非酒精性脂肪肝模型(图1和图版Ⅰ:1~4)。
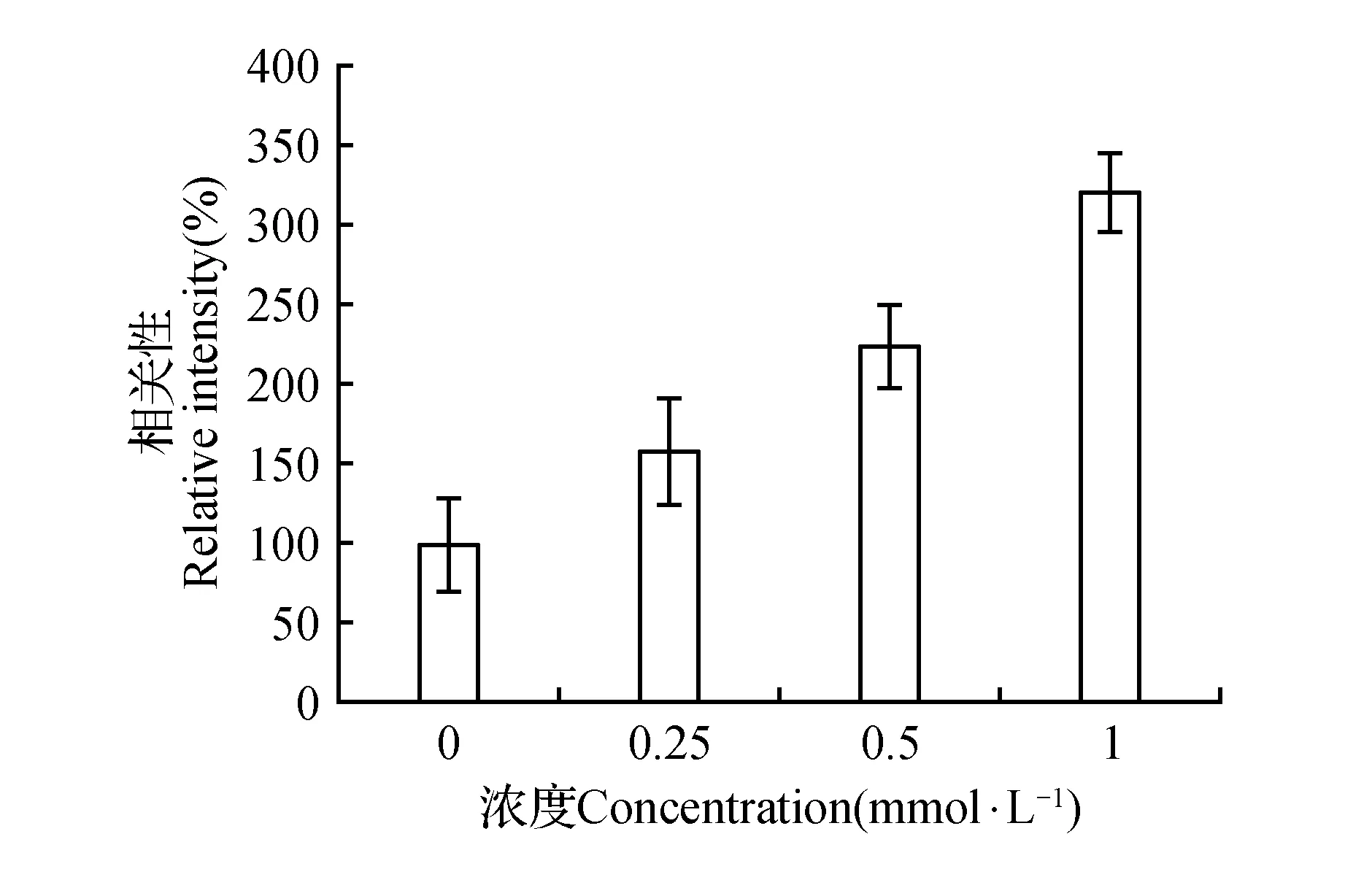
图1 油红O染色定量分析Fig.1 Quantification of oil red O staining
2.2 皮诺敛酸对HepG2细胞模型中积累脂质的影响
利用MTT法检测皮诺敛酸对HepG2细胞生长的影响,结果显示皮诺敛酸浓度在0.5~25 μmol·L-1时,对HepG2细胞存活率无显著影响,而超过50 μmol·L-1时对细胞有一定的毒性(图2A),因此选择皮诺敛酸的处理浓度为1.562 5、3.125、6.25、12.5 μmol·L-1,在此基础上处理HepG2细胞,观察细胞中脂滴的积累量。油红O染色结果表明,皮诺敛酸处理组HepG2细胞中红色脂滴显著下降,说明皮诺敛酸能够有效降低HepG2细胞内积累的脂质,且最佳降脂浓度为6.25 μmol·L-1(图2B和图版Ⅰ:5~10)。

图2 不同浓度的皮诺敛酸对HepG2细胞的降脂作用A.皮诺敛酸对细胞存活状况的影响;B.油红O染色定量分析Fig.2 Effects of different concentrations of pinolenic acid on lipid decrease in HepG2 cells A. Cell viability treated with pinolenic acid; B. Quantification of oil red O staining
2.3 左旋肉碱对HepG2细胞模型中积累脂质的影响
MTT法检测结果表明,左旋肉碱浓度为20~2 000 μmol·L-1时,细胞存活率为80%以上,说明对HepG2细胞生长无显著影响,而超过4 000 μmol·L-1时细胞的存活率低于80%,说明对细胞有一定的毒性(图3A)。因此,选择左旋肉碱处理浓度为62.5、125、250、500 μmol·L-1处理细胞,并观察细胞中脂滴的积累量。结果显示左旋肉碱处理组细胞中红色脂滴显著下降,左旋肉碱的最佳降脂浓度为250 μmol·L-1(图3B和图版Ⅰ:11~16)。
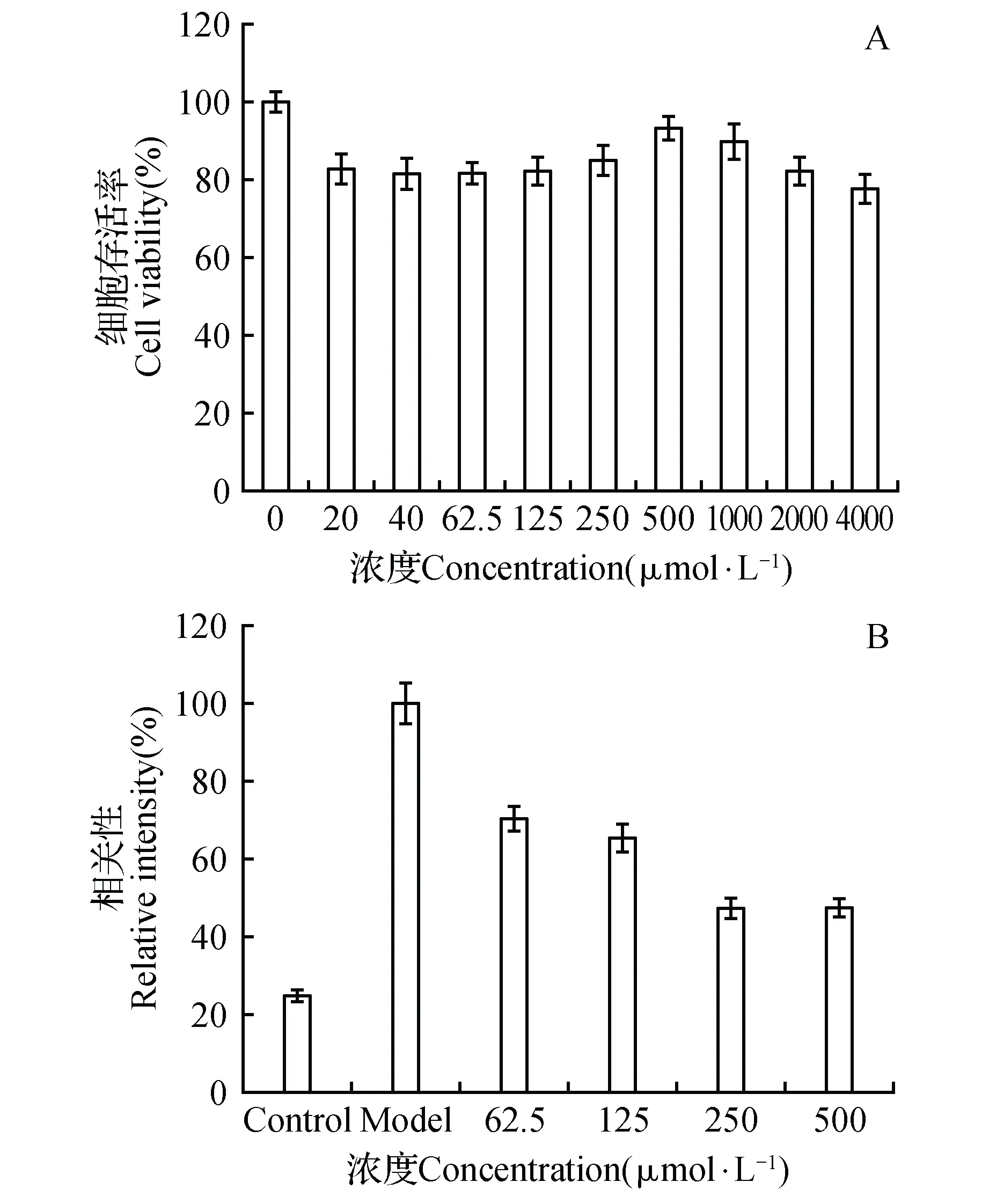
图3 不同浓度的左旋肉碱对HepG2细胞的降脂作用A.细胞存活状况;B.油红O染色定量分析Fig.3 Effects of different concentrations of L-Carnitine on lipid decrease in HepG2 cells A. Cell viability treated with L-Carnitine; B. Quantification of oil red O staining
2.4 皮诺敛酸/左旋肉碱复配物对HepG2细胞模型中积累脂质的影响
由MTT结果可知,与对照组相比,皮诺敛酸/左旋肉碱浓度配比为:0.5∶20、1∶40、1.5∶80、2∶100、2.5∶200、5∶300、10∶400、12.5∶500(μmol·L-1/μmol·L-1),对细胞生长无抑制作用(图4A)。在此浓度复配物基础上处理细胞,观察细胞中脂滴的积累量,油红O染色细胞形态学表明,高浓度复配物组细胞内脂滴量没有减小,因此说明以上浓度不具有降脂作用(图4:B和图版Ⅰ:17~22)。然而低浓度复配物组与模型组比较可知,HepG2细胞内脂滴量显著减少,并且优化出复配物最佳降脂浓度比例PLA/LC为1∶40(μmol·L-1/μmol·L-1)(图4:C和图版Ⅰ:23~28)。
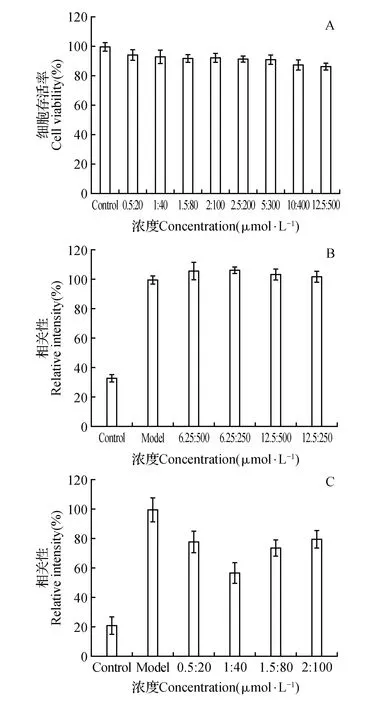
图4 不同浓度的复配物对HepG2细胞的降脂作用 A.复配物物对细胞存活状况的影响;B.高浓度复配物油红O染色定量;C.低浓度复配物油红O染色定量分析Fig.4 Effect of different concentrations of combination compounds on lipid decrease in HepG2 cells A. Cell viability treated with combination compounds; B. High concentration of compounds quantification of oil red O staining; C. Low concentration of compounds quantification of oil red O staining
3 结论
近年来,随着生活水平的提高,肥胖症及代谢紊乱性疾病不断增加,NAFLD的发病率也不断上升,它的防治已受到广泛的关注,因此本实验采用油酸诱导法建立非酒精性脂肪肝模型,筛选优化出皮诺敛酸、左旋右碱的最佳降脂浓度以及皮诺敛酸/左旋右碱复配物的最佳浓度比例。
通过MTT实验法筛选出皮诺敛酸对细胞无毒作用的浓度范围是0.5~25 μmol·L-1,通过油红O染色法观察细胞内脂滴的积累量,皮诺敛酸浓度为6.25 μmol·L-1时,细胞内红色脂滴量最少,降脂作用最明显;左旋肉碱对细胞无毒作用的浓度范围是20~2 000 μmol·L-1,通过油红O染色法观察到左旋肉碱浓度为250 μmol·L-1时,细胞内脂滴量最少,降脂效果最佳。

图版Ⅰ 油红O染色(10×20)细胞形态 1~4油酸处理组:0、0.25、0.5、1 mmol·L-1油酸对HepG2细胞脂滴积累的影响,皮诺敛酸油红O染色图(10×20) 5~10皮诺敛酸处理组:5.对照组;6.模型组;7~10. 1.562 5、3.125、6.25、12.5 μmol·L-1的皮诺敛酸;左旋肉碱油红O染色图(10×20) 11~16左旋肉碱处理组:11.对照组;12;模型组;13~16. 62.5、125、250、500 mmol·L-1的左旋肉碱;皮诺敛酸/左旋肉碱低浓度复配物油红染色(10×20) 17~22低浓度复配物处理组:17.对照组;18.模型组;19~22. 6.25∶500、6.25∶250、12.5∶500、12.5∶250的皮诺敛酸/左旋肉碱低浓度复配物;皮诺敛酸/左旋肉碱高浓度复配物油红染色(10×20) 23~28高浓度复配物处理组:23.对照组;24.模型组;25~28. 0.5∶20、1∶40、1.5∶80、2∶100的皮诺敛酸/左旋肉碱低浓度复配物Plate Ⅰ Oil red O staining(10×20) 1~4 oleic acid treated group: 0, 0.25, 0.5, 1 mmol·L-1 of oleic acid on lipid accumulation in HepG2 cell; Pinolenic acid oil red O staining(10×20) 5~10 pinolenic acid treated group: 5. Control; 6. Model; 7-10. 1.562 5, 3.125, 6.25, 12.5 μmol·L-1 of pinolenic acid; L-Carnitine oil red O staining(10×20) 11~16 L-Carnitine treated group: 11. Control; 12. Model; 13-16. 62.5, 125, 250, 500 mmol·L-1 of L-Carnitine; High concentration of combination pinoleic acid/L-Carnitine oil red O staining(10×20) 17-22 high concentration of combination pinoleic acid/L-Carnitine treated group: 17. Control; 18. Model; 19-22. 6.25∶500, 6.25∶250, 12.5∶500, 12.5∶250 of combination pinoleic acid/L-Carnitine; Low concentration of combination pinoleic acid/L-Carnitine oil red O staining(10×20) 23-28 low concentration of combination pinoleic acid/L-Carnitine treated group: 23. Control; 24. Model; 25-28. 0.5∶20, 1∶40, 1.5∶80, 2∶100 of combination pinoleic acid/L-Carnitine
为了达到更好的降脂作用,采用复配法进行实验研究。通过油红O染色法观察到,将两种单一药物的最佳降脂浓度进行复配时,细胞内脂滴积累量没有减少,表明降脂作用不明显。之后分别将两种药物的浓度降低后进行复配,观察到细胞内红色脂滴量减少,表明降脂作用明显。实验结果表明,当皮诺敛酸/左旋肉碱配比为1∶40 μmol·L-1/μmol·L-1的降脂效果最好。综上所述,低浓度混合的皮诺敛酸/左旋肉碱复配物降脂效果优于单一成分的降脂效果,且明显好于两种药物最佳浓度混合时的效果。这说明活性成分复配不仅能够降低用量,而且减少成分的耐受性,同时能够激活多靶点,协同作用效果突出,作用效果稳定。本文研究结果将为红松籽油降脂减肥复方保健品或者药品开发提供了重要的科学数据。
1.No D S,Kim I H.Pinolenic acid as a new source of phyto-polyunsaturated fatty acid[J].Lipid Technology,2013,25(6):135-138.
2.李佳军.松籽调和油配方及脂肪酸成分分析[J].黑龙江大学工程学报,2014(04):48-51.
Li J J.Determine the composition of the pine nut blend oil andanalyse it’s fatty acid composition[J].Journal of Engineering of Heilongjiang University,2014(04):48-51.
3.王萍,张银波,江木兰.多不饱和脂肪酸的研究进展[J].中国油脂,2008,33(12):42-46.
Wang P,Zhang Y B,Jiang M L,et al,Research advance in polyunsaturated fatty acid[J].CHINA OILS AND FATS,2008,33(12):42-46.
4.孙宇,松籽油中皮诺敛酸的提取纯化与减肥功能的研究[D].天津:天津科技大学,2009.
Sun Y.Study on Extraction and Purification of Pinotactic Acid from Pine Seed Oil and Its Weight Loss[D].Tianjin:Tianjin University of Science and Technology,2014.
5.Chen S J.Pinolenic acid inhibits human breast cancer MDA-MB-231 cell metastasis in vitro[J].Food chemistry,2011,126(4):1708-1715.
6.孙宇,张泽生,崔翠翠.皮诺敛酸抑制小鼠营养性肥胖作用研究[J].营养学报,2009(04):405-406.
Sun Y,Zhang Z S,Cui C C.Study on the Inhibitive Effect of Pinolenic Acid on Obesity in Mice[J].Acta Nutrimenta Sinica,2009(04):405-406.
7.Lee B M.Enrichment of pinolenic acid from pine nut oil via lipase-catalyzed ethanolysis with an immobilized Candida antarctica lipase[J].Biocatalysis and Biotransformation,2011,29(4):155-160.
8.吴晓宁,岳信念,中药滴丸剂研究进展[J].中医研究,2009(08):59-61.
Wu X N,Yue X N.Research Progress of Chinese Medicine Dropping Pills[J].Traditional Chinese Medicinal Research,2009(08):59-61.
9.杨晓惠.左旋肉碱与降脂减肥[J].生物技术世界,2015(04):129-130.
Yang X H.L-carnitine and lipid-lowering[J].BIOTECHWORLD,2015(04):129-130.
10.Fan Z.L-carnitine preserves cardiac function by activating p38 MAPK/Nrf2 signalling in hearts exposed to irradiation[J].European journal of pharmacology,2017,804:7-12.
11.Canbolat E P.Effects of L-carnitine on oxidative stress parameters in oophorectomized rats[J].Alexandria Journal of Medicine,2017.53(1):55-60.
12.Blanca A J.L-Carnitine ameliorates the oxidative stress response to angiotensin Ⅱ by modulating NADPH oxidase through a reduction in protein kinase c activity and NF-κB translocation to the nucleus[J].Food Chemistry,2017,228:356-366.
13.周峰,华春,李建梅,等.非酒精性脂肪肝的发病机制及其饮食干预[J].中国老年学杂志,2013(21):5482-5484.
Zhou F,Hua C,Li J M,et al.,Pathogenesis of nonalcoholic fatty liver disease and its diet intervention[J].Chinese Journal of Gerontology,2013(21):5482-5484.
14.Golabi P.Effectiveness of exercise in hepatic fat mobilization innon-alcoholic fatty liver disease:Systematic review[J].World Journal of Gastroenterology,2016,22(27):6318-6327.
15.Cohen J C,Horton J D,Hobbs H H.Human Fatty Liver Disease:Old Questions and New Insights[J].Science,2011,332(6037):1519-1523.
16.邱邦东.鳖甲煎丸改善肠道菌群失调治疗大鼠非酒精性脂肪肝的机制探讨[J].中国实验方剂学杂志,2017(04):145-151.
Qiu B D.Biejia Jianwan Improves Intestinal Flora Imbalance and Attenuates Nonalcoholic Fattv Liver Disease in Rats[J].Chinese Journal of Experimental Traditional Medical Formulae,2017(04):145-151.
17.刘晏.荷泽降脂口服液治疗肝郁脾虚型非酒精性脂肪肝的临床研究[J].中成药,2014(08):1607-1612.
Liu Y.The clinical study of Heze lipid-lowering oral liquid in the management of nonalcoholic fatty liver due to liver-qi stagnation and spleen deficiency[J].Chinese Traditional Patent Medicine,2014(08):1607-1612.
18.黄志华.荷叶降脂煎联合肝病治疗仪治疗中重度非酒精性脂肪肝的临床效果[J].中国当代医药,2014(21):42-43,49.
Huang Z H.Clinical effect of lotus lipid-lowering decoction combined with liver therapy instrument in the treatment of moderate and severe non-alcoholic fatty liver[J].CHINA MODERN MEDICINE,2014(21):42-43,49.
“13th Five-Year” The National Key Research Projects(2016YFD0600805)
introduction:YANG Ming-Fei(1989—),male,master of clinical Engaged in cancer medicine research.
date:2017-03-15
TheOptimizedProportionofCombinationPinoleicAcid/L-CarnitineDecreaseLipidinHepG2
YANG Ming-Fei1ZHANG Jing3SU Wen2WANG Peng3ZHANG Sun-Dong3KOU Ping3JIAO Jiao3YANG Yu-Chun4FU Yu-Jie3*
(1.Research and Development Department of Kitanihon Pharmaceutical CO.,No.55,Kamiichi,Nakaniikawa District,Toyama,Japan930-0314;2.Management Center of Public Medical and Health Institutions in Doumen District,Zhuhai City,Guangdong Province,Zhuhai519125;3.Key Laboratory of Forest Plant Ecology,Ministry of Education,Northeast Forestry University,Harbin150040;4.Forestry Academy of Jilin Province,Changchun130033)
As the single active ingredient is poor and prone to drug resistance on effects of lose weight and lipid-lowering, so the study focuses on screening and optimizing the optimal concentration ratio of pinoleic acid/L-carnitine to reduce the lipid of HepG2cell, which provides the basic data for the development of pinoleic acid lipid-lowering products. Oleic acid induced HepG2cell adipogenesis, which was used to simulate the model of nonalcoholic fatty liver in vitro. The optimal concentration in combination of pinoleic acid/L-Carnitine decrease lipid was determinated by oil red O staining. The results show that the optimum concentration of oleic acid-induced HepG2cell steatosis is0.5mmol·L-1.The optimal lipolysis concentration of pinoleic acid is6.25μmol·L-1. The optimal lipid metabolism concentration of L-Carnitine is250μmol·L-1. The best lipid-lowering ratio of pinoleic acid/L-carnitine(PLA/LC) is1∶40(μmol·L-1/μmol·L-1). The characteristics of pinoleic acid and L-Carnitine complexes decreased the doses and improved synergistic effect, Therefore, Combination of pinoleic acid/L-Carnitine has a potential prospectin in the development of lipid-lowering diet products.
pinoleic acid;L-Carnitine;complexes;lipid-lowering;nonalcoholic fatty liver disease
“十三五”国家重点研发计划项目(2016YFD0600805)
杨明非(1989—) ,男,临床医学硕士,主要从事肿瘤药物研究。
* 通信作者:E-mail:yujie_fu@163.com
2017-03-15
* Corresponding author:E-mail:yujie_fu@163.com
Q547
A
10.7525/j.issn.1673-5102.2017.06.018
