丽影和红韵蝴蝶兰快速繁殖试验
2017-12-22曾武清陈柳婵曾瑞珍易懋升宿庆连郭和蓉黎扬辉
曾武清,陈柳婵,曾瑞珍,易懋升,宿庆连,郭和蓉,黎扬辉,谢 利
(1.广州花卉研究中心,广东 广州 510360;2.华南农业大学林学与风景园林学院,广东 广州 510642)
丽影和红韵蝴蝶兰快速繁殖试验
曾武清1,陈柳婵2,曾瑞珍2,易懋升1,宿庆连1,郭和蓉2,黎扬辉1,谢 利2
(1.广州花卉研究中心,广东 广州 510360;2.华南农业大学林学与风景园林学院,广东 广州 510642)
以花梗腋芽为材料,研究了蝴蝶兰新品种丽影和红韵的快速繁殖技术。结果表明,消毒时间对营养芽诱导率有显著影响,0.1%HgCl2消毒8 min的红韵蝴蝶兰营养芽诱导率最高,激素对营养芽诱导率影响不显著。6-BA浓度、有机附加物和芽数对丛生芽增殖影响显著,当6-BA浓度为8.0 mg/L时,丽影和红韵芽增殖系数最高,分别为2.31和2.22;添加椰汁更有利于减轻褐变,提高增殖系数;单芽接入的增殖系数最高。激素对生根率无显著影响,但对平均根数和苗高有显著影响,在含6-BA 0.1 mg/L+NAA 1.0 mg/L的培养基上试管苗株高最高,平均根数最多。以松树皮为基质,丽影和红韵蝴蝶兰试管苗移栽成活率分别为91.58%和87.27%。
蝴蝶兰;新品种;组织培养;快速繁殖;丛生芽
蝴蝶兰是兰科蝴蝶兰属(Phalaenopsis Blume)植物,市场前景广阔,其产业被称为“农业中的IT产业”[1]。在我国,蝴蝶兰已列入植物新品种保护名录,但目前商业化生产的蝴蝶兰品种主要是台湾或国外选育的品种,因此加快蝴蝶兰新品种选育和推广对我国蝴蝶兰产业高效可持续发展具有十分重要的现实意义。
种苗生产是新品种推广的基础,蝴蝶兰种苗生产主要采用组织培养快速繁殖方法[2-3]。对蝴蝶兰种苗工厂化生产技术研究的结果表明,不同蝴蝶兰品种工厂化繁殖效率、适宜的快繁途径、培养基和培养条件不完全相同[4-19]。因此,研究蝴蝶兰新品种组培快繁技术,建立新品种种苗工厂化生产技术体系对加快新品种推广至关重要。
丽影蝴蝶兰是采用幸福鹰蝴蝶兰和台大梦幻蝴蝶兰杂交选育的大红花条纹盆栽蝴蝶兰新品种,红韵蝴蝶兰是采用五唇兰和台大梦幻蝴蝶兰杂交选育的中小型紫红花盆栽蝴蝶兰新品种,分别于2013年和2015年通过广东省农作物品种审定,市场前景广阔。通过对丽影和红韵蝴蝶兰组培快繁技术进行研究,旨在建立这两个品种种苗工厂化生产技术体系,为新品种推广奠定基础。
1 材料与方法
1.1 试验材料
供试材料为广州花卉研究中心和华南农业大学合作选育的丽影与红韵蝴蝶兰新品种,种植于广州花卉研究中心从化基地,常规方法管理。
1.2 试验方法
1.2.1 外植体消毒 剪取丽影与红韵蝴蝶兰带有休眠芽的花梗,流水清洗表面后把休眠芽的苞片轻轻剥去,将花梗剪成2~3 cm带1个休眠芽的小段,洗洁精溶液浸泡5 min,流水冲洗干净后用0.1%HgCl2溶液消毒8~15 min,再用无菌水冲洗5次。接种时用无菌解剖刀将花梗两端分别切去0.3~0.5 cm,用无菌镊子将花梗基部向下插入诱导培养基进行培养。
1.2.2 营养芽诱导 (1)HgCl2消毒时间对营养芽诱导的影响:设8、10、15 min 3个处理,每个处理3次重复,每个重复接30个外植体。按1.2.1方法对红韵蝴蝶兰花梗进行消毒后,接种到1/2MS+6-BA5.0 mg/L+NAA0.5 mg/L +蔗糖30 g/L+卡拉粉8.0 g/L培养基中,每瓶接1个。
(2)激素对营养芽诱导的影响:将消毒10 min的红韵蝴蝶兰花梗腋芽接种到含不同浓度6-BA和NAA的1/2MS+蔗糖30 g/L+卡拉粉8.0 g/L+椰子汁150 mL/L培养基中,每瓶接1个。激素设3个处理,每个处理3次重复,每个重复接30个外植体。
培养50 d后记录外植体污染数、褐化死亡数和形成营养芽数,计算诱导率、污染率和褐化死亡率:

1.2.3 丛生芽诱导 将诱导出来的营养芽切下并接种到1/2MS+6-BA5.0 mg/L+NAA0.5 mg/L+蔗糖30 g/L+卡拉粉8.0 g/L培养基中继续培养,50 d后将长出的丛芽切去小叶,再次接种到新的培养基上培养以获得较多的丛生芽。
1.2.4 丛生芽增殖 (1)6-BA浓度对丛生芽增殖的影响:选取大小一致的营养芽切去叶片后以单芽接入含不同浓度6-BA的1/2MS+NAA0.5 mg/L+蔗糖30 g/L+卡拉粉8.0 g/L+椰子汁150 mL/L培养基中,每瓶接6芽。6-BA浓度设6.0、8.0、10.0 mg/L 3个处理,每个处理3次重复,每个重复30个芽。
(2)附加物对丛生芽增殖的影响:选取大小一致的营养芽切去叶片后以单芽接入含不同附加物的1/2MS+6-BA5.0 mg/L+NAA0.5 mg/L+蔗糖30 g/L+卡拉粉8.0 g/L培养基中,每瓶接6芽。附加物为土豆(30 g/L)、椰汁(150 mL/L)和香蕉(80 g/L),以不加附加物为对照,每个处理3次重复,每个重复30个芽。
(3)芽数对丛生芽增殖的影响:以1/2MS+6-BA5.0 mg/L+NAA0.5 mg/L+蔗糖30 g/L+卡拉粉8.0 g/L+椰汁150 mL/L为基本培养基,设单芽、双芽、三芽、四芽4个处理,每个处理3次重复,每个重复30个(丛)芽。培养40 d后记录芽数(芽长≥0.5 cm)和褐化死亡的芽数,计算褐化死亡率和增殖系数:

1.2.5 生根培养 将生长健康的无根苗(约2 cm高)接种于添加不同浓度6-BA和NAA的1/2MS+蔗糖30 g/L+卡拉粉7.5 g/L+椰汁150 mL/L培养基中,每瓶接6苗。激素设3个处理,每个处理3次重复,每个重复30苗。培养40 d后记录生根的苗数、根数(根长≥0.5cm),测量苗高,计算生根率:
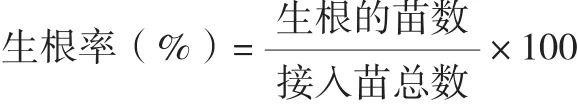
试验中所用培养基的pH值为5.8,接种后均置于温度26(±1)℃、光照时间12 h/d、光强1 500~1 800 lx的培养室培养。
1.2.6 移栽 将再生植株带瓶置于室温下炼苗1周,然后洗去根部培养基,用0.1%高锰酸钾溶液浸泡10 min,晾干后植入6号松树皮(0.6~0.9 cm)基质中,常规管理,2个月后统计成活数,计算成活率。
试验数据采用Excel 2007和SPSS 17.0进行统计分析,多重比较采用邓肯氏新复极差检验法。
2 结果与分析
2.1 红韵蝴蝶兰营养芽的诱导
2.1.1 消毒时间对红韵蝴蝶兰营养芽诱导的影响 消毒时间对红韵蝴蝶兰外植体污染率、褐化死亡率和营养芽诱导率有显著影响(表1)。在8~15 min内,消毒时间越长,污染率越低,褐化死亡率越高,营养芽诱导率越低。消毒8、10 min的褐化死亡率和营养芽诱导率没有显著差异,但诱导率显著高于消毒15 min的处理。因此红韵蝴蝶兰外植体适宜的消毒时间为8~10 min。
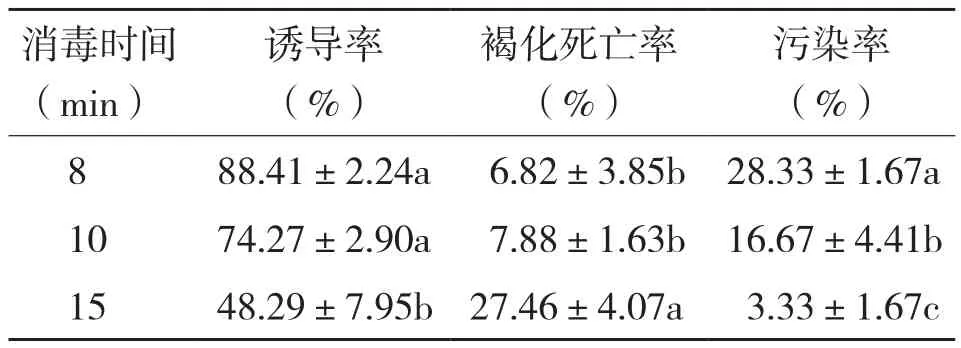
表1 消毒时间对红韵蝴蝶兰营养芽诱导的影响
2.1.2 激素对红韵蝴蝶兰营养芽诱导的影响 激素对红韵蝴蝶兰营养芽诱导没有显著影响(表2)。当6-BA浓度为2.0 mg/L、NAA为0.2 mg/L时,营养芽诱导率最高,褐化死亡率最低;当NAA浓度为0.5 mg/L时,营养芽诱导率随6-BA浓度的增加而略有增加,但污染率和褐化死亡率随6-BA浓度的增加而略有下降。因此,适合红韵蝴蝶兰营养芽诱导的激素浓度为6-BA2.0 mg/L和NAA0.2 mg/L。

表2 激素浓度对红韵蝴蝶兰营养芽诱导的影响
2.2 丽影和红韵蝴蝶兰丛生芽的增殖
2.2.1 6-BA浓度对蝴蝶兰丛生芽增殖的影响 6-BA浓度对红韵蝴蝶兰和丽影蝴蝶兰丛生芽的增殖和褐化死亡影响显著(表3),6-BA浓度过高或过低均不利于红韵和丽影蝴蝶兰的芽增殖。当6-BA浓度为8.0 mg/L,红韵和丽影蝴蝶兰的增殖系数最高,分别为2.31和2.22;6-BA浓度越高,丛生芽的褐化死亡率越高。适合红韵和丽影蝴蝶兰丛生芽增殖的6-BA浓度为8.0 mg/L。
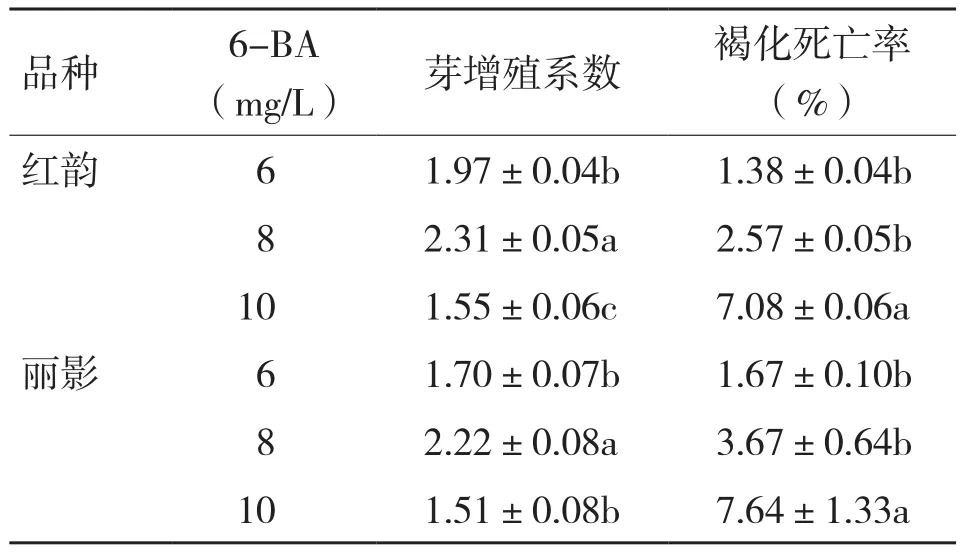
表3 6-BA浓度对丽影和红韵蝴蝶兰丛生芽增殖的影响
2.2.2 附加物对蝴蝶兰丛生芽增殖的影响 有机附加物对蝴蝶兰丛生芽增殖影响显著(表4)。添加30 g/L土豆汁、150 mL/L椰汁和80 g/L香蕉汁均有利于蝴蝶兰增殖,并有一定的防褐化效果。添加150 mL/L椰汁时芽增殖系数最高,红韵和丽影蝴蝶兰的芽增殖系数分别是2.40和2.15,其次是添加土豆汁,添加香蕉汁的效果最差。因此,适合红韵和丽影蝴蝶兰芽增殖的有机附加物为150 mL/L椰汁。

表4 附加物对红韵和丽影蝴蝶兰丛生芽增殖的影响
2.2.3 芽数对蝴蝶兰丛生芽增殖的影响 接种芽数对蝴蝶兰丛生芽增殖和褐化死亡影响显著(表5)。以单芽接入时,红韵和丽影蝴蝶兰的芽增殖系数最高,分别为2.21和2.29;同时褐化死亡率最低。随着接种芽数的增加,芽增殖系数明显降低,褐化死亡率显著升高。因此以单芽接入培养基更有利于红韵和丽影蝴蝶兰丛生芽的增殖。

表5 芽数对蝴蝶兰丛生芽增殖的影响

表6 激素对蝴蝶兰丛生芽生根的影响
2.3 红韵和丽影蝴蝶兰的生根培养
将生长良好、大小一致的无根苗接种于添加不同浓度6-BA和NAA的生根培养基中培养40 d,结果表明,激素对红韵和丽影蝴蝶兰生根率没有影响,但对生根数和株高有显著影响(表6)。当培养基中NAA浓度为1.0 mg/L、6-BA浓度为0.1 mg/L时,红韵和丽影蝴蝶兰试管苗的平均根数最多,分别为3.28和3.23条;平均株高最高,分别为5.96 cm和4.15 cm。
2.4 移栽
以6号松树皮为基质,分别移栽432株丽影和285株红韵蝴蝶兰试管苗,2个月后移栽成活率分别为91.58%和87.27%。
3 结论与讨论
组织培养快速繁殖是蝴蝶兰种苗生产的主要方法。本试验结果表明,红韵蝴蝶兰花梗采用0.1%HgCl2消毒8 min,营养芽诱导率最高,丽影和红韵蝴蝶兰丛生芽增殖适宜的培养基为1/2MS+6-BA 5.0 mg/L+NAA0.5 mg/L+椰汁150 mL/L+蔗糖30 g/L+卡拉粉8.0 g/L,生根壮苗适宜的培养基为1/2MS+6-BA 0.1 mg/L+NAA1.0 mg/L+椰汁150 mL/L+蔗糖30 g/L+卡拉粉8.0 g/L,采用松树皮移栽试管苗,成活率分别为91.58%和87.27%。上述结果为丽影和红韵蝴蝶兰新品种的种苗工厂化生产和推广奠定了技术基础。
无菌外植体获得是种苗工厂化生产的首要环节。曾德华等[10]的研究表明,蝴蝶兰花梗用0.1%升汞消毒15 min效果最好,许忠秋[8]认为用0.1%升汞消毒12 min效果最好,沈周高等[9]对V31花梗采用0.1%升汞消毒15 min的方案。本试验结果表明,红韵蝴蝶兰花梗适宜消毒方案为0.1% HgCl2消毒8 min,这可能与材料及其预处理不同有关。激素对红韵蝴蝶兰花梗营养芽诱导无显著影响,这与曾德华等[10]的研究结果一致。
丛生芽增殖是影响蝴蝶兰工厂化繁殖效率的关键。潘学峰等[5]研究表明,满天红蝴蝶兰丛生芽发生有群体效应,采用双芽接比单芽接的增殖效果好。本试验发现以单芽接入更有利于红韵和丽影蝴蝶兰丛生芽增殖,显著提高增殖系数。激素是影响蝴蝶兰丛生芽增殖效率的关键因素。潘学峰等[5]研究表明,采用6-BA12.5 mg/L+NAA0.05 mg/L,满天红蝴蝶兰丛生芽增殖最好。沈周高等[9]研究表明,V31蝴蝶兰最佳丛生芽增殖培养基为MS+KT10 mg/L+NAA0.6 mg/L+2,4-D0.2 mg/L,增殖系数为7.94。武爱龙等[11]发现大辣椒蝴蝶兰不定芽增殖和分化的最佳培养基为花宝1号+6-BA6 mg/L+NAA0.2 mg/L,增殖系数最高达到5.53。许忠秋[8]研究表明,蝴蝶兰丛生芽增殖的激素配方为MS+BA5 mg/L+NAA 0.1 mg/L,增殖率为2.07%。本试验发现,当激素浓度为6-BA8 mg/L+NAA0.5 mg/L时,丽影和红韵蝴蝶兰丛生芽增殖最快,说明不同蝴蝶兰品种增殖培养适宜的激素种类和浓度不完全相同。
褐化是蝴蝶兰种苗生产中常见的问题[19]。培养基中添加活性炭[20-22]、PVP[20-22]、柠檬酸[20,23]、半胱氨酸[20]、谷胱甘肽[20]、维生素C[20,23]、硫代硫酸钠[20]以及热击处理[24]、暗培养[21-22]等均能有效减轻褐变。本试验结果表明培养基中加入150 mL/L椰子汁可防止褐变并促进增殖,这与汪金萍等[19]报道的结果一致。
[1] 杜君,王利民,孟月娥,等. 我国蝴蝶兰产业发展现状及对策研究[J]. 北方园艺,2015(9):172-175.
[2] 张伟,乔保建,李冰冰,等. 蝴蝶兰高效组培快繁及温室移栽技术[J]. 江苏农业科学,2015,43(9):83-86.
[3] Chen C C. Application of growth models to evaluate the microenvironmental conditions using tissue culture plantlets of Phalaenopsis SogoYukidian‘V3’[J]. Scientia Horticulturae,2015,191:25-30.
[4] 鲁雪华,郭文杰,徐立晖,等. 蝴蝶兰花梗节间段培养繁殖的初步研究[J].园艺学报,2002,29(5):491-492.
[5] 潘学峰,王安石,李海珠. 利用从芽途径快速繁殖蝴蝶兰的研究[J]. 海南大学学报(自然科学版),2005,23(1):47-60.
[6] 李金雨,洪丽萍. 蝴蝶兰丛生芽途径的组织培养技术[J]. 热带作物学报,2010,31(4):610-613.
[7] 谭鹏鹏,彭方仁,江荣翠,等. 蝴蝶兰丛生芽快繁体系的建立[J]. 林业科技开发,2013,27(4):80-84.
[8] 许忠秋. 蝴蝶兰组培快繁技术研究[J]. 安徽农学通报,2013,19(12):23-24.
[9] 沈周高,任洁,项艳. 蝴蝶兰‘V31’品种花梗腋芽快繁体系的建立[J]. 安徽农业大学学报,2014,41(3):435-439.
[10] 曾德华,郁培义,陈伟玉,等. “满天红”蝴蝶兰花梗组培快繁技术研究[J]. 热带林业,2014,42(1):46-49,32.
[11] 武爱龙,吴建阳,卓海容. 蝴蝶兰“大辣椒”组织培养与快速繁殖[J]. 福建农业学报,2015,30(31):1075-1081.
[12] 杨录军,王俊,杨书才,等. 蝴蝶兰新品种“郑农火凤凰”的组培快繁技术研究[J]. 陕西农业科学,2015,61(11):52-54.
[13] 徐丽娟,董梅,王永香,等. 激素浓度和配比对蝴蝶兰离体培养的影响[J]. 青岛农业大学学报(自然科学版),2016,33(1):20-23.
[14] Ernst R. Effects of thidiazuron on in vitro propagation of Phalaenopsis and Doritaenopsis(Orchidaceae)[J]. Plant Cell,Tissue and Organ Culture,1994,39(3):273-275.
[15] Park SY,Murthy HN,Pack KY. Rapid propagation of Phalaenopsis from floral stalk-derived leaves[J]. In Vitro Cellular & Developmental Biology-Plant,2002,38(2):168-172.
[16] Chugh S,Guha S,Rao IU. Micropropagation of orchids:A review on the potential of different explants[J]. Scientia Horticulturae,2008,122(4):507-520.
[17] Van PT,da Silva JAT,Ham LH,et al. Effects of permanent magnetic fields on the proliferation of Phalaenopsis protocorm-like bodies using liquid medium[J]. Scientia Horticulturae,2011,128(4):479-484.
[18] Enoki S,Takahara Y. Development of a highly efficient and simple micropropagation system for Phalaenopsis ssing elongated protocorm-like bodies Induced by skotomorphogenesis under dark conditions[J]. Journal of the Japanese Society for Horticultural Science,2014,83(2):149-155.
[19] 汪金萍,杨端,杨海军. 控制蝴蝶兰组培褐变的研究[J]. 农业科学,2015,35(4):16-18.
[20] 刘真华,葛红,郭绍霞. 蝴蝶兰组织培养中的褐化控制研究[J]. 园艺学报,2005,32(4):732-734.
[21] 王立娅,方正,李英丽,等. 蝴蝶兰组织培养中防褐化技术研究. 河北农业大学学报,2008,31(5):42-45.
[22] 余慧琳,王爱武,赵辉. 蝴蝶兰花梗腋芽离体快繁控制褐变的研究[J]. 中国农学通报,2009,25(9):192-195.
[23] 赖艳艳,许传俊,陈冬茵,等. 柠檬酸和抗坏血酸对蝴蝶兰叶外植体褐变发生的影响[J]. 生物技术,2010,20(2):70-72.
[24] 赵滢,杨树华,李秋香,等. 热激处理对蝴蝶兰组培褐变的抑制及其生理机制[J]. 北京林业大学学报,2013,35(1):103-107.
Micropropagation of Phalaenopsis ‘Liying’and ‘Hongyun’
ZENG Wu-qing1,CHEN Liu-chan2,ZENG Rui-zhen2,YI Mao-sheng1,SU Qing-lian1,GUO He-rong2,LI Yang-hui1,XIE Li2
(1.Guangzhou Flower Research Center,Guangzhou 510360,China;2.College of Forestry and Landscape Architecture,South China Agricultural University,Guangzhou 510642,China)
Micropropagation of new cultivars of Phalaenopsis ‘Liying’ and Phalaenopsis ‘Hongyun’ was investigated by using of peduncle as explant. The results indicated that disinfection time had significant effect on the induction rate of vegetative shoot,after disinfected with 0.1% HgCl2for 8 minutes,the induction rate of vegetative bud was the highest,while exogenous hormones had no significant effect on the induction rate of Phalaenopsis‘Hongyun’. The concentration of 6-BA,organic additives and the number of bud in an inoculums had significant influence on bud proliferation. At the concentration of 6-BA being 8 mg/L,the proliferation coefficients of Phalaenopsis ‘Liying’ and Phalaenopsis ‘Hongyun’ were the highest,accounting for 2.31 and 2.22,respectively.Supplying coconut milk in proliferation medium was more beneficial for alleviating the browning and enhancing the proliferation coefficient compared with adding potato or banana. Single bud as an inoculum favored bud proliferation and enhanced the multiplication coefficient. Exogenous hormone had little effect on the root induction rate,but had significant effect on the mean number of root and height of plantlet. Seedling height of Phalaenopsis ‘Hongyun’ and Phalaenopsis ‘Liying’ was the highest and the mean number of root was the most on modified 1/2MS medium with 6-BA 0.1 mg/L + NAA 1 mg/L. By using pine bark as culture substrate,the survival rates of Phalaenopsis ‘Liying’and Phalaenopsis ‘Hongyun’ were 91.58% and 87.27%,respectively.
Phalaenopsis;new cultivar;tissue cutire;micropropagation ;clump shoot
S682.31
A
1004-874X(2017)08-0055-06
曾武清,陈柳婵,曾瑞珍,等. 丽影和红韵蝴蝶兰快速繁殖试验[J].广东农业科学,2017,44(8):55-60.
2017-05-19
广州市科技计划项目(2014Y2-00125);广州市农业财政专项资金项目(1510170,穗财农[2016]26号)
曾武清(1968-),男,硕士,高级农艺师,E-mail:zwq0308@126.com
谢利(1974-),女,博士,副教授,E-mail:xieli@scau.edu.cn
(责任编辑 杨贤智)
