18F-FDG PET/CT显像在预测肺鳞癌隐匿性淋巴结转移中的价值
2017-12-22李天女丁重阳
汤 泊,张 银,徐 阳,李天女,丁重阳*
(1.江苏省沭阳县中医院影像科,江苏 宿迁 223600;2.南京医科大学第一附属医院核医学科,江苏 南京 210029)
18F-FDGPET/CT显像在预测肺鳞癌隐匿性淋巴结转移中的价值
汤 泊1,张 银1,徐 阳1,李天女2,丁重阳2*
(1.江苏省沭阳县中医院影像科,江苏 宿迁 223600;2.南京医科大学第一附属医院核医学科,江苏 南京 210029)
目的探讨术前18F-FDG PET/CT显像中PET代谢参数预测临床N0期肺鳞癌隐匿性淋巴结转移(OLM)中的价值。方法收集接受根治性手术的临床N0期肺鳞癌91例患者的临床资料,所有患者术前均接受18F-FDG PET-CT检查,以最大标准化摄取值(SUVmax)=2.5为阈值,测量代谢体积(MTV)及病灶糖酵解总量(TLG)。采用ROC曲线获得SUVmax、MTV、TLG、最大径预测OLM的最佳界值点。通过单因素及多因素分析筛选临床N0期肺鳞癌发生OLM的独立危险因素。结果91例临床N0期肺鳞癌患者中,26例术后病理证实有淋巴转移。隐匿性淋巴结转移阳性(OLMP)的SUVmax、MTV、TLG、最大径均大于隐匿性淋巴结转移阴性(OLMN)(P均<0.05)。SUVmax、MTV、TLG及最大径预测OLM的最佳界值点分别为12.76、31.17 m3,153.13、3.8 cm。单因素分析显示肿瘤位置(中央型)、最大径、SUVmax、MTV、TLG与OLM发生率有关(P均<0.05);多因素分析显示肿瘤位置(中央型)、最大径>3.8 cm、MTV>31.17 cm3是肺鳞癌发生OLM的高危因素(P均<0.05)。结论18F-FDG PET/CT显像所测得的MTV是临床N0期肺鳞癌OLM的独立危险因素,可为外科制定手术方案提供一定的参考价值。
肺肿瘤;癌,鳞状细胞;体层摄影术,发射型计算机;氟脱氧葡萄糖F18
肺癌居我国城市人口恶性肿瘤死亡原因的第一位,准确的临床分期是选择治疗方案的关键,而切除所有肿瘤病灶是治愈的关键。尽管医学影像技术有飞速发展,但隐匿性淋巴结转移(occult lymph node metastasis, OLM)的发生率仍较高[1]。有研究[2-4]报道,肺癌原发灶的病理类型、分化程度、肿瘤位置、形态、大小等是发生OLM的高危因素,如何筛查OLM高危人群,以提前干预是目前研究的热点。18F-FDG PET/CT在肺鳞癌OLM的预后判断方面的报道鲜见。本研究回顾性分析18F-FDG PET/CT诊断为N0期肺鳞癌患者的PET/CT和病理资料,探讨肺癌原发灶PET代谢参数判断OLM的价值。
1 资料与方法
1.1 一般资料 收集2009年9月—2016年10月于我院接受手术治疗的肺鳞癌患者91例,其中男86例,女5例,年龄43~84岁,平均(63.5±8.8)岁。原发肿瘤位于左肺上叶36例,左肺下叶15例,右肺上叶20例,右肺中叶2例,右肺下叶18例。全部手术均为全胸腔镜下解剖式肺切除+淋巴结清扫,其中肺叶切除89例,全肺切除2例,术中取原发灶的最大径进行测量和记录,同时记录病灶的位置、病理类型;并对肺内、肺门及纵隔淋巴结进行清扫,共1 462枚淋巴结,平均16.07枚/例,经病理证实的淋巴结转移60枚。根据Mountain和Dresler分类,将1~9组(N2)淋巴结划分为纵隔淋巴结,10~14组(N1)淋巴结划分为肺门肺内淋巴结。经术后病理证实,N1淋巴结转移19例,N2淋巴结转移7例。所有患者术前均接受18F-FDG PET/CT检查。
纳入标准:①PET/CT检查与手术间隔时间在2周以内;②除生理性摄取外,以最大标准化摄取值(maximal standard uptake value, SUVmax)≥2.5作为肿瘤转移病灶的阳性判断标准,PET/CT检查结果均无纵隔、肺门淋巴结转移及远处转移;③PET/CT检查前均未行化疗、放疗及肿瘤相关治疗;④有明确的病理诊断结果;⑤全胸腔镜肺叶切除、胸腔镜小切口肺叶切除及纵隔淋巴结清扫术;⑥有明确肿瘤最大径、淋巴结清扫及转移数据。排除标准:①多原发癌;②肺癌继发或复发;③未行淋巴结清扫的肺叶切除;④临床资料不完整。
1.2 仪器与方法 患者检查前空腹6 h,采指尖血检测血糖,控制血糖≤7.0 mmol/L;注射18F-FDG(剂量为3.70~5.55 MBq/kg体质量)后静卧60~70 min,排空膀胱后行PET/CT扫描。首先行CT扫描,管电压120 kV,管电流140 mA,层厚5.0 mm,准直 1.5 mm;之后行PET采集,采用三维模式,2~3分钟/床位,6~7个床位;采用CT数据进行衰减校正,迭代法重建,最终获得轴位、矢状位、冠状位CT、PET及PET/CT融合图像。
1.3 图像分析 沿肺癌原发灶勾画ROI,采用固定阈值法,参照文献[5]标准,以SUVmax=2.5为阈值,由麦迪克斯软件自动于轴位、矢状位及冠状位对病灶进行容积分割,获得原发灶的SUVmax、平均标准摄取值(mean standard uptake value, SUVmean)及代谢体积(metabolic tumor volume, MTV),并计算病灶糖酵解总量(total lesion glycolysis, TLG):TLG=MTV×SUVmean。
1.4 统计学分析 采用SPSS 17.0统计分析软件。偏态分布的计量资料以中位数(上、下四分位数)[M(P25,P75)]表示;采用ROC曲线获得SUVmax、MTV及TLG的最佳界值,并计算曲线下面积(area under the curve, AUC)。计量资料的比较采用Mann-WhitneyU检验,计数资料的比较采用χ2检验,多因素分析采用Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
91例肺鳞癌PET/CT表现为18F-FDG摄取不同程度增高,纵隔及肺门淋巴结18F-FDG摄取均未见异常增高,全身均未见远处转移灶(图1、2)。原发灶的SUVmax、MTV、TLG分别为11.88(8.57,17.30)、26.93(11.10, 49.27)cm3、152.32(48.75,346.99)。肿瘤最大径3.4(2.0,4.5)cm。隐匿性淋巴结转移阳性(OLM positive, OLMP)的SUVmax、MTV、TLG、最大径均大于隐匿性淋巴结转移阴性(OLM negative, OLMN),差异均有统计学意义(P均<0.05),见表1。SUVmax、MTV、TLG及最大径预测OLM的最佳界值点分别为12.76、31.17 m3、153.13、3.8 cm,诊断效能见表2。单因素分析结果显示,肿瘤位置(中央型)、最大径、SUVmax、MTV、TLG与OLM有关(P均<0.05),见表3。多因素Logistic回归分析结果显示,肿瘤位置(中央型)、最大径及MTV是肺鳞癌发生OLM的独立危险因素(P均<0.05),见表4。
3 讨论
肺叶切除及淋巴结清扫是临床N0期肺鳞癌患者标准的治疗方案,且预后较好。研究[6-8]表明,OLM是临床N0期肺鳞癌患者术后复发或转移的主要危险因素,明确是否伴淋巴结转移对患者的预后非常重要,但扩大淋巴结清扫范围,有一定的创伤及术后并发症。
因此,如何预测OLM的潜在发生率,对OLM高危人群进行提前干预是目前研究的热点。
18F-FDG PET/CT是一种集解剖形态成像与功能代谢显像于一体的影像技术,在肺癌的诊断及分期作用重要。Park等[9]分析147例NSCLC的PET/CT资料及术后病理结果,发现肺癌原发灶SUVmax>7.3是OLM的高危因素。Miyasaka等[10]发现NSCLC原发灶SUVmax>10的患者OLM发生率明显高于SUVmax≤10的患者(41.0% vs 12.7%,P<0.001),且预后相对较差。Li等[11]分析189例临床Ⅰ期NSCLC患者的临床资料,结果表明肺癌原发灶SUVmax>4.3是OLM的高危因素。上述研究由于病理类型及临床分期不一致,因此,SUVmax的界值点也不同。本研究仅纳入N0期的肺鳞癌患者,单因素分析显示SUVmax≤12.76 OLM的发生率明显低于SUVmax>12.76(P<0.001)。本研究SUVmax界值高于上述研究,主要因肺鳞癌的SUVmax高于腺癌,不同病理类型的肺癌SUVmax不同,可能影响SUVmax的界值。目前,临床主要通过SUVmax反映肿瘤的葡萄糖代谢活性,存在一定的局限性,亟需更好的PET代谢参数来反映肿瘤的代谢活性。
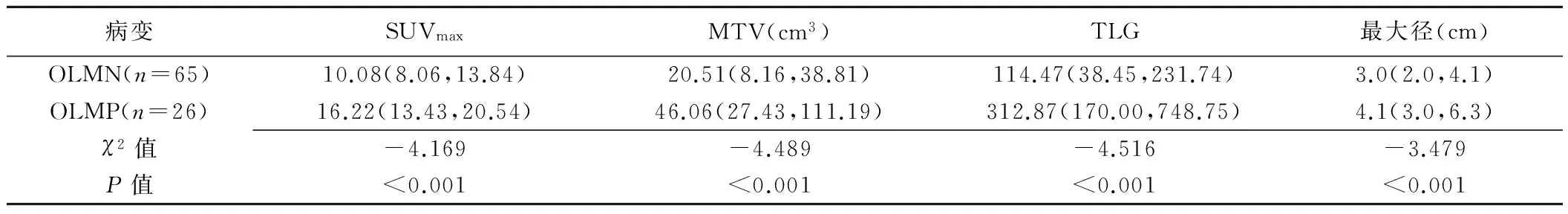
表1 OLMN和OLMP原发灶SUVmax、MTV、TLG及最大径比较[M(P25,P75)]
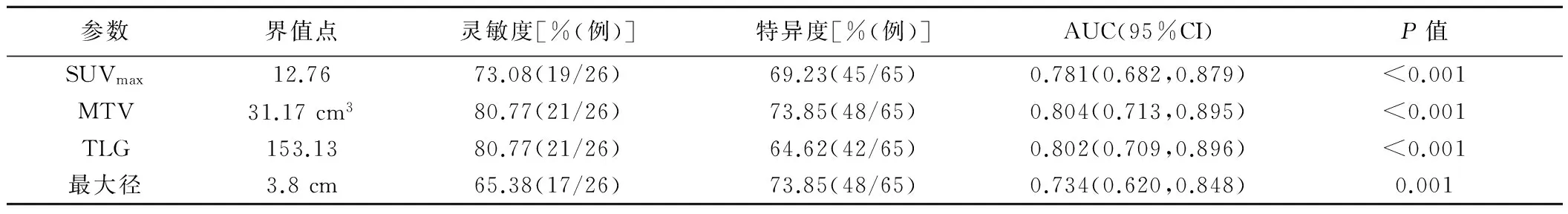
表2 肺鳞癌的SUVmax、MTV、TLG及最大径ROC曲线分析
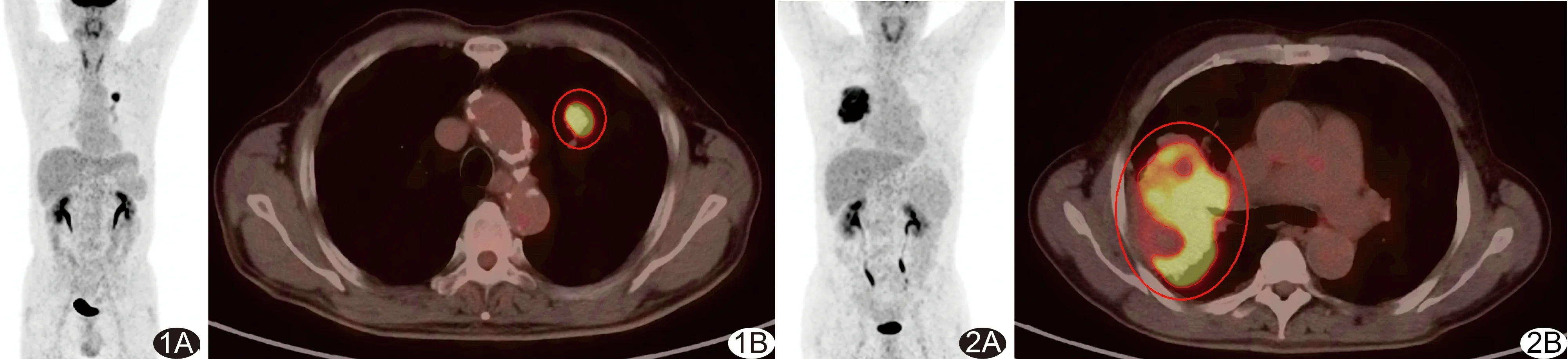
图1 患者男,77岁,左肺上叶中分化鳞癌,无淋巴结转移 A.全身MIP图像示左肺上叶18F-FDG代谢增高灶,纵隔及肺门未见18F-FDG代谢增高灶;余全身未见18F-FDG代谢增高异常灶; B.PET、CT轴位融合图像示左肺上叶病灶18F-FDG代谢增高,SUVmax=9.30,MTV=6.70 cm3,TLG=31.99 图2 患者男,51岁,右肺上叶低分化鳞癌,第2~4组淋巴结转移 A.全身MIP图像示右肺上叶18F-FDG代谢增高灶,纵隔及肺门未见18F-FDG代谢增高灶;余全身未见18F-FDG代谢增高异常灶; B.PET、CT轴位融合图像示右肺上叶病灶18F-FDG代谢增高,SUVmax=10.63,MTV=175.14 cm3,TLG=759.01
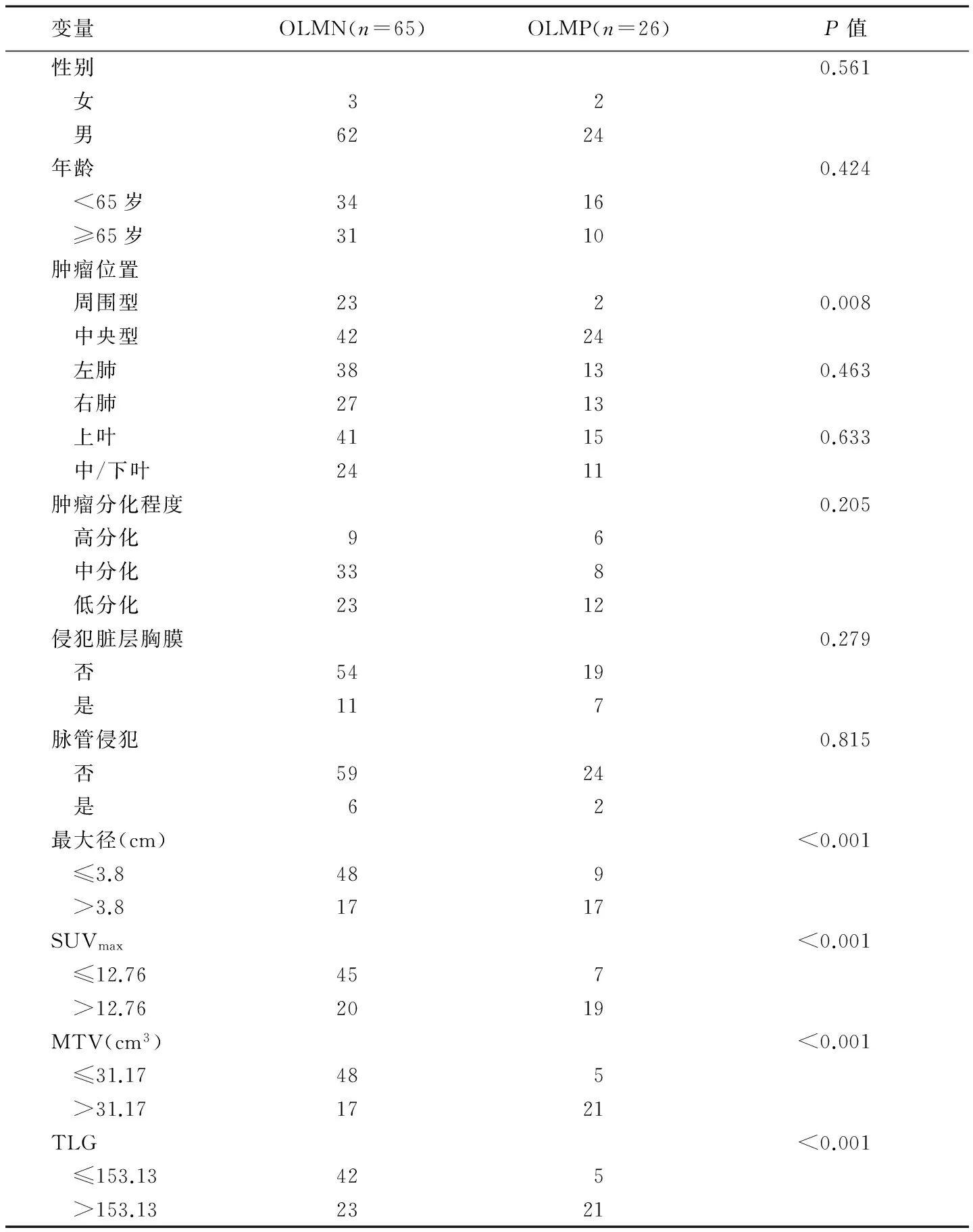
变量OLMN(n=65)OLMP(n=26)P值性别0.561 女32 男6224年龄0.424 <65岁3416 ≥65岁3110肿瘤位置 周围型2320.008 中央型4224 左肺38130.463 右肺2713 上叶41150.633 中/下叶2411肿瘤分化程度0.205 高分化96 中分化338 低分化2312侵犯脏层胸膜0.279 否5419 是117脉管侵犯0.815 否5924 是62最大径(cm)<0.001 ≤3.8489 >3.81717SUVmax<0.001 ≤12.76457 >12.762019MTV(cm3)<0.001 ≤31.17485 >31.171721TLG<0.001 ≤153.13425 >153.132321
肿瘤的体积大小对肺癌的临床分期及治疗非常重要,既往评估肿瘤负荷通常依靠手术切除的肿瘤标本大小或CT扫描,但由于肿瘤形态的不规则性及肿瘤内坏死组织的形成,导致上述方法在测量体积时存在一定的局限性,测得的肿瘤最大径和体积并无法代表其实际大小。由于坏死的肿瘤组织及纤维瘢痕组织不能摄取18F-FDG,故PET/CT将反映解剖形态的CT图像与反映肿瘤代谢活性的PET图像融合,直接根据肿瘤内异常的葡萄糖代谢信息与解剖结构相结合,所测得的肿瘤代谢体积更加准确、可靠。MTV、TLG在肺癌的预后判断中较SUVmax具有更好的预测价值,但预测OLM的方面鲜见报道。Kaseda等[12]分析70例NSCLC的临床资料,发现以SUVmax=2.5为界值,所测得的MTV=2.5是预测OLM的独立危险因素。Kim等[1]发现MTV>18.9 cm3是OLM的高危因素(OR=20.65,P<0.05)。本组单因素分析显示SUVmax、MTV、TLG均与OLM有关;但多因素分析显示,仅MTV是预测OLM的独立影响因素;原发灶MTV>31.17 cm3时,OLM发生率明显高于MTV≤31.17 cm3(P<0.001),且OR值为15.412,与既往研究[1,12]报道相符。TLG为MTV与SUVmean的乘积,TLG不仅可反映肿瘤的代谢体积,还可反映肿瘤的平均SUV值,理论上TLG更能反映肿瘤的整体代谢情况,但本研究多因素分析显示TLG并非独立影响因素,可能与SUVmean的影响因素较多有关,如患者的血糖水平、仪器的衰减校正等;TLG在肺鳞癌OLM的预测价值有待大样本研究证实。

表4 临床N0期肺鳞癌OLM的多因素Logistic回归分析
综上所述,临床N0期肺鳞癌原发灶的SUVmax、MTV、TLG与OLM有关,MTV是OLM的独立危险因素;对于MTV较高的患者,尽管PET/CT图像未显示淋巴结转移,但OLM的发生率较高,外科医师在制定手术方案时应考虑PET代谢参数。
[1] Kim DH, Song BI, Hong CM, et al. Metabolic parameters using18F-FDG PET/CT correlate with occult lymph node metastasis in squamous cell lung carcinoma. Eur J Nucl Mol Imaging, 2014,41(11):2015-2057.
[2] Yeh YC, Kadota K, Nitadori JI, et al. International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society classification predicts occult lymph node metastasis in clinically mediastinal node-negative lung adenocarcinoma. Eur J Cardiothorac Surg, 2016,49(1):e9-e15.
[3] 段晓蓓, 樊卫,许泽清,等.基于18F-FDG PET/CT显像分析非小细胞肺癌纵隔淋巴结转移的危险因素.中国医学影像技术,2012,28(6):1135-1139.
[4] Martin LW, D'Cunha J, Wang X, et al. Detection of occult micrometastases in patients with clinical stage I non-small-cell lung cancer: A prospective analysis of mature results of CALGB 9761 (Alliance). J Clin Oncol, 2016,34(13):1484-1491.
[5] Lee JW, Lee SM, Yun M, et al. Prognostic value of volumetric parameters on staging and posttreatment FDG PET/CT in patients with stage IV non-small cell lung cancer. Clin Nucl Med, 2016,41(5):347-353.
[6] Rusch VW, Hawes D, Decker PA, et al. Occult metastases in lymph nodes predict survival in resectable non-small-cell lung cancer: Report of the ACOSOG Z0040 trial. J Clin Oncol, 2011,29(32):4313-4319.
[7] Zhang LY, Liu ZW, Liu YW, et al. risk factors for nodal metastasis in cn0 papillary thyroid microcarcinoma. Asian Pac J Cancer Prev, 2015,16(8):3361-3363.
[8] 王娟,齐丽萍,李晓婷,等.探讨周围型非小细胞肺癌纵隔淋巴结转移相关CT表现.中国医学影像技术,2012,28(10):1839-1843.
[9] Park HK, Jeon K, Koh WJ, et al. Occult nodal metastasis in patients with non-small cell lung cancer at clinical stage IA by PET/CT. Respirology, 2010,15(8):1179-1184.
[10] Miyasaka Y, Suzuki K, Takamochi K, et al. The maximum standardized uptake value of fluorodeoxyglucose positron emission tomography of the primary tumour is a good predictor of pathological nodal involvement in clinical N0 non-small-cell lung cancer. Eur J Cariothorac Surg, 2013,44(1):83-87.
[11] Li L, Ren S, Zhang Y, et al. Risk factors for predicting the occult nodal metastasis in T1-2N0M0 NSCLC patients staged by PET/CT: Potential value in the clinic. Lung Cancer, 2013,81(2):213-217.
[12] Kaseda K, Asakura K, Kazama A, et al. Risk factors for predicting occult lymph node metastasis in patients with clinical stage I non-small cell lung cancer staged by integrated fluorodeoxyglucose positron emission tomography/computed tomography. Word J Surg, 2016,40(12):2976-2983.
Valueof18F-FDGPET/CTimaginginpredictingoccultlymphnodemetastasisinpatientswithsquamouscelllungcarcinoma
TANGBo1,ZHANGYin1,XUYang1,LITiannv2,DINGChongyang2*
(1.DepartmentofRadiology,JiangsuShuyangTraditionalChineseMedicineHospital,Suqian223600,China; 2.DepartmentofNuclearMedicine,theFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,China)
ObjectiveTo investigate the predictability of occult lymph node metastasis (OLM) using metabolic parameters of pretreatment18F-FDG PET-CT in squamous cell lung carcinoma patients manifesting clinical negative node (cN0).MethodsA total of 91 cN0 squamous cell lung carcinoma patients who underwent curative surgery and pretreatment18F-FDG PET/CT were enrolled retrospectively. Metabolic tumor volume (MTV) and total lesion glycolysis (TLG) of primary tumor were obtained with standardized uptake value (SUV) threshold of 2.5. ROC curve analysis was performed to quantify the predictive value of SUVmax, MTV, TLG and the maximal tumor length. To identify risk factors for OLM, univariate and multivariateLogisticregression analysis were performed.ResultsOf 91 patients, 26 had OLM. Significantly higher SUVmax, MTV, TLG and the maximal tumor length were observed in patients with OLM compared with negative occult lymph node metastasis (allP<0.05). ROC curve showed that the cutoff point of SUVmax, MTV, TLG and the maximal tumor length were 12.76, 31.17 cm3, 153.13 and 3.8 cm, respectively. Univariate analysis showed correlation of tumor location (central), the maximal tumor length, SUVmax, MTV and TLG with the rate of OLM (allP<0.05). In multivariate analysis, tumor location (central), the maximal tumor length >3.8 cm and MTV >31.17 cm3showed association with increased risk of OLM (allP<0.05).ConclusionMTV in18F-FDG PET/CT is an independent factor for predicting OLM in patients with cN0 squamous cell lung carcinoma, which can be used to guide surgical planning.
Lung neoplasms; Carcinoma, squamous cell; Tomography, emission-computed; Fluorodeoxyglucose F 18
R734.2; R817.4
A
1003-3289(2017)12-1835-05
汤泊(1977—),男,江苏宿迁人,本科,副主任医师。研究方向:呼吸系统影像学诊断。E-mail: 837092035@qq.com
丁重阳,南京医科大学第一附属医院核医学科,210029。E-mail: chongyangding@163.com
2017-03-20
2017-10-15
10.13929/j.1003-3289.201703100
