同型半胱氨酸对C17.2小鼠神经干细胞的影响及作用机制
2017-12-22王丹阮妙华周爱华钱燕陈亦明
王丹 阮妙华 周爱华 钱燕 陈亦明
●论著
同型半胱氨酸对C17.2小鼠神经干细胞的影响及作用机制
王丹 阮妙华 周爱华 钱燕 陈亦明
目的探讨同型半胱氨酸(Hcy)对C17.2小鼠神经干细胞(NSCs)的影响及可能的分子机制。方法培养C17.2小鼠NSCs,分为对照组、0.25mM Hcy组、0.25mM Hcy+5mM N-乙酰半胱氨酸(NAC)组;加入相应药物培养24h后,采用CCK-8法检测各组NSCs生长活力,流式细胞术和Caspase-3法检测Hcy对NSCs凋亡的影响,彗星实验检测Hcy对NSCs DNA的损伤程度,H2DCF-DA染色检测NSCs的氧自由基(ROS)水平。结果Hcy能诱导细胞ROS产生和DNA损伤,从而导致NSCs凋亡增加。相反,NAC可降低Hcy诱发的ROS产生,明显改善DNA损伤,提高细胞存活率。结论Hcy能诱导NSCs ROS产生和DNA损伤,并导致NSCs凋亡;而减少Hcy引发的ROS产生可以明显改善DNA损伤并提高细胞存活率。
同型半胱氨酸DNA损伤氧化应激神经干细胞
同型半胱氨酸(homocysteine,Hcy)是一种蛋氨酸代谢过程中产生的非蛋白氨基酸,在儿童和成人神经系统疾病的发生、发展中起着重要作用[1-2]。有研究表明母体血浆中的高Hcy水平与胎儿神经管畸形有关[1]。相关流行病学调查发现血浆Hcy水平与神经退行性疾病(如认知障碍、阿尔茨海默病和中风等)相关[2]。体外实验和小鼠实验发现Hcy对人和鼠神经元细胞有毒害作用[3]。神经干细胞(neural stem cells,NSCs)能够分化成神经元细胞、少突神经胶质细胞和星形胶质细胞,在胚胎神经发生和成人大脑的损伤修复中起着至关重要的作用。相关研究表明NSCs对细胞外Hcy非常敏感,Hcy能抑制NSCs的增殖和分化能力[4-5],但其具体作用机制尚不清楚。本研究检测并观察经Hcy处理后C17.2小鼠NSCs的氧自由基(ROS)水平和DNA损伤程度,以探讨Hcy对NSCs的作用机制。
1 材料和方法
1.1 主要试剂C17.2小鼠NSCs购自英国欧洲动物细胞培养物保藏中心;Dullbecco改良的Eagle培养基购自美国Gibco公司;D,L-Hcy、N-乙酰半胱氨酸(NAC)购自美国Sigma公司;CCK-8试剂盒购自日本株式会社同仁化学研究所;Annexin V/PI细胞凋亡试剂盒购自美国B.D.Biosciences Pharmingen公司;Caspase-3试剂盒购自美国Cell Signaling Technology公司;彗星测定试剂盒购自美国Trevigen公司;H2DCF-DA试剂盒购自美国Fluka公司。
1.2 方法
1.2.1 细胞培养与分组将C17.2小鼠NSCs置于含10%FBS、5%马血清、2mM谷氨酰胺、100U/ml青霉素和100μg/ml链霉素的Dullbecco改良的Eagle培养基中,在37°C、5%CO2、相对湿度95%的培养箱中培养24h。然后将C17.2小鼠NSCs分为3组,分别为对照组、0.25mM Hcy组和0.25mM Hcy+5mM NAC组(后两组称为实验组),上述药物用双蒸水稀释至工作浓度后加入培养基中作用24h。
1.2.2 NSCs生长活力的检测采用CCK-8法。将C17.2小鼠NSCs以4 000个/孔的密度接种于96孔板中,每孔加Eagle培养基,平行6孔为复孔,培养24h后分成以上3组,置于培养箱中。接种1、2、3d后,每孔依次加入CCK-8试剂10μl,置37°C、5%CO2培养箱中孵育2h,并设不加NSCs的空白组;在450nm波长处检测吸光度(OD值)。取每天6孔平均值绘制细胞生长曲线。细胞生长活力用细胞存活率进行评估,细胞存活率=(OD值实验组-OD值空白组)/(OD值对照组-OD值空白组)×100%。
1.2.3 Hcy对NSCs凋亡影响的检测采用流式细胞术和Caspase-3法。(1)流式细胞术:C17.2小鼠NSCs经Hcy或Hcy+NAC处理24h后,用胰酶消化并收集各组细胞,再以1×106个/ml的浓度将细胞重悬于1×缓冲液(0.01M 4-羟乙基哌嗪乙磺酸,0.14M NaCl,2.5mM CaCl2,pH7.4)中,5μl Annexin-V和5μl propidium iodide(PI)室温避光孵育15min后,再加入400μl缓冲液,使用Accurri C6流式细胞仪检测各组细胞凋亡情况,Annexin-V和/或PI染色阳性细胞均为凋亡细胞,Annexin-V和PI染色阴性细胞为正常细胞,检测结果应用FlowJo 7.6.2软件进行分析。凋亡细胞百分比=[凋亡细胞/(凋亡细胞+正常细胞)]×100%。(2)Caspase-3法:使用冷PBS洗涤并收集各组C17.2小鼠NSCs;随后加入细胞裂解液,将细胞裂解物稀释至约3mg/ml;再按照Caspase-3试剂盒说明书进行处理。使用VeritasTM发光检测仪在380、460nm波长下检测每个样品的荧光值。将对照组的荧光值设定为1,其他组的荧光值均为对照组的相对值,即相对Caspase-3活性。
1.2.4 Hcy对NSCs DNA损伤程度的检测采用彗星实验。将各组C17.2小鼠NSCs包埋在铺于载玻片上1%的低熔点琼脂糖凝胶中,再在4°C下用裂解液裂解过夜。DNA在室温、碱性条件下解链20min,然后在300mA、碱性条件下电泳30min。将载玻片用双蒸水漂洗5min×2次,75%乙醇中脱水5min,再用SYBR Green溶液染色30min,最后在Leica DMI 4 000B荧光显微镜下观察(激发波长425~500nm)。在400倍镜下随机选取50个细胞并拍摄照片用于评估DNA损伤程度。镜下表现:(1)未损伤DNA保持球形;(2)受损DNA则产生拖尾,类似“彗星”;损伤愈重,拖尾愈长。采用彗星阳性细胞百分比和Olive尾矩(OTM)评估DNA损伤程度。使用CPAP1.2.3软件进行图像分析并得出OTM值。OTM值=尾部DNA%×头部中心到尾部中心的距离。
1.2.5 NSCs ROS水平的检测采用H2DCF-DA染色法。C17.2小鼠NSCs经Hcy或Hcy+NAC分别处理1、2、3d后,加入10μmol/L的H2DCF-DA溶液,于37°C孵育30min,PBS漂洗2次后收集细胞。在荧光显微镜下观察并测定荧光强度,激发波长480nm,发射波长525nm。将对照组的荧光值设定为1,其他组的荧光值均为对照组的相对值,即ROS水平。
1.3 统计学处理应用SPSS 19.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 Hcy对C17.2小鼠NSCs生长活力的影响CCK8法检测结果显示,经Hcy处理1、2、3d后,C17.2小鼠NSCs活力较对照组分别降低28.34%、38.28%和43.85%(均P<0.05),呈时间依赖性;经Hcy+NAC处理1、2、3d后,C17.2小鼠NSCs活力较Hcy组均明显增加(均P<0.05),见图1。

图1 3组C17.2小鼠NSCs经处理1、2、3d后的OD值(与对照组比较,*P<0.05,**P<0.01;与Hcy组比较,△P<0.05)
2.2 Hcy对C17.2小鼠NSCs凋亡的影响经流式细胞仪检测发现,Hcy组凋亡细胞百分比为(43.90±8.00)%,明显高于对照组的(16.43±2.68)%(P<0.01);Hcy+NAC组凋亡细胞百分比为(25.11±3.02)%,较Hcy组明显减少(P<0.05),见图2a-b。经Caspase-3法测定,Hcy组Caspase-3活性较对照组增加2.12倍(P<0.01);Hcy+NAC组较Hcy组降低34.92%(P<0.01),见图2c。

图2 3组C17.2小鼠NSCs的凋亡情况比较(a-b:流式细胞仪检测结果;c:Caspase-3活性;与对照组比较,*P<0.01;与Hcy组比较,△P<0.05,△△P<0.01)
2.3 Hcy对C17.2小鼠NSCs DNA损伤的影响彗星实验结果显示,对照组中仅检测到少量彗星阳性细胞,为10.05%;与对照组比较,Hcy组彗星阳性细胞和OTM值均明显上升(均P<0.01);与Hcy组比较,Hcy+NAC组彗星阳性细胞和OTM值分别降低43.14%、46.33%(均P<0.05),见图3。说明Hcy诱导C17.2细胞DNA损伤,而NAC能缓解Hcy造成的DNA损伤。
2.4 Hcy对C17.2小鼠NSCs ROS的影响与对照组比较,经Hcy处理1、2、3d后C17.2小鼠NSCs内ROS产生分别增加了1.1、1.7、2.9倍(均P<0.05),呈时间依赖性;与Hcy组比较,经Hcy+NAC处理1、2、3d后C17.2小鼠NSCs内ROS产生均明显减少(均P<0.05),见图4。
3 讨论
Hcy是必需氨基酸甲硫氨酸的代谢产物,具有神经毒性。流行病学研究结果显示,在阿尔茨海默病、血管性痴呆、中风和认知障碍等成年神经疾病的患者中,Hcy水平明显升高[2]。母体血浆Hcy水平的升高与胎儿神经管畸形有关,鸡胚模型证实了过量Hcy能诱导神经管畸形[1,6]。相关实验表明Hcy能诱导NSCs凋亡[4-5]。但目前关于Hcy影响NSCs的分子机制尚未完全清楚。本研究经体外实验证实Hcy能增加C17.2小鼠NSCs ROS的产生,从而诱导细胞DNA损伤,导致NSCs凋亡增加。NAC是一种常用的抗氧化剂,可以减少由Hcy诱导的ROS产生,改善DNA损伤并提高NSCs存活率。以上结果表明Hcy通过氧化应激引起DNA损伤,从而诱导NSCs凋亡。
本研究结果发现Hcy诱导C17.2小鼠NSCs DNA损伤,而NAC能缓解Hcy造成的细胞DNA损伤。在皮层和海马神经元细胞研究中亦发现Hcy升高诱导DNA损伤和细胞凋亡[3,7]。Picerno等[8]发现人外周血淋巴细胞中加入Hcy培养后会导致DNA损伤和微核比例增加;Vanzin等[9]发现Hcy以浓度依赖性诱导白细胞DNA损伤,而使用吡哆醇、叶酸、甜菜碱或维生素B12降低Hcy水平后,白细胞DNA损伤明显改善。

图3 3组C17.2小鼠NSCs的DNA损伤情况比较(a:彗星实验结果;b:彗星阳性细胞百分比;C:OTM值;与对照组比较,*P<0.01;与Hcy组比较,△P<0.05,△△P<0.01)
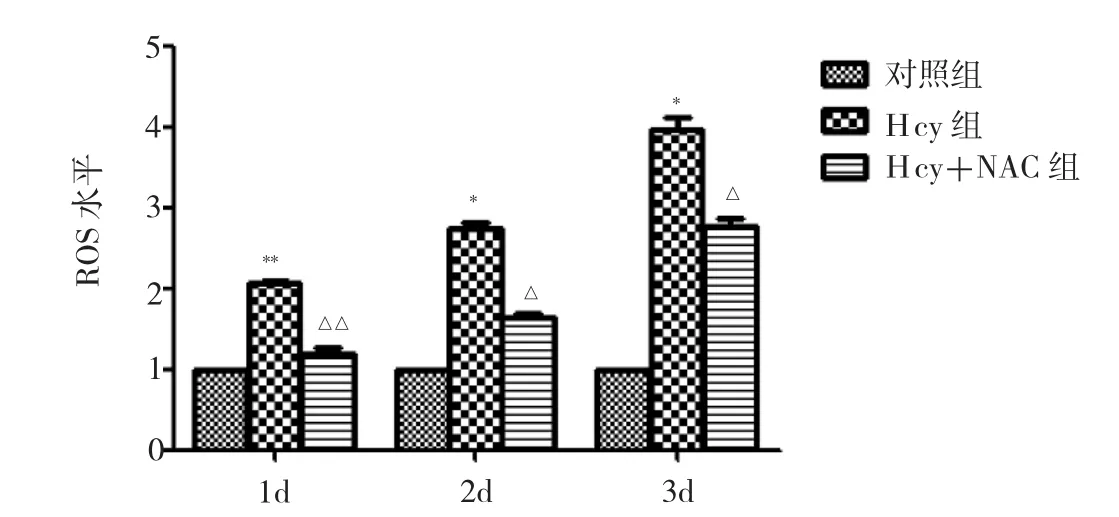
图4 各组C17.2小鼠NSCs的ROS水平比较(与对照组比较,*P<0.05,**P<0.01;与Hcy组比较,△P<0.05,△△P<0.01)
本研究还发现Hcy诱导C17.2小鼠NSCs ROS生成;而NAC可以通过减少ROS生成,改善DNA损伤和促进NSCs存活。既往研究也发现,Hcy通过产生ROS诱导人神经母细胞瘤细胞DNA损伤和细胞凋亡,而抗氧化剂NAC能抑制上述作用[10]。此外,在高同型半胱氨酸血症患者的血浆中也发现脂质和蛋白质氧化损伤[11]。Zhao等[12]研究发现高Hcy水平损害神经元细胞的分子机制可能是氧化应激反应介导DNA损伤,从而导致细胞凋亡。另有研究发现,Hcy通过增加HL-60细胞内H2O2的生成,介导DNA损伤,诱发细胞凋亡[13]。罗丹红等[14]研究发现高同型半胱氨酸血症患者通过氧化应激途径增加脑梗死发生率。而本研究结果表明Hcy可能通过氧化应激诱导NSCs的DNA损伤。
综上所述,Hcy能诱导NSCs ROS产生和DNA损伤,并导致NSCs凋亡;而减少Hcy引发的ROS产生可以明显改善DNA损伤并提高细胞存活率。因此,笔者认为Hcy可能通过氧化应激导致DNA损伤,从而促进NSCs凋亡;而抗氧化剂可以挽救部分由Hcy导致的NSCs损伤及凋亡,为与Hcy相关的神经系统疾病的治疗提供了理论基础。
[1] Denny K J,Kelly C F,Kumar V,et al.Autoantibodies against homocysteinylated protein in a mouse model of folate deficiency-induced neural tube defects[J].Birth Defects Res A Clin Mol Teratol,2016,106(3):201-207.
[2] Hooshmand B,Polvikoski T,Kivipelto M,et al.Plasma homocysteine,Alzheimer andcerebrovascular pathology:apopulation-based autopsy study[J].Brain,2013,136(pt9):2707-2716.
[3] Ye W,Blain S W.Sphase entry causes homocysteine-induced death while ataxia telangiectasia and Rad3 related protein functions anti-apoptotically to protect neurons[J].Brain,2010,133(8):2295-2312.
[4] Lin N,Qin S,Luo S,et al.Homocysteine induces cytotoxicity and proliferation inhibition in neural stem cells via DNA methylation in vitro[J].FEBS J,2014,281(8):2088-2096.
[5] Fang Z,Lu L,Tian Z,et al.Overexpression of phosphorylated 4E-binding protein 1 predicts lymph node metastasis and poor prognosis of Chinese patients with hilar cholangiocarcinoma[J].MedicalOncology,2014,31(5):940.
[6] Afman L A,Blom H J,Van N M,et al.Homocysteine interference in neurulation:a chick embryo model[J].Birth Defects Res A Clin MolTeratol,2003,67(6):421-428.
[7] Kruman I I,Culmsee C,Chan S L,et al.Homocysteine elicits a DNA damage response in neurons that promotes apoptosis and hypersensitivity to excitotoxicity[J].J Neurosci,2000,20(18):6920-6926.
[8] Picerno I,Chirico C,Condello S,et al.Homocysteine induces DNA damage and alterations in proliferative capacity of T-lymphocytes:a model for immunosenescence?[J].Biogerontology,2007,8(2):111-119.
[9] Vanzin C S,Manfredini V,Marinho A E,et al.Homocysteine contribution to DNA damage in cystathionine β-synthase-deficient patients[J].Gene,2014,539(2):270-274.
[10] Ho P I,Collins S C,Dhitavat S,et al.Homocysteine potentiates beta amyloid neurotoxicity:role of oxidative stress[J].J Neurochem,2001,78(2):249-253.
[11] Vanzin C S,BianciniG B,Sitta A,et al.Experimental evidence of oxidative stress in plasma of homocystinuric patients:a possible role for homocysteine[J].MolGenet Metab,2011,104(1-2):112-117.
[12] Zhao Y,Huang G,Chen S,et al.Homocysteine aggravates cortical neural cell injury through neuronal autophagy overactivation following rat cerebralischemia-reperfusion[J].Int J Mol Sci,2016,17(8):E1196.
[13] Huang R F,Huang S M,Lin B S,et al.Homocysteine thiolactone induces apoptotic DNA damage mediated by increased intracellular hydrogen peroxide and caspase 3 activation in HL-60 cells[J].Life Sci,2001,68(25):2799-2811.
[14] 罗丹红,黄鉴政.脑梗死患者同型半胱氨酸及氧化、抗氧化指标的测定及其意义[J].浙江医学,2004,26(7):495-496.
Effects of homocysteine on neural stem cells and its underlying mechanism
WANG Dan,RUAN Miaohua,ZHOU Aihua,et al.
Department of Neonatology,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou 32500,China
ObjectiveTo investigate the effects of homocysteine(Hcy)on C17.2 mouse neural stem cells(NSCs),and to explore its possible mechanism.MethodsC17.2 mouse NSCs were cultured and divided into blank control group,Hcy group and Hcy+N-acetylcysteine(NAC)group.The growth activity of NSCs was detected by CCK-8 method.The apoptosis of NSCs was assessed by flow cytometry analysis and caspase-3 method.Comet assay was used to evaluate the DNA damage of NSCs.The intracellular reactive oxidative species(ROS)level was detected by H2DCF-DA staining method.Results Hcyevoked ROS production and induced cell DNA damage,leading to an increase in NSCs apoptosis.On contrary,NAC decreased Hcy-evoked ROS production and significantly ameliorated DNA damage and improved NSCs survival.ConclusionHcy may play a negative role in NSCs survival via inducing DNA damage by oxidative stress.
Homocysteine DNA damage Oxidative stress Neural stemcell
10.12056/j.issn.1006-2785.2017.39.23.2017-1547
国家自然科学基金项目(81701485);浙江省医药卫生科技计划项目(2017KY452);温州市科技局项目(2017Y0578)
325000温州医科大学附属第一医院新生儿科(王丹、阮妙华、周爱华、钱燕);温州医科大学附属第二医院肝胆外科(陈亦明)
陈亦明,E-mail:chenyiming209@126.com
2017-07-02)
(本文编辑:陈丹)
