羽毛降解菌株Streptomyces sp.DJ产生的蛋白酶酶学性质
2017-12-22柯野朱艳媚余国兴叶杰洲刘玉萍刘圆圆朱永丽
柯野,朱艳媚,余国兴,叶杰洲,刘玉萍,刘圆圆,朱永丽
(韶关学院英东生命科学学院,广东 韶关 512005)
羽毛降解菌株Streptomyces sp.DJ产生的蛋白酶酶学性质
柯野,朱艳媚,余国兴,叶杰洲,刘玉萍,刘圆圆,朱永丽
(韶关学院英东生命科学学院,广东 韶关 512005)
从羽毛废弃物堆的土壤中采集样品,通过富集培养、初筛和复筛分离出一株高效降解羽毛的DJ菌株;对该菌株的形态学观察和基于16S rDNA序列的系统进化分析,初步鉴定为链霉菌Streptomycessp. DJ。该菌株在32 ℃摇床培养10 d后,对天然羽毛的降解率高达50%,且羽毛水解产物中含有多种自由氨基酸。该菌株产生的蛋白酶最适反应温度为45 ℃,最适反应pH为10.0;对羽毛的降解能力高于商品化的碱性蛋白酶和木瓜蛋白酶,对疏水性或亲水性的自然底物也具有较强的水解能力。以上结果表明:DJ菌株及其产生的蛋白酶具有良好的应用潜力。
羽毛降解菌株;分离鉴定;酶学性质
近年来,随着畜牧业的迅速发展,每年都有上百万顿的废弃羽毛产生[1]。对于废弃羽毛的处理方式通常为填埋、焚烧或掩埋等简单的处理方式[2],废弃羽毛常导致各种类型疾病(如萎黄、支原体病和禽霍乱等)相互传染[3];这造成蛋白质浪费和严重的环境污染。羽毛以角蛋白为主的w(粗蛋白)占90%以上,w(氨基酸)在70%以上,包括动物所需的多种必需氨基酸;角蛋白富含α-螺旋和β-螺旋,是由二硫键、氢键和疏水键等交联而成的不溶性纤维蛋白。一般不易被木瓜蛋白酶、胰蛋白酶和胃蛋白酶等蛋白酶水解;因此,较难被动物直接消化利用[4-6]。常采用物理、机械和化学方法对羽毛降解,这易使必需氨基酸受到破坏,降低了降解产物的质量和效率[7]。利用微生物酶降解羽毛,避免以上的不足,高效地生产稀有氨基酸、肽等产品,应用于皮革工业、医药、化妆品等多种行业;这促进羽毛的深加工发展,并且还具有保护环境、变废为宝的作用[8]。
从自然界分离获得30多种可降解羽毛的微生物,这些微生物包括细菌、放线菌和真菌[6,9]。多数真菌产生的角蛋白酶具有致病性[3],因此,多数研究集中在放线菌和细菌。目前获得的羽毛降解菌多数对羽毛的降解效率低,需对羽毛进行前处理等不足;因此,筛选出对羽毛降解效率高,羽毛前处理简单的微生物菌株更具有实用性。本文旨在筛选获得高效降解羽毛的菌株,提高羽毛降解效率,为酶法生产获得系列羽毛降解产品、促进羽毛深加工的高值化提供理论和技术基础。
1 材料与方法
1.1 试验材料
1.1.1 羽毛与菌株来源 羽毛粉:采购于韶关市三鸟市场的天然羽毛,剪碎备用。菌株来源:韶关市养鸡场的土壤、三鸟市场废弃羽毛堆的土壤、三鸟市场废水沟的土壤。
1.1.2 培养基 富集培养基:NH4Cl 0.5 g/L,NaCl 0.5 g/L,K2HPO40.3 g/L,KH2PO40.4 g/L,MgCl20.1 g/L,酵母提取物1.0 g/L,羽毛粉10.0 g/L,未剪碎的羽毛少量,pH 7.5。羽毛粉平板:K2HPO41.5 g/L,MgSO4·7H2O 0.025 g/L,无水CaCl20.025 g/L,FeSO40.015 g/L,羽毛粉10.0 g/L,琼脂粉20.0 g/L,蒸馏水1 000 mL,pH 7.5。发酵培养基:NaCl 0.15 g/L,KH2PO40.54 g/L,K2HPO40.09 g/L,MgSO4·7H2O 0.15 g/L,无水CaCl20.005 g/L,未处理羽毛50.0 g/L,蒸馏水1 000 mL,pH自然。LB培养基:NaClw=1.0%,蛋白胨w=1.0%,酵母提取物w=0.5%,pH 7.0。
1.1.3 生化与化学试剂等 PCR反应的酶与引物购自上海生工公司;半胱氨酸、甲硫氨酸、丝氨酸、缬氨酸、脯氨酸购自广州普博欣生物科技有限公司;甘氨酸、酪氨酸、谷氨酸购自上海展云化工有限公司;高效薄层层析硅胶板HSGF254(5×10)购自烟台江支硅胶开发有限公司;其他试剂均为分析纯。
1.2 试验方法
1.2.1 羽毛降解菌的分离筛选
1) 羽毛降解菌的平板分离。
分别取5.0 g土壤样品接种于富集培养液中,37 ℃、160 r/min摇床培养3 d;取少量培养液,稀释液涂布于羽毛粉平板上,37 ℃培养7 d,挑取生长势强的菌株划线接种于羽毛粉平板上,37 ℃培养;反复划线至挑取到单菌落为止。
2) 羽毛降解菌的发酵筛选。
将菌株接种于LB培养液中,37 ℃、160 r/min培养48 h,将菌液接种于装有100 mL发酵培养基的250 mL三角瓶中,接种量为1%(V/V),37 ℃、160 r/min培养8 d,用Whatman滤纸过滤发酵液,50 ℃烘干,称量残留羽毛质量。无菌水代替菌液作为对照。羽毛降解率=[(制备发酵培养基的羽毛干质量-发酵后残留羽毛的干质量)/制备发酵培养基的羽毛干质量]×100%。
1.2.2 菌株的鉴定
1)菌体的形态观察。
对DJ菌株的菌落形态进行观察;并通过单染色,镜检观察其菌体结构形态。
2) 16S rDNA分子鉴定。
将DJ菌株接种于LB培养液中,培养24 h,收集菌体。参考酵母DNA的快速分离方法[10],提取其基因组DNA。以提取的基因组为模板,进行16S rDNA的PCR扩增。PCR反应体系:DNA模板1 μL,上游引物2 μL(8-27F: 5′- AGAGTTTGATCCTGGCTCAG -3′),下游引物2 μL(1523-1504R: 5′-AAGG AGGTGATCCAGCCGCA-3′)[11],水 20 μL,2×HiFi-PCR Master 25μL,总体积50 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min 30 s,29个循环;72 ℃恒温5 min。对PCR产物电泳鉴定,纯化回收测序分析。
1.2.3 发酵时间对羽毛降解的影响 将DJ菌株接种于LB液体培养基中,32 ℃、160 r/min、培养48 h,以1.0%(V/V)的接种量接种菌液于装有80 mL发酵培养基的250 mL的三角瓶中,32 ℃,160 r/min摇床培养,取不同培养时间的发酵液,测其pH、蛋白酶酶活,以及残留羽毛的重量来计算羽毛的降解率。
1.2.4 羽毛水解产物中的氨基酸分析 利用TLC法,取培养8 d后发酵培养液进行过滤,收集滤液,60 ℃恒温干燥浓缩后,向浓缩液中加入2.5倍的无水乙醇,20 ℃放置30 min,12 000 r/min离心,收集澄清的上清液,采用正丁醇∶冰醋酸∶水=4∶1∶2的混合液作为展开剂进行TLC薄膜层析,采用茚三酮法显色。
1.2.5 发酵液中蛋白酶的酶学性质研究
1) 粗酶液的制备。
对发酵液过滤,收集滤液,11 000 r/min离心10 min,收集上清液;添加硫酸铵使其饱和度达到80%以上进行盐析后,11 000 r/min离心10 min,收集沉淀,用蒸馏水溶解,透析获得粗酶液,4 ℃保存备用。测定粗酶液中蛋白酶的活性参考文献[12]略有改动,即具体的方法为:取适当稀释后的100 μL粗酶液和100 μL 2.0%酪蛋白(pH 10.0),40 ℃中水浴10 min,然后加入200 μL三氯乙酸,水浴20 min后,12 000 r/min离心10 min,取300 μL上清依次加入1.5 mL Na2CO3和300 μL福林酚试剂,摇匀,40 ℃保温发色20 min后在660 nm测其吸光度。以先加三氯乙酸灭酶活性的方式作为对照。酶活单位定义为:40 ℃反应温度下,每分钟水解酪蛋白产生1 μg酪氨酸为1个酶活力单位。
2) 最适反应温度和最适反应pH。
测定酶液在30、35、40 、45 、50 、55 和60 ℃反应温度下的活性,以确定最适反应温度;测定反应pH为3.0、6.0、8.0、10.0和11.0的活性,以确定最适合反应pH。
3) 金属离子与抑制剂对活性的影响。
分别向粗酶液中添加K+、Ca2+、Na+、Mg2+、Mn2+、PMSF、EDTA和SDS,室温下放置30 min后,测定其活性。以未添加试剂的酶液作为对照。
4)3种蛋白酶对羽毛降解的比较。
称取5.0 g洁净羽毛装入三角瓶中,然后加70 mL蒸馏水润湿羽毛,121 ℃灭菌20 min,冷却后分别加入粗酶液(反应pH 10.0,温度45 ℃)、木瓜蛋白酶(反应pH 7.2,温度45 ℃)和碱性蛋白酶(反应pH 10.0,温度45 ℃) 各30 mL酶液(酶活力为160 U/mL),水解2 d,测其对羽毛的降解率。
5) 对不同自然底物的水解。
按蛋白酶活性的测定方法,分别以酪蛋白、BSA、明胶和大豆分离蛋白为底物,测定酶液的活性,探究对不同底物的水解活性。为了直观地观察,将水解产物置于沸水中5 min使酶失活,12 000 r/min离心10 min 收集上清液,进行w=12% SDS-PAGE凝胶电泳,染色观察。
2 结 果
2.1 羽毛降解菌的筛选分离
将土壤样品中的羽毛降解菌株进行富集培养后,把富集培养液稀释涂布于羽毛粉平板上培养;进一步反复划线分离,筛选出27株长势较强的菌株。分别将27株菌株液体发酵培养后,测定比较菌株间对羽毛的降解率,从中筛选出长势强、降解羽毛效率最高的DJ菌株。
2.2 DJ菌株的鉴定
DJ菌株在羽毛粉平板生长1 d为白色小菌落,菌落边缘为浅白色;培养2 d菌落变为灰绿色,菌落表面干燥,有土腥味,该菌株的菌落形态见图1。镜检可见丝状菌丝体,弯曲的孢子丝和球状的孢子(见图2)。对DJ菌株提取基因组DNA,以其为模板扩增16S rDNA基因,PCR产物约1 500 bp,对PCR产物测序;据测序结果利用GenBank数据中Blastx程序比对,进一步利用Mega 5.0软件构建进化树。综合DJ菌株的菌落特征、菌丝体形态、以及16S rDNA序列分析,初步鉴定DJ菌株为Streptomycessp. DJ。
2.3 发酵时间对羽毛降解的影响结果
发酵培养DJ菌株1 d后,培养液逐渐浑浊,羽毛有降解迹象;培养6~7 d,羽片明显被降解;培养8 d后,羽片和羽枝几乎完全降解,仅余几支最粗大的羽轴,发酵液变为黄褐色,具有明显刺鼻的氨味。发酵4 d的羽毛降解效果见图3,由图3可见,处理的羽毛明显地被降解,对照的羽毛未出现明显的降解迹象。
不同发酵时间对羽毛降解效果见表1。由表1可知,当DJ菌株在羽毛发酵培养基中培养10 d,羽毛的降解率几乎达到最高,10 d后降解率趋向稳定(约50%);发酵液的pH值逐渐升高,当达到8 d时发酵液pH达到最高9.1,而后pH逐渐降低趋于稳定。发酵液中胞外碱性蛋白酶的活性逐渐增加,后期逐渐降低。
2.4 羽毛水解产物的氨基酸分析结果
将羽毛发酵液通过浓缩,去掉大分子蛋白后进行薄层层析(TLC),层析结果见图4。由图4可知,羽毛水解产物中可能含有半胱氨酸、酪氨酸、脯氨酸、丝氨酸、甲硫氨酸和谷氨酸等自由氨基酸。

表1 不同发酵时间对羽毛的降解率Table 1 Effects of incubation period on feather degradation by DJ strain grown in shake culture

图1 DJ菌株在羽毛粉平板上的菌落图Fig.1 Colonies of DJ strain growing on feather meal plate

图2 沟DJ菌株的显微图Fig.2 Cell morphology of DJ strain
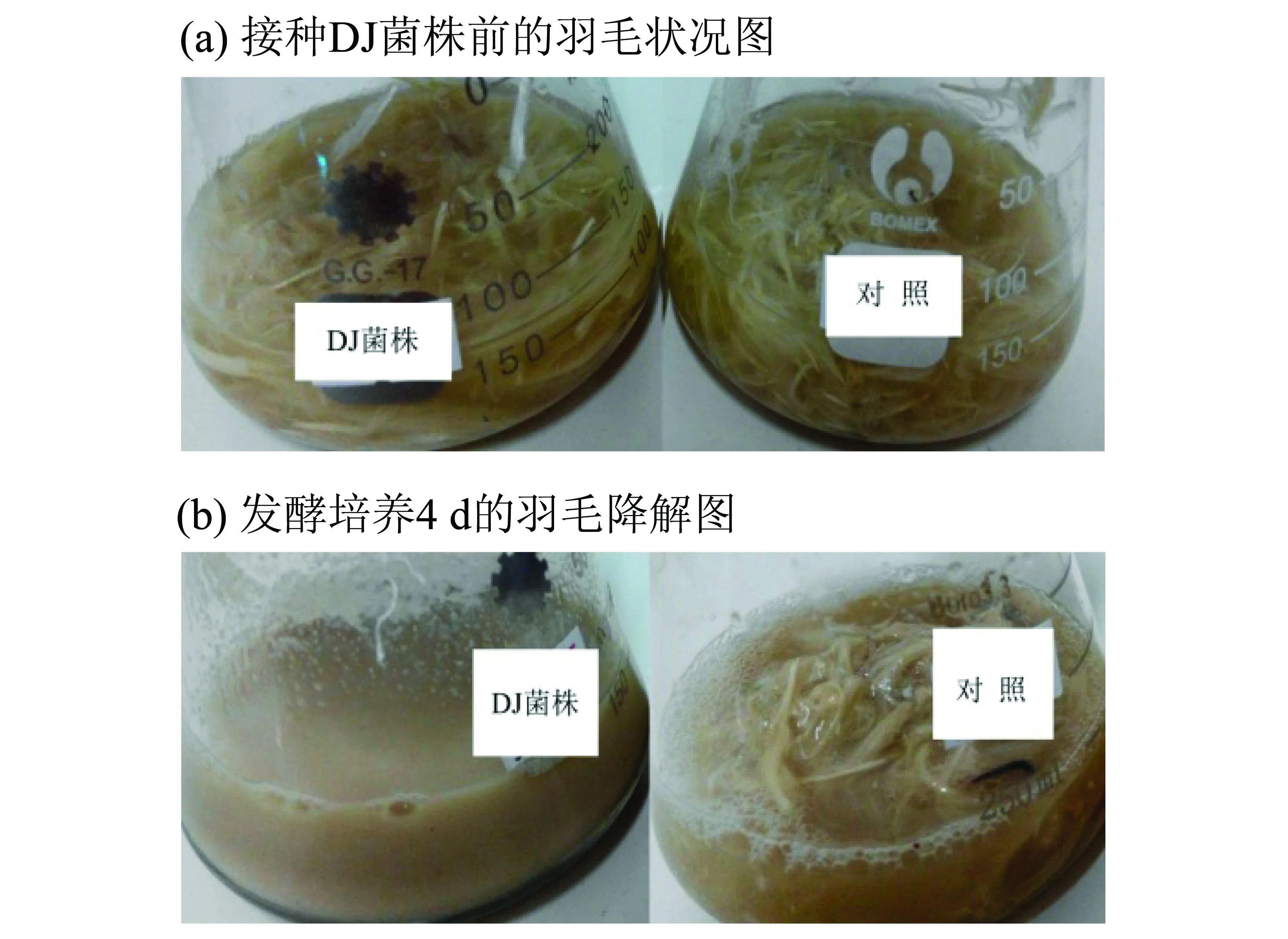
图3 发酵培养中羽毛的降解图Fig.3 Degradation of feathers by DJ strain (a,b: 左边三角瓶为处理,右边三角瓶为对照)
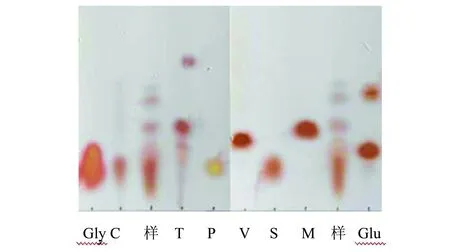
图4 羽毛水解产物中的氨基酸TLC图Fig.4 Thin layer chromatography (TLC) plate showing amino acids composition of feather hydrolysate样:发酵液样品; Gly:甘氨酸; C:半胱氨酸; T: 酪氨酸; P:脯氨酸; V:缬氨酸; S:丝氨酸; M:甲硫氨酸; Glu:谷氨酸
2.5 粗酶液的酶学性质结果
2.5.1 最适反应温度和最适反应pH结果 反应温度和反应pH对蛋白酶活性的影响分别见图5和图6。图5可见,蛋白酶最适反应温度为45 ℃;当温度低于40 ℃或高于55 ℃,活性显著下降,不到最适反应温度活性的80%,这表明反应温度对酶活性影响极显著。由图6可见,随着反应pH升高,酶活性逐渐提高,最适pH为10.0;当反应pH高于10.0时,活性降低。
2.5.2 金属离子与抑制剂对活性的影响结果 不同金属离子和抑制剂对活性的影响结果见表2。由表2可知,K+、Ca2+Na+和Mg2+对活性具有一定的促进作用;Mn2+对活性有显著地促进作用,能提高活性60%。螯合剂EDTA和抑制剂PMSF能显著地抑制活性,分别使活性仅保留28.9%和55.0%。
2.5.3 3种蛋白酶对羽毛降解的比较结果 3种蛋白酶对羽毛降解结果见表3。由表3可见,粗酶液对羽毛降解率达到20.9%,碱性蛋白酶的降解率为8.8%,而木瓜蛋白酶几乎不能降解羽毛;该结果表明粗酶液对羽毛的降解效果明显高于商品化木瓜蛋白酶和碱性蛋白酶,具有较强的应用价值。

图5 反应温度对酶活的影响Fig.5 Effects of temperature on the protease activity

图6 反应pH对酶活的影响Fig.6 Effects of pH on the protease activity

试剂浓度/mmol相对酶活/%无试剂001000K+101031Ca2+101068Na+101079试剂浓度/mmol相对酶活/%Mg2+101103Mn2+101600EDTA10289PMSF10550
表3 3种蛋白酶对羽毛降解效果
Table 3 Effects of 3 kinds of proteases on feather degradation

酶种类粗酶液碱性蛋白酶木瓜蛋白酶羽毛降解率/%2098805
2.5.4对不同自然底物的水解结果 对不同底物的水解结果见表4。由表4可知,蛋白酶对酪蛋白的水解能力最强,次之是大豆分离蛋白(48.5%)、较差为明胶(26.9%),最差是BSA(15.7%)。蛋白酶对4种底物的水解产物SDS-PAGE电泳图(见图7)。由图7可见,蛋白酶对酪蛋白和大豆分离蛋白的水解效果较好,水解产物中的蛋白条带不明显;而对BSA的水解效果较差,水解产物中有大量的不同分子量的蛋白条带,该电泳图与测定水解活性结果一致。

表4 不同自然底物的水解结果Table 4 Hydrolysis effects of different natural substrates

图7 4种底物的水解产物的SDS-PAGE电泳图Fig.7 SDS-PAGE analysis of the hydrolysates of 4 natural substrates1:明胶(-);2:明胶(+);3:BSA(-);4:BSA(+);5:酪蛋白(-);6:酪蛋白(+);7:SPI(-);8:SPI(+);M: 蛋白Marker
3 讨 论
目前,从自然界中分离获得对羽毛有降解作用的微生物已有报道,但是很少应用于工业;主要是这些微生物对羽毛的降解能力有限。究其原因是当w(羽毛粉)高于1.5%时,菌株产生的胞外蛋白酶被抑制,导致羽毛粉的降解效率降低[13];这正如JAIN R等报道的StreptomycesexfoliatusCFS 1068菌株对w=0.5%的羽毛降解率为96.6%,对w=2.0%羽毛粉的降解率仅为72.1%[14];王继勇等分离的羽毛降解菌株对w=1.0%羽毛粉的最高降解率仅为71.3%[2]。本文分离的DJ菌株对w=5.0%的羽毛粉仍有51.2%的降解率,这表明该菌株比目前报道的多数菌株都具有较强的应用潜力。
DJ菌株产生的胞外酶能分别被EDTA和PMSF显著地抑制活性,这表明DJ菌株分泌的胞外蛋白酶的活性中心与金属离子和丝氨酸有关,且最适反应pH为10.0;该结果与朱友峰等报道的角蛋白酶可能是一种丝氨酸金属蛋白酶,最适pH为9.0的结果相一致[1]。该酶与一般的内肽酶(碱性蛋白酶和木瓜蛋白酶)相比,对羽毛具有极强的水解能力,羽毛水解产物中含有多种自由氨基酸;并且对內肽酶几乎不能水解的亲水性自然底物(如明胶和BSA)都具有较强的水解效果,这表明该酶具有广泛的肽键选择性,具有良好的开发价值和应用前景。今后将对该酶基因进行克隆表达、纯酶的性质、结构与功能,以及对羽毛的降解机理等方面进行深入的研究。
[1] 朱友峰,岳寿松,宋爱荣,等.降解羽毛的嗜麦芽窄食单胞菌YHYJ-1角蛋白酶纯化及酶学性质研究[J].西南农业学报,2013,26(3):982-986.
ZHU Y F, YUE S S, SONG A R, et al. Purification and characterization of a novel keratinase from feather-degradingStenotrophomonasmaltophiliastrain YHYJ-1[J]. Southwest China Journal of Agricultural Sciences, 2013,26(3):982-986.
[2] 王继勇,何敏,陈聪,等.羽毛降解菌的筛选及其产酶特性[J].武汉大学学报(理学版),2015,61(2):183-186.
WANG J Y, HE Min, CHEN C, et al. Isolation and characteristics of enzyme production of feather-degrading bacteria[J]. Journal of Wuhan University (Natural Science Edition), 2015,61(2):183-186.
[3] MOUSAVI S, SALOUTI M, SHAPOURY R, et al. Optimization of Keratinase Production for Feather Degradation byBacillussubtilis[J].Jundishapur Journal of Microbiology, 2013,6(8):1-5.
[4] MAZOOTTO A M, COELHO R R R, CEDROLA S M, et al. Keratinase production by threeBacillusspp. using feather meal and whole feather as substrate in a submerged fermentation[J]. Enzyme Research, 2011,2011:1-7.
[5] ONIFADE A A, Al-SANE N A, Al-MUSALLAM A A, et al. A review: Potentials for biotechnological applications of keratin-degrading microorganisms and their enzymes fornutritional improvement of feathers and other keratins as livestock feed resources[J]. Bioresource Technology,1998,66(1):1-11.
[6] LIN Xiang, LEE C G, CASALE E S, et al. Purification and characterization of a keratinase from a feather-degradingBacilluslicheniformisstrain[J]. Applied and Environmental Microbiology,1992,58(10):3271 -3275.
[7] 李金婷,路福平,李玉,等.高效降解羽毛角蛋白菌株的筛选与鉴定[J].天津科技大学学报,2010,25(6): 14-17, 29.
LI J T, LU F P, LI Yu, et al. Screening and identification of a high efficient keratin-degrading strain [J]. Journal of Tianjin University of Science & Technology,1992,58(10):3271 -3275.
[8] BRANDELLI A, SALA L, KALIL SJ. Microbial enzymes for bioconversion of poultrywaste into added-value products[J]. Food Research International,2015,73(SI):3-12.
[9] CAI Chenggang, LOU Bing-gan, ZHENG Xiaodong. Keratinase production and keratindegradation by amutant strain ofBacillussubtilis[J]. Journal of Zhejiang University-SCIENCE B, 2008, 9(1):60-67.
[10] 萨姆布鲁克 J, 拉塞尔 D W, 黄培堂.分子克隆实验指南[M]. 3版. 北京:科学出版社, 2005:485-487.
SAMBROOK J, RUSSELL D W, HUANG P T, et al. Molecular cloning a laboratory manual [M]. 3th ed. Beijing: Science Press,2005: 485-487.
[11] 徐平,李文均,徐丽华,等. 微波法快速提取放线菌基因组DNA[J].微生物学通报, 2003, 30(4):82-84.
XU P, LI W J, XU L H, et al. A microwave-based method for genomic DNA extraction from actinomycetes[J]. Journal of Microbiology China, 2003, 30(4):82-84.
[12] SB/T 10317-1999. 中华人民共和国专业标准蛋白酶活力测定法[S] .北京:中国标准出版社,1999.
SB/T 10317-1999. The professional standards of the People’s Republic of China, measurement of proteinase activity [S]. Beijing:Standards Press of China,1999.
[13] KANCHANA R, MESTA D. Native feather degradation by aKeratinophilicfungus[J]. International Journal of Chem Tech Research, 2013,5(6):2947-2954.
[14] JAIN R, PRAKASH C J, AGRAWALS C. Feather degradation byStreptomycesexfoliatusCFS 1068[J]. Annals of Microbiology, 2012, 62(3):973-978.
CharacteristicsofProteinasesProducedbyafeather-degradingStreptomycessp.DJStrian
KEYe,ZHUYanmei,YUGuoxing,YEJiezhou,LIUYuping,LIUYuanyuan,ZHUYongli
(Henry Fok College of Life Sciences, Shaoguan University, Shaoguan 512005, China)
A DJ strain with a high efficience of feather-degrading capability was isolated from the soil of feather waste by the enrichment culture and the screening process.The strain was identified asStreptomycessp. according to morphologic observation, 16S rDNA sequence alignment, and phylogenetic trees analysis. After fermenting at 32 ℃ for 10 days, the feather degradation rate reached 50%, and the feather hydrolysate was found to contain amino acids. The protease produced by the DJ strain had a maximal activity at 45 ℃, and the optimum reactive pH at 10.0. The protease displayed a higher hydrolysis activity to feather than Alcalase and Papain, and had a strong hydrolysis ability to the hydrophobic or hydrophilic natural substrates. The results indicated that the DJ strain and its protease was of potential application prospects.
feather-degradingStreptomycessp. DJ strian; isolation and identification;characteristics of proteinases
10.13471/j.cnki.acta.snus.2017.06.23
2016-11-14
广东省教育厅特色创新项目(2015KTSCX126);韶关学院大学生创新创业训练计划省级项目(201710576032) ;韶关学院大学生科技创新培育项目(pdjh2017b0460);广东省科技计划项目(2016A010105024)
柯野(1977年生),男;研究方向微生物学和酶工程;E-mail:keye518@163.com
Q939.9
A
0529-6579(2017)06-0147-06
