二甲双胍对小鼠衰老过程中学习记忆能力的影响
2017-12-21张丽君张丽霞王郝莹李莉红轩瑞晶王昭君郭建红
张丽君,张丽霞,王郝莹,张 琼,李莉红,轩瑞晶,王昭君,郭建红*
(1.山西医科大学病理生理学教研室,太原 030001; 2.山西医科大学实验动物中心,实验动物与人类疾病动物模型 山西省重点实验室,太原 030001; 3.山西医科大学生理学系, 细胞生理学省部共建教育部重点实验室,太原 030001)
二甲双胍对小鼠衰老过程中学习记忆能力的影响
张丽君1,张丽霞1,王郝莹1,张 琼1,李莉红2,轩瑞晶2,王昭君3,郭建红1*
(1.山西医科大学病理生理学教研室,太原 030001; 2.山西医科大学实验动物中心,实验动物与人类疾病动物模型 山西省重点实验室,太原 030001; 3.山西医科大学生理学系, 细胞生理学省部共建教育部重点实验室,太原 030001)
研究报告
目的探究D-半乳糖诱导小鼠衰老过程中补充二甲双胍对小鼠学习记忆能力的影响及可能机制。方法将24只雌性ICR小鼠随机分为3组:对照组、衰老组、衰老+二甲双胍组,每组8只,连续给药16周。监测各组小鼠体重及食物摄取量;行为学检测小鼠学习记忆能力;HE染色观察小鼠海马组织结构;比色法检测各组小鼠海马组织中谷胱甘肽(glutathione, GSH)水平。结果与衰老组相比,衰老+二甲双胍组小鼠体重降低(P< 0.05);Morris水迷宫逃避潜伏期、游泳路程明显减少(P< 0.01或P< 0.05),目标象限内游泳时间延长(P< 0.05),游泳速度加快(P< 0.05);穿梭实验中主动回避次数升高(P< 0.05);HE染色显示海马齿状回中核皱缩、深染的海马神经元明显减少;海马组织GSH水平显著升高(P< 0.05)。结论补充二甲双胍可以明显延缓小鼠衰老过程中学习记忆能力的下降,维持海马神经元正常结构,其机制可能与降低小鼠体重及增强海马组织抗氧化水平有关。
二甲双胍;衰老;氧化应激;海马神经元
二甲双胍是目前广泛用于治疗二型糖尿病(type 2 diabetes,T2DM)的一线药物[1]。随着现代医学科研水平的不断进步,二甲双胍的治疗潜力已经远远超出其常规的作为治疗糖尿病的用途。越来越多的文献报道,补充二甲双胍可以降低多种疾病(包括癌症[2]和心血管疾病[3])的发病率;减轻肝脏脂肪变性[4];调节肠道微生物群促进健康[5];甚至延缓衰老进程[6]。然而,二甲双胍对于小鼠衰老过程中中枢神经系统的作用尚未完全阐明[7]。本实验通过使用D-半乳糖诱导小鼠衰老同时补充二甲双胍,运用行为学及组织学等方法检测小鼠学习记忆、运动功能、海马组织结构以及氧化应激稳态的变化,用以评估二甲双胍在脑组织衰老过程的作用机制。
1 材料和方法
1.1 实验动物
SPF级7月龄雌性ICR小鼠24只,体重(50.67±1.66)g,由长沙市天勤生物技术有限公司提供[SCXK(湘)2014-0011]。所有动物在本实验室独立动物房饲养[SYXK(晋)2015-0001],室温(22±2)℃,12 h光照/12 h黑暗循环,提供充足食物及饮水。按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂及仪器
D-半乳糖(G5388-100G Sigma,美国);盐酸二甲双胍(D9351索莱宝,北京);生理盐水(石家庄四药有限责任公司);GSH检测试剂盒(A006-1,南京建成生物工程研究所);BCA蛋白定量试剂盒(KGP920,凯基生物); Morris水迷宫视频跟踪系统(Ethovision 3.0,Noldus Information Technology,荷兰);小鼠穿梭箱(上海欣软信息科技有限公司,中国);高速离心机(GL-20C,美国);分光光度计(上海第三分析仪器厂,中国);酶标仪(SpectraMAX 190,USA)等。
1.3 实验方法
1.3.1 实验动物分组及处理
24只雌性ICR小鼠适应性饲养2周后,按数字随机表法分为正常对照(control,Ctr.)组,D-半乳糖诱导衰老模型(D-gala)组,诱导衰老同时补充二甲双胍(D+Met)组,每组8只。D+Met组和D-gal组每日颈背部皮下注射D-半乳糖(D-galactose 125 mg/kg·d)诱导衰老,同时给予二甲双胍(metformin 300 mg/kg·d)或同等剂量0.9%生理盐水灌胃;Ctr.组给予注射、灌胃等剂量生理盐水。连续给药16周,每天监测小鼠食物摄取量,每周称取小鼠体重。
1.3.2 Morris水迷宫
经典Morris水迷宫实验主要监测小鼠长期空间学习记忆能力。实验共分三个阶段,第一阶段为定位航行阶段,为期5 d,从4个不同象限将小鼠面朝水池内壁依次放入水池中,记录其1 min内找到水下平台所用的时间,为逃避潜伏期(escape latency,EL),同时记录小鼠游泳路程;第二阶段为空间探索,即第6天撤走平台,随机选出2个象限,将小鼠面朝水池内壁依次从该象限放入水中,让其自由探索1 min,记录小鼠游泳轨迹并计算小鼠在目标象限内游泳时间占总时间的百分比(time in target quadrant);第三阶段为可视平台实验,将平台抬高至水面1 cm,随机选取2个象限,将小鼠依次放入水池中,记录小鼠找到平台所用时间及速度。
1.3.3 穿梭箱实验
水迷宫实验结束后对小鼠进行为期7 d的穿梭箱实验,每天1次。具体做法如下:将小鼠放入穿梭箱中,适应30 s后给予灯光(光照强度为90级)和蜂鸣音刺激(声音强度为80级,频率为500 Hz),刺激持续10 s,若此时动物从隔板的圆孔中到达对侧暗箱则为主动回避反应(active avoidance response,AAR);若未到达对侧暗箱,继续给予0.4 mA电刺激,持续时间为5 s,若此时动物穿梭至对侧则为被动回避反射(passive avoidance response,PAR);若给予电刺激后动物仍停留在同侧暗箱中,则为逃避失败(escape failure,EF)。统计AAR次数作为其学习记忆成绩的评价指标[8]。
1.3.4 HE染色观察海马形态结构
行为学实验结束后,1%戊巴比妥麻醉小鼠,迅速断头取脑,分离右侧海马组织置于-80℃冰箱中备用,将左侧脑组织置于4%多聚甲醛进行固定。固定24 h后,梯度乙醇脱水、二甲苯透明、石蜡包埋,经冠状面切片(切片厚度为5 μm),行苏木素-伊红(HE)染色,光学显微镜下观察各组海马组织结构变化。
1.3.5 抗氧化水平检测
准确称取新鲜海马组织,按试剂盒说明书制备匀浆,检测蛋白浓度,采用二硫代二硝基苯甲酸与巯基化合物反应时产生一种黄色化合物,经分光光度计比色测定,计算各样品GSH实际浓度(mg/gprot)。
1.4 统计学方法
2 结果
2.1 各组小鼠体重及食物摄入量情况
表1为各组小鼠每四周体重变化情况:随着年龄的增加,各组小鼠体重均出现明显升高。自第8周至实验结束,D+Met组小鼠的体重低于Ctr.组(P< 0.05),实验结束时该组小鼠体重低于D-gala组(P< 0.05)。表2为各组小鼠食物摄取量:D+Met小鼠的食物摄取量自第8周起低于正常对照组(P< 0.05),虽然该组小鼠的食物摄取量低于衰老模型组,但差异无显著性(P> 0.05)。
2.2 各组小鼠Morris水迷宫测试结果
图1 A为各组小鼠定位巡航实验。随着训练次数的增加,各组小鼠逃避潜伏期的时间均出现不同程度减少,第3~5天,D-gala小鼠逃避潜伏期较Ctr.小鼠明显增加(P< 0.001),而D+Met小鼠显著低于D-gala小鼠(P< 0.01或P< 0.001)。图1B为各组小鼠游泳路程。如图所示,Ctr.小鼠及D+Met小鼠的游泳路程逐渐减少,而D-gala小鼠游泳路程几乎没有变化(P< 0.05)。说明D-gala小鼠出现明显的空间学习障碍,而补充二甲双胍可改善这种学习能力。
图1C为第6天各组小鼠空间探索实验中代表性游泳轨迹图。经统计分析得到图1D:D-gala小鼠在目标象限内游泳时间占总时间的百分比显著低于Ctr.及D+Met小鼠(P< 0.01或P﹤0.05)。图1E为小鼠游泳热力图,Ctr.及D+Met小鼠目标象限内停留时间均高于D-gala小鼠。这些数据表明,D-gala小鼠空间记忆能力明显受损,补充二甲双胍可明显改善空间记忆能力。
图2F及2G分别为可视平台实验中各组小鼠找到平台所用时间及游泳速度。如图所示,各组小鼠找到平台所用的时间差异无显著性(P> 0.05),而D+Met小鼠游泳速度明显加快(P< 0.05)。说明D-gala小鼠逃避潜伏期的延长、游泳路程的增加及在目标象限内游泳时间的减少不是由于视力问题,而是出现明显的学习、记忆能力受损。
2.3 各组小鼠穿梭实验中的主动回避次数
穿梭实验结果如图2所示。随着训练次数的增加,各组小鼠主动回避次数明显增多,第4~7天,与Ctr.组相比,D-gala小鼠主动回避次数显著降低(P< 0.05或P<0.01),第6~7天D+Met小鼠主动回避次数高于D-gala小鼠(P< 0.05)。这一结果表明,D-gala小鼠学习记忆能力下降,而补充二甲双胍可明显改善衰老小鼠的学习记忆能力。

表1 各组小鼠体重变化Tab.1 Changes of body weight in the mice
注:与对照组相比较,*P< 0.05;与D-gala组相比较,#P< 0.05。
Note.Compared with the control group,*P< 0.05. Compared with the D-gala group,#P< 0.05.

表2 各组小鼠食物摄入量变化Tab.2 Changes of food intake of the mice in each group
注:与对照组相比较,*P< 0.05;与D-gala组相比较,#P< 0.05。
Note.Compared with the control group,*P< 0.05. Compared with the D-gala group,#P< 0.05.

注:C:空间探索实验中小鼠游泳轨迹;E:各组小鼠空间探索游泳热力图。与对照组相比较,* P< 0.05,** P< 0.01,***P< 0.001;与D-gala组相比较,#P< 0.05,##P< 0.01,###P< 0.001。图1 Morris水迷宫测试各组小鼠长时程空间学习记忆能力变化Note.C: Sample swimming traces of mice in different groups tested by hidden platform test. E:Swimming thermographic diagram of probe test of the mice in different groups. Compared with the control group,* P< 0.05,** P< 0.01,***P< 0.001. Compared with the D-gala group,#P< 0.05,##P< 0.01,###P< 0.001.Fig.1 Results of Morris water maze test of the spatial learning and memory ability of mice
2.4 海马组织HE染色
图3 A-C分别为各组小鼠海马齿状回区域HE染色图,Ctr.小鼠(图A),海马神经元排列紧密,细胞形态结构正常;与D-gala组相比,D+Met小鼠(图C),呈三角形或不规则型皱缩、深染的海马神经元明显减少。
2.5 各组小鼠海马组织GSH含量
如图4所示,与Ctr.相比,D-gala小鼠海马中GSH含量明显下降(P< 0.05),而补充二甲双胍可恢复衰老小鼠海马组织中GSH水平(P< 0.05)。
3 讨论
人口老龄化是21世纪全球都将面临的重大问题。减缓衰老进程,改善老年人健康已成为各国科学领域研究重点。当前,国际上正在开展替代药物发展战略,即利用现有药物治疗其他疾病。这样既可以节省相当多的时间和金钱,同时由于这些药物的药代动力学、药效学和安全性已经建立,绕开了临床前研究这一繁琐环节而被许多国家提倡。二甲双胍正是目前研究的新型药物之一[9]。
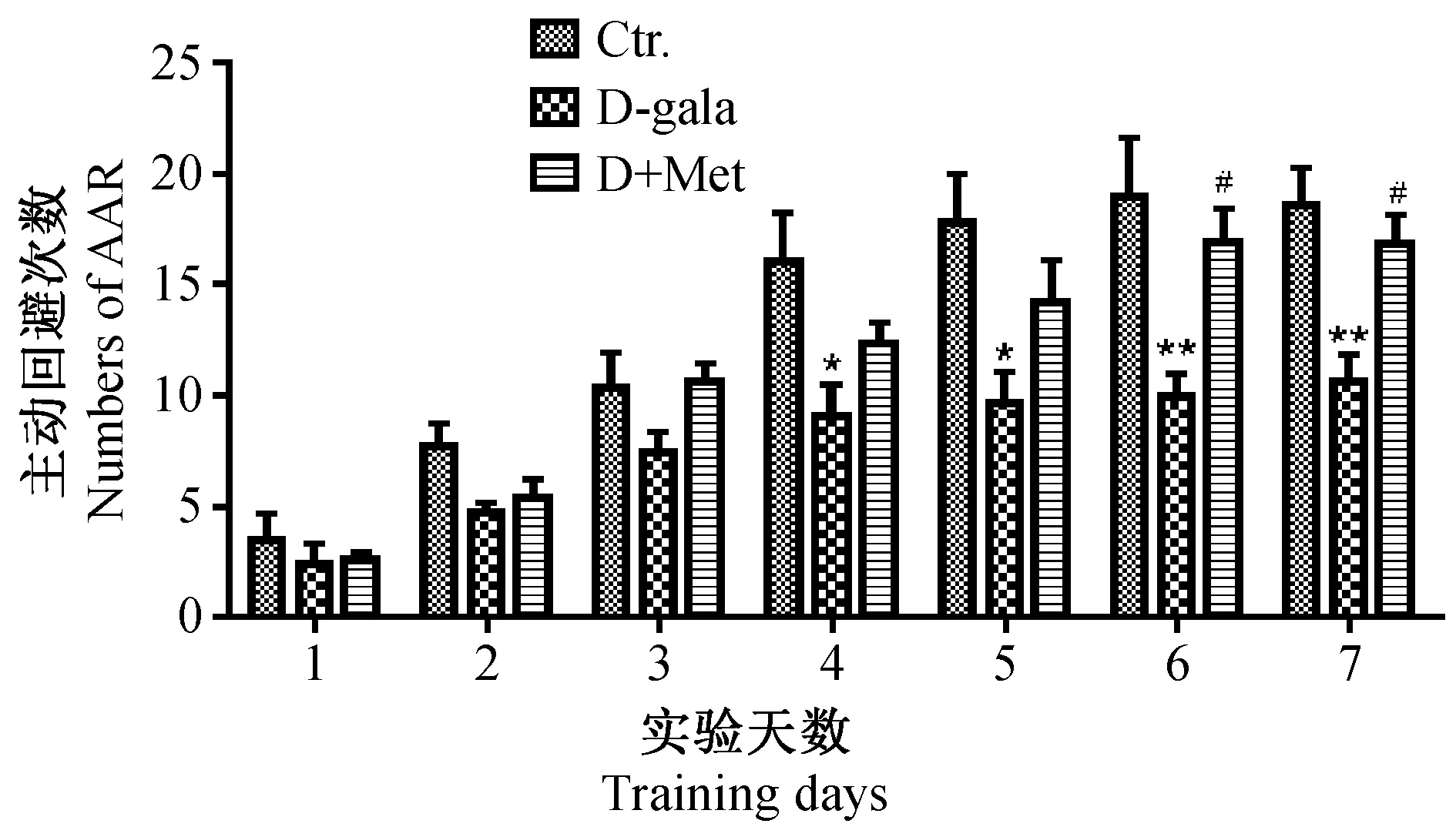
注:与对照组相比较,* P< 0.05,** P< 0.01;与D-gala组相比较,#P< 0.05。图2 穿梭箱实验检测各组小鼠学习记忆能力变化Note.Compared with the control group,* P< 0.05,** P< 0.01. Compared with the D-gala group,#P< 0.05.Fig.2 Changes of learning and memory ability of the mice in each group assessed by shuttle-box test
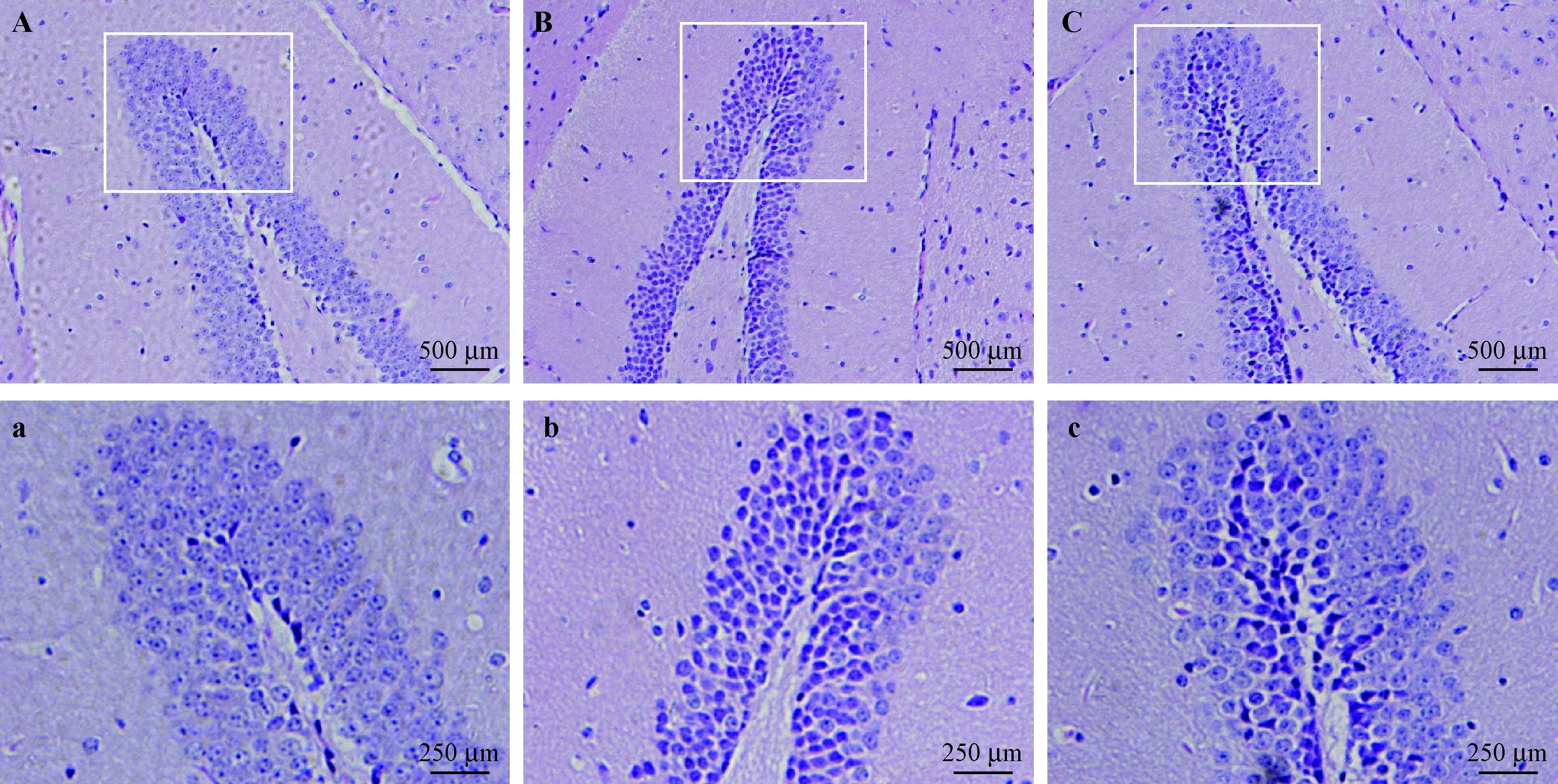
注:A,a:对照组;B,b:D-gala组;C,c:D+Met组。图3 各组小鼠海马齿状回区域HE染色图Note.A,a: control group. B,b: D-gala group. C,c: D+Met group. Fig.3 Comparison of the histology of hippocampal dentate gyrus in the mice.HE staining
于其治疗效果好、副作用小、价格便宜等优势,目前世界上约有1.5亿2型糖尿病人服用二甲双胍[10]。虽然二甲双胍在体内的代谢过程已经阐明[11],并且证实其的确可以通过血脑屏障[12],但是,近年来,研究者们发现二甲双胍对大脑中枢神经系统的作用出现了自相矛盾的结论。一些研究显示二甲双胍可以促进脑神经再生[13]、改善学习记忆能力[14],降低认知衰退的风险[15];而另一些研究则出现相反的结果,如二甲双胍加重阿尔茨海默病(Alzheimer’ s disease,AD)发生的风险[16],促进受损神经元的存活[17]以及导致AD模型大鼠的认知功能障碍的恶化[18]。由于二甲双胍对中枢神经系统存在不确定的作用,本文旨在应用不同方法检测二甲双胍对衰老小鼠学习记忆、运动功能的作用,从而为二甲双胍是否可以作为一种抗中枢神经系统衰老药物被用于临床研究作出一定贡献。
由慢性施用D-半乳糖诱导神经毒性作用是目前广泛用于研究衰老和记忆障碍的常见模型[19]。查询美国国家医学图书馆PubMed数据库,截止2017年5月,发表D-半乳糖诱导小鼠衰老模型相关文献已达800多篇,但二甲双胍对D-半乳糖诱导衰老模型的相关作用尚未见报道。本文旨在观察二甲双胍对D-半乳糖诱导的衰老小鼠学习记忆能力的影响及有关机制研究。首先,我们对D-半乳糖诱导的衰老小鼠进行Morris水迷宫及穿梭实验测试,结果显示衰老小鼠逃避潜伏期、游泳路程显著增加、在目标象限内游泳时间以及主动穿梭次数明显下降,提示衰老小鼠学习记忆能力明显衰退,与曹雪姣等[20]的实验结论相一致。其次,DiTacchio等[21]发现补充二甲双胍对雌性小鼠的学习记忆能力发挥保护作用,本实验中二甲双胍的补充同样改善衰老小鼠空间和非空间(水迷宫和穿梭实验)学习记忆能力,这与上述研究结果一致。实验中,我们还发现,补充二甲双胍可降低小鼠食物摄取量并减轻小鼠体重,与先前报道的给中年小鼠补充二甲双胍,其体重明显小于年龄匹配的对照组[22]的结果相同。此外,另有文献报道[23]D-半乳糖可诱导啮齿类动物大脑氧化失衡,导致脑组织神经变性、记忆缺陷等脑衰老表现,这与我们观察到施用D-半乳糖降低小鼠体内GSH含量相一致。而补充二甲双胍可明显恢复体内GSH水平,提高海马组织抗氧化能力,从而发挥对海马组织的保护作用。但二甲双胍作为抗氧化调节剂如何调节氧化应激、降低小鼠体重,改善其学习记忆能力,相关实验正在进行中。

注:与对照组相比,* P< 0.05;与D-gala组相比,#P< 0.05。图4 各组小鼠海马组织中GSH变化情况Note.Compared with the control group,* P< 0.05. Compared with the D-gala group,#P< 0.05.Fig.4 Changes of glutathione (GSH) contents in hippocampal tissues of the mice
总之,本实验运用行为学及组织学方法研究D-半乳糖诱导小鼠衰老过程中补充二甲双胍对小鼠学习记忆、运动功能及海马神经元的影响,结果表明二甲双胍可以延缓脑衰老过程中学习记忆能力的下降,维持海马神经元正常结构,这一保护作用可能与降低小鼠体重以及维持海马组织中抗氧化水平有关。
[1] American Diabetes Association. Standards of medical care in diabetes-2014 [J]. Diabetes care, 2014, 37 (Supplement 1): S14-80.
[2] Chae YK, Arya A, Malecek MK, et al. Repurposing metformin for cancer treatment: current clinical studies [J]. Oncotarget, 2016, 7(26): 40767-40780.
[3] Whittington HJ, Hall AR, McLaughlin CP, et al. Chronic metformin associated cardioprotection against infarction: not just a glucose lowering phenomenon [J]. Cardiovasc Drugs Ther, 2013, 27(1): 5-16.
[4] Young MS, Lee YH, Kim JW, et al. Metformin alleviates hepatosteatosis by restoring SIRT1-mediated autophagy induction via an AMP-activated protein kinase-independent pathway [J]. Autophagy, 2015, 11(1): 46-59.
[5] Dehkordi EH, Sattari F, Khoshdel A, et al. Effect of folic acid and metformin on insulin resistance and inflammatory factors of obese children and adolescents [J]. J Res Med Sci, 2016, 21:71. eCollection 2016.
[6] Castillo-Quan JI, Blackwell TK. Metformin: restraining nucleocytoplasmic shuttling to fight cancer and aging [J]. Cell, 2016, 167(7): 1670-1671.
[7] Tasci I. Metformin: good or bad for the brain? [J]. Ann Transl Med, 2014, 2(6): 53.
[8] 鲁燕侠, 张癸荣, 聂凌云, 等. 不同实验条件对穿梭箱系统研究大、小鼠学习记忆行为学的影响 [J]. 中国药理学通报, 2012, 28(6): 787-791.
[9] Pryor R, Cabreiro F. Repurposing metformin: an old drug with new tricks in its binding pockets [J]. Biochem J, 2015, 471(3): 307-322.
[10] An H, He L. Current understanding of metformin effect on the control of hyperglycemia in diabetes [J]. J Endocrinol, 2016, 228(3): R97-106.
[11] Nakamichi N, Shima H, Asano S, et al. Involvement of carnitine/organic cation transporter OCTN1/SLC22A4 in gastrointestinal absorption of metformin [J]. J Pharm Sci, 2013, 102(9): 3407-3417.
[12] Labuzek K, Suchy D, Gabryel B, et al. Quantification of metformin by the HPLC method in brain regions, cerebrospinal fluid and plasma of rats treated with lipopolysaccharide [J]. Pharmacol Rep, 2010, 62(5): 956-965.
[13] Ahmed S, Mahmood Z, Javed A, et al. Effect of metformin on adult hippocampal neurogenesis: comparison with donepezil and links to cognition [J]. J Mol Neurosci, 2017, 62(1): 88-98.
[14] Wang J, Gallagher D, DeVito LM, et al. Metformin activates an atypical PKC-CBP pathway to promote neurogenesis and enhance spatial memory formation [J]. Cell Stem cell, 2012, 11(1): 23-35.
[15] Qi B, Hu L, Zhu L, et al. Metformin attenuates cognitive impairments in hypoxia-ischemia neonatal rats via improving remyelination [J]. Cell Mol Neurobiol, 2016, doi: 10.1007/s10571-016-0459-8.
[16] Moore EM, Mander AG, Ames D, Increased risk of cognitive impairment in patients with diabetes is associated with metformin [J]. Diabetes Care, 2013, 36(10): 2981-2987.
[17] Barini E, Antico O, Zhao Y, et al. Metformin promotes tau aggregation and exacerbates abnormal behavior in a mouse model of tauopathy [J]. Mol Neurodeqener, 2016, 11: 16.
[18] Son SM, Shin HJ, Byun J, et al. Metformin facilitates amyloid-β generation by β- and γ-secretases via autophagy activation [J]. J Alzheimers Dis, 2016, 51(4): 1197-1208.
[19] Shahroudi MJ, Mehri S, Hosseinzadeh H. Anti-aging effect ofNigellasativafixed oil on D-galactose-induced aging in mice [J]. J Pharmacopuncture, 2017, 20(1): 29-35.
[20] 曹雪姣, 耿成燕, 董伟, 等. D-半乳糖对成年小鼠海马神经元p-ERK1/2表达和学习记忆能力的影响 [J]. 中国比较医学杂志, 2013, 23(11): 40-43.
[21] DiTacchio KA, Heinemann SF, Dziewczapolski G. Metformin treatment alters memory function in a mouse model of Alzheimer’ s disease [J]. J Alzheimers Dis,2015, 44(1): 43-48.
[22] Spindler SR. Use of microarray biomarkers to identify longevity therapeutics [J]. Aging Cell, 2006, 5(1): 39-50.
[23] Chen X, Li Y, Chen W, et al. Protective effect of hyperbaric oxygen on cognitive impairment induced by D-galactose in mice [J]. Neurochem Res, 2016, 41(11): 3032-3041.
Effectofmetforminonlearningandmemoryabilityinmiceduringagingandthepossibleunderlyingmechanisms
ZHANG Li-jun1, ZHANG Li-xia1, WANG Hao-ying1, ZHANG Qiong1, LI Li-hong2, XUAN Rui-jing2, WANG Zhao-jun3, GUO Jian-hong1*
(1.Department of Pathophysiology,Shanxi Medical University,Taiyuan 030001, China; 2.Laboratory Animal Center, Shanxi Key Laboratory of Experimental Animal Science and Hunman Disease Animal Model, Taiyuan 030001; 3.Department of Physiology, Key Laboratory for Cellular Physiology of Ministry of Education, Shanxi Medical University, Taiyuan 030001)
ObjectiveTo explore the effect of metformin on learning and memory ability and hippocampal tissue structure in mice during aging induced by D-galactose, and the possible underling mechanisms.MethodsTwenty-four SPF 7-month-old female ICR mice were randomly divided into three groups. Mice of the aging group and aging+metformin group were given subcutaneous injection with D-galactose on the back to induce senescence, and given intragastric gavage with 0.9% saline or metformin. Mice of the control group were treated with 0.9% saline. All treatments lasted for 16 weeks. The body weight and food intake were monitored, learning and memory ability and motor function were tested by Mirros water maze and shuttle box tests, HE staining was used to observe the pathology of hippocampus in the mice, and the levels of glutathione (glutathione, GSH) in hippocampus of mice were detected by colorimetry.ResultsCompared with the aging group, the aging+meformin group showed diverse differences: the body weight was decreased (P< 0.05), the escape latency and swimming distance were decreased (P< 0.01 orP< 0.05), the swimming time in the target quadrant was prolonged (P< 0.05) and swimming speed was accelerated (P< 0.05) in the Morris water maze test. The numbers of active avoidance response were markedly increased in shuttle box test (P< 0.05). The neurons with nuclear condensation and deep staining were obviously decreased in the dentate gyrus of hippocampus, however the GSH level was significantly increased (P< 0.05).ConclusionsMetformin can delay the decline of learning and memory ability, maintain the normal structure of hippocampus during the aging process in mice, which may be related to the reduction of body weight and enhancement of antioxidant levels in the hippocampus.
Metformin; Aging; Oxidative stress; Hippocampal neurons
2017-04-25
山西省自然科学基金资助(201311054-2)。
张丽君(1987-),女,研究生,研究方向:衰老及相关疾病。E-mail: zlj202020@163.com
郭建红(1968-),女,副教授,博士,研究方向:衰老及相关疾病。E-mail: sgs7551@126.com
R-33
A
1671-7856(2017) 12-0033-06
10.3969.j.issn.1671-7856. 2017.12.006
