敲除TRPC6对MPTP诱导小鼠神经炎性损伤的影响
2017-12-21王淑贞钟耀艺范伟伟林庚海
王淑贞,尹 红,钟耀艺,范伟伟,林庚海*
(1.漳州卫生职业学院,福建 漳州 363000; 2.厦门大学附属东南医院(福建省漳州中国人民解放军第175医院), 福建 漳州 363000)
敲除TRPC6对MPTP诱导小鼠神经炎性损伤的影响
王淑贞1,尹 红1,钟耀艺2,范伟伟2,林庚海2*
(1.漳州卫生职业学院,福建 漳州 363000; 2.厦门大学附属东南医院(福建省漳州中国人民解放军第175医院), 福建 漳州 363000)
研究报告
目的在小鼠MPTP(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine)诱导的神经炎症模型中检测小胶质细胞的TRPC6通道的表达,并探究TRPC6通道对于炎症表达和多巴胺能神经元损伤的影响。方法在MPTP注射的小鼠中,用标记CD11b的磁珠分选出黑质区域的小胶质细胞,并通过蛋白质免疫印迹的方法检测TRPC6的表达。在构建CD11b-TRPC6-/-小鼠后,通过免疫荧光的方法检测MPTP诱导的小胶质细胞的增殖以及多巴胺能神经元的损伤。同时结合蛋白质免疫印迹和实时荧光定量PCR的方法,在MPTP模型中检测TRPC6敲除后cryαB蛋白水平和炎症因子表达。结果在MPTP注射的小鼠中,小胶质细胞中TRPC6通道的表达显著上调。另外,在注射MPTP的CD11b-TRPC6-/-小鼠中,小胶质细胞中的cryαB蛋白水平被上调。同时,MPTP诱导的小胶质细胞的增殖以及炎症因子表达增强被抑制,而多巴胺能神经元的损伤得到缓解。结论小胶质细胞中TRPC6通道表达在MPTP模型中上调,而TRPC6的敲除可增加小胶质细胞中cryαB蛋白水平,并降低炎症因子的表达,从而减少多巴胺能神经元的损伤。
小胶质细胞;TRPC6通道;炎症;MPTP;多巴胺能神经元;帕金森病
帕金森病(Parkinson’ s disease,PD)是仅次于阿尔兹海默症(Alzheimer’ s disease,AD)的第二常见的神经退行性疾病,其主要病理学表现为PD患者黑质区域多巴胺能神经元(dopaminergic neuron)的退行性病变[1, 2]。另外,研究表明,在PD的发生发展过程中,患者脑部的炎症反应逐渐增强[3, 4],而过度的炎症表达会直接导致神经元的损伤[5-7],提示炎症可能在PD的发病过程中扮演重要角色。
小胶质细胞(microglia)被报道是大脑内一类主要的免疫细胞,其主要负责感知外界的炎性刺激,启动大脑内的免疫系统以及吞噬并清除外来侵入的病原体[8, 9]。在PD患者脑部以及小鼠的PD模型——1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine(MPTP)模型中,小胶质细胞也被大量激活,并促进黑质区域多巴胺能神经元的炎性损伤[10, 11]。因此,通过抑制小胶质细胞的炎症反应,进而减少巴胺能神经元的死亡很有可能成为延缓PD病程发展的有效手段。但是,对于小胶质细胞在PD发展过程中被过度激活的机制仍在探索之中。
钙离子是细胞内的第二信使,同时也对于小胶质细胞的激活和增殖也至关重要[12, 13]。作为瞬时受体电势通道(transient receptor potential channel,TRPC)家族一员,TRPC3受到脑源性营养因子(brain derived neurotrophic factor,BDNF)的调控,可以在小胶质细胞中抑制一氧化氮的产生[14]。另外,在β淀粉样蛋白诱导的AD细胞模型中,小胶质细胞中TRPC6被报道表达升高,并促进炎症因子表达[15]。但是,对于TRPC通道是否参与PD发展过程中的炎症调节目前还未研究透彻。
α晶状蛋白B链(α-crystallin B chain,cryαB)是一类小热休克蛋白。除了结合错误折叠蛋白防止其聚集外,cryαB还被报道具有炎症调节的功能[16, 17]。在PD的小鼠模型中,cryαB可以在星形胶质细胞中介导多巴胺受体2(dopamine receptor D2)信号进而抑制炎症的过度表达[6]。
在本研究中,我们在注射MPTP的小鼠中发现,小胶质细胞的TRPC6通道的表达显著升高。而在小胶质细胞中特异敲除TRPC6之后,MPTP模型中小胶质细胞的cryαB蛋白水平被上调,同时小胶质细胞的增殖和炎症因子的表达被显著抑制,黑质区域多巴胺能神经元的损伤得到缓解。
1 材料和方法
1.1 实验动物
CD11b-Cre转基因小鼠(C57BL/6背景)购于European Mouse Mutant Archive(EMMA),TRPC6flox/flox小鼠(129/sv背景)购于美国Jackson Laboratory。野生型C57BL/6小鼠购于上海斯莱克实验动物有限公司[SCXK(沪)2012-0002]。动物模型建立及相关实验在中国人民解放军第一七五医院[SYXK(军)2012-0054]开展。本研究中涉及的全部动物实验均参考中国人民解放军第一七五医院动物管理委员会有关实验动物使用的相关规定,并遵照实验动物试验3R原则给予人道关怀。
1.2 抗体和试剂
TRPC6抗体购于Alomone公司(货号ACC-017);TRPC3抗体购于Alomone公司(货号ACC-016);离子钙结合衔接子分-1(ionized calcium-binding adapter molecule 1,Iba1)抗体购于Wako公司(货号019-19741);六糖核苷酸结合蛋白-3(hexaribonucleotide binding protein-3/NeuN)抗体购于Abcam公司(货号ab177487);胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体购于Sigma公司(货号G3893);酪氨酸羟化酶(tyrosine hydroxylase,TH)抗体购于Millipore公司(货号MAB318);cryαB抗体购于Abgent公司(货号ALS12840);分化分子簇-11b(cluster of differen-tiation molecule 11b,CD11b)抗体标记磁珠购于MiltenyiBiotec公司(货号130-049-601);MPTP购于Sigma公司(货号M0896);TRIzol购于Sigma公司(货号T9424)。
1.3 实验方法
1.3.1 CD11b-TRPC6-/-小鼠品系构建
通过将CD11b-Cre转基因小鼠与TRPC6flox/flox小鼠交配获得CD11b-TRPC6+/-F1代杂合小鼠(+,TRPC6野生型;-,TRPC6敲除)。再将CD11b-TRPC6+/-F1代与TRPC6flox/flox小鼠回交并筛选获得CD11b-TRPC6-/-F2代纯合子小鼠。而通过将CD11b-TRPC6-/-F2代与TRPC6flox/flox小鼠交配,则可稳定获得CD11b-TRPC6-/-小鼠子代。
1.3.2 MPTP注射
待雄性CD11b-TRPC6-/-小鼠生长至8~10周(23~25 g)后,即可建立MPTP模型。MPTP(20 mg/kg)注射采用急性腹腔给药的方式,模型中每只小鼠连续给予4次MPTP注射,每次间隔2 h。在MPTP模型建立后的第3天进行小胶质细胞的增殖及炎症因子表达检测,而多巴胺神经元损伤检测于模型建立后的第7天。
1.3.3 免疫荧光
在MPTP模型建立后,使用戊巴比妥钠麻醉小鼠。经过生理盐水和4%的多聚甲醛灌流小鼠后,解剖出脑部,置于4%的多聚甲醛中过夜。第二天,更换30%的蔗糖溶液以脱去组织中的水分。待脑组织在蔗糖溶液中沉底后,进行冰冻切片(30 m)。脑片经0.01 mol/L的磷酸盐缓冲生理盐水 (phos-phate buffer saline,PBS)漂洗后,置于10%的牛血清白蛋白中室温封闭1 h。在4℃孵育一抗过夜(抗体稀释比例均为1∶1000)后,再使用PBS漂洗三次,并置于荧光二抗(稀释比例均为1∶1000)中室温孵育2 h。待PBS漂洗去非特异结合二抗后,置于显微镜下进行荧光检测。
实验中,将Iba1蛋白在黑质区域的平均荧光表达强度(mean fluorescence intensity,MFI)定义为小胶质细胞的增殖水平,并通过ImageJ软件进行荧光定量分析。而黑质区域TH阳性表达细胞使用Image Pro Plus软件进行计数。
1.3.4 小胶质细胞分选
在将小鼠进行二氧化碳安乐死后,在冰上快速解剖出小鼠的腹侧中脑,并使用眼科剪将组织剪碎。在经过消化液(0.05%的胶原蛋白酶D+0.025 U/mL的DNA酶)室温消化组织0.5 h后,500 r/min离心沉淀细胞。待PBS重悬细胞后,使用CD11b抗体标记的磁珠4℃孵育标记细胞1 h。经过分选器分选后,获得CD11b阳性表达细胞。
1.3.5 蛋白免疫印迹
将分选的小胶质细胞置于蛋白裂解液(碧云天)裂解后,进行聚丙烯酰胺凝胶电泳分析。待将凝胶上蛋白4℃转移至醋酸纤维膜上后,使用5%的脱脂牛奶室温封闭0.5 h。在4℃孵育一抗过夜(NeuN、Iba1、GFAP和cryαB抗体稀释比例均为1∶800,-actin抗体稀释比例为1∶10000)后,进行PBS漂洗,并室温孵育二抗(稀释比例均为1∶5000)2 h。经过PBS再次漂洗三次后,滴加曝光液,置于成像仪中进行分析。
1.3.6 实时荧光定量PCR
样品经过TRIzol提取总RNA后,通过反转录酶于42℃反转获得cDNA。肿瘤坏死因子-(tumor necrosis factor alpha,TNF-α)、白介素-1(interleukin-1,IL-1)、IL-6以及诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)的相对表达使用SYBR green法进行荧光实时定量。TNF-a的引物为:正向5′-CTACGAGACCAAGTGCAATCC-3′;反向5′-AATCGCCAGCCAATTCTCTTT-3′。IL-1b的引物为:正向5′-GTACATAAAATCTGGGGGTTCTGGG-3′;反向5′-AGTCTTAAAGCAAGGAACAACGTATTT-3′;IL-6的引物为:正向5′-CTACGAGACCAAGTGC AATCC-3′;反向5′-AATCGCCAGCCA ATTCTCTTT-3′。iNOS的引物为:正向5′-GTTCTCAGCCCAAC AATACAAGA-3′;反向5′-GTGGACGGGTCGATGTCA C-3′。bβ-actin的引物为:正向5′-CCTCGCCTTTG CCGATCCG-3′;反向5′-ATGCCGGAGCCGTTGTCG- 3′。
1.4 统计学方法

2 结果
2.1 小胶质细胞中TRPC6通道的表达在MPTP模型中显著升高
为了探究TRPC通道在PD发展过程中的炎症调节作用,我们首先在小鼠上建立了MPTP模型,并通过标记有CD11b抗体的磁珠将小胶质细胞从黑质区域分选出来。如图1A显示,CD11b磁珠分选出的细胞特异地表达小胶质细胞的标记蛋白—Iba1,而并不表达星形胶质细胞的标记蛋白—GFAP和神经元的的标记蛋白—NeuN。另外,通过蛋白质免疫印迹分析,我们发现在CD11b磁珠分选出的细胞中TRPC6的蛋白表达有显著升高(图1B-C),而TRPC家族的另一成员TRPC3的表达并不受到影响(图1B和D)。这些提示MPTP可以特异地上调小胶质细胞的TRPC6通道的表达。

注:与生理盐水组比,***P<0.001。图1 MPTP注射对于小胶质细胞中TRPC6蛋白表达影响(n=6) Compared with the saline group,*** P<0.001.Fig.1 Effect of MPTP administration on the expression of TRPC6 in the microglia. Compared with the saline group,*** P<0.001.
2.2 小胶质细胞中特异敲除TRPC6抑制MPTP介导的小胶质细胞激活和炎症因子表达
为了进一步研究小胶质细胞中TRPC6通道在MPTP模型中对炎症的调控,我们通过将CD11b-Cre和TRPC6flox/flox的小鼠杂交,得到在小胶质细胞中TRPC6蛋白特异敲除的小鼠。炎症因子TNF-、IL-1、IL-6以及氧化应激相关蛋白iNOS等被报道在MPTP介导的神经炎性损伤中扮演重要角色[6, 10,11]。我们发现,在CD11b-TRPC6-/-小鼠中,其这些炎症因子表达并没有发生改变(图2D-F)。而在注射MPTP之后,其TNF-、IL-1、IL-6以及iNOS的mRNA水平相对于TRPC6flox/flox的小鼠被显著下调(图2D-F)。同时,免疫荧光的结果显示,在小胶质细胞中敲除TRPC6通道后,MPTP注射引起的黑质区域Iba1阳性表达的小胶质细胞的增多也受到抑制(图2 A和C)。
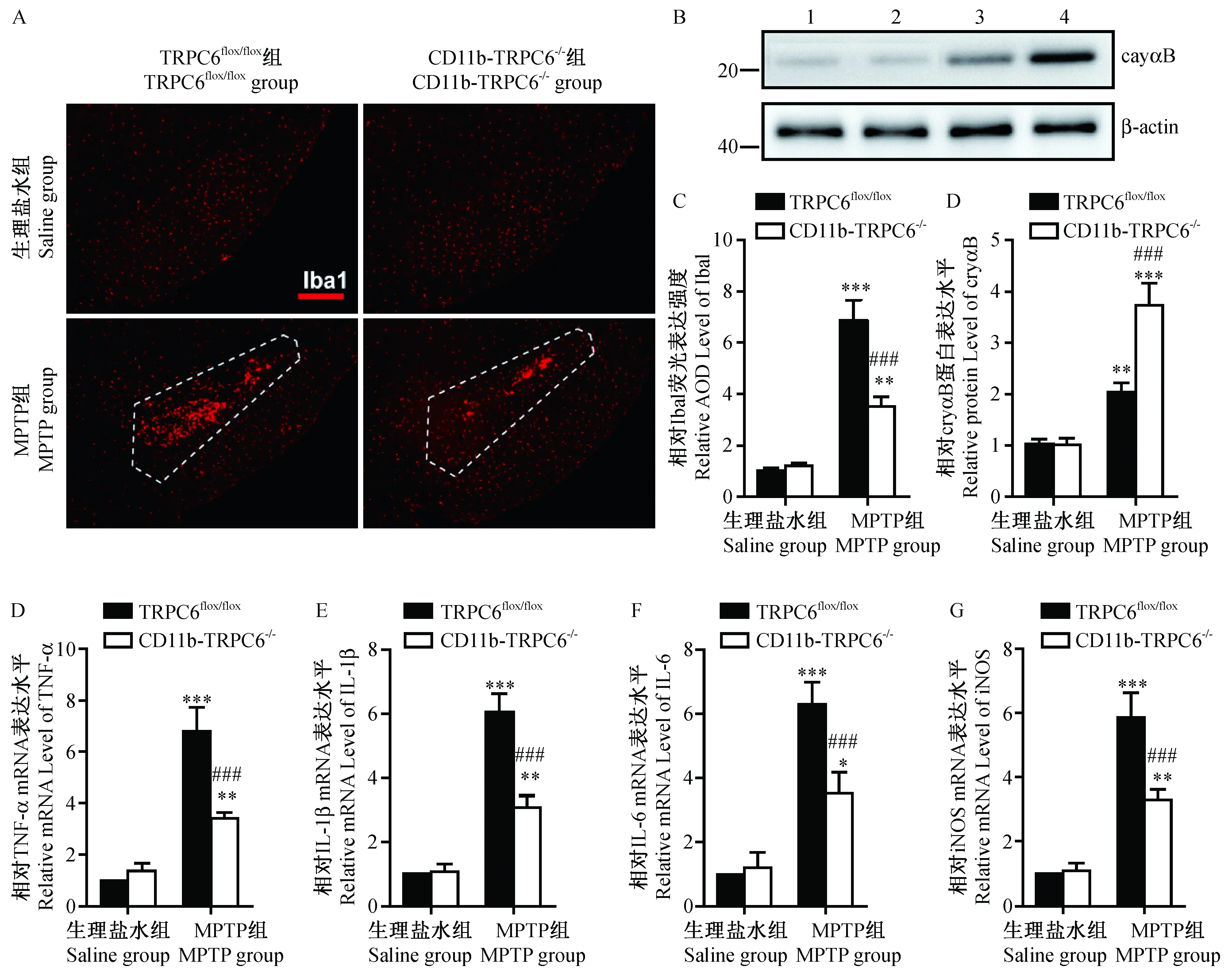
注:1:TRPC6flox/flox-生理盐水组;2:CD11b-TRPC6-/--生理盐水组;3:TRPC6flox/flox-MPTP组;4:CD11b-TRPC6-/--MPTP组。与TRPC6flox/flox-生理盐水组相比,* P<0.05,** P<0.01,***P<0.001;与TRPC6flox/flox-MPTP组相比,##P<0.01,###P<0.001;虚线框里显示黑质区域Iba1阳性表达细胞。图2 小胶质细胞中TRPC6蛋白敲除对于MPTP介导cryαB蛋白表达、 小胶质细胞增殖以及炎症因子产生的影响(n=5, Bar=250 μm)Note.1: TRPC6flox/flox-saline group. 2: CD11b-TRPC6-/--saline group. 3: TRPC6flox/flox-MPTP group. 4: CD11b-TRPC6-/--MPTP group in Fig. 2B. Compared with the TRPC6flox/flox-saline group,* P<0.05,** P<0.01,***P<0.001. Compared with the TRPC6flox/flox-MPTP group,##P<0.01,###P<0.001. Dashed boxes indicate Iba1-positive cells in substantia nigra.Fig.2 Effect of TRPC6 knock-out in microglia on the MPTP-induced cryαB expression, microglia proliferation and cytokine production
2.3 小胶质细胞中特异敲除TRPC6导致cryαB蛋白水平被上调
由于胶质细胞中的cryαB蛋白被报道具有抑制炎症作用[16, 17],我们接下来检测了cryαB在TRPC6flox/flox和的CD11b-TRPC6-/-小鼠表达。在注射MPTP之后,相对于TRPC6flox/flox小鼠,cryαB蛋白在CD11b-TRPC6-/-小鼠的小胶质细胞中表达被显著上调(图2B和D),提示cryαB可能在TRPC6通道下游发挥炎症调节功能。
2.4 小胶质细胞中特异敲除TRPC6减少MPTP介导的多巴胺能神经元损伤
为了探究TRPC6通道调控小胶质细胞炎症表达的病理意义,我们通过染色多巴胺能神经元的标记蛋白—TH来测定MPTP 注射小鼠中多巴胺能神经元的存活数量。结果显示,在注射MPTP后的第7天,黑质区域的TH阳性表达神经元数目显著减少(图3A-B)。而在小胶质细胞中敲除TRPC6通道后,MPTP注射引起的TH阳性表达神经元损伤被部分抑制(图3A-B)。

注:与TRPC6flox/flox-生理盐水组相比,* P<0.05,***P<0.001;与TRPC6flox/flox-MPTP组相比,#P<0.05。图3 小胶质细胞中TRPC6蛋白敲除对于MPTP介导多巴胺能神经元损伤的影响(n=6,Bar=250 μm)Note.Compared with the TRPC6flox/flox-saline group,* P<0.05,***P<0.001. Compared with the TRPC6flox/flox-MPTP group,#P<0.05.Fig.3 Effect of TRPC6 knock-out in the microglia on MPTP-induced dopaminergic neuron damages
3 讨论
在PD的发生发展过程中,伴随着大脑内炎症反应的增强,提示炎症很可能参与了患者黑质区域多巴胺能神经元的损伤,进而促进病情的发展。另外,钙离子信号的传导对于小胶质细胞发挥正常功能至关重要,而其中TRPC6调节的钙信号在小胶质细胞的炎症调节过程中扮演重要角色。因此,探究TRPC通道是否参与PD发展过程中的炎症调节作用,进而影响神经元的存活,对于理解PD的发病机制以及临床干预PD的发展进程具有重要意义。
在本次实验中,我们发现小胶质细胞中的TRPC6通道在小鼠MPTP模型中显著升高。而在小胶质细胞中特异敲除TRPC6蛋白后,炎症抑制蛋白cryαB的水平显著上调。另外,MPTP所介导的小胶质细胞的增殖以及炎症因子的表达被有效抑制,同时经元的损伤也得到部分缓解。
细胞内钙离子信号对小胶质细胞增殖、迁移和炎症表达具有重要调节作用[12]。然而,在小胶质细胞的激活期间,钙离子信号是如何进行信号传递并发挥功能还未研究清楚。在实验中,我们发现在注射MPTP后,CD11b-TRPC6-/-小鼠中cryαB蛋白水平被上调,同时炎症因子表达和小胶质细胞的激活被明显抑制。鉴于cryαB蛋白被认为是一类炎症抑制蛋白[16, 17],提示cryαB可能在TRPC6通道下游发挥炎症调节功能。另外,钙离子信号被报道可以调节cryαB的翻译后修饰并影响其活性[18, 19],为后续探究TRPC6通道在小胶质细胞中对于cryαB的调节奠定了理论基础。
本研究中发现,MPTP注射可以导致小胶质细胞中TRPC6通道的表达升高,但对于其中的机制还未阐述明晰。根据报道,在小胶质细胞的细胞系—BV-2细胞中,β淀粉样蛋白可以同样导致TRPC6蛋白表达的上升。而在此过程中,TRPC6蛋白表达变化受到了转录因子NF-kappaB的调控[15]。在MPTP模型中,小胶质细胞中的NF-kappaB同样也被激活[10]。因此,探究NF-kappaB是否介导MPTP注射导致的TRPC6通道的表达上调,对于我们理解PD发生发展过程中小胶质细胞的炎症调控具有重要意义。
本研究中,我们发现在MPTP模型中,小胶质细胞中TRPC6通道表达被上调,并促进了小胶质细胞的增殖以及炎症因子的表达,进而影响了多巴胺能神经元的存活,而cryαB蛋白可能在TRPC6通道下游参与了炎症的表达调控,为阐明小胶质细胞的功能以及以TRPC6为靶标缓解PD过程中的炎症损伤提供了理论依据。
[1] Groger A, Kolb R, Schafer R, et al. Dopamine reduction in the substantia nigra of Parkinson’ s disease patients confirmed by in vivo magnetic resonance spectroscopic imaging [J]. PLoS One, 2014, 9(1): e84081.
[2] Drui G, Carnicella S, Carcenac C, et al. Loss of dopaminergic nigrostriatal neurons accounts for the motivational and affective deficits in Parkinson’ s disease [J]. Mol Psychiatry, 2014, 19(3):358-367.
[3] Deleidi M, Gasser T. The role of inflammation in sporadic and familial Parkinson’ s disease [J]. Cell Mol Life Sci, 2013, 70(22): 4259-4273.
[4] Gerhard A, Pavese N, Hotton G, et al. In vivo imaging of microglial activation with [11C](R)-PK11195 PET in idiopathic Parkinson’ s disease [J]. Neurobiol Dis, 2006, 21(2):404-412.
[5] Ouchi Y, Yoshikawa E, Sekine Y, et al. Microglial activation and dopamine terminal loss in early Parkinson’ s disease [J]. Ann Neurol, 2005, 57(2): 168-175.
[6] Shao W, Zhang SZ, Tang M, et al. Suppression of neuroinflammation by astrocytic dopamine D2 receptors via alphaB-crystallin [J]. Nature, 2013, 494(7435): 90-94.
[7] Gao X, Chen H, Schwarzschild MA, et al. Use of ibuprofen and risk of Parkinson disease [J]. Neurology, 2011, 76(10): 863-869.
[8] Yamasaki R, Lu H, Butovsky O, et al. Differential roles of microglia and monocytes in the inflamed central nervous system [J]. J Exp Med, 2014, 211(8): 1533-1549.
[9] Ginhoux F, Lim S, Hoeffel G, et al. Origin and differentiation of microglia [J]. Front Cell Neurosci, 2013, 7: 45.
[10] Jing H, Wang S, Wang M, et al. Isobavachalcone attenuates MPTP-induced Parkinson’ s disease in mice by inhibition of microglial activation through NF-kappaB pathway [J]. PLoS One, 2017, 12(1): e0169560.
[11] Jiang J, Kim JJ, Kim DY, et al. Acorus gramineus inhibits microglia mediated neuroinflammation and prevents neurotoxicity in 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP)-induced mouse model of Parkinson’ s disease [J]. J Ethnopharmacol, 2012, 144(3): 506-513.
[12] Kettenmann H, Hanisch UK, Noda M, et al. Physiology of microglia [J]. Physiol Rev, 2011, 91(2): 461-553.
[13] Miyake T, Shirakawa H, Kusano A, et al. TRPM2 contributes to LPS/IFNgamma-induced production of nitric oxide via the p38/JNK pathway in microglia [J]. Biochem Biophys Res Commun, 2014, 444(2): 212-217.
[14] Mizoguchi Y, Kato TA, Seki Y, et al. Brain-derived neurotrophic factor (BDNF) induces sustained intracellular Ca2+elevation through the up-regulation of surface transient receptor potential 3 (TRPC3) channels in rodent microglia [J]. J Biol Chem, 2014, 289(26): 18549-18555.
[15] Liu N, Zhuang Y, Zhou Z, et al. NF-kappaB dependent up-regulation of TRPC6 by Aβ in BV-2 microglia cells increases COX-2 expression and contributes to hippocampus neuron damage [J]. Neurosci Lett, 2017, 651: 1-8.
[16] Park H, Hwang HJ, Hwang HS, et al. Alpha B-crystallin prevents ventricular arrhythmia by attenuating inflammation and oxidative stress in rat with autoimmune myocarditis [J]. Int J Cardiol, 2015, 182: 399-402.
[17] Holtman IR, Bsibsi M, Gerritsen WH, et al. Identification of highly connected hub genes in the protective response program of human macrophages and microglia activated by alpha B-crystallin [J]. Glia, 2017, 65(3): 460-473.
[18] Chebotareva NA, Eronina TB, Sluchanko NN, et al. Effect of Ca2+and Mg2+ions on oligomeric state and chaperone-like activity of αB-crystallin in crowded media [J]. Int J Biol Macromol, 2015, 76: 86-93.
[19] Aggeli IK, Beis I, and Gaitanaki C. Oxidative stress and calpain inhibition induce alpha B-crystallin phosphorylation via p38-MAPK and calcium signalling pathways in H9c2 cells [J]. Cell Signal, 2008, 20(7): 1292-1302.
EffectofTRPC6knock-outonthemouseneuroinflammationinducedbyMPTP
WANG Shu-zhen1, YIN Hong1, ZHONG Yao-yi2, FAN Wei-wei2, LING Geng-hai2*
(1.Zhangzhou Health Vocational College, Zhangzhou 363000, China; 2.The Affiliated Dongnan Hospital of Xiamen University (PLA 175th Hospital), Zhangzhou 363000)
ObjectiveTo measure the level of microglia TRPC6 in mouse MPTP (1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine)-induced neuroinflammation model and investigate its role in cytokine production and dopaminergic neuron damages.MethodsMicroglia were sorted by magnetic beads labeled with CD11b antibody and the level of TRPC6 in MPTP-induced neuroinflammation models was measured by western blotting. The proliferation of microglia and damages of dopaminergic neurons induced by MPTP were analyzed by immunofluorescence in CD11b-TRPC6-/-mice. Meanwhile, the expression of cryαB and cytokines in microglia was measured by western blotting and real-time quantitative PCR, respectively.ResultsThe level of microglia TRPC6 in MPTP-induced neuroinflammation model was up-regulated. The expression of cryαB was increased and the cytokine level was down-regulated in the microglia in MPTP-injected CD11b-TRPC6-/-mice. Moreover, the dopaminergic neuron survival was improved in the MPTP-induced neuroinflammation model after TRPC6 knock-out in the microglia.ConclusionsThe expression of TRPC6 in microglia is up-regulated after MPTP injection, while in CD11b-TRPC6-/-mice the MPTP-induced cytokine expression is reduced, contributing to the improvement of dopaminergic neuron survival.
Microglia; TRPC6; Inflammation; MPTP; Dopaminergic neuron; Parkinson’s disease
国家自然基金(81601223)。
王淑贞(1982-),女,讲师,研究方向: 妊娠期合并神经系统疾病诊断和治疗。E-mail: wsz2211518@126.com
林庚海(1978-),男,副主任医师,研究方向: 炎症调节和心血管疾病治疗。E-mail: 183961581@qq.com
R-33
A
1671-7856(2017) 12-0001-07
10.3969.j.issn.1671-7856. 2017.12.001
2017-05-17
简讯
《中国实验动物学报》入编《中文核心期刊要目总览》(北大图书馆)
2014年版(即第七版)
《中文核心期刊要目总览》是学术界对某类期刊的定义,一种期刊等级的划分。它的对象是中文学术期刊。是根据期刊影响因子等诸多因素所划分的期刊。中文核心期刊是北京大学图书馆联合众多学术界权威专家鉴定,目前受到了学术界的广泛认同。从影响力来讲,其等级属同类划分中较权威的一种。按照惯例,北大核心期刊每四年由北大图书馆评定一次,并出版《北大核心期刊目录要览》一书。

